基于磁性固相萃取剂(MWCNTs/Fe3O4)同时测定水中毒死蜱和TCP的方法研究
2017-09-15马崇迪常玉鹏赵仕林
李 越, 马崇迪, 刘 茜, 常玉鹏, 罗 凤, 毛 卉,2, 赵仕林,2*
(1. 四川师范大学 化学与材料科学学院, 四川 成都 610066; 2. 四川师范大学 四川省高校农田生态服务能力建设工程中心, 四川 成都 610066)
基于磁性固相萃取剂(MWCNTs/Fe3O4)同时测定水中毒死蜱和TCP的方法研究
李 越1, 马崇迪1, 刘 茜1, 常玉鹏1, 罗 凤1, 毛 卉1,2, 赵仕林1,2*
(1. 四川师范大学 化学与材料科学学院, 四川 成都 610066; 2. 四川师范大学 四川省高校农田生态服务能力建设工程中心, 四川 成都 610066)
通过溶剂热还原反应法一步制备了兼具磁性和优良吸附特性的磁性固相萃取剂MWCNTs/Fe3O4,对材料的XRD、SEM、VSM的表征分别证实和说明了材料中Fe3O4晶型单一,Fe3O4成功负载于MWCNTs管束,材料具有良好磁性,将材料分散于水中后也能通过强力磁铁完全回收.实验探究了MWCNTs/Fe3O4吸附水中毒死蜱和TCP的平衡时间,适宜的pH和温度,并在此基础上优化MWCNTs/Fe3O4磁固相萃取条件,以实现对水中毒死蜱、TCP的高效富集,其中包括适宜的材料用量、洗脱剂的种类、洗脱体积和温度的确定等,以此建立了一种磁固相萃取联合HPLC同时测定水样中毒死蜱和TCP的分析方法.该方法对水样中不同质量浓度添加的毒死蜱和TCP回收率分别是83.2%~91.7%与93.5%~97.1%,相对标准偏差分别是3.2%~7.4%与1.1%~4.6%,日内、日间精密度均小于10%,该方法对水样中毒死蜱和TCP定量限分别是2.5与1.5 μg/L.利用该方法测定实际水样,并进行不同质量浓度的加标实验,仍能实现对毒死蜱和TCP回收率范围为88.9%~98.1%,且相对标准偏差均小于8%,说明本方法对水中杂质有一定抗干扰能力,适用于实际水样的检测.
毒死蜱; TCP; 多壁碳纳米管; 磁固相萃取; 高效液相色谱分析
毒死蜱(chlorpyrifos)是世界上应用最广泛的有机磷杀虫剂之一[1],可用于农业和城市虫害的防治[2],虽然属于低毒农药,但对生态与人体安全仍存在潜在危险性,已在一些发达国家限量、限制使用[3];其降解产物3,5,6-三氯-2-吡啶酚(TCP)生物毒性大,在Microtox系统中对土壤细菌群落的毒性是毒死蜱的2.5倍,对鸡胎盘的毒性比毒死蜱高2~3倍[2],而且和毒死蜱可能存在协同效应.此外,毒死蜱的水溶性小,在水中溶解度只有2 mg/L,TCP则水溶性较大,约为49.1 g/L,所以TCP比毒死蜱更容易渗入地下水,从而污染水体和生态环境[4].因此,对水中毒死蜱和TCP含量进行分析测定,对于毒死蜱残留所带来环境污染的防治和确保生态环境安全都是非常重要的.
对于样品中农药的分析测试,主要包括两大部分,即样品预处理和仪器测试,前者所需的时间最长,约占据了整个过程60%或者更长的时间,此外预处理过程,也是测定误差的主要来源,且影响着后续的仪器分析,很明显,预处理手段很大程度上决定了该分析方法的效率和准确性.
对于水样的预处理,传统又最常用的是液液萃取法[5],该过程需消耗大量有机溶剂,且耗时较长.此外由于毒死蜱和TCP水溶性相差巨大,难以选择合适的溶剂将两者同时从水中萃取出,尤其是对于低浓度的样品.而另一种常规方法,固相萃取法[5]能减少有机试剂的使用,耗时稍短,但仍存在一些缺陷.磁固相萃取是在传统固相萃取的液固分配理论上发展而来的一种分散固相萃取方法[6],本方法将磁性固相萃取剂直接投加至需要前处理的液体样中,通过震荡等方式使材料充分散至溶液体系,从而使萃取颗粒与目标分析物接触更加充分,较传统固相萃取将极大缩短萃取平衡的时间.磁固相萃取还适于浑浊的水样,不同于传统固相萃取会因为水样中的悬浮颗粒堵塞固相萃取柱筛板而延长前处理的时间.萃取结束后,通过磁力作用即可将萃取剂与溶液体系快速分离,所以磁固相萃取这种新型的样品前处理技术省时、高效、环境友好,萃取材料可回收再用,目前已广泛应用于食品、环境中有机污染物的分析检测领域[7].
Deng X. J.等[8]合成氨基化磁性多壁碳纳米管(MNPs/MWCNTs)用于茶叶样品中异丙威及8种杀虫剂的快速富集净化,采用GC-MS测定,方法检测限0.02~0.08 mg/kg,回收率可达72.5%~109.1%.Wu Q. H.等[9]合成磁性石墨烯(G-Fe3O4)将其用于5种氨基甲酸酯农药(速灭威、克百威、抗蚜威、异丙威和乙霉威)预浓缩,并结合高效液相色谱分析检测,方法能实现对目标物的有效富集,检测限范围为0.02~0.04 μg/L.Guan Y.等[10]制备了Fe3O4@SiO2与MWCNTs复合的磁性萃取剂,并将其用于环境水中多种雌激素分析,对目标物均表现出良好的回收率.
结合相关报道,磁固相萃取应用于水中毒死蜱和其降解产物TCP分析的研究鲜见,本实验通过溶剂热法制备了多壁碳纳米管与Fe3O4的复合材料(MWCNTs/Fe3O4),并将其作为一种磁固相萃取剂用于水体中毒死蜱与TCP的吸附富集,再结合高效液相色谱(HPLC)分析技术,建立了水中毒死蜱与TCP的磁固相萃取/HPLC分析方法.
1 实验部分
1.1 试剂与仪器 多壁碳纳米管(工业级,直径10~20 nm,长度20~100 μm):中科时代纳米;乙二醇、甲醇(分析纯、HPLC色谱纯):成都金山化学试剂有限公司;无水乙酸钠、无水乙醇、无水硫酸钠、盐酸(分析纯):成都市科龙化工试剂厂;无水三氯化铁:上海山浦化工有限公司;毒死蜱、3,5,6-三氯吡啶酚(分析标准品):阿拉丁试剂厂;其他试剂:超纯水、由HPLC色谱纯甲醇配制的一定浓度的毒死蜱、TCP标准溶液,毒死蜱与TCP混合标准溶液,不同加标浓度的毒死蜱与TCP水溶液.
超纯水制造仪(成都优越科技有限公司);DZF-6050真空干燥箱(上海齐欣科学仪器有限公司);SHZ-C水浴恒温振荡器(上海跃进医疗器械有限公司);LD4-2A低速离心机(北京雷勃尔医疗器械有限公司);ME204E/02电子分析天平(梅特勒-托利多仪器(上海)有限公司);DF-101B集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);RH-Ⅱ型旋转蒸发仪(上海申顺生物科技有限公司);SHB-III循环水式多用真空泵(郑州汇成科工贸有限公司);SB-5200 DTD超声波清洗机(宁波新芝科技股份有限公司);皖仪LC3000高效液相色谱(安徽皖仪科技股份有限公司).1.2 材料的制备 采用溶剂热反应法[8,11],于水热反应釜中一步实现磁性Fe3O4纳米粒子的形成以及与MWCNTs的复合.材料合成的具体操作步骤如下:准确称取0.4 g MWCNTs于水热反应釜的聚四氟乙烯内胆(内含磁力搅拌子),加入40 mL乙二醇,强磁力搅拌1 h,使MWCNTs在乙二醇溶液中完全均匀分散.准确称量0.64 g无水三氯化铁加入上述溶液,强磁力搅拌0.5 h使其分散均匀,然后向溶液中加入2.60 g无水乙酸钠,强磁力搅拌0.5 h,使整个反应溶液体系均一分散.最后取出搅拌子,将反应容器密封于水热反应釜中,在200 ℃烘箱内反应8 h后结束,待反应釜冷却至室温,将反应后的溶液完全转移到离心管内,于4 000 r/min离心4 min,弃上层液体.向盛黑色沉淀物的离心管中加入适量无水乙醇,涡旋振荡洗涤数分钟,以除去未反应完全的残留试剂,后于4 000 r/min离心4 min,弃上层液体,重复洗涤步骤,直至上层液体无色澄清.将最后所得黑色沉淀物于60 ℃真空烘干,用玛瑙研钵研细,即得MWCNTs/Fe3O4.
1.3 样品前处理 用盐酸调节超纯水到pH值为2,向其中加入一定质量浓度的以甲醇溶解的毒死蜱与TCP混合标准溶液,定容到一定体积,配制不同质量浓度的模拟溶液.
准确称取40 mg MWCNTs/Fe3O4于100 mL具塞锥形瓶,向其中加入100 mL模拟溶液,后将锥形瓶置于恒温振荡器上涡旋振荡5 min,使固相萃取颗粒完全分散于水溶液中,并吸附富集目标分析物.反应结束取出锥形瓶,用强力磁铁将材料磁吸于锥形瓶底,待上层水溶液澄清后,弃去上层废液,并用胶头滴管吸去残余水溶液,后用4 mL甲醇将材料洗出,转移至5 mL离心管,并在40 ℃恒温振荡器上涡旋振荡2 min以洗脱目标物,重复洗脱3次(后2次各取2 mL甲醇),取洗脱液于盛有无水硫酸钠的一次性注射器,过0.22 μm有机系滤膜,旋蒸近干定容至2 mL.
1.4 高效液相色谱条件 Apollo C18色谱柱(250 mm×4.6 mm,5 um),流速1 mL/min,柱温30 ℃,检测波长230 nm,进样量20 μL,流动相甲醇-水(体积分数90%,pH=3)等度洗脱,使用外标法定量.
2 结果与讨论
2.1 材料的磁性性能考察与结构表征
2.1.1 材料的磁性能考察 称取一定质量(m1)已制备好的材料分散于一定体积的二次蒸馏水中,如图1上图所示,材料悬浮在水体中;取一强力磁铁置于容器底部,分散的材料向磁铁靠拢,黑色的材料全部被磁吸于容器底部,水体恢复澄清透明.回收的材料用无水乙醇洗涤,于真空烘箱中烘干至恒重(m2),通过公式
计算材料的损失率.对于优化条件下合成的MWCNTs/Fe3O4所得结果仅为2.75%,综上可以说明材料具有良好的磁性并能借助磁力几乎完全回收.图1为改性前后材料的磁性对比.
2.1.2 材料的结构表征 1) 材料的XRD分析.所得产物的XRD分析结果如图2所示.可以看出图中2θ=18.22°、30.09°、35.44°、43.06°、53.54°、56.98°、62.52°处的衍射峰归属于Fe3O4的特征峰,与Fe3O4的XRD标准谱JCPDS card No. 89-3854相对应,对应HKL值分别为(111)、(220)、(311)、(400)、(422)、(511)、(440),说明产物中有Fe3O4粒子的形成,且Fe3O4拥有尖晶石晶型结构.
2) 材料的SEM分析.对改性前后的材料进行SEM表征,观察并对比两者的形貌.图3为MWCNTs的SEM图,可以清晰看出的多壁碳纳米管的管束结构,而从图4可以看出有微球分散,附着在MWCNTs管束上,结合XRD表征可以说明该微球为Fe3O4的纳米粒子,表明MWCNTs负载Fe3O4成功.
3) 材料的VSM分析.MWCNTs/Fe3O4的VSM测试结果的磁滞回线如图5所示,计算出材料的饱和磁化强度为28.29 emu/g,可以说明材料具有良好的磁性能.


图 1 改性前后材料磁性对比图
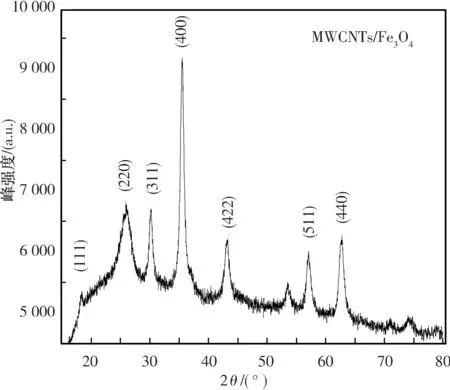
图 2 MWCNTs/Fe3O4的XRD图
2.2 吸附特性探究 分别配制质量浓度0.1 mg/L毒死蜱与TCP的模拟溶液,确定反应体积为100 mL,萃取剂质量40 mg如1.3中的预处理方法进行吸附试验,探究吸附时间、温度、溶液pH对CNTs/Fe3O4吸附性能的影响,并寻找到最佳的吸附条件.

图 3 SEM图:MWCNTsFig. 3 SEM:MWCNTs

图 4 SEM图:MWCNTs/Fe3O4Fig. 4 SEM:MWCNTs/Fe3O4

图 5 MWCNTs/Fe3O4的磁滞回线图
2.2.1 MWCNTs/Fe3O4对毒死蜱与TCP吸附动力学 调节反应溶液pH=3,控制恒温振荡器温度为20 ℃,间隔不同的时间对毒死蜱与TCP分别进行吸附试验,绘制成吸附速率曲线结果如图6所示.可以看出MWCNTs/Fe3O4对毒死蜱与TCP的吸附均在30 min后达到平衡,吸附量随时间变化可通过
拟二级速率方程拟合,且线性相关性R2>0.99,如图7所示.

图 6 MWCNTs/Fe3O4吸附毒死蜱与TCP随时间的变化

图 7 MWCNTs/Fe3O4吸附毒死蜱与TCP的拟二级吸附速率
2.2.2 pH对MWCNTs/Fe3O4吸附毒死蜱与TCP的影响 调节反应溶液pH分别为2、3、5、7、9,控制恒温振荡器温度为20 ℃,振荡反应30 min,经预处理上机测试得到不同pH条件的吸附量,并绘制出关系图,结果如图8所示.可以看出随着pH的增大,MWCNTs/Fe3O4对毒死蜱与TCP的吸附量均减小,可能是因为毒死蜱在偏碱性条件下存在水解,而TCP作为弱酸,也会随着pH的增大分子形态发生改变[12〗,所以选择吸附的最优pH为2.

图 8 不同pH时MWCNTs/Fe3O4对毒死蜱与TCP的吸附
2.2.3 温度对MWCNTs/Fe3O4吸附毒死蜱与TCP的影响 调节反应溶液pH=2,控制恒温振荡器温度分别为20、30、40、50 ℃,振荡反应30 min,经预处理上机测试得到不同温度条件的吸附量,并绘制出关系图,结果如图9所示.可以看出随着反应温度升高,MWCNTs/Fe3O4对毒死蜱与TCP的吸附量均减小,说明该吸附反应属于放热反应,结合室温确定吸附温度为20 ℃.

图 9 不同温度时MWCNTs/Fe3O4对毒死蜱与TCP的吸附
2.3 磁固相萃取条件优化 配制质量浓度0.1 mg/L毒死蜱与TCP的混合模拟溶液,如1.3的预处理方法进行固相萃取实验(吸附条件均为2.2中所优化条件),探究萃取材料用量、洗脱剂种类、洗脱剂体积、洗脱次数、洗脱温度对毒死蜱和TCP回收率的影响.
2.3.1 材料用量 准确称取不同质量的吸附材料,并保证其他条件均相同,进行吸附试验,实验结果所得材料质量与毒死蜱和TCP的回收率关系如图10所示.可以看出当萃取材料质量在10~40 mg范围时,毒死蜱和TCP回收率随萃取材料质量增大而增大,当材料质量在达到40 mg以后继续增加时,目标物回收率反而有所减小,可能是材料过多导致目标物洗脱不完全,所以确定MWCNTs/Fe3O4的最佳用量为40 mg.

图 10 萃取剂质量对毒死蜱与TCP回收率的影响
2.3.2 洗脱剂种类 分别用正己烷、甲醇、丙酮及丙酮-甲醇混合溶剂(体积分数50%)4种洗脱剂来解吸附萃取材料富集的分析目标物.实验结果表明,当以正己烷作洗脱剂时,因萃取材料上残留有微量水分会导致磁性材料在正己烷体系中结块沉积无法均匀分散,故该体系不宜用无法与水互溶的有机试剂作洗脱剂;当选择丙酮或丙酮-甲醇混合溶剂(体积分数50%)作洗脱剂时,会洗脱出一些杂质,与目标物峰无法分开,影响分析定量的准确性,用甲醇作洗脱剂时能实现较高的回收率,目标物能与杂质达到理想的分离度,此外因为洗脱剂与高液分析的流动相一致,能出现较好的峰型,故选用甲醇作洗脱剂.
2.3.3 洗脱剂体积 分别用2、4、6、8、10 mL甲醇溶剂对目标物进行解吸附,并保证其他实验条件一致,实验结果所得洗脱剂体积与毒死蜱和TCP的回收率关系如图11所示.可以看出随着洗脱剂用量增大目标物的回收率逐渐增大,当洗脱剂体积达到8 mL时,回收率不再有明显变化,说明8 mL洗脱剂已能将目标物洗脱完全,考虑到后续实验还需旋蒸浓缩,为节省时间和有机试剂用量,确定洗脱剂用量为8 mL.

图 11 萃取剂用量对毒死蜱与TCP回收率的影响
2.3.4 洗脱温度 在优化了其他条件的情况下,对吸附了目标物的材料在不同温度下进行洗脱,所得加标回收率,随洗脱温度改变如图12所示.可以看出,在20~50 ℃范围随着温度升高,回收率逐渐增大,而温度继续升高时回收率不再明显变化,所以选择最优的解析温度为40 ℃.也表明解析过程属于吸热反应,与吸附反应时放热是对应的.
2.4 方法性能评价
2.4.1 线性方程与检出限 精密量取2.1.2中所配置100 mg/L毒死蜱与TCP混合标准溶液,通过
逐级稀释的方法精确配制多个质量浓度(0.05、0.1、0.2、0.5、1、2、5、7、10 mg/L)混合标准溶液,HPLC检测,所得毒死蜱与TCP的峰面积与其对应的质量浓度进行线性回归,绘制成标准曲线,得出相关系数;并通过稀释标样(S/N=3,LOD;S/N=10,LOQ)得出仪器的最低检测限[13],通过测试0.001、0.005、0.01、0.05 mg/L不同低质量浓度加标样品结合信噪比计算方法检出限MDL、方法定量限MQL[14],结果如表1所示.

图 12 洗脱温度对毒死蜱与TCP回收率的影响
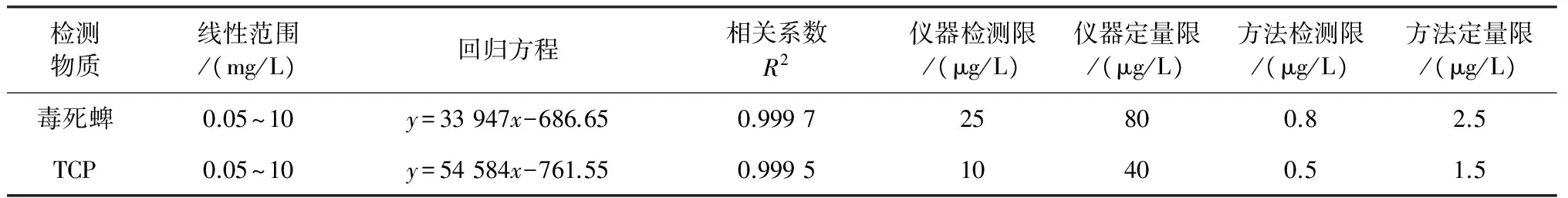
检测物质线性范围/(mg/L)回归方程相关系数R2仪器检测限/(μg/L)仪器定量限/(μg/L)方法检测限/(μg/L)方法定量限/(μg/L)毒死蜱0.05~10y=33947x-686.650.999725800.82.5TCP0.05~10y=54584x-761.550.999510400.51.5
2.4.2 方法回收率及精密度的检测结果 精密量取2.1.2中所配置100 mg/L毒死蜱与TCP混合标准溶液添加到100 mL空白水样中,使水样中毒死蜱与TCP的质量浓度分别为0.01、0.05、0.1 mg/L,按照1.3对样品进行预处理后进行HPLC分析,每个样做3组平行,依据标准曲线定量.回收率计算方式如下:

分析结果如表2所示,毒死蜱和TCP在不同浓度水平添加的回收率范围分别为83.2%~91.7%与93.5%~97.1%,相对标准偏差范围分别是3.2%~7.4%与1.1%~4.6%.
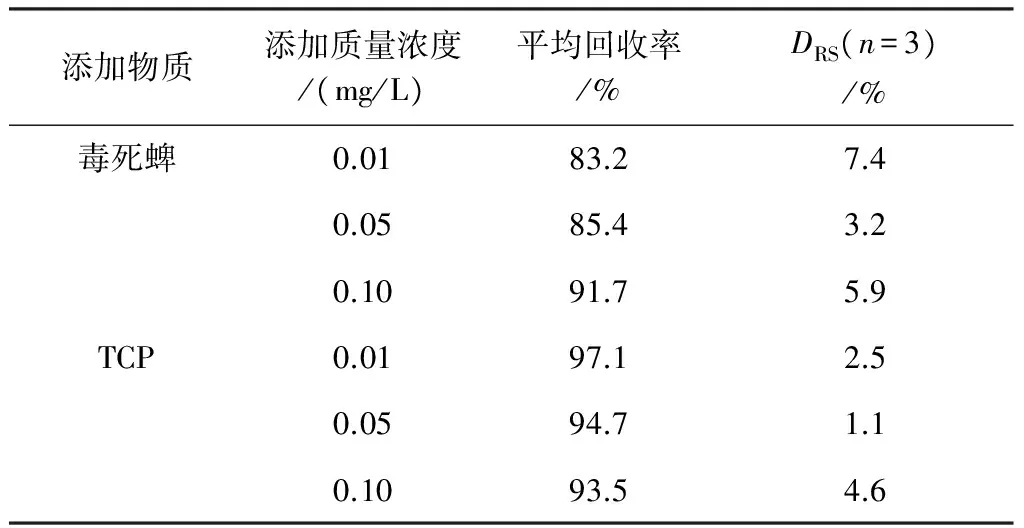
表 2 模拟水样中毒死蜱和TCP的添加回收率(n=3)
分别在0.01、0.05、0.1 mg/L 3个质量浓度水平添加量下进行日内和日间精密度实验.在同一分析日每个样品测定5次得日内精密度、在不同分析日(5 d)制备并测定3组不同加标浓度的样品[15],计算日间精密度(由相对标准偏差获得精密度值),分析结果如表3所示,可以看出该方法对于水体中毒死蜱和TCP的分析精密度良好,RSD均小于10%.
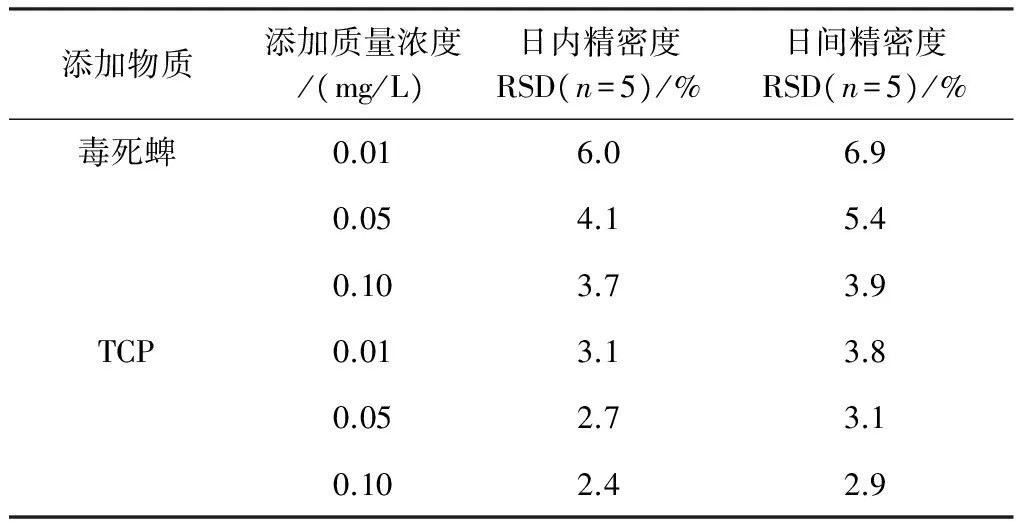
表 3 毒死蜱和TCP不同浓度水平下的精密度
2.4.3 实际样品的处理与分析 采集校园内荷花池水,并按照1.3对样品进行预处理后HPLC分析,测定其中毒死蜱和TCP含量情况.实验结果表明,荷花池水样中未检测出毒死蜱,TCP质量浓度约2.57 μg/L.向池水中加入毒死蜱与TCP混合标准溶液,分别呈0.01、0.05、0.1 mg/L 3个不同质量浓度水平,并按相同的预处理方法制样后进行HPLC分析,测定加标回收率.

分析结果如表4所示.

表 4 实际水样中毒死蜱和TCP的添加回收率(n=3)
可以看出毒死蜱3个添加浓度的回收率为88.9%~98.1%,相对标准偏差是4.1%~7.5%,TCP 3个添加浓度的回收率为91.1%~94.1%,相对标准偏差是0.5%~6.7%;可以说明荷花池水中的杂质对毒死蜂和TCP的定性和定量分析并没有明显影响,本实验方法具有一定的抗干扰性,能用于实际水样的测试.
3 结束语
本文采用溶剂热法一步制得了兼具良好吸附性能和磁性的固相萃取剂MWCNTs/Fe3O4,通过对其吸附特性研究,优化萃取条件等最终建立了磁固相萃取-HPLC法测定水中毒死蜱和TCP的分析方法.方法对水中毒死蜱和TCP能有效吸附、富集,预处理过程操作简单、有机试剂用量少,绿色、环保,且材料可回收利,方法灵敏度较高、准确度和精密度良好,可用于实际水样中的毒死蜱和TCP分析.
[1] 郭瑞峰,黄彬彬,杨晓伟,等. 毒死蜱-聚乳酸微球的制备及其性能评价[J]. 农药学学报,2011,13(4):409-414.
[2] 刘腾飞,邓金花,周峰杰,等. 毒死蜱在土壤中的降解及分析研究进展[J]. 中国农学通报,2014,30(9):26-34.
[3] 葛志荣. 食品中农业化学品残留限量[M]. 北京:中国标准出版社,2006:16-1581.
[4] 韩畅,朱鲁生,王军,等. HPLC测定水体中毒死蜱及其有毒降解产物TCP[J]. 农业环境科学学报,2009,28(7):1552-1556.
[5] 蔡玺晨. 分散固相萃取-HPLC-QTOF/MS法测定水中农药残留的研究[D]. 苏州:苏州科技学院,2014.
[6] 潘胜东,叶美君,金米聪. 磁性固相萃取在食品安全检测中的应用进展[J]. 理化检验:化学分册,2015,51(3):416-424.
[7] 朱建国,李培武,张文,等. 磁固相萃取/气相色谱-串联质谱法测定花生中多种农药残留[J]. 分析测试学报,2016,35(9):1087-1093.
[8] DENG X J, GUO Q J, CHEN X P, et al. Rapid and effective clean-up based on magnetic multiwalled carbon nanotubes for the determination of pesticide residues in tea by gas chromatography-mass spectrometry[J]. Food Chemistry,2014,39(145):853-858.
[9] WU Q H, ZHAO G Y, FENG C. Preparation of a graphene-based magnetic nanocomposite for the extraction of carbamate pesticides from water samples[J]. J Chromatography,2011,A19(44):7936-7942.
[10] GUAN Y, JIANG C, HU C, et al. Preparation of multi-walled carbon nanotubes functionalized magnetic particles by sol-gel technology and its alication in extraction of estrogens[J]. Talanta,2010,83(2):337-343.
[11] 付佳. 溶剂热法制备纳米四氧化三铁研究[D]. 西安:西安建筑科技大学,2007.
[12] XIONG J F, ZHOU G M, GUAN Z, et al. Determination of chlorpyrifos and its main degradation product TCP in water samples by dispersive liquid-liquid microextraction based on solidfication of floating organic droplet combined with high-performance liquid chromatography liquidchromatogramance liquid chromatography[J]. J Liquid Chromatography & Related Technologies,2014,37(11):1499-1512.
[13] 孙宝利,曾希柏. 高效液相色谱法同时测定土壤中毒死蜱残留及其有毒代谢物3,5,6-TCP[J]. 分析试验室,2011,30(8):19-22.
[14] 秦烨. 磁性石墨烯固相萃取-HPLC-MS/MS在水产品药残检测中的应用研究[D]. 杭州:浙江工商大学,2016.
[15] 王娜,孙娟,石利利. 超高效液相色谱-串联质谱法测定人尿中毒死蜱的主要代谢产物3,5,6-三氯-2-吡啶醇[J]. 色谱,2013,31(9):903-907.
(编辑 周 俊)
Simultaneous Determination of Chlorpyrifos and TCP in Water Based on Magnetic Solid Phase Extraction Agent (MWCNTs/Fe3O4)
LI Yue1, MA Chongdi1, LIU Qian1, CHANG Yupeng1, LUO Feng1, MAO Hui1,2, ZHAO Shilin1,2
(1.CollegeofChemistryandMaterialsScience,SichuanNormalUniversity,Chengdu610066,Sichuan; 2.TheEngineeringCenterfortheDevelopmentofFarmlandEcosystemServiceFunction,SichuanNormalUniversity,Chengdu610066,Sichuan)
The magnetic solidphase extraction agent MWCNTs/Fe3O4with both magnetic and excellent adsorption properties was prepared by solvothermal reduction reaction. The XRD, SEM and VSM characterization of the materials were confirmed and demonstrated respectively. The Fe3O4crystal single, Fe3O4successfully loaded in the MWCNTs tube bundle, the material has a good magnetic, the material is dispersed in the water can also be fully recovered by the powerful magnet. The equilibrium time, suitable pH and temperature of chlorpyrifos and TCP in MWCNTs/Fe3O4adsorbed water were investigated. Based on this, the MWCNTs/Fe3O4magnetic solid phase extraction conditions were optimized to achieve the efficient enrichment of chlorpyrifos and TCP in water. The amount of material, elution volume and temperature were determined. A method of simultaneous determination of chlorpyrifos and TCP in water samples was established by magnetic solid phase extraction (SPE) combined with HPLC. The recoveries of chlorpyrifos and TCP were 83.2%~91.7% and 93.5%~97.1%, respectively. The relative standard deviations were 3.2%~7.4% and 1.1%~4.6%, respectively. The limits of quantification were 2.5 and 1.5 μg/L, respectively. The recoveries of chlorpyrifos and TCP were 88.9%~98.1%, and the relative standard deviations were less than 8%, which indicated that the method was effective for the presence of impurities in the water and suitable for the real water sample detection.
chlorpyrifos; TCP; multi-walled carbon nanotubes; magnetic solid phase extraction; analysis by high performance liquid chromatography
2017-03-20
国家自然科学基金应急管理项目(51641209)
X592
A
1001-8395(2017)04-0516-08
10.3969/j.issn.1001-8395.2017.04.015
*通信作者简介:赵仕林(1956—),男,教授,主要从事环境污染控制与修复的研究,E-mail:zhaoslin@aliyun.com
