锌离子对螺旋霉素生物合成的影响
2017-09-15张小红刘守强孙玉杰
武 培,张小红,刘守强,谢 婷,孙玉杰
(1.西北农林科技大学,陕西 杨凌 712100;2.天方药业有限公司,河南 驻马店 463000)
锌离子对螺旋霉素生物合成的影响
武 培1,2,张小红1*,刘守强2,谢 婷2,孙玉杰2
(1.西北农林科技大学,陕西 杨凌 712100;2.天方药业有限公司,河南 驻马店 463000)
在螺旋链霉菌发酵过程中添加锌离子有利于螺旋霉素的生物合成。在摇瓶发酵过程中,于发酵开始28 h时向发酵培养基中添加0.24 g/L的锌离子,螺旋霉素的效价提高17%;放大至15 L发酵罐,成功验证了锌离子对螺旋霉素生物合成的促进作用,发酵放罐效价达3590 U/mL,比对照罐效价提高了20%,比摇瓶发酵培养的效价提高了125 U/mL。采用高效液相色谱法检测发酵液中的有机酸发现,锌离子可能刺激了菌体代谢,提高了螺旋霉素合成前体乙酸和丙酸的含量,进而促进了螺旋霉素的生物合成。
螺旋链霉菌;螺旋霉素;锌离子;生物合成
螺旋霉素(spiramycin,简称SPM)是一种16元的大环内酯类抗生素,属于多组分中谱抗生素[1-2],无诱导耐药性,不良反应较低,交叉耐药性小[3],在临床上占有重要的地位[4]。在螺旋霉素的生物合成过程中,菌体的初级代谢与次级代谢相互交叉作用,故在生长期内促进初级代谢不仅有助于增大生物量,增强菌体活力,还为合成螺旋霉素提供更多的原材料。大量的前体物质会在螺旋霉素生物合成过程中通过一系列反应参与普拉特内醋的形成,如乙酸、丙酸、丁酸及一些还未被研制清楚的物质[5-6]。
目前,国内外学者对螺旋霉素的生物合成进行了多方面的优化研究,从碳源、氮源、接种量、搅拌和剪切力到前体的添加等,取得了斐然的成果。例如:Ahmed Lebrihi等[7]报道铵离子调节氨基酸的代谢,氨基酸影响了螺旋霉素前体乙酸,丙酸和丁酸等的合成,在一定程度上影响螺旋霉素的生物合成。胡蓉等[5]发现在螺旋霉素链霉菌发酵过程中,添加丙三醇丙会促进细胞的EMP途径和TCA循环,增加前体物质的含量,为其合成螺旋霉素提供更多的能量,多方面提高了螺旋霉素的效价。毛全贵等[8]报道某些金属离子对螺旋霉素的生物合成有一定的影响,通过小试、中试及生产性实验验证了Cu2+、Ca2+、Fe2+和Mg2+等不同金属离子、不同添加浓度及不同添加时间对螺旋霉索发酵水平的影响。锌离子是细胞中碱性磷酸酶、脱氢酶、肽酶和脱羧酶的辅因子,存在于乙醇脱氢酶、碱性磷酸酶、醛缩酶、RNA与DNA聚合酶中。发酵培养基中锌离子能提高磷酸甘油醛脱氢酶、苹果酸脱氢酶等锌酶的活性[9-11]。目前,关于锌离子对螺旋霉素生物合成的影响未见相关研究报道。
本文通过摇瓶发酵培养考察不同浓度的锌离子、锌离子不同添加时间对螺旋霉素生物合成的影响,并扩大至15 L发酵罐进行验证,同时检测发罐酵体系发酵液中螺旋霉素合成前体乙酸和丙酸的浓度,以明确锌离子对螺旋霉素生物合成的影响,为提高螺旋霉素工业化生产效率提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
螺旋霉素链霉菌(Streptomyces spiramyceticus),由天方药业有限公司提供。
1.1.2 培养基
种子培养基(%):淀粉3.0,黄豆饼粉2.5,NaCl 0.2,蛋白胨0.5,玉米浆0.4,CaCO30.5,pH值 6.4。
发酵培养基(%):淀粉5.0,黄豆饼粉2.0,鱼粉2.5,葡萄糖0.3,KH2PO40.1,NaCl 0.8,玉米浆2.5,NH4NO30.5,MgSO40.1,CaCO30.5,植物油0.4,pH值 6.4。
补料培养基(%):淀粉12.0,鱼粉2.0,α-淀粉酶0.03,玉米浆1.5,NH4NO30.8,NaCl 0.5,KH2PO40.05,MgSO40.1,CaCO30.7,植物油0.4,泡敌0.03,自然pH值。
培养基灭菌条件:121 ℃,30 min。
1.1.3 仪器与设备
pH计:北京哈纳仪器厂;中型压力灭菌器:山东新华医疗器械股份有限公司;隔水式电热恒温培养箱:上海跃进医疗器械有限公司;TDL-80-2B台式低速离心机:上海安亭科学仪器厂;SZK202超净工作台:蚌埠中瑞净化设备有限公司,GZF-GF101-BS干燥箱:上海跃进医疗器械厂;CX31-12L02显微镜:奥林巴斯;BSW-A 10 L发酵罐:上海傲中生物工程有限公司,LC-20AT高效液相色谱仪:岛津企业管理(中国)有限公司。
1.2 方法
1.2.1 培养工艺
1.2.1.1 摇瓶培养
摇瓶一级种子培养:挖取斜面培养基上0.5 cm左右的菌块,接种于装有50 mL种子培养基的500 mL三角瓶中,27℃,220 r/min,培养48 h。
摇瓶二级种子培养:摇瓶一级种子培养液以6%的接种量接种到装有50 mL种子培养基的500 mL三角瓶中,27℃,220 r/min,培养24 h。
摇瓶发酵培养:摇瓶二级种子培养液以6%的接种量接种到装有50 mL种子培养基的500 mL三角瓶中,27℃,220 r/min,培养96 h。
1.2.1.2 15 L发酵罐培养
发酵罐所需的一级和二级种子培养方法与摇瓶种子培养方法相同。
将二级种子培养液以6%的接种量接入装有发酵培养基的15 L发酵罐中(接后体积10 L)。控制发酵温度27℃,转速100 r/min,风量1:0.3 vvm,培养108 h。发酵25 h起每隔8 h补一次料,以保证发酵过程中有足够的营养和能量。
1.2.2 锌离子对发酵培养中螺旋霉素生物合成的影响
1.2.2.1 摇瓶发酵培养基中锌离子最适添加浓度的确定
在摇瓶发酵开始0 h时分别向发酵培养基中添加为0.16、0.20、0.24、0.28和0.32 g/L的锌离子作为实验组,以不添加锌离子的作为对照组,进行放瓶效价的比较,确定摇瓶发酵培养基中锌离子的最适添加浓度。
1.2.2.2 摇瓶发酵培养基中锌离子最适添加时间的确定
在摇瓶发酵中分别于20、24、28、32和36 h添加0.24 g/L的锌离子作为实验组,并以不添加锌离子作为对照组,发酵结束后,通过比较放瓶效价,确定摇瓶发酵中锌离子的最适添加时间。
1.2.2.3 小试(15 L发酵罐)
利用15 L发酵罐进行不添加锌离子(对照组)和在发酵24 h时添加量0.24 g/L的锌离子(实验组)的发酵培养,周期取样,通过比较放罐效价以及发酵过程中乙酸浓度和丙酸浓度的变化情况,进一步确定锌离子对螺旋霉素生物合成的影响。
1.2.3 测定方法
1.2.3.1 生物效价
生物效价的测定采用管碟法[12]。
1.2.3.2 有机酸的测定
采用高效液相色谱法检测发酵液中乙酸和丙酸的浓度,采用内标法[13]。
1.3 数据分析
所得实验数据均为最少3次平行实验的平均值。
2 结果与分析
2.1 不同浓度锌离子对螺旋霉素生物合成的影响
在摇瓶发酵培养基中分别添加一定浓度梯度的锌离子(0.16~0.32 g/L)作为实验组,以不添加锌离子作为对照组,摇瓶发酵效价结果如图1所示。

图1 不同浓度锌离子对螺旋霉素生物合成的影响
由图1可知,摇瓶发酵开始0 h时分别向发酵培养基中添加不同浓度的锌离子在一定程度上有利于螺旋霉素的生物合成。螺旋霉素摇瓶发酵效价随着锌离子浓度的增加而增加,当锌离子的浓度为0.24 g/L时,螺旋霉素摇瓶发酵效价达到最大值3201 U/mL,比对照组效价提高了10%;当锌离子的浓度继续增大时,螺旋霉素摇瓶发酵效价反而大幅度降低,当锌离子的浓度为0.32 g/L时,螺旋霉素摇瓶发酵效价达3018 U/mL,比对照组效价仅提高了3%,可能是菌体不能完全利用高浓度的锌离子,多余的锌离子可能对菌体代谢产生了毒性,影响了螺旋霉素的合成。因此,锌离子浓度为0.24 g/L时,为促进螺旋霉素摇瓶发酵效价的最适浓度。
2.2 锌离子不同添加时间对螺旋霉素生物合成的影响
在摇瓶发酵培养基中分别于发酵的不同时间添加0.24 g/L的锌离子,以不添加锌离子作为对照,发酵结束后,摇瓶效价测定结果如图2所示。
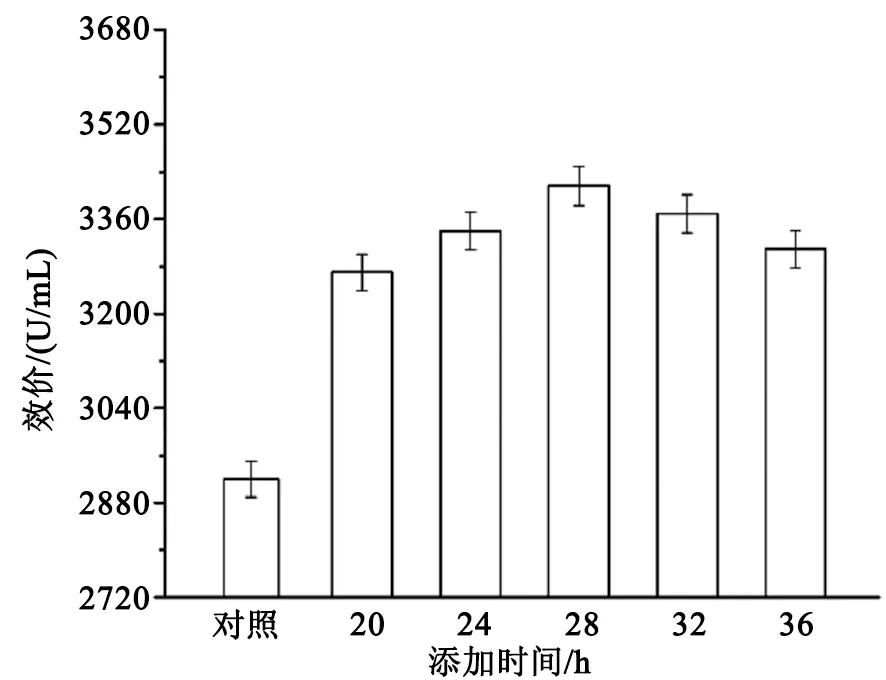
图2 锌离子不同添加时间对螺旋霉素生物合成的影响
由图2看出,在螺旋链霉菌摇瓶发酵的不同时间添加锌离子对螺旋霉素产量的影响存在明显差异,在发酵20~36 h期间添加锌离子均显著促进了螺旋霉素产量的提高,与对照组相比,效价分别提高了12%、14%、17%、15%和13%。其中发酵28 h时添加0.24 g/L的锌离子,对螺旋霉素生物合成的促进作用最明显,摇瓶发酵效价高达3465 U/mL。可能发酵28 h添加锌离子大大刺激了菌体的初级代谢,增了强菌体活力,积累了大量合成前体物,为发酵后期大量合成螺旋霉素提供了更多的原材料。
2.3 15 L发酵罐中添加锌离子对螺旋霉素生物合成的影响
前期摇瓶实验证明,在摇瓶发酵过程中,于发酵28 h时向发酵培养基中添加0.24 g/L的锌离子,螺旋霉素的效价提高了17%。以此浓度和添加时间为基点放大至15 L发酵罐,分析放罐效价,进一步确定锌离子对螺旋霉素生物合成的影响。实验结果如图3所示。
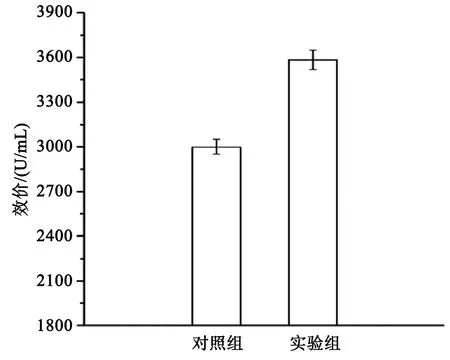
图3 15 L发酵罐中添加锌离子对螺旋霉素生物合成的影响
图3表明,当向发酵培养基中添加了锌离子后,螺旋霉素生物合成能力大幅度提高,放罐效价达3590 U/mL,比对照罐效价提高了20%。同时,相比摇瓶发酵培养的效价3465 U/mL,发酵罐培养发酵效价提高了125 U/mL,这不仅验证了在发酵开始28 h时向发酵培养基中添加0.24 g/L的锌离子对螺旋链霉的生物合成有促进作用,同时也反映了锌离子对螺旋霉素工业生产的意义。
2.4 15 L发酵罐中添加锌离子对有机酸积累的影响
15 L发酵罐发酵培养螺旋链霉菌时,周期取样,采用高效液相色谱法测发酵液中乙酸浓度和丙酸浓度,分析锌离子对螺旋链霉菌发酵过程中有机酸积累的影响。实验结果如图4所示。
图4表明,28 h向发酵培养基中添加0.24 g/L的锌离子和不添加锌离子的对照组有显著差异,76 h左右大概是发酵的一个时间节点,76 h前对照组乙酸浓度比实验组略高,而76 h后,实验组乙酸浓度迅速增加,96 h达到最高,浓度为2.45 g/L,但此时对照组乙酸浓度仅为0.76 g/L,仅为实验组的30%。在76~96 h间乙酸大量积累为螺旋霉素的生物合成提供了条件,96 h后实验组的乙酸浓度开始下降,108 h乙酸浓度仅为0.93 g/L,说明乙酸被菌体利用得较多,而对照组中的乙酸浓度也逐渐降低至0.43g/L。对于丙酸来讲,整体呈增长趋势,对照组整体高于对照组。对照组丙酸浓度由2.67 g/L增长至4.27g/L,实验组丙酸浓度由2.46 g/L增长至4.10 g/L,说明丙酸在整个发酵过程中处于积累状态,实验组积累的丙酸浓度低于对照组,推测可能被利用的更充分。乙酸和丙酸可以促进大环内酯类抗生素的生物而合成,表明锌离子的添加大大丰富了大环内酯合成的前体库,进一步说明了锌离子对螺旋霉素的生物合成具有促进作用。
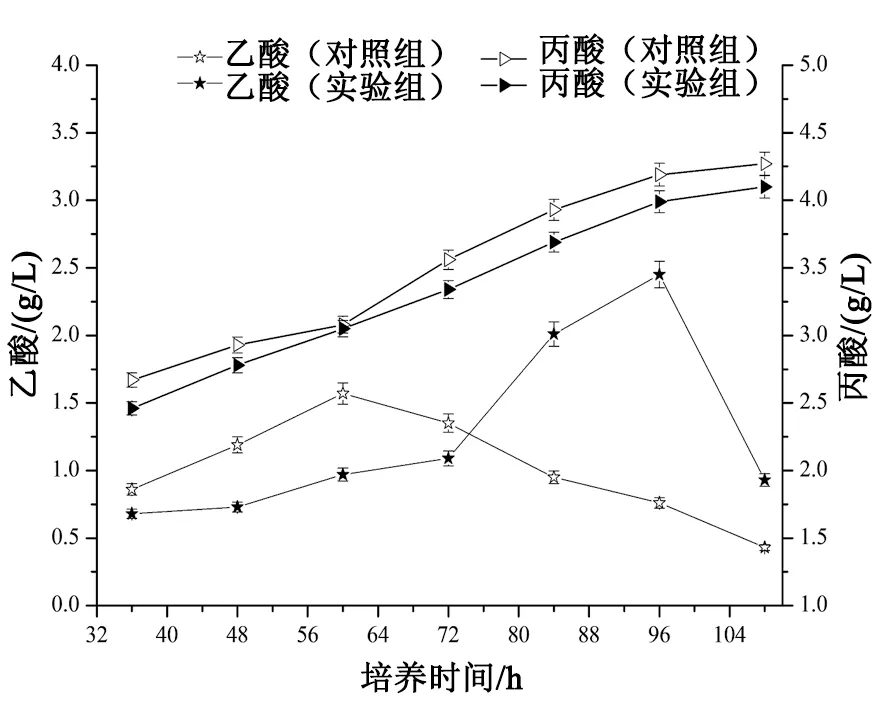
图4 发酵液中有机酸的含量
3 结论
在摇瓶发酵过程中,于发酵开始28 h时向发酵培养基中添加0.24 g/L的锌离子,螺旋霉素的效价提高17%。放大至15 L发酵罐,验证了发酵培养过程中添加锌离子可大幅度提高螺旋霉素的生物合成能力,放罐效价达3590 U/mL,比对照罐效价提高了20%,比摇瓶发酵培养效价提高了125 U/mL。同时采用高效液相色谱法检测发酵液中乙酸和丙酸的浓度变化,发现有机酸浓度受锌离子添加的影响,锌离子可能刺激了菌体代谢,提高了螺旋霉素合成前体乙酸和丙酸的含量,进而促进了螺旋霉素的生物合成。
[1] Omura S,Kitao C,Hamada H,et al. Bioconversion and biosynthesis of 16-membered macrolide antibiotics. XV. final steps in the biosynthesis of spiramycin,using enzyme inhibitor: cerulenin[J].Chemical & Pharmaceutical Bulletin,1979,27(1):176-182.
[2] 朱 峰,王尔健.螺旋霉素的再评价[J].中国抗生素杂志,1991,16(3):231-236.
[3] 司 良.大环内酯类抗生素的作用机制与应用进展[J].现代预防医学,2010,37(22):4397-4398.
[4] 江国庆,吴荣昌,金淑文.应对螺旋霉素重新评价[J].中国药学杂志,1995,30(5):299-300.
[5] 胡 蓉,陈长华,张 琪,等.丙三醇对螺旋霉素生物合成过程的影响[J].华东理工大学学报(自然科学版),2009,35(1):30-34.
[6] Omura S,Takeshima H,Nakagawa A,et al. Studies on the biosynthesis of 16-membered macrolide antibiotics using carbon-13 nuclear magnetic resonance spectroscopy[J]. Biochemistry,1977,16(13):2860-2866.
[7] Ahmed Lebrihi.铵离子对螺旋霉素生物合成的影响[J].国外医药抗生素分册,1994,15(2):90-92.
[8] 毛全贵,赵胜利,韩德全,等.金属离子对螺旋霉素生物合成的影响[J].中国抗生素杂,2005,30(11):647-648.
[9] Насолодин В В,王光辉.锌的生物学作用及机体缺锌的表现[J].国外医学.卫生学分册,1988(1):34-36.
[10] Kuchel P W.生物化学[M].姜招峰,等译.北京:科学出版社,2004:267.
[11] 周德庆.微生物教程[M].北京:高等教育出版社,2004:173-174.
[12] 国家药典委员会.中华人民共和国药典(二部)[M].北京:化学工业出版社,2010.
[13] 李友元.螺旋霉素生物合成代谢与调控[D].上海:华东理工大学,2001:26-27.
(本文文献格式:武 培,张小红,刘守强,等.锌离子对螺旋霉素生物合成的影响[J].山东化工,2017,46(11):20-22,26.)
Influence of Zn2+on Spiramycin Biosynthesis
WuPei1,2,ZhangXiaohong1*,LiuShouqiang2,XieTing2,SunYujie2
(1.Northwest A&F University, Yangling 712100,China;2.Topfond Pharmaceutical Co., Ltd., Zhumadian 463000,China)
Adding Zn2+made for Spiramycin biosynthesis during the fermentation process of Streptomyces spiramyceticus. It increased the titer about 17% more than the control that added 0.24 g/L of Zn2+ions at 28 h in the process of shake flask fermentation. It was successfully demonstrated the role of Zn2+ions to promote Spiramycin biosynthesis after amplification to 15 L fermentor. The titer of fermentation tank was 3590 U/mL, which was increased by about 20% compared with that of the control tank, and the titer was increased by 125 U/mL compared with that of the shake flask. The detection of organic acids in the fermentation broth by HPLC showed that the Zn2+ions could stimulate the metabolism of the cells and improve the content of acetic acid and propionic acid, and further promote the Spiramycin biosynthesis.
Streptomyces spiramyceticus;spiramycin;Zn2+;biosynthesis
2017-04-08
武 培(1984—),男,硕士研究生,工程师,主要从事微生物发酵工作;通讯作者:张小红,女,博士,副教授,硕士生导师。
TQ465.5
A
1008-021X(2017)11-0020-03
