失效钴酸锂电极材料微结构修复研究*
2017-09-15王大辉杨玉娇陈怀敬孙建勇梁鸿雁
王大辉,杨玉娇,陈怀敬,2,孙建勇,梁鸿雁
环境·健康·安全
失效钴酸锂电极材料微结构修复研究*
王大辉1,杨玉娇1,陈怀敬1,2,孙建勇1,梁鸿雁1
(1.兰州理工大学有色金属先进加工与再利用省部共建国家重点实验室,甘肃兰州730050;2.兰州理工大学理学院)
提出了针对失效钴酸锂(LiCoO2)电极材料微结构修复的新工艺。将钴酸锂与硫酸氢钠(NaHSO4·H2O)分别按物质的量比为1∶0.05、1∶0.10混合,然后进行焙烧—溶解—修复。采用热重-差式扫描量热分析(TG-DSC)、电感耦合等离子体原子发射光谱仪(ICP-OES)、X射线衍射仪(XRD)、扫描电镜(SEM)等表征方法,研究了修复过程中材料的热量和质量的变化、成分的变化、相组成及晶胞参数的变化以及材料表面形貌的变化。研究结果表明,钴酸锂与硫酸氢钠混合在酸性环境焙烧的过程中其表面微结构发生了明显变化。以钴酸锂与硫酸氢钠物质的量比为1∶0.05的混合物经焙烧—溶解—修复所得钴酸锂,其晶格参数a=0.281 90 nm、c=1.390 41 nm、c/a=4.932 3,十分接近商用钴酸锂的晶格参数值。再生修复的钴酸锂材料颗粒粒径小,形状不规则。
失效钴酸锂;电极材料;微结构;修复
锂离子电池能够弥补煤、天然气等不可再生资源的缺陷,实现能源的高效转化和存储,受到越来越多高端消费产业的喜爱,得到广泛应用。由于锂离子电池使用寿命有限,因此其报废量逐年提升。废旧锂离子电池中含有大量有价金属,将失效锂离子电池再利用,不仅可以解决资源的供需矛盾,而且还能消除其对生态环境的威胁。锂离子电池正极材料的性能决定了该电池的电化学性能。目前商业化应用的正极材料主要有LiCoO2、LiMn2O4、LiFePO4和三元材料,其中LiCoO2所占市场份额最大。锂离子电池在长期的充放电过程中LiCoO2的微结构会发生变化[1],这是导致锂离子电池失效的主要原因。针对失效锂离子电池中LiCoO2的微结构(成分、结晶度、晶胞参数及表面Co元素的价态)进行修复,被认为是促进失效锂离子电池再利用的重要途径之一[2]。刘勇[3]研究表明,锂离子电池在循环过程中LiCoO2正极材料逐渐由六方层状结构(R3m群)向立方晶体结构(Fd3m)转变,Li+相对含量降低,并且材料表面Co3+2p轨道结合能增大。朱曙光等[4]、刘云建[5]和Kim等[6]将废锂离子电池正极材料中失效钴酸锂置于LiOH等溶液中进行修复与再生,结果表明修复的钴酸锂材料为层状结构,颗粒均匀且晶体表面光滑,首次充放电容量达到132.2、131.9 mA·h/g。刘云建等[7-8]向废LiCoO2中加入一定量Li2CO3,再在750~950℃烧结12 h合成LiCoO2,结果发现废LiCoO2中的Co3O4全部转化为LiCoO2,且样品分布较为均匀,颗粒粒径小,在850℃烧结温度合成的LiCoO2首次放电比容量达到151 mA·h/g。王大辉等[9-10]采用失效LiCoO2粉末与适量硫酸盐进行酸性焙烧,得到钴、锂的硫酸盐,钴、锂的硫酸盐经水溶液浸出—沉淀—再合成重新获得了电化学性能良好的LiCoO2电极材料。
笔者提出了针对失效LiCoO2电极材料微结构修复的新工艺,即将从报废的锂离子电池中获得的失效LiCoO2粉末在酸性气氛中进行表面剥离,然后添加适量的碳酸锂进行成分修复,得到微观结构较好的修复LiCoO2。研究了修复过程中材料的热量及质量的变化、成分的变化、相组成及晶胞参数的变化以及材料表面形貌的变化。
1 实验方法
将收集的以LiCoO2做正极活性物质的报废锂离子电池做放电处理,然后手工拆解获得正极片。将正极片经550℃/2 h焙烧,残余物采用水溶液浸泡处理,再经过滤、洗涤、烘干、焙烧获得LiCoO2粉末[11]。将LiCoO2粉末与化学纯硫酸氢钠分别按物质的量比为1∶0.05(样品1)、1∶0.10(样品2)混合均匀,置于加盖的陶瓷坩埚中,放入KSL-1200X-J型箱式电阻炉中(控温精度为±1℃)进行焙烧。焙烧产物经溶解、过滤、洗涤、干燥,干燥产物和碳酸锂按Li、Co物质的量比为1.06∶1混合,置于QM-3B型高速振动球磨机中球磨30 min,然后置于陶瓷坩埚中,再放入KSL-1200X-J型箱式电阻炉中(控温精度为±1℃)分别进行600℃/8 h、800℃/8 h两次焙烧,得性能良好的钴酸锂。
利用STA-449F3热分析仪研究焙烧过程材料的质量和热量变化。利用Agilent-725电感耦合等离子体原子发射光谱仪研究实验过程中锂、钴元素的质量变化。利用D/max-2400型X射线粉末衍射仪分析材料的物相结构。利用JSM-6701F型冷场发射扫描电子显微镜观察产物的形貌,利用能谱仪对产物微区成分进行分析。使用Jade6.0软件计算LiCoO2的晶格参数。
2 结果与讨论
2.1 TG-DSC分析
图1为失效LiCoO2(a)、样品2(b)TG-DSC曲线。从图1a看出,失效LiCoO2在25~600℃无明显的质量损失平台,略微质量损失及对应温度下的吸热、放热现象与废LiCoO2中仍含有极少量的炭粉等杂质有关。对比图1中a和b看出,LiCoO2与NaHSO4· H2O以1∶0.10物质的量比混合后,其TG-DSC曲线在质量损失台阶、质量损失率以及吸热峰方面均与单一LiCoO2表现出明显的不同,这表明LiCoO2和NaHSO4·H2O的混合物在焙烧过程中发生了相应的化学反应,该结果与Wang等[12]的研究结果一致。LiCoO2与NaHSO4·H2O混合样在25~150℃表现出明显的质量损失现象,且对应的DSC曲线有吸热峰出现;在150~300℃再次出现略微质量损失现象,且出现一个较弱的吸热峰;在300~600℃没有质量损失现象,但出现两个明显的吸热峰。

图1 失效LiCoO2(a)、样品2(b)的TG-DSC曲线
2.2 ICP-OES分析
为研究失效LiCoO2修复前后Li、Co含量的变化,对样品中Li、Co含量进行ICP-OES检测,结果见表1。由表1看出,失效LiCoO2中Li、Co物质的量比为0.902∶1,说明失效LiCoO2中Li元素缺失;样品1和样品2经焙烧、水洗所得残渣Li、Co物质的量比分别为0.739∶1、0.783∶1,均小于失效LiCoO2的Li、Co物质量比,说明LiCoO2与NaHSO4·H2O以两种比例混合焙烧发生了化学反应,且生成了溶于水的锂、钴盐;样品1和样品2修复后,其Li、Co物质的量比分别为1.078∶1、0.884∶1,说明LiCoO2与NaHSO4· H2O以1∶0.05物质的量比混合焙烧再经修复,有更多的Li嵌入到LiCoO2材料中,可以更好地提高LiCoO2材料的比容量。

表1 失效LiCoO2修复前后Li、Co含量变化
2.3 XRD分析
图2是失效LiCoO2(a)、样品1和样品2焙烧后水洗渣(b、c)、样品1和样品2添加Li2CO3修复所得LiCoO2材料(d、e)XRD谱图。从图2a看出,失效LiCoO2粉末中主要物相是LiCoO2,且峰型尖锐、对称、半峰宽较窄,表明LiCoO2粉末结晶度比较高。此外,还有少量Co3O4存在,这可能与脱锂态的钴酸锂受热发生分解有关。
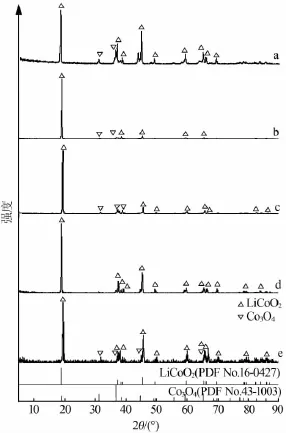
图2 失效LiCoO2(a)、样品1和样品2焙烧后水洗渣(b、c)、样品1和样品2添加Li2CO3修复所得LiCoO2(d、e)的XRD谱图
从图2b、c看出,LiCoO2与NaHSO4·H2O混合焙烧后水洗渣的残留物质主要是LiCoO2,与失效钴酸锂XRD谱图相比除最强峰外其余峰的峰高降低、峰强减弱、峰数减少;另一方面,水洗渣的残留物质还含有少量Co3O4,但与失效钴酸锂XRD谱图相比其峰强、峰高同样降低。这一结果表明LiCoO2与NaHSO4·H2O以物质的量比为1∶0.10、1∶0.05混合焙烧发生了相应的化学反应,且生成的产物溶于水,在一定程度上改变了废钴酸锂的晶体结构,这一结果与ICP-OES相对应。但是,由水洗渣残留物质XRD谱图看出,LiCoO2的(018)(110)峰分叉以及(006)(012)峰分叉没有完全出现,说明水洗残留渣中的钴酸锂不是层状结构或是层状结构不完美[13-14]。
从图2d、e可见,添加Li2CO3修复后的LiCoO2其(003)(101)(006)(012)(104)(015)(107)(018)(110)(113)等特征峰明显、峰型尖锐,与标准钴酸锂(PDFNo.16-0427)XRD谱图基本一致。修复钴酸锂晶体XRD谱图中出现(018)(110)峰分叉以及(006)(012)峰分叉,表明修复后钴酸锂材料为层状结构,结构有序,且有利于Li+在其中嵌入和脱出。
钴酸锂材料结晶程度可由I(003)/I(104)反映,且比值越大结晶度越好,Li+、Co+、O2-在(111)面上排列也越有序,越有利于Li+脱嵌[15]。其中,LiCoO2与NaHSO4· H2O分别以1∶0.10、1∶0.05物质的量比混合焙烧后水洗残留渣中添加Li2CO3修复LiCoO2的I(003)/I(104)分别为2.79、4.84。可以看出,LiCoO2与NaHSO4·H2O以1∶0.05物质的量比混合焙烧后水洗残渣对钴酸锂的修复层状结构好,可能是因为该比例下反应生成的硫酸盐水洗剥离后剩余的钴酸锂材料成分分布均匀、钴化合价单一,有利于对钴酸锂修复。
表2是不同LiCoO2样品晶格参数。a表示Co—Co之间距离,LiCoO2从半导体向金属导体转换的临界Co—Co距离为0.282 nm[16],如果Co—Co间距小于此值,表明LiCoO2将出现金属导电特性,提高电子导电率,这对电极材料性能的提高非常有利。从表2看出,修复LiCoO2的a均小于0.282 nm。在LiCoO2晶格参数中,c越大说明O—Co—O层距离越大,越有利于Li+在充放电过程中脱出和嵌入。从表2看出,LiCoO2与硫酸氢钠以1∶0.05物质的量比焙烧再修复的LiCoO2其c为1.390 41 nm,接近商用产品c。
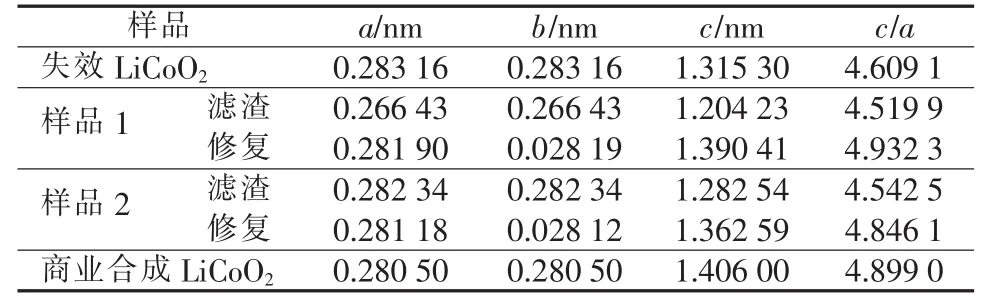
表2 不同LiCoO2样品晶格参数
2.4 SEM-EDS分析
图3是失效LiCoO2(a)、样品1和样品2焙烧后水洗渣(b、c)、样品1和样品2添加Li2CO3修复所得LiCoO2(d、e)的SEM照片。从图3a、b、c可以看出,回收得到的LiCoO2材料形状不规则,以块状为主,颗粒平均大小约为10 nm。由图3d、e可以看出,修复合成的钴酸锂颗粒细小,平均粒径远远小于10 nm。其中,与以LiCoO2和硫酸氢钠物质的量比为1∶0.10焙烧再修复合成LiCoO2的SEM相比,以物质的量比为1∶0.05焙烧再修复合成LiCoO2的空隙比较多,具有大量的界面结构和表面结构,具有比较开放的空间结构,有利于增加嵌锂的空间位置,提高嵌锂容量[17]。

图3 失效LiCoO2(a)、样品1和样品2焙烧后水洗渣(b、c)、样品1和样品2添加Li2CO3修复所得LiCoO2(d、e)的SEM照片
3 结语
失效LiCoO2与NaHSO4·H2O分别按物质的量比为1∶0.05、1∶0.10混合,在酸性环境焙烧过程中其表面结构发生了变化。再生修复的LiCoO2材料为层状结构,结晶程度较好,结构有序,晶格参数发生了变化。再生修复的LiCoO2材料粒径小,形状不规则。
[1]李卫,田文怀,其鲁.锂离子电池正极材料技术研究进展[J].无机盐工业,2015,47(6):1-5.
[2]王大辉,彭勃,陈怀敬,等.机械力作用对钴酸锂硫酸化焙烧产物的影响[J].无机盐工业,2016,48(3):20-24.
[3]刘勇.锂离子电池正极材料LiCoO2失效机理和再生的研究[D].天津:南开大学,2005.
[4]朱曙光,贺文智,李光明,等.废锂离子电池中失效钴酸锂材料超声再生[J].中国有色金属学报,2014,24(10):2525-2529.
[5]刘云建.钴酸锂原位再生的研究及其应用[D].长沙:中南大学,2006.
[6]Kim D S,Sohn J S.Simultaneous separation andrenovation of lithium cobalt oxide from the cathode of spent lithium ion rechargeablebatteries[J].J.PowerSources,2004,132(1):145-149.
[7]刘云建,胡启阳,李新海,等.从不合格锂离子蓄电池中直接回收钴酸锂[J].电源技术,2006,30(4):308-310.
[8]刘云建,胡启阳,李新海,等.钴酸锂的再生及其电化学性能[J].中国有色金属学报,2007,17(6):984-989.
[9]王大辉,王耀军,陈怀敬,等.LiCoO2在酸性焙烧环境中元素赋存形式的演变规律及分布特征研究[J].稀有金属材料与工程,2016,45(6):1500-1504.
[10]Wang D H,Wen H,Chen H J,et al.Research on chemical evolutionoftheLiCoO2andKHSO4mixturesintheroastingprocess[C]∥In Guangzhou:2016 international conference on material,energy and environment engineering,2016:38-44.
[11]王大辉,文豪.报废锂离子电池正极片上钴酸锂与铝箔的分离方法:中国,103985920[P].2014-08-13.
[12]Wang D H,Wen H,Chen H J,et al.Chemical evolution of LiCoO2and NaHSO4·H2O mixtures with different mixing ratios during roastingprocess[J].Chem.Res.ChineseU.,2016,32(4):674-677.
[13]Gopukumar S,Jeong Y,Kim K B.Synthesis and electrochemical performance of tetravalent doped LiCoO2in lithium rechargeable cells[J].Solid State Ionics,2003,159(3/4):223-232.
[14]Zou M J,Yoshio M,Gopukumar S,et al.Synthesis of high-voltage(4.5 V)cycling doped LiCoO2for use in lithium rechargeable cells[J].Chem.Mater.,2003,15(25):4699-4702.
[15]Wu F,Wang M,Su Y F,et al.A novel method for synthesis of layered LiNi1/3Mn1/3Co1/3O2as cathode material for lithium-ion battery[J]. J.Power Sources,2010,195(8):2362-2367.
[16]Antolini E.Lithium loss from lithium cobalt oxide:hexagonal Li0.5Co0.5O to cubic Li0.065Co0.935O phase transition[J].Int.J.Inorg. Mater.,2001,3(7):721-726.
[17]闫时建,张敏刚,田文怀,等.LiCoO2电极材料晶体结构的XRD和TEM研究[J].稀有金属材料与工程,2007,36(3):440-444.
联系方式:wangdh@lut.cn
一种高纯沉淀碳酸钙的制备方法
本发明公布了一种高纯沉淀碳酸钙的制备方法。具体步骤:1)以含有碳酸钙的矿物为原料,煅烧后得到含有氧化钙的产物;2)产物用氯化铵溶液洗脱;3)洗脱后得到氯化钙溶液,分离溶液中的不溶性组分;4)对氯化钙溶液进行碳化,分离碳化后得到的沉淀碳酸钙。实验得到的沉淀碳酸钙纯度>95%,其他杂质质量分数<0.5%,BET比表面积为3.5~12.5 m2/g,TAPPI白度为95%~99%,光反射率为96%~99%,黄色指数为0.5~3.0。
US,9725330
Study on microstructure repair of failure LiCoO2electrode materials
Wang Dahui1,Yang Yujiao1,Chen Huaijing1,2,Sun Jianyong1,Liang Hongyan1
(1.State Key Laboratory of Advance Processing and Recycling of Nonferrous Metals,Lanzhou University of Technology,Lanzhou 730050,China;2.College of Science,Lanzhou University of Technology)
A new technique for repairing the microstructure LiCoO2electrode materials was proposed,and the mixtures of LiCoO2and NaHSO4·H2O with the amount of substance ratio of 1∶0.05 and 1∶0.1,respectively,were roasted,dissolved,and repaired.The changes of heat,mass,phase composition,unit cell parameters,and the surface morphology were characterized by TG-DSC,ICP-OES,XRD,and SEM.Results indicated that the surface microstructure of the mixtures of LiCoO2and NaHSO4·H2O significantly changed during the calcination in acid environment.The LiCoO2lattice constants repaired 1∶0.05 mixtures of LiCoO2and NaHSO4·H2O approached to a=0.281 90 nm,c=1.390 41 nm,and c/a=4.932 3,which were very close to the value of commercial LiCoO2.Besides,the morphologies of regeneration LiCoO2were irregular and had a small particle size.
failure LiCoO2;electrode materials;microstructure;repair
TQ131.11
A
1006-4990(2017)09-0048-04
2017-03-22
王大辉(1972—),男,博士,教授。
国家自然科学基金项目(51264027);国家重点基础研究发展规划项目(973计划,2012CB722806)。
