硫酸镁与碳酸钠反应制备碱式碳酸镁的研究*
2017-09-15赵斌马雪晴白艳郭宏飞曹吉林
赵斌,马雪晴,白艳,郭宏飞,曹吉林
硫酸镁与碳酸钠反应制备碱式碳酸镁的研究*
赵斌,马雪晴,白艳,郭宏飞,曹吉林
(河北工业大学化工学院,河北省绿色化工与高效节能重点实验室,天津300130)
围绕七水合硫酸镁和碳酸钠为原料制备碱式碳酸镁,考察了复分解反应温度、热解温度、热解时间、反应物浓度、原料配比以及原料硫酸镁中加入硫酸钠等因素对硫酸镁转化率和产品结构形貌的影响。采用X射线衍射(XRD)、扫描电镜(SEM)对样品进行表征。结果表明:制备碱式碳酸镁的适宜条件为复分解反应温度为50℃、热解温度为85℃、热解时间为2 h、原料硫酸镁的浓度为0.3 mol/L、硫酸镁与碳酸钠物质的量比为1∶1.1;所得产品碱式碳酸镁为片状结构聚集的玫瑰花样棒状;原料硫酸镁中加入一定量硫酸钠对碱式碳酸镁的制备没有明显的影响。此外,设计了制备碱式碳酸镁的工艺,并实现了母液的循环利用。
碱式碳酸镁;硫酸镁;碳酸钠;硫酸钠
碱式碳酸镁是一种重要的无机化工材料,具有良好的填充性、分散性和流动性,是橡胶、塑料等制品的优良填充剂和补强剂,可以作为绝热和耐高温的防火保温材料和涂料以及牙膏、化妆品、医药等的添加剂,也可作为工业上的中间原料(或产品)制备高纯度的镁砂或氧化镁。碱式碳酸镁的合成方法大致分为纯碱法和碳酸化法。吴健松等[1]直接利用徐闻盐场苦卤为原料以氢氧化钠碱液作为沉淀剂制备了质优的碱式碳酸镁晶须;朱云等[2]曾采用工业级硫酸镁废液为原料制取碱式碳酸镁进而制得轻质碳酸镁;鲜海洋等[3]以温石棉尾矿为镁源对其进行煅烧,产物经盐酸浸取得到氯化镁溶液,再与碳酸氢铵进行碳化反应制得碱式碳酸镁晶须。但是,目前关于碱式碳酸镁的制备研究都重视产品的形貌和结构,几乎没有对原料的利用率特别是合成碱式碳酸镁后母液的利用进行研究,这不利于碱式碳酸镁制备工艺的工业化应用。白钠镁矾是一种含水的钠镁硫酸复盐(Na2SO4·MgSO4·4H2O),在中国的山西运城、内蒙古阿拉善盟、甘肃玉门、柴达木盆地西部等具有丰富的矿藏。针对该资源中硫酸钠和硫酸镁的分离利用人们进行了大量研究,出现了直接结晶分离法制备硫酸钠和硫酸镁[4]、与氯化钾转化法制备硫酸钾[5]、氢氧化钠沉淀法制备氢氧化镁[6]、硫酸铵盐析法分离硫酸钠和硫酸镁[7]等方法。白钠镁矾中硫酸镁的价值高于硫酸钠,硫酸镁除作为镁肥使用外主要用作原料制备氢氧化镁、氧化镁和碱式碳酸镁等无机产品。笔者为简化白钠镁矾的加工分离工艺和提高镁资源的利用价值,主要考虑硫酸镁原料的利用率并考虑产品的结构形貌进行了以硫酸镁和硫酸镁与硫酸钠的混合物为原料与碳酸钠反应制备碱式碳酸镁的研究。
1 实验部分
1.1 碱式碳酸镁晶须的制备
实验试剂:Na2SO4、Na2CO3、MgSO4·7H2O、EDTA、BaCl2、HCl,均为分析纯。
称量一定质量的MgSO4·7H2O加入100 mL三口烧瓶中,加入一定量水配成一定浓度的硫酸镁溶液。将三口烧瓶放入带有磁搅拌的恒温油浴锅中,调节油浴温度至反应温度,恒温5 min后加入称量好的无水碳酸钠固体于三口烧瓶中,开动磁搅拌进行复分解反应0.5 h。将反应后的混合物升温至热解温度,进行一段时间的热解反应。反应结束后停止搅拌,在热解温度下陈化一段时间。停止加热,将反应后的混合物减压过滤,得到滤液及滤饼。滤饼经3次洗涤,放入120℃烘箱中烘干得到固相产品。分析母液中各物质的含量。制备碱式碳酸镁反应如下:
复分解反应:

热解反应:

1.2 分析测试方法
样品物相结构表征采用D8 FOCUS型X射线衍射仪(XRD)。样品表观形貌表征采用Nova Nano SEM450型扫描电镜。镁离子含量测定采用EDTA络合滴定法;Na2CO3含量测定采用HCl标准溶液滴定法;硫酸根含量测定采用硫酸钡重量法;硫酸钠的含量用差减法计算。硫酸镁转化率是指参与反应制备碱式碳酸镁的硫酸镁质量占原料硫酸镁的质量分数,参与反应的硫酸镁质量通过原料中硫酸镁的质量减去制备碱式碳酸镁后母液中硫酸镁的质量得到。
2 结果与讨论
2.1 以硫酸镁为原料制备碱式碳酸镁条件的确定
2.1.1 复分解反应温度对制备碱式碳酸镁的影响
在MgSO4浓度为0.3 mol/L、MgSO4与Na2CO3物质的量比为1∶1.1、复分解反应时间为0.5 h、热解温度为85℃、热解时间为3 h条件下,考察复分解反应温度对反应后母液的组成及反应物转化率的影响,结果见表1。从表1看出3个温度条件下均可使绝大部分硫酸镁转变为碱式碳酸镁和硫酸钠,但不能使原料硫酸镁与碳酸钠发生完全反应。50℃时母液中硫酸镁和Na2CO3含量最低,说明此时硫酸镁和Na2CO3转化率最高。因此确定反应温度为50℃。
2.1.2 热解时间对制备碱式碳酸镁的影响
在MgSO4浓度为0.3 mol/L、MgSO4与Na2CO3物质的量比为1∶1.1、复分解反应温度为50℃、复分解反应时间为0.5 h、热解温度为85℃条件下,考察热解时间对反应后母液的组成及反应物转化率的影响,结果见表2。从表2看出,热解时间在2~4 h母液中硫酸镁与碳酸钠的含量变化不明显,说明增加热解时间并不能提高硫酸镁的转化率。

表2 热解时间对母液中各物质含量的影响
热解时间为2 h及5 h时所得固相产品XRD谱图见图1。图1表明两个样品的峰位置和峰强度极为相近,均为碱式碳酸镁晶体,说明延长复分解反应时间对产品的结构没有明显的影响。从节能角度考虑确定热解时间为2 h。
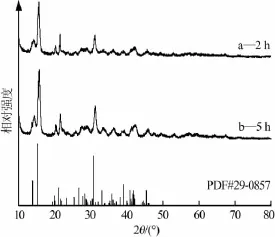
图1 不同热解时间所得产品XRD谱图
2.1.3 热解温度对制备碱式碳酸镁的影响
在MgSO4浓度为0.3 mol/L、MgSO4与Na2CO3物质的量比为1∶1.1、复分解反应温度为50℃、复分解反应时间为0.5 h、热解时间为2 h条件下,考察热解温度对反应后母液的组成及反应物转化率的影响,结果见表3。从表3看出,热解温度为90℃时母液中MgSO4及Na2CO3的含量稍低于80、85℃时的含量,而80℃和85℃时母液中各离子含量差别较小。
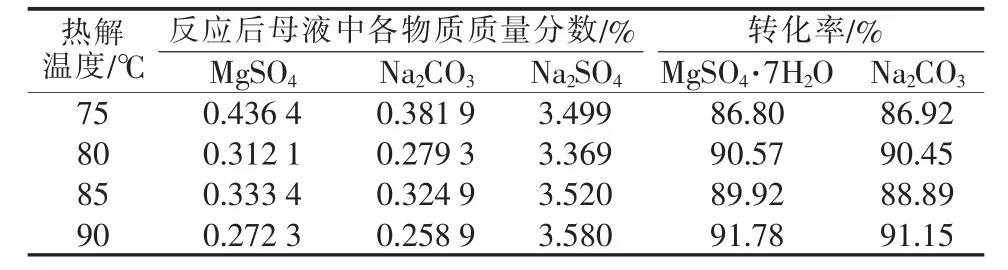
表3 热解温度对母液中各物质含量的影响
图2为热解温度为80、85℃时所得固相产品XRD谱图。图2表明两个样品均为碱式碳酸镁,热解温度为85℃所得固相产品的特征峰较80℃时尖锐且峰强度更强,说明其结晶度更高。综合考虑母液中MgSO4及Na2CO3的含量以及产品的结晶度,选择热解温度为85℃。
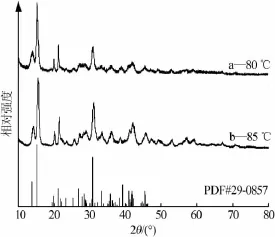
图2 不同热解温度所得产品XRD谱图
2.1.4 原料配比对制备碱式碳酸镁的影响
在MgSO4浓度为0.3 mol/L、复分解反应温度为50℃、复分解反应时间为0.5 h、热解温度为85℃、热解时间为2 h条件下,考察MgSO4与Na2CO3物质的量比对反应后母液组成及反应物转化率的影响,结果见表4。从表4看出,随着碳酸钠用量增加,反应后母液中硫酸镁含量呈现下降趋势,而碳酸钠和硫酸钠含量呈现增加趋势,但实验条件下均不能使原料中的硫酸镁全部反应转化为碱式碳酸镁。
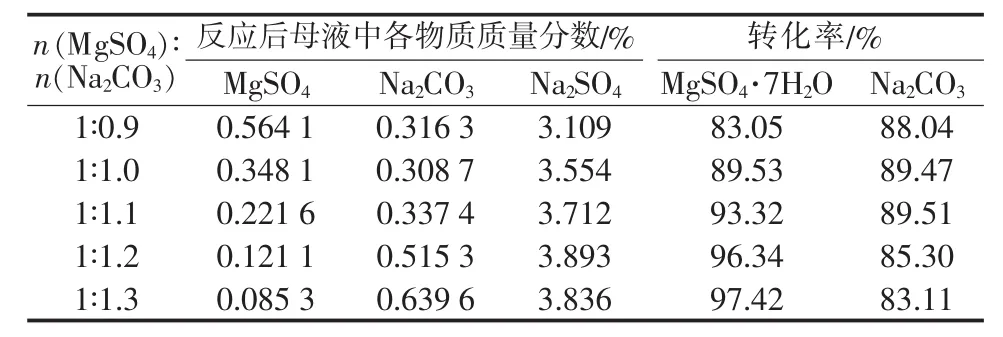
表4 原料配比对母液中各物质含量的影响
原料配比分别为1∶1.1、1∶1.2、1∶1.3时所得固相产品XRD谱图见图3。由图3可以看出,不同原料配比所得产品均为碱式碳酸镁且它们的特征峰强度和峰位置都很相近,说明增加碳酸钠含量不会影响产品结构。对应产品SEM照片见图4。由图4可以看出产品的形貌都为小片状结构聚集而成的玫瑰花样棒状体,形貌差别不大。综合反应后母液中MgSO4的含量及产品的形貌结构,选择原料配比为1∶1.1。
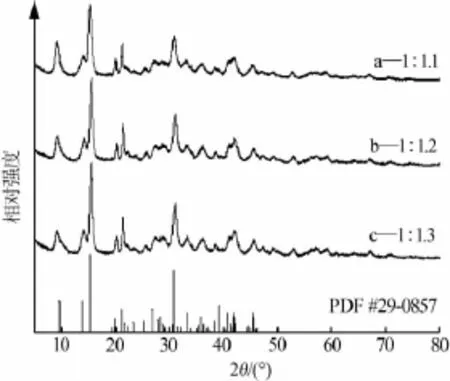
图3 不同原料配比所得产品XRD谱图

图4 不同原料配比所得产品SEM照片
2.1.5 反应物浓度对制备碱式碳酸镁的影响
在硫酸镁浓度分别为0.3、0.6、1.0、1.5 mol/L时进行碱式碳酸镁的制备实验。发现硫酸镁浓度为1.0、1.5 mol/L时,固体Na2CO3颗粒加入到MgSO4溶液中后,溶液内生成水合碳酸镁固相凝结在一起,液相含量极少,生成的水合碳酸镁前驱体包裹未溶解的Na2CO3固体,使原料混合极不均匀,反应继续进行极为困难。为此,在复分解反应温度为50℃、复分解反应时间为0.5 h、热解温度为85℃、热解时间为2 h条件下,在MgSO4与碳酸钠物质的量比分别为1∶0.9、1∶1.1、1∶1.3时进行了硫酸镁浓度为0.6 mol/L制备碱式碳酸镁实验,反应后母液的组成及反应物的转化率见表5。由表5看出,MgSO4与碳酸钠物质的量比为1∶0.9时MgSO4的反应量最少,而MgSO4与碳酸钠物质的量比为1∶1.1、1∶1.3时母液中Mg2+的含量明显减少,但是Na2CO3的含量明显增加。由于Na2CO3-Na2SO4-H2O三元体系中纯的Na2CO3和Na2SO4的单盐结晶区较小,而Na2CO3和Na2SO4可以形成复盐且复盐与Na2CO3或Na2SO4的共结晶区很大,所以当母液中Na2CO3的含量较高时,通过降温结晶的方法难以分离出纯的硫酸钠。因此,增大原料中碳酸钠相对于MgSO4的理论反应量会造成母液中Na2CO3相对于Na2SO4含量的增加,不利于碱式碳酸镁合成工艺中硫酸钠的分离和母液的循环利用。
表5 反应物浓度对母液中各物质含量的影响
MgSO4与碳酸钠物质的量比为1∶1.1、硫酸镁浓度分别为0.3、0.6 mol/L时所得固相产物XRD谱图见图5。从图5看出,低硫酸镁浓度及高硫酸镁浓度所得产品的XRD谱图均可与标准卡片相匹配,但高硫酸镁浓度时所得产物的衍射峰强度相对于低硫酸镁浓度所得产物的衍射峰强度弱。
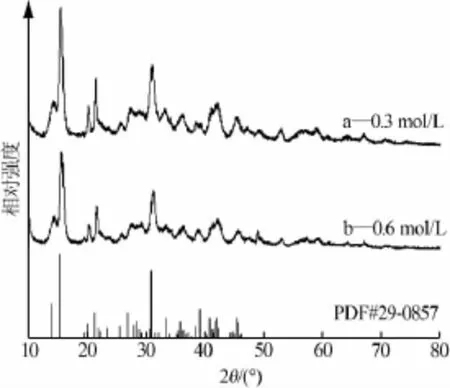
图5 不同硫酸镁浓度所得产品XRD谱图
综合考虑单因素实验,确定硫酸镁与碳酸钠反应制备碱式碳酸镁的适宜条件:MgSO4浓度为0.3 mol/L,MgSO4与碳酸钠物质的量比为1∶1.1,复分解反应温度为50℃,复分解反应时间为0.5 h,热解温度为85℃,热解时间为2 h。
2.2 硫酸镁与硫酸钠混合物为原料制备碱式碳酸镁
为开发白钠镁矾为原料制备碱式碳酸镁的工艺,同时也考虑到纯硫酸镁为原料合成碱式碳酸镁后母液的循环利用,需要对硫酸镁与硫酸钠混合物为原料制备碱式碳酸镁进行研究。在2.1节确定的适宜条件下,对原料中MgSO4与Na2SO4不同物质的量比进行制备碱式碳酸镁的实验,结果见表6。从表6看出,随着Na2SO4加入量的增加母液中Na2SO4的含量明显增加,而其他两种物质含量的变化不是十分明显,说明反应原料中加入Na2SO4对硫酸镁与碳酸钠的反应影响不大。常温(20℃)下Na2SO4的溶解度为19.5 g(100 g水),故实验中将反应后的混合物冷却至室温不会出现Na2SO4析出。

表6 MgSO4与Na2SO4物质的量比对母液中各物质含量的影响
图6为硫酸镁与硫酸钠物质的量比为1∶0.5、1∶1.0所得固相产品XRD谱图,图7为对应产物SEM照片。图6表明两产物均为碱式碳酸镁且特征峰强度和峰位置都很相近;图7表明两产物形貌均为小片状结构聚集而成玫瑰花样棒状体,形貌差别不大。这说明反应原料中加入Na2SO4对产品的结构和形貌没有影响。
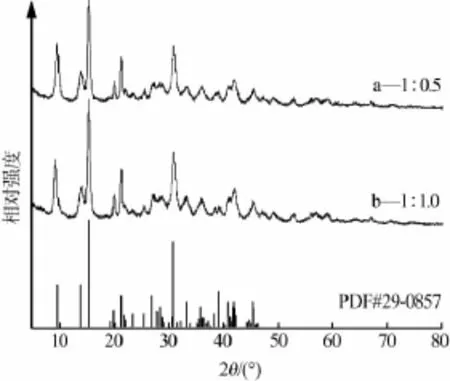
图6 不同MgSO4与Na2SO4物质的量比所得产品XRD谱图

图7 不同MgSO4与Na2SO4物质的量比所得产品SEM照片
2.3 碱式碳酸镁制备工艺设计
以硫酸镁或硫酸镁与硫酸钠的混合物为原料与碳酸钠反应制备碱式碳酸镁,均不能使原料中硫酸镁完全转化,反应后的母液中除反应物硫酸钠外总有少量没有反应的硫酸镁和碳酸钠存在,反应后母液体系组成为MgSO4-Na2CO3-Na2SO4-H2O。为对母液中的副产品硫酸钠进行分离,并对未反应原料硫酸镁和碳酸钠进行循环再利用,需要依据MgSO4-Na2CO3-Na2SO4-H2O体系相图进行工艺分析,但是目前没有该体系的溶解度数据和相图。针对合成母液体系中硫酸镁和碳酸钠含量低且远没有达到饱和,而Na2SO4含量近似为硫酸镁或碳酸钠含量10倍的特点,可近似将MgSO4看做Na2CO3或将Na2CO3看做MgSO4,依据Na2CO3-Na2SO4-H2O、MgSO4-Na2SO4-H2O体系相图,进行硫酸钠结晶分离工艺设计。
常温(20℃)下Na2SO4溶解度为19.5 g(100 g水),而降到低温(0℃)时其溶解度仅为4.9 g(100 g水)。所以可以采用降温结晶的方法将合成碱式碳酸镁后母液中的硫酸钠分离出来。图8为0℃时Na2CO3-Na2SO4-H2O体系相图[8],可以看出以硫酸镁或白钠镁矾(硫酸镁和硫酸钠物质量比为1∶1)为原料,在适宜条件下合成碱式碳酸镁后母液的组成点均落在了Na2SO4·10H2O结晶区,降温到0℃时即可析出Na2SO4·10H2O,析出Na2SO4·10H2O的母液作为反应介质可返回溶解硫酸镁或白钠镁矾,进行下一个制备碱式碳酸镁的过程,从而实现稳定生产。图9为碱式硫酸镁制备工艺流程图。

图80 ℃Na2CO3-Na2SO4-H2O三元体系相图
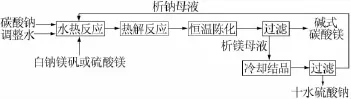
图9 制备碱式硫酸镁工艺流程图
3 结论
1)以MgSO4·7H2O和Na2CO3为原料通过单因素实验考察了各因素对制备碱式硫酸镁的影响,确定适宜制备条件:复分解反应温度为50℃,原料硫酸镁与碳酸钠物质的量比为1∶1.1,热解温度为85℃,热解时间为2 h,原料硫酸镁浓度为0.3 mol/L。2)以硫酸镁和硫酸钠为原料与Na2CO3反应制备碱式硫酸镁,在硫酸镁和硫酸钠物质的量比分别在1∶0、1∶1条件下均可合成碱式硫酸镁,一定量Na2SO4的加入对硫酸镁和Na2CO3的反应转化率没有明显影响,也不影响产品形貌。3)设计了硫酸镁或硫酸镁与硫酸钠混合物为原料与碳酸钠反应制备碱式碳酸镁的工艺,合成碱式碳酸镁的母液通过冷却结晶分离出Na2SO4·10H2O后,母液作为反应介质可以循环与原料混合,重新进行碱式碳酸镁的稳定生产。
[1]吴健松,梁海群,黄雪清.徐闻盐场苦卤制备Mg2(OH)2CO3· 3H2O晶须[J].人工晶体学报,2015,44(6):1713-1717.
[2]朱云,郭淑仙,李智.以硫酸镁废液为原料制取轻质碳酸镁[J].矿产综合利用,2006(5):27-30.
[3]鲜海洋,姜延鹏,彭同江,等.以温石棉尾矿为镁源制备碱式碳酸镁晶须[J].非金属矿,2011,34(5):1-3,7.
[4]韩蔚田,谷树起.对Na+,Mg2+∥Cl-,SO42--H2O四元体系多温图的修正[J].科学通报,1981(16):989-991.
[5]黄雪莉,高飞.迪木拉提.钠镁矾类矿制取硫酸钾工艺开发研究[J].海湖盐与化工,2001,30(5):8-11.
[6]王林祥,孙敬锋,陆海涛,等.内蒙古某地芒硝矿选矿试验研究[J].矿产保护与利用,2006(4):31-33.
[7]曹吉林,郭宏飞,张广林,等.一种由白钠镁矾加工制备硫酸钠和氮镁复肥的方法:中国,102583451A[P].2012-07-18.
[8]曾英,郑志远,林晓锋.Na2CO3-Na2SO4-H2O三元体系273 K相平衡实验研究[C]∥北京:中国化学会第26届学术年会无机与配位化学分会场论文集,2008.
Research on preparation of magnesium carbonate hydroxide by MgSO4reacting with Na2CO3
Zhao Bin,Ma Xueqing,Bai Yan,Guo Hongfei,Cao Jilin
(School of Chemical Engineering&Technology,Hebei University of Technology,Hebei Provincial Key Lab of Green Chemical Technology&High Efficient Energy Saving,Tianjin 300130,China)
Magnesium carbonate hydroxide was successfully prepared using MgSO4·7H2O and Na2CO3as staring materials. The effects of the reaction temperature,pyrolysis temperature,pyrolysis time,reactant concentration,molar ratios of raw materials,and adding Na2SO4into the raw material of magnesium sulfate on the conversion rate of magnesium sulfate and product structure morphology were investigated.X-ray powder diffraction and scanning electron microscopy were employed to characterize the samples.Results demonstrated that the suitable conditions of the preparation of magnesium carbonate hydroxide were as follows:reaction temperature was 50℃,pyrolysis temperature was 85℃,pyrolysis time was 2 h,raw material MgSO4concentration was 0.3 mol/L,the amount of substance ratio of MgSO4·7H2O to Na2CO3was 1∶1.1;the shape of magnesium carbonate hydroxide is roses rod with lamellar structure gathering;There was no significant effect on the preparation of magnesium carbonate hydroxide,when a certain amount of sodium sulfate was added into raw materials of magnesium sulfate. In addition,the preparation of basic magnesium carbonate process was designed and the mother liquor can be recycled.
magnesium carbonate hydroxide;magnesium sulfate;sodium carbonate;sodium sulfate
TQ132.2
A
1006-4990(2017)09-0021-05
2017-03-25
赵斌(1966—),男,研究生,研究方向为精细无机化学品制备。
曹吉林
国家自然科学基金项目(21076057);河北省自然科学基金项目(B2017202268)。
联系方式:cao_jilin@126.com
