和田羊睾丸支持细胞的体外培养与分离鉴定
2017-09-15贾琦珍王连群陈根元
王 帅,贾琦珍,张 玲,王连群,陈根元
和田羊睾丸支持细胞的体外培养与分离鉴定
王 帅,贾琦珍,张 玲,王连群,陈根元*
(塔里木大学动物科学学院/新疆生产建设兵团塔里木畜牧科技重点实验室,新疆阿拉尔 843300)
【目的】研究和田羊睾丸支持细胞的体外培养特性。【方法】取新生和田羊睾丸组织,利用两步酶消化后,采用差速贴壁法纯化细胞进行体外培养,并通过形态学观察、HE染色、AKP染色、油红O染色、吖啶橙染色、罗丹明123染色、免疫组化染色、RTPCR和MTT法检测细胞活性及纯度。【结果】培养基中加入2.00%血清浓度的DMEM/F-12可提高支持细胞纯度,在体外培养传至20代的和田羊睾丸支持细胞形态和核型均为正常;所培养的细胞内波形蛋白表达及标志基因SCF和GDNF的表达均为阳性。【结论】本试验成功建立了和田羊睾丸支持细胞体外培养模型。
和田羊;睾丸;支持细胞;体外培养;鉴定
【研究意义】和田羊是新疆南疆地区和田、阿克苏等地的主要放牧品种,具有耐粗饲、适应性强、抗病力强等特点,目前已被农业部列入《国家级畜禽遗传资源保护名录》[1]。和田羊的羊毛具有较好的弹性和光泽度,是本区维吾尔优质地毯的主要原料[2]。【前人研究进展】目前新疆南疆地区因牲畜数量增长、过度放牧、缺水等原因,导致本地草甸、草场严重退化,豆科黄芪属和棘豆属等疯草植物大量蔓延。近年来,和田羊因采食疯草而导致大量中毒,目前已严重影响了南疆地区畜牧业的可持续发展[3]。王帅等[4]研究发现,和田羊采食疯草中毒的主要表现为繁殖系统损伤,其中和田羊公羊性欲降低、精子数量减少、无配种能力,严重时甚至死亡。【本研究切入点】睾丸支持细胞是曲精细管的组成部分,分布于各期生精细胞中。支持细胞是生精上皮中的唯一体细胞,可分泌必要的营养成分,并作为生精细胞的支架,起到营养、支持及保护生精细胞的作用,使精原细胞可顺利分化为精子[5]。疯草中毒和田羊临床表现为精子数量减少,可能与疯草毒性物质导致的生精细胞、支持细胞损伤有关。【拟解决的关键问题】本研究以新生24 h雄性和田羊羊羔为研究对象,通过分离其睾丸支持细胞并进行体外培养,优化和田羊睾丸支持细胞的培养条件,以期得到纯度高、活性强的和田羊睾丸支持细胞,为探讨疯草毒性成分对雄性和田羊繁殖系统损伤的机制提供基础。
1 材料与方法
1.1 材料
试验新生24 h雄性和田羊羊羔由塔里木大学动物科学学院实验基地提供。
DMIL-PH1型倒置相差显微镜,DMI4000B型倒置荧光显微镜,德国Leica;GELDOC-1T型凝胶成像分析仪,美国UVP;PRO 250型组织匀浆仪,美国Pro Scientific;3110型CO2培养箱,美国Thermo;5480R型高速冷冻离心机、5331型PCR仪、Realplex2型实时荧光定量PCR仪,德国Eppendorf。
胰蛋白酶、胶原酶、罗丹明123、L-谷氨酰胺、丙酮酸钠、β-巯基乙醇、苏木精染液、丝裂霉素-C、EDTA、吖啶橙染料、油红O染料均购自Sigma公司,胎牛血清、DMEM/F12和小牛血清均购自GIBCO公司,试验所用抗体购自Santacruz公司,RNA提取试剂盒、Taq酶、dNTPs和反转录试剂盒等均购自TAKARA宝生物工程(大连)公司,AKP试剂盒购自华美生物工程有限公司。
1.2 新生和田羊睾丸支持细胞的分离及培养
参考前人[5-8]研究,75.00%酒精消毒后,于无菌条件下将新生24 h和田羊羊羔断头处死,将睾丸组织剥离白膜和血管后,浸于双抗液+pH 7.20的磷酸缓冲液中浸洗3次,剪碎。把剪碎的组织800 r/min离心2 min后弃上清,依次用10倍体积的0. 15%胶原酶和0.25%胰蛋白酶进行两步法消化,添加少量pH 7.20的磷酸缓冲液800 r/min离心1 min,收集上清,100μm滤网过滤后的细胞悬液以1000 r/min离心10 min,将细胞使用含10.00%胎牛血清的髙糖DMEM培养基进行悬浮,调整细胞至接种密度,在37℃、5%CO2的条件下培养。24 h后更换培养基DMEM/F12,并除去死亡细胞,每48 h更换2/3的培养基,之后根据细胞生长情况进行传代培养。
1.3 和田羊睾丸支持细胞的传代培养
从细胞培养瓶中吸取和田羊睾丸支持细胞培养液,用pH 7.20的磷酸缓冲液清洗数次以去除死亡的睾丸支持细胞。加入适量0.25%胰蛋白酶液于培养瓶中,镜检观察发现培养液中出现细胞突起缩回、间隙增大、近乎缩成圆形时终止消化,通过吸管吹打脱落和田羊睾丸支持细胞。然后使用含10.00 %胎牛血清的髙糖DMEM培养基重新悬浮细胞,调整细胞密度至1×106个/mL,接种后在37℃、5 %CO2的条件下培养。每24 h观察,每48 h更换2/3的培养基。
1.4 和田羊睾丸支持细胞的鉴定
根据睾丸支持细胞的特性,参考Aumuller G[9]、Allard E K[10]和Aponte PM[11]的研究,对培养得到的和田羊睾丸支持细胞进行形态学染色(HE染色)、特征性染色(AKP染色、罗丹明123染色、油红O染色和吖啶橙染色)及免疫组化染色。并参照RNA提取试剂盒说明书提取和田羊睾丸支持细胞总RNA,将合格RNA利用gDNA Eraser去除基因组DNA,反应条件:42℃,2min。然后采用两步法进行反转录以检测支持细胞标志基因SCF和GDNF,反应体系为Prime Script®Buffer 5×4.00μl,Prime Script®RT Enzyme MixⅠ1.00μl,RT Primer Mix 1. 00μl,RNA提取液10.00μl,RNase Free dH2O 4.00 μl;反应条件:37℃15 min,85℃5 s。引物序列见表1,由TAKARA宝生物工程(大连)公司合成。
1.5 和田羊睾丸支持细胞的活性测定
将培养的和田羊睾丸支持细胞悬液浓度调整为1×105个/mL,然后接种于96孔细胞板中,每2 d更换1/2的细胞培养液。参考贾琦珍等[3]的研究,于培养的第1、2、3、4、5、6、7、8天对培养细胞进行MTT检测,每组设置6个重复。确定培养的和田羊睾丸支持细胞活性最强的时间段以进行下一步实验。

表1 引物序列信息Table1 The nucleotide sequence of primers

图1 和田羊睾丸支持细胞的体外培养Fig.1 The culture of testis sertoli cells in Hetian sheep in vitro
1.6 和田羊睾丸支持细胞染色体的制备
将培养的和田羊睾丸支持细胞悬液浓度调整为1×106个/mL浓度后接种于细胞培养基中,然后向细胞培养基中加入0.20 mg/L的秋水仙素溶液,孵育4 h后1000 r/min离心10 min收集细胞。0.075 mol/L KCl溶液处理,固定液(V(甲醇)∶V(冰乙酸) =3∶1)预处理3 min,然后正式固定20 min,重复3次。染色后镜检观察其核型,并进行计数。
2 结果与分析
2.1 新生和田羊睾丸支持细胞的体外培养特性
镜检发现,在原代培养过程(图1)中,新分离的和田羊睾丸支持细胞为圆形,以均一的单细胞态存在;生长试验表明和田羊睾丸支持细胞贴壁速度快于和田羊睾丸精原细胞,约0.5 h时和田羊睾丸支持细胞即有突起贴壁长出,2 h时80%以上的和田羊睾丸支持细胞已贴壁,4 h后可观察到部分贴壁细胞具胞体伸展现象。培养24 h后,和田羊睾丸支持细胞数量增多、体积变大,细胞两侧具多个突起;培养48 h后,和田羊睾丸支持细胞基本以单层铺在瓶底,试验表明培养3~4 d和田羊睾丸支持细胞即可铺满瓶底。新生和田羊睾丸支持细胞传代后约2 d即可增殖1代,但传至6代以后速度明显减缓,传代时间间隔延长,部分细胞的细胞质出现空泡,而且细胞边缘多呈现为拉丝状。传至第20代时需14~15 d左右才能铺满培养皿底壁,而且传代后的细胞基本不增殖,部分细胞死亡并悬浮于培养液中。
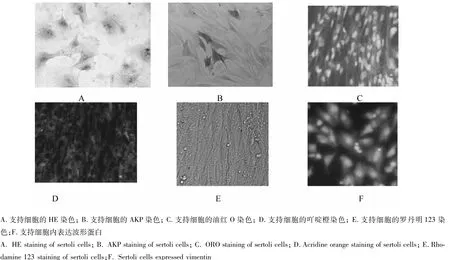
图2 和田羊睾丸支持细胞的鉴定Fig.2 The identification of testis sertoli cells in Hetian sheep in vitro
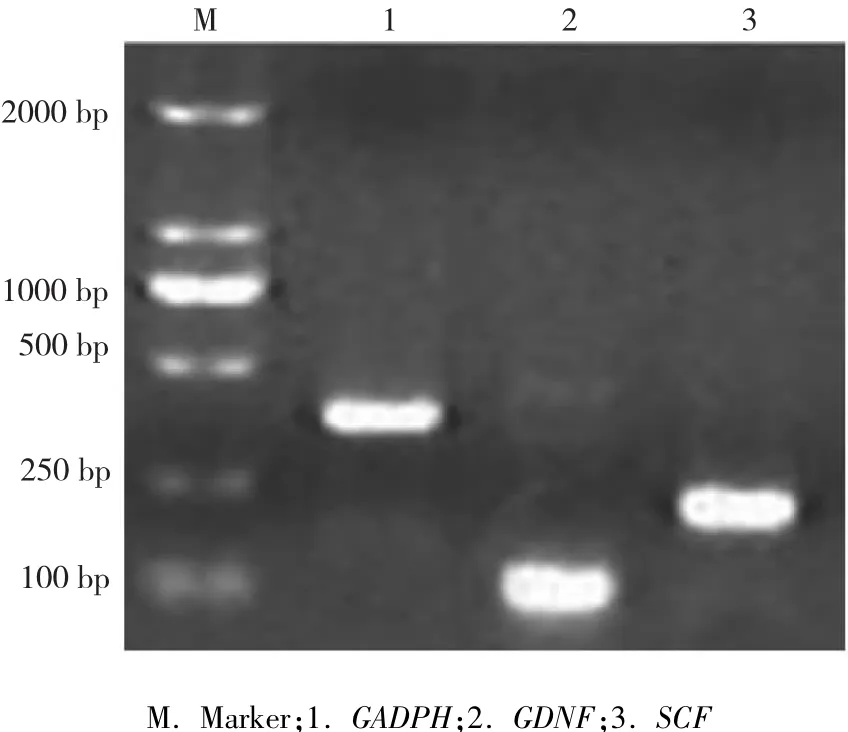
图3 支持细胞中标志基因的表达检测Fig.3 Marker gene expression detection of sertoli cells
2.2 新生和田羊睾丸支持细胞的鉴定
HE染色结果表明新生和田羊睾丸支持细胞胞核位于胞质中央或偏位,染色较深,而细胞质染色不明显(图2-A);AKP染色鉴定发现新生和田羊睾丸支持细胞不着色,为AKP阴性(图2-B);油红O染色鉴定发现新生和田羊睾丸支持细胞中油滴被染为红色,细胞核被染为淡蓝色,并可见双极小体(图2-C);吖啶橙染色鉴定发现新生和田羊睾丸支持细胞细胞质被染为桔红色,而胞核被染为绿色(图2-D);罗丹明123染色鉴定发现新生和田羊睾丸支持细胞细胞质在荧光显微镜下可见发绿色荧光的线粒体(图2-E)。免疫组化结果表明培养的新生和田羊睾丸支持细胞内波形蛋白表达明显(图2-F)。RTPCR结果表明培养的新生和田羊睾丸支持细胞中SCF和GDNF基因均显著表达(图3)。
2.3 新生和田羊睾丸支持细胞的活性测定结果
由MTT法检测(图4)可知,培养前5 d时新生和田羊睾丸支持细胞活性呈上升趋势,第5天时其检测值最高,之后开始下降。表明培养第5天时的新生和田羊睾丸支持细胞的活力最强,可用于下一步试验。
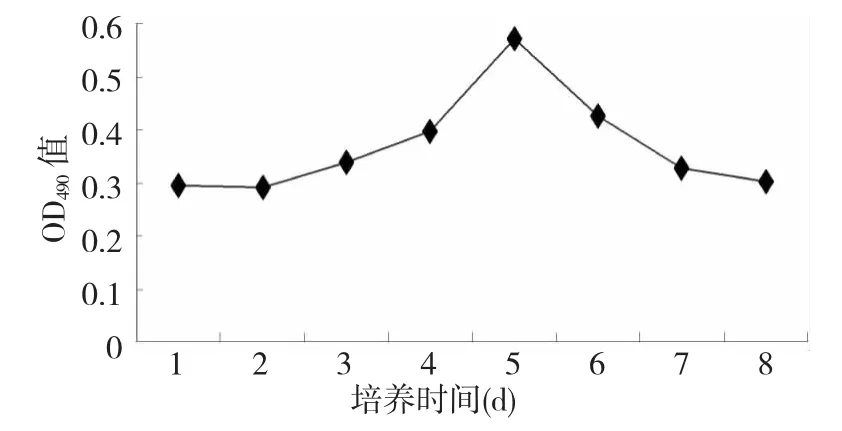
图4 MTT法检测不同培养时间睾丸支持细胞的活性Fig.4 The viabilitymeasurement of testis sertoli cells at various culturing time by MTT assay
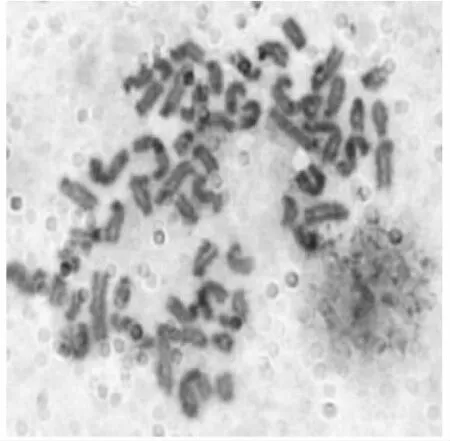
图5 和田羊睾丸支持细胞核型分析Fig.5 The karyotype analysis of testis sertoli cells in Hetian sheep
2.4 新生和田羊睾丸支持细胞染色体核型分析
如图5所示,体外培养至第5天的新生和田羊睾丸支持细胞内均含有正常的二倍体核型,计数可得新生和田羊睾丸支持细胞中共有42条染色体。
3 讨 论
支持细胞是动物睾丸曲精上皮中唯一的体细胞,可通过分泌多种蛋白质,促进局部免疫豁免而参与精子的发生过程。睾丸支持细胞不仅为精子的发生提供有利的微环境,还可清除凋亡的精子细胞,优化精子质量,目前已被广泛应用于繁殖细胞发育研究。胚胎动物具有细胞分化程度低、体外生存能力强等优点,使用新生动物体外培养可获得高活率的睾丸组织细胞。蛋白酶消化法因其对细胞的损害程度较轻,已成为国内外学者[6,12]采用较多的方法。本试验采用两步酶消化法,先用胶原酶去除曲精细管间的间质细胞和管周细胞,然后再用胰蛋白酶释放出曲精细管中的支持细胞。结果表明,该方法获得的睾丸支持细胞纯度较高。与Bucci等[12]和张学明等[13]的研究相比,本试验以短时间的胰蛋白酶消化取代透明质酸酶和脱氧核糖核酸酶作用,既避免了长时间的酶作用对细胞的损伤,又得到了较好的分离效果,说明胰蛋白酶的选择和两步酶消化法的确定有利于新生和田羊睾丸组织的消化分离。
研究表明,睾丸管周细胞为AKP染色阳性,而睾丸支持细胞为AKP染色阴性;油红O染色可用来鉴定细胞中是否含有油滴,而双极小体和油滴是睾丸支持细胞所特有;吖啶橙染色显示细胞质被染成桔红色,细胞核被染成绿色,与睾丸支持细胞中胞质富含RNA,胞核富含DNA的特性一致;罗丹明123可对睾丸支持细胞中富含的线粒体膜电位进行染色鉴定;波形蛋白可用于区分精原干细胞和睾丸支持细胞,GDNF和SCF均为鉴定睾丸支持细胞的特征性基因。本试验通过对新生和田羊睾丸支持细胞进行体外培养试验,并利用形态学方法、相关染色、免疫组化染色及分子生物学技术进行了相应的鉴定。结果表明,本试验获得了纯度较高的睾丸支持细胞。MTT法具有成本低、灵敏度高等特点,是现代分子生物学和细胞生物学的常用分析方法[3,14]。本研究结果表明,体外培养的新生和田羊睾丸支持细胞在前5 d为活性上升期,第5天活性最强;核型分析表明培养的睾丸支持细胞具有正常的二倍体构型,即本试验成功培养出活性正常的和田羊睾丸支持细胞,培养第5天的细胞可用于外源毒性物质对细胞结构、功能的影响研究。
血清是动物细胞培养基中重要的组成部分,可为细胞培养提供必要的营养成分,从而促进细胞的生长;又可通过内含的生长调节因子与激素抑制细胞的过速生长,从而对细胞生长的过程进行调节。本试验结果表明,含有2.00%浓度血清的细胞培养基可促进新生和田羊睾丸支持细胞的体外生长速率,该研究结果对和田羊睾丸支持细胞的驯化和筛选均具有一定的研究意义。
4 结 论
本试验利用胶原酶和胰蛋白酶进行两步法消化新生和田羊睾丸组织,然后采用差速贴壁法纯化细胞进行体外培养。镜检及染色结果表明,培养基中加入2%血清浓度的DMEM/F-12可提高支持细胞纯度,在体外培养传至20代的和田羊睾丸支持细胞形态和核型均为正常,所培养的细胞内波形蛋白表达及标志基因SCF和GDNF的表达均为阳性,MTT法测定第5天时细胞活性最强。通过试验建立了稳定的和田羊睾丸支持细胞体外培养模型。
[1]王 帅,贾琦珍,陈根元,等.小花棘豆中毒对和田羊瘤胃微生物数量的影响[J].中国兽医学报,2014,34(8):1358-1363.
[2]王 帅,贾琦珍,陈根元,等.小花棘豆中毒对和田羊血清蛋白和血脂的研究[J].中国畜牧兽医,2014,41(2):148-152.
[3]贾琦珍,岳耀峰,陈根元,等.和田羊大脑皮质神经细胞体外培养与鉴定[J].中国畜牧杂志,2016,52(17):33-36.
[4]王 帅,廖秋萍,贾琦珍,等.小花棘豆中毒对和田羊丘脑-垂体-性腺轴α-甘露糖苷酶的影响[J].中国畜牧杂志,2015,51 (23):59-62.
[5]于 磊,郑 鹏,荣恩光,等.新生牛睾丸支持细胞的体外培养及鉴定分析[J].吉林农业大学学报,2013,35(1):63-66.
[6]黄东晖,赵 虎,田永红,等.大鼠睾丸支持细胞的分离、纯化和鉴定[J].解剖学报,2007,38(2):246-249.
[7]丁海雷.鸡精原干细胞和支持细胞的分离培养与鉴定[D].江苏扬州:扬州大学,2008.
[8]葛秀国,张 伟,丁向斌,等.成年犬睾丸支持细胞体外分离培养的研究[J].黑龙江畜牧兽医,2014,56(8):17-20.
[9]Aumuller G,Schulze C,Viebahn C.Intermediate filaments in sertoli cells[J].Microsc Res Tech,1992,20(1):50-72.
[10]Allard E K,Blanchard K T,Boekelheide K.Exogenous stem cell factor(SCF)compensates for altered endogenousSCF expression in 2,5-hexanedione-induced testicular atrophy in rats[J].Biol Reprod,1996,55(1):185-193.
[11]Aponte PM,Soda T,Van de Kant H J,etal.Basic features of bovine spermatogonial culture and effects of glial cell line-derived neurotrophic factor[J].Theriogenology,2006,65(9):1828-1847.
[12]Bucci L R,Brock W A,Johnson TS,et al.Isolation and biochemical studiesof enriched populationsofspermatogonia and early primary spermatocytes from rat testis[J].Biol Reprod,1986,34(1):195-206.
[13]张学明,赖良学,李德雪,等.小鼠精原细胞的分离和纯化[J].解剖学报,2000,31(3):235-239.
[14]LiQ F,Wang Y Z,RudolfM,etal.Swainsonine asa lysosomal toxin affects dopaminergic neurons[J].Journal of Neural Transmission,2012,119:1483-1490.
(责任编辑 李山云)
Culture and Identification of Testis Sertoli Cells in Hetian Sheep in vitro
WANG Shuai,JIA Qi-zhen,ZHANG Ling,WANG Lian-qun,CHEN Gen-yuan*
(College of Animal Science,Tarim University/Key laboratory of Tarim Animal Husbandry Science and Technology,XinJiang Production& Construction Corps,Xinjiang Alar 843300,China)
【Objective】The aim of this study was to explore the cultural characteristics of testis sertoli cells in Hetian sheep in vitro.【Method】The experimental testis sertoli cellswere obtained from Hetian sheep lamb in 24 h by two-step enzymatic digestion,then the adhesion method was used to purify testis sertoli cells.To observe the testis sertoli cells growth and purity withmorphologicmethod,HE staining detection,AKP staining detection,ORO staining detection,acridine orange staining detection,rhodamine123 staining detection,immunohistochemical staining detection,RT-PCR,cell counting MTT assay.【Result】The results showed that2.00%fetal bovine serum in DMEM/ F-12 medium could be good to culture testis sertoli cells in vitro,the sertoli cells which obtained from Hetian sheep lamb in 24 h could be passaged to 20th generation,the testis sertolicells contained normal cellmorphous and diploid karyotype,the testis sertoli cells expressed vimentin by immunohistochemical staining,RT-PCR result indicated that the SCF gene and GDNF gene expressed in testis sertoli cells.【Conclusion】These results demonstrated thatwe successed to establish themodle of testis sertoli cells in Hetian sheep.
Hetian sheep;Testis;Sertoli cell;Culture in vitro;Identification
S823.3
A
1001-4829(2017)8-1918-05
10.16213/j.cnki.scjas.2017.8.039
2016-10-02
国家自然科学基金(31460678);国家星火计划项目(2015GA891015);兵团塔里木畜牧科技重点实验室开放课题(HS201409)
王 帅(1984-),男,山西长治人,高级实验师,硕士,主要从事动物中毒病及毒理学方面的研究,E-mail:wangshuaidky@126.com,*为通讯作者。
