番茄SSR遗传多样性及其品质性状的关联分析
2017-09-15叶仕伦
黄 静,王 苓,江 卫,叶仕伦
番茄SSR遗传多样性及其品质性状的关联分析
黄 静,王 苓,江 卫,叶仕伦*
(1.四川省农业科学院经济作物育种栽培研究所,四川成都 610300;2.蔬菜种质与品种改良四川省重点实验室,四川成都610066;3.农业部西南地区园艺作物生物学与种质创制重点实验室,四川成都 610066)
【目的】本文旨在分析番茄资源材料的亲缘关系及它们的遗传多样性,挖掘与番茄品质性状相关的分子标记。【方法】选用37对SSR多态性引物对30份番茄资源材料进行聚类分析,在此基础上采用Tassel3.0GLM方法进行标记位点与品质性状的关联分析。【结果】SSR结果显示,37对SSR引物共检测到102个等位变异位点,各种质遗传相似系数为0.61~0.97。关联分析结果表明与品种性状显著相关的位点有9个。供试材料之间有一定的遗传差异,但遗传背景较狭窄。【结论】利用SSR标记分析了30份番茄资源材料的遗传多样性,30份番茄资源材料在遗传相似系数0.71处被划分为4大类,并通过关联分析模型,找到了9个与总酸、成熟前果色、成熟果色、果面棱沟、番茄红素相关联的标记。
番茄;遗传多样性;SSR;关联分析
【研究意义】番茄(Solanum lycopersicum,Tomato),别名西红柿、洋柿子,属茄科(SoLanaceae)番茄属,原产南美洲西部太平洋沿岸安第斯山脉的秘鲁、厄瓜多尔、玻利维亚、智利等国的高原或谷地[1]。是世界上重要的蔬菜作物之一。因SSR具有较高的多态性、共显性分离、位点专化性、标记覆盖整个基因组且分布均匀、DNA样本用量少、技术简便易操作、重复性和稳定性好等优点在小麦[2]、大豆[3]、玉米[4]等主要作物中广泛用来构建连锁遗传图谱、进行遗传多样性和分子标记等研究。【前人研究进展】在番茄方面,应用SSR分析番茄材料的遗传变异、构建遗传连锁图和分子标记的研究也较多,以番茄敏感材料01137和耐热材料CLN2001A杂交产生的F2单株为作图群体,应用SSR分子标记技术筛选得到一个SSR标记[5]。采用18对SSR多态性引物对20份番茄种质资源材料进行分析,扩增出66条谱带中有52条具有多态性,多态率为78.8%,以遗传相似系数0.67为标准将20份番茄育种材料划分为4大类[6]。但利用SSR分子标记结合番茄品质性状进行关联分析的报道还很少。【本研究切入点】本研究采用SSR标记对30个番茄种质资源进行遗传多样性分析,同时通过分子标记与品质性状关联分析。【拟解决的关键问题】旨在为番茄的亲本选择提供依据,进一步探讨与品质性状相关联的分子标记位点,为培育高品质的番茄提供理论基础。

表1 30份番茄材料及其相关信息Table 1 30 tested tomato varieties and their relative information
1 材料与方法
1.1 供试材料
本试验选用了30份不同类型的番茄资源材料,于2014年3月初播种育苗,4月中旬定植于四川省农科院经济作物育种栽培研究所姚渡基地大田中。供试材料的编号和特征农艺性状见表1。
1.2 试验方法
1.2.1 番茄果实品质性状调查与测定 2014年5 -7月对番茄果实的品质性状进行了调查和测定。与番茄果实有关品质性状大致可分为外观品质和营养品质两大类,本试验调查测定的外观品质有果横径、果纵径、果形指数、果梗洼大小、果柄长度、果肩有无、果色(成熟前果色、成熟果色)和单果质量、果实硬度、果面棱沟、果肉厚、心室数,方法参照《番茄种质资源描述规范和数据标准》[7]进行;营养品质有可溶性总糖含量、有机酸含量和糖酸比、可溶性固形物含量、番茄红素含量、抗坏血酸含量,其中可溶性总糖的测定采用硫酸-蒽酮法,有机酸的测定采用酸碱滴定法,可溶性固形物的含量采用折光仪测定,番茄红素的测定采用紫外-可见分光光度法,抗坏血酸的测定采用钼蓝比色法[8]。
1.2.2 SSR引物选择 本试验SSR引物选自NCBI数据库(http://www.ncbi.nlm.nih.gov/)及相关文献[9-10],由上海生工生物工程股份有限公司合成。从120对SSR引物中筛选到37对多态性高、重复性好的引物。
1.2.3 DNA的提取 本试验采用简化CTAB法进行DNA提取,取幼嫩番茄叶片0.1~0.3 g于2 mL离心管中,液氮速冻后研磨成粉末;快速加入65℃预热的CTAB提取缓冲液650μl,混匀后置于65℃水浴保温30 min,其间不断轻摇,颠倒混匀;冷却至室温加入700μl(氯仿-异戊醇(24∶1),颠倒混匀5 min;4℃,12 000 r/min,离心15 min,吸取上清入另一离心管中,加入2倍体积的-20℃预冷的无水乙醇,缓慢混匀,-20℃放置30 min;4℃,12 000 r/ min,离心5 min,弃上清;用-20℃预冷的70%乙醇清洗沉淀2次,室温风干,用100μl TE溶解样品DNA。利用琼脂糖凝胶电泳检测DNA质量。
1.2.4 SSR基本程序 扩增反应使用BIO-RAD PCR仪,Taq酶使用购自北京康为世纪科技有限公司的2×Taq MasterMix。反应总体积10μl:模板DNA 1μl(20~40μl/ng),上下游引物各0.4μl(10 nmol/μl),2×Taq MasterMix 5μl,ddH2O 3.2μl。反应程序:95℃预变性3 min,94℃30 s,55℃30 s,72℃1 min,35个循环后,72℃延伸10 min,4℃保存。PCR扩增产物在6%聚丙烯酰胺凝胶上电泳,银染显色拍照[11]。
1.2.5 数据统计分析 采用人工读胶的方法,有带的读1,无带的读0,不确定的记为-9。利用NTSYSpc2.10软件中的Qualitativedate计算材料间的遗传相似系数(Jaccard系数),采用UPGMA法进行聚类分析,并绘制树状聚类图。采用TASSEL3.0[12]中的GLM(General linearmodel)模型结合分子标记数据和品质性状数据进行标记-性状的关联分析,确定关联位点。
2 结果与分析
2.1 番茄群体SSR分子标记多态性分析
在120对SSR引物中选择了37对多态性效果好的引物,利用这些引物对30份番茄材料基因组DNA进行PCR扩增反应,SSR多态性引物及扩增多态性结果列于表2。37对SSR引物在30份材料中共检测到102个等位变异。变化范围2~7个等位变异,其中引物Tom236-237检测出的等位变异最多,达到7个。Tom236-237扩增的SSR图谱如图1。
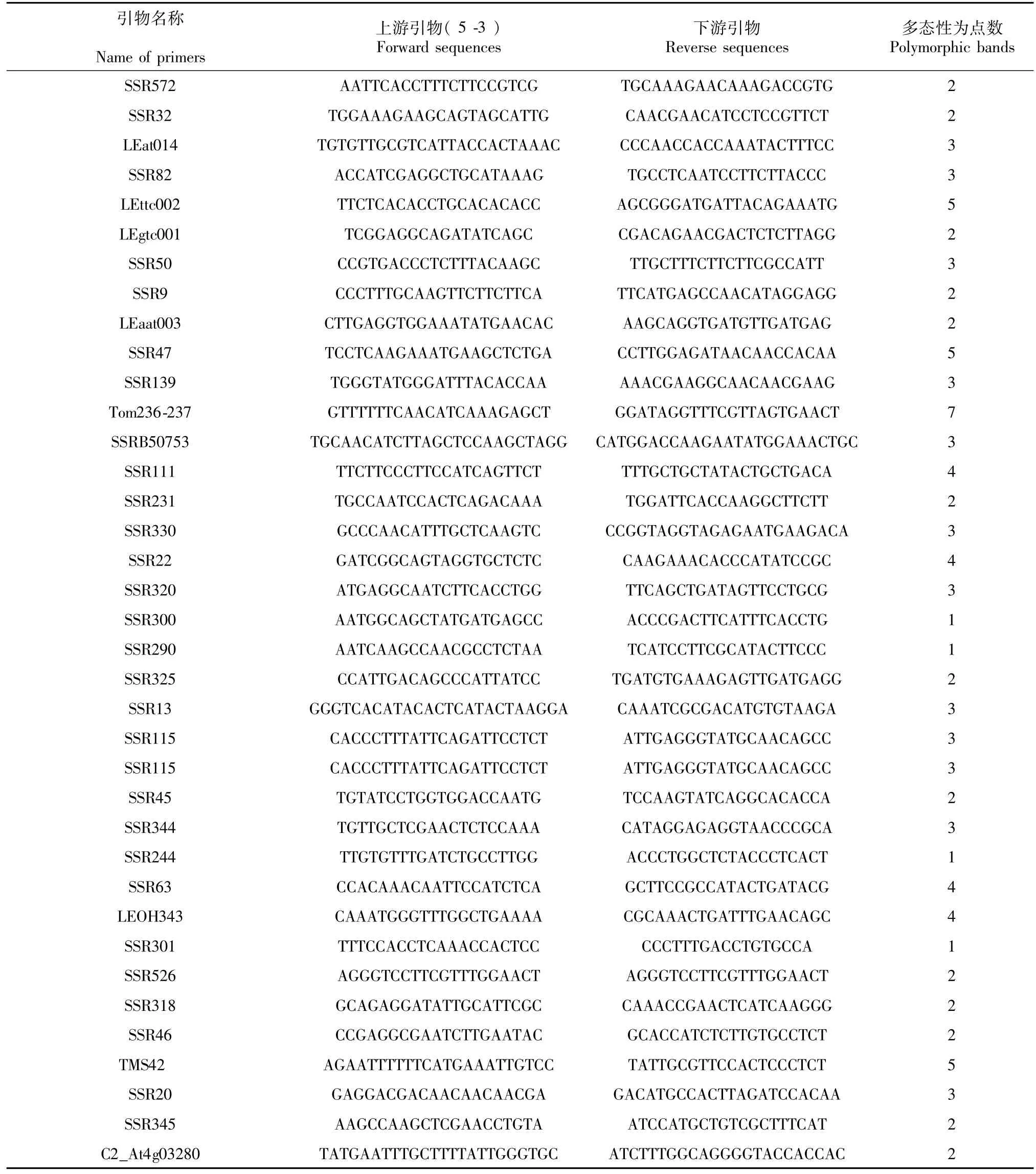
表2 SSR引物及扩增多态性Table 2 SSR primers used in the experiment and numbers of polymorphic bands amplified
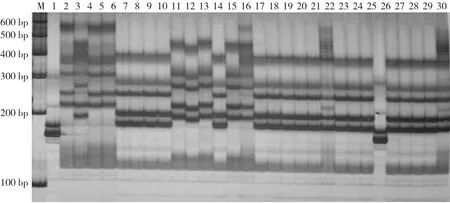
图1 SSR标记在30份材料中的DNA扩增Fig.1 Amplification with SSR primer Tom236-237 for 30 tomato varieties
2.2 番茄种质材料的聚类分析
利用37对SSR引物对番茄材料进行鉴定,对数据进行聚类分析,聚类树状图结果(图2)显示,在相似系数0.71处30份番茄材料可分为4大类。第1大类包含4份材料,第2大类包含2份材料,大多数材料集中在第3大类,包含了22份材料,第4大类包含2份材料。30份番茄材料的遗传相似系数分布在0.61~0.97,表明不同番茄材料之间有一定差异,但差异不大,各材料之间亲缘关系较近,遗传背景较窄[13]。
2.3 SSR标记与品质性状的关联分析
从表3可看出,检测37对SSR引物,有9对引物的9个位点与品质性状相关联,其中与总酸相关联的位点有3个,与成熟前果色、成熟果色、果面棱沟相关联的位点有各有2个,与番茄红素相关联的位点有1个。
3 讨 论
3.1 番茄遗传多样性分析
SSR分子标记是鉴定番茄材料亲缘关系有效途径之一,本研究用37对SSR多态性引物对30份番茄材料进行遗传多样性分析,在一定程度上反应了30份材料的亲缘关系,聚类分析结果显示遗传相似系数分布在0.61~0.97,以遗传相似系数0.71为标准将30份番茄育种材料划分为4大类。结果表明这些番茄材料在分子水平上遗传差异不大,遗传背景较狭窄,这个问题在番茄育种中普遍存在,因此亟需加强新种质资源材料的引进从而丰富育种基础。从聚类树状图中观察到7和9号番茄材料未分离开,分析其原因可能就是没有筛选到合适的引物,导致这2份材料无法分开,因此在进行SSR分子标记分析遗传多样性时,需要足够多的多态性位点,并且这些位点要尽量均匀的覆盖整个基因组[14]。
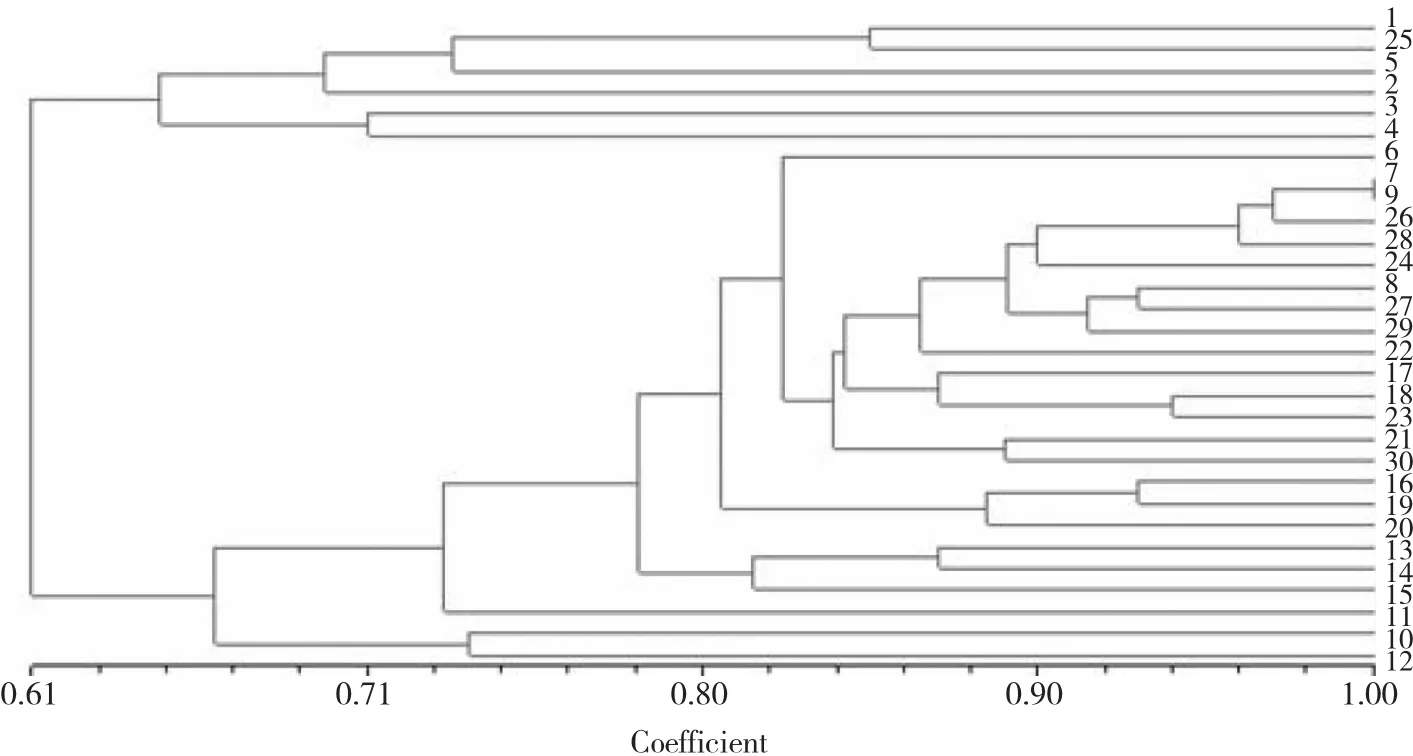
图2 30份番茄材料UPGMA聚类图Fig.2 Dendrogram of 30 tomato varieties by SSR-UPGMA based on genetic similarities
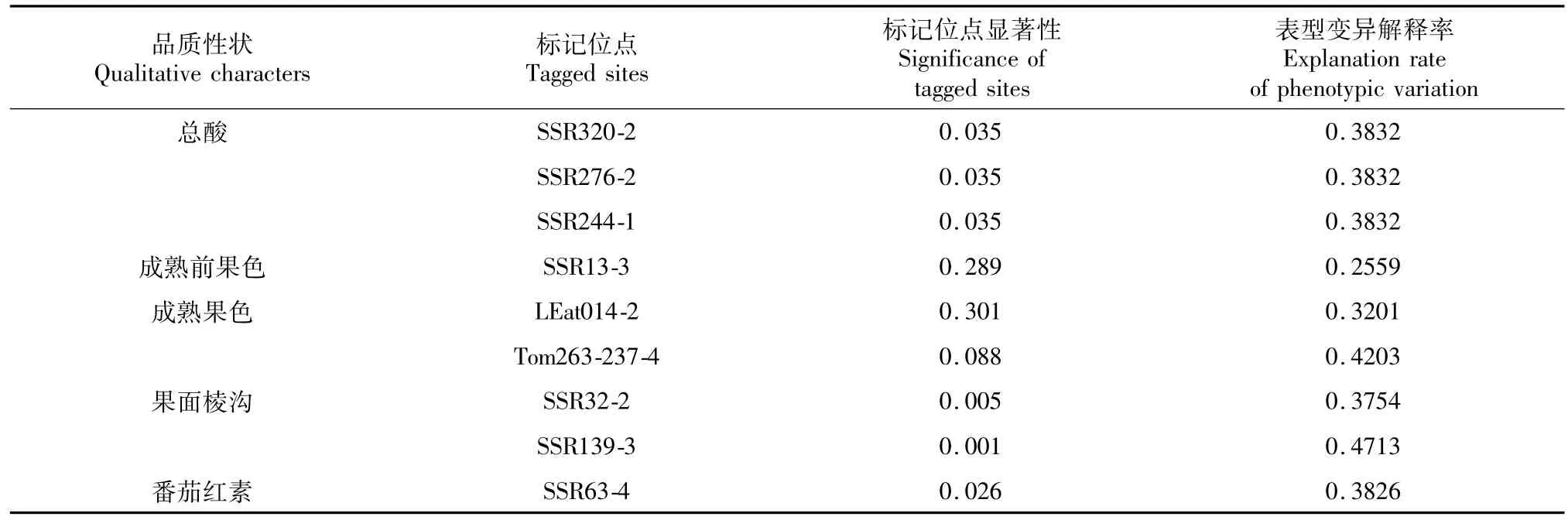
表3 与品质性状显著相关的SSR标记Table 3 SSR loci significantly associated with agronomic traits of tomato
3.2 番茄SSR分子标记的关联分析
关联分析(Association analysis),又称关联作图(Association mapping),目前关联分析在作物方面主要用在小麦[15]、玉米[16]、水稻[17]、棉花[18]等。利用SSR标记分析113份大麦亲本材料的遗传多样性及群体遗传结构,并通过2种关联分析模型,分别寻找到了9个与株高、穗长、芒长、穗粒数相关联,6个与株高、芒长和小穗着生密度相关联的标记[19]。本研究在37对引物上共检测9对引物的9个位点与番茄的5个品质性状相关联,分析结果发现,存在同一个性状与多个位点相关联的情况,原因可能是番茄的许多品质性状均属于多个基因控制的数量性状[13]。
4 结 论
利用SSR标记分析了30份番茄资源材料的遗传多样性,30份番茄资源材料在遗传相似系数0.71处被划分为4大类,并通过关联分析模型,在37对引物上共检查到9个位点与番茄总酸、成熟前果色、成熟果色、果面棱沟、番茄红素相关联。其中位点SSR320-2、SSR276-2、SSR244-1与总酸显著相关(P<0.05),表型变异解释率为38.32%,位点SSR32-2、SSR139-3与果面棱沟显著相关(P<0.05),表型变异解释率分别为37.54%,47.13%,位点SSR63-4与番茄红素显著相关(P<0.05),表型变异解释率为38.26%。
[1]余延年,吴定华,陈竹君,等.番茄遗传学[M].长沙:湖南科技出版社,1999.
[2]陈新民,何中虎,史建荣.利用SSR标记进行优质冬小麦品种(系)的遗传多样性研究[J].作物学报,2003,29(1):13-19.
[3]海 林,王克晶,杨 凯.半野生大豆种质资源SSR位点遗传多样性分析[J].西北植物学报,2002,22(4):751-757.
[4]Smith J S.An evaluation of the utility of SSR loci.As molecular marker sinmaize(Zea mays L.):comparison with data from RFLP sand pedigree[J].Theor Appl Genet,1997,95(1-2):163-173.
[5]许向阳,王冬梅,康立功,等.番茄耐热性相关的SSR和RAPD标记筛选[J].园艺学报,2008,35(1):47-52.
[6]丘漫宇,张素平,郭 爽,等.番茄种质资源亲缘关系的SSR分析[J].中国蔬菜,2012(24):39-42.
[7]李锡香,杜永臣.番茄种质资源描述规范和数据标准[M].北京:中国农业出版社,2006:51-71.
[8]刘绍俊,牛 英,刘冰浩,等.钼蓝比色法测定沙田柚果肉中还原型维生素C含量的研究[J].北方园艺,2011(1):8-12.
[9]Segers R P,Kenter T,deHaan L A,et al.Characterization of the gene encoding suilysin from Streptococcus suis and expression in field strains[J].FEMSMicrobiolLett,1998,167(2):255-261.
[10]Silva L M,Baums C G,Rehm T,et al.Virulence-associated gene profiling of Streptococcus suis isolates by PCR[J].Vet Microbiol,2006,115(1-3):117-127.
[11]骆晚侠,张 李,杨 凯,等.小豆SSR分子标记遗传连锁图谱构建[J].中国农业科学,2013,46(17):3534-3544.
[12]BRADURYPJ,ZHANGZW,KROONDE,et al.TASSEL:software for association mapping of complex traits in diverse samples[J]. Bioinformatics,2007,23:2633-2635.
[13]冯英娜,柳李旺,刘卫东,等.茄子SSR遗传多样性及其农艺性状的关联分析[J].江苏农业学报,2014,30(4):839-847.
[14]宋 建,陈 杰,陈火英,等.利用SSR分子标记分析番茄的遗传多样性[J].上海交通大学学报(农业科学版),2006,24(6): 524-528.
[15]赖 勇,王鹏喜,范贵强,等.大麦SSR标记遗传多样性及其与农艺性状关联分析[J].中国农业科学2013,46(2):233-242.
[16]文阳平,贺浩华,王建革,等.关联分析及其在玉米中的研究进展[J].安徽农业科学,2009,37(19):8947-8949,8956.
[17]张斐斐,杨雅云,董 超,等.关联分析及其在水稻遗传研究中的应用[J].云南农业大学学报,2014,29(5):752-758.
[18]聂新辉,尤春源,鲍 健,等.基于关联分析的新陆早棉花品种农艺和纤维品质性状优异等位基因挖掘[J].中国农业科学,2015,48(15):2891-2910.
[19]赖 勇,王鹏喜,范贵强,等.大麦SSR标记遗传多样性及其与农艺性状关联分析[J].中国农业科学,2013,46(2):233-242.
(责任编辑 陈 虹)
Genetic Diversity of Tomato Revealed by SSR M arkers and Its Association w ith Quality Traits
HUANG Jing,WANG Ling,JIANGWei,YE Shi-lun*
(1.Industrial Crops Research Institute,Sichuan Academy of Agricultural Sciences,Sichuan Chengdu 610300,China;2.Vegetable Germplasm Innovation and Variety Improvement Key Laboratory of Sichuan Province,Sichuan Chengdu 610066,China;3.Sichuan Academy of Agricultural Sciences/Key Laboratory of Biology and Genetic Improvement of Horticultural Crops(Southwest Region),Ministry of Agriculture,Sichuan Chengdu 610066,China)
【Objective】The present paper aimed to analyze tomato genetic diversity and reveal the molecularmarker loci related to tomato quality traits.【Method】A total of 37 simple sequence repeat(SSR)markerswere selected for the polymorphism detection of 30 materials,and based on cluster analysis,the association betweenmarker locus and quality trait by Tassel3.0 GLM program were analyzed.【Result】A total of102 allelics variations from 37 SSRmarkerswere detected,and the genetic similarity coefficients of their germplasms ranged from 0. 61 to 0.97.Tassel3.0 general linearmodel showed thata total of9 lociwere significantly correlated with 5 quality traits.There were genetic diversities among these tomatomaterials,but the genetic basis was narrow.【Conclusion】The genetic diversities of 30 tomato resources were analyzed by SSR markers.Thirty tomato resources were divided into four groups at the genetic similarity coefficient of 0.71.There were 9 SSR markers associated with total acid,mature color,ripe fruit color,fruit face furrow and lycopene under GLM program.
Tomato;Genetic diversity;Simple sequence repeat(SSR);Association analysis
S641.2
A
1001-4829(2017)8-1867-05
10.16213/j.cnki.scjas.2017.8.029
2016-09-13
四川省财政创新能力提升工程青年基金项目(2014QNJJ-004)
黄 静(1985-),女,四川双流人,硕士,从事番茄育种与栽培研究,E-mail:2464790707@qq.com,Tel:13550202776,*为通讯作者,E-mail:kwww163@163.com。
