广玉兰花精油的化学成分、抗氧化及抑菌活性分析
2017-09-15叶生梅孙俊峰庞宽壮张荣莉
叶生梅 孙俊峰 庞宽壮 张荣莉
(安徽工程大学生物与化学工程学院,芜湖 241000)
广玉兰花精油的化学成分、抗氧化及抑菌活性分析
叶生梅 孙俊峰 庞宽壮 张荣莉
(安徽工程大学生物与化学工程学院,芜湖 241000)
用乙醚为溶剂索氏提取广玉兰花精油。气相色谱-质谱联用仪(GC-MS)分离并分析鉴定广玉兰花精油成分及相对含量;鉴定出43个化合物,占精油总量的95.49%。DPPH自由基清除法测定精油的抗氧化活性;广玉兰精油有很强的清除DPPH自由基的能力,当质量浓度达到20 μg/mL时,去除率与抗坏血酸相当。抑菌圈法和平板菌落生长法测定精油的抑菌抗菌活性;广玉兰花精油对细菌、真菌均有抑制作用,特别是对红酵母有强的抑制作用,当培养基中精油质量浓度为5.00 mg/mL时能完全抑制培养基中的红酵母生长。广玉兰花精油用于食品工业不仅可作香料还具有食品防腐保鲜效果,具有一定的开发和利用价值。
广玉兰 精油 化学成分 抗氧化活性 抗菌活性
植物精油又称挥发油或香精油,取自于植物的花、苞、叶、枝、根、树皮、果实、种子和树脂等,因其萃取自天然植物,自古以来被人们所喜爱,也日益受到国内外专家学者的关注,一方面是因为精油有令人愉悦的香气;另一方面是由于精油具有多种活性功能,如抗氧化、抗菌、安神镇痛等。从植物中寻找高效低毒的天然抗氧化物质将成为目前抗氧化剂发展的一个必然趋势,植物精油的抗氧化活性国内外的研究报道比较多[1-4]。在农业领域,植物精油也得到越来越广泛的研究,其对农业害虫、植物病原菌表现出的生物活性引起了科研工作者的注意[5-8]。近年来,植物精油对动物致病真菌和细菌的杀菌活性得到了广泛的研究。许多植物精油杀菌谱广,对革兰氏阴性菌、革兰氏阳性菌、病原真菌等均有一定的杀菌活性[9-11]。植物精油的杀菌广谱性以及强杀菌活性使其能够开发成为消毒杀菌药剂。 目前,植物精油在香料工业、医疗、农业等方面均得到了一定的应用和发展。我国野生与栽培的芳香植物就有56科,136属,约300种。我国丰富的植物资源为精油的开发利用提供了有利条件。虽然,精油在植物界分布很广,但是植物精油是植物的次生代谢产物,化学成分较为复杂,植物精油往往含有十多种至上百种化合物。寻找高活性的精油资源,精油中高效生理活性成分的鉴定与研究、将精油开发成为农药、抗氧化剂、药物等还有待研究[12-14]。
广玉兰(MagnoliagrandifloraL.)为木兰科、木兰属常绿乔木,又称洋玉兰、荷花玉兰。叶革质,叶长10~20 cm;花大如荷,呈现白色或浅黄色,芳香馥郁,花通常6瓣,直径20~30 cm,花期5~7月;种子外皮红色,9~10月果熟。广玉兰还对二氧化硫等有毒气体有较强的抗性,病虫害少,是净化空气、保护环境的优良环保树种。广玉兰叶及花中含有挥发油、木兰花碱等多种化学成分,可治疗呕吐、腹泻、高血压、偏头疼等,在医药方面的应用已有报道[5,15-17],但对广玉兰花香精油的化学成分分析及其抗菌、抗氧化活性研究报道较少。本研究采用乙醚索氏提取广玉兰花香精油,用GC-MS联用仪对其化学组成进行分析,并进一步考察香精油的抗氧化活性和抗菌性能,拟为合理利用广玉兰资源提供参考。
1 材料和方法
1.1 材料与仪器
广玉兰花2015年6月初采摘于安徽工程大学校园。无水乙醚、无水乙醇、无水硫酸钠、抗坏血酸(均为分析纯):国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)自由基:美国Sigma 公司。
大肠杆菌(Escherichiacoli)、枯草芽胞杆菌(Bacillussubtilis)、金黄色葡萄球菌(Staphylococcusaureus)、红酵母 (Rhodotorula)、黑曲霉 (Aspergillusniger)、根霉(Rhizopussp):本校微生物实验室保存。
GCMS-QP2010气相色谱-质谱联用仪:日本岛津公司;SW-CJ-2FD型双人单面净化工作台:苏州净化设备有限公司;PYX-DHS型隔水式恒温培养箱:上海跃进医疗设备厂。
1.2 试验方法
1.2.1 广玉兰花精油的提取及化学成分分析
采摘的广玉兰花(整朵花)于烘箱60 ℃干燥后,万能粉碎机粉碎用于精油提取的原料;无水乙醚索氏提取,虹吸4次;蒸馏回收乙醚后,加入无水乙醇-20 ℃放置24 h过滤,滤液蒸馏回收乙醇,得精油。对精油进行GC-MS分析、抑菌试验和抗氧化试验。
1.2.1.1 色谱条件
色谱柱:Rtx-5 MS(30 m×0.25 mm,0.25 μm);载气为氦气;进样口温度250 ℃,分流比1∶20;进样量1 μL,柱流量1.3 mL/min升温程序:60 ℃保持1 min,11 ℃/min升温至90 ℃,保持2 min, 2 ℃/min升温至95 ℃保持1 min,18 ℃/min升温至180 ℃保持2 min,2 ℃/min升温至185 ℃保持1 min,13 ℃/min升温至255 ℃保持2min,2 ℃/min升温至270 ℃保持1 min。
1.2.1.2 质谱条件
质谱参数:电子轰击(EI)离子源70 eV;离子源温度230 ℃;接口温度270 ℃;扫描范围m/z30.00~500.00;延迟时间3 min;程序时间35.33 min。
1.2.1.3 数据处理
化合物的相对含量采用峰面积归一法计算;根据NIST08和NIST08s谱库检索,并与标准谱图对照解析对化合物进行定性分析。
1.2.2 精油对有机自由基DPPH抑制率的测定
DPPH自由基是一种稳定的有机自由基,其乙醇溶液呈紫红色,在可见光区的最大吸收峰525 nm,当存在自由基清除剂时可与其单电子配对而使其褪色,褪色程度与其所接受的电子数成定量关系,因而可用分光光度法测定精油对DPPH自由基的抑制率来评价其抗氧化性能[4,18]。用二倍稀释法将精油稀释成不同浓度,将2.00 mL样品液及2.00 mL 0.1 mmol/L的DPPH溶液加入到同一试管中,摇匀,室温下暗处静置30 min后测定525 nm吸光度A,同时测定2.00 mL DPPH与2.00 mL溶剂(无水乙醇或蒸馏水)混合后的吸光度A0;以相同浓度的抗坏血酸为对照,用同样方法测定抗坏血酸对DPPH的清除率。
自由基清除率=(A0-A)/A0×100%
1.2.3 玉兰花精油抗细菌活性测定
1.2.3.1 菌种培养:大肠杆菌、枯草杆菌、金黄色葡萄球菌经斜面活化后分别转接一环入LB液体培养基37 ℃培养12 h,用于精油抑菌活性测定菌种。
1.2.3.2 琼脂扩散法测定抑菌圈直径:取液体菌种0.2 mL于LB平板上,涂布均匀后将灭菌后烘干的直径5 mm的圆形滤纸片2张叠放在平板上,在滤纸片上滴加10 μL的用1,3丙二醇二倍稀释法稀释的精油(0.22 μm微孔滤膜过滤除菌),以1,3丙二醇为对照。37 ℃培养24 h,测量抑菌圈直径。每种菌每个精油浓度重复3次。
抑菌圈直径=样品抑菌圈直径-对照抑菌圈直径。
1.2.4 玉兰花精油抗真菌活性测定
1.2.4.1 红酵母悬液及黑曲霉、根霉孢子悬液的制备
将活化的红酵母斜面菌种转入生理盐水中制成菌悬液,调整菌浓度105~166cfu/mL。将黑曲霉,根霉斜面孢子用无菌生理盐水刮下,用4层无菌擦镜纸过滤制成孢子悬液,并调整孢子浓度105~166cfu/mL。
1.2.4.2 琼脂稀释法测定抑菌活性
将精油(0.22 μm微孔滤膜过滤除菌)及菌液加入到冷却至约50 ℃的15.0 mL PDA培养基中(PDA培养基中加入了0.5% Tween 20起乳化精油作用),混匀到平皿,使平板中精油的终质量浓度5.00、2.50、1.25、0.63、0.00 mg/mL每个浓度重复3次。30 ℃培养一定时间,记录菌落数及菌丝生长情况。
2 结果与分析
2.1 广玉兰花精油的化学成分
广玉兰花以乙醚为溶剂索氏提取的精油得率为1.98%。香精油的GC-MS测定总离子流图见图1,从精油样品中共分离出74个峰。总离子流图中各峰经质谱扫描后得到质谱图,根据比对结果进一步进行人工图谱解析鉴定出43个化合物,占精油总量的95.49%,见表1。
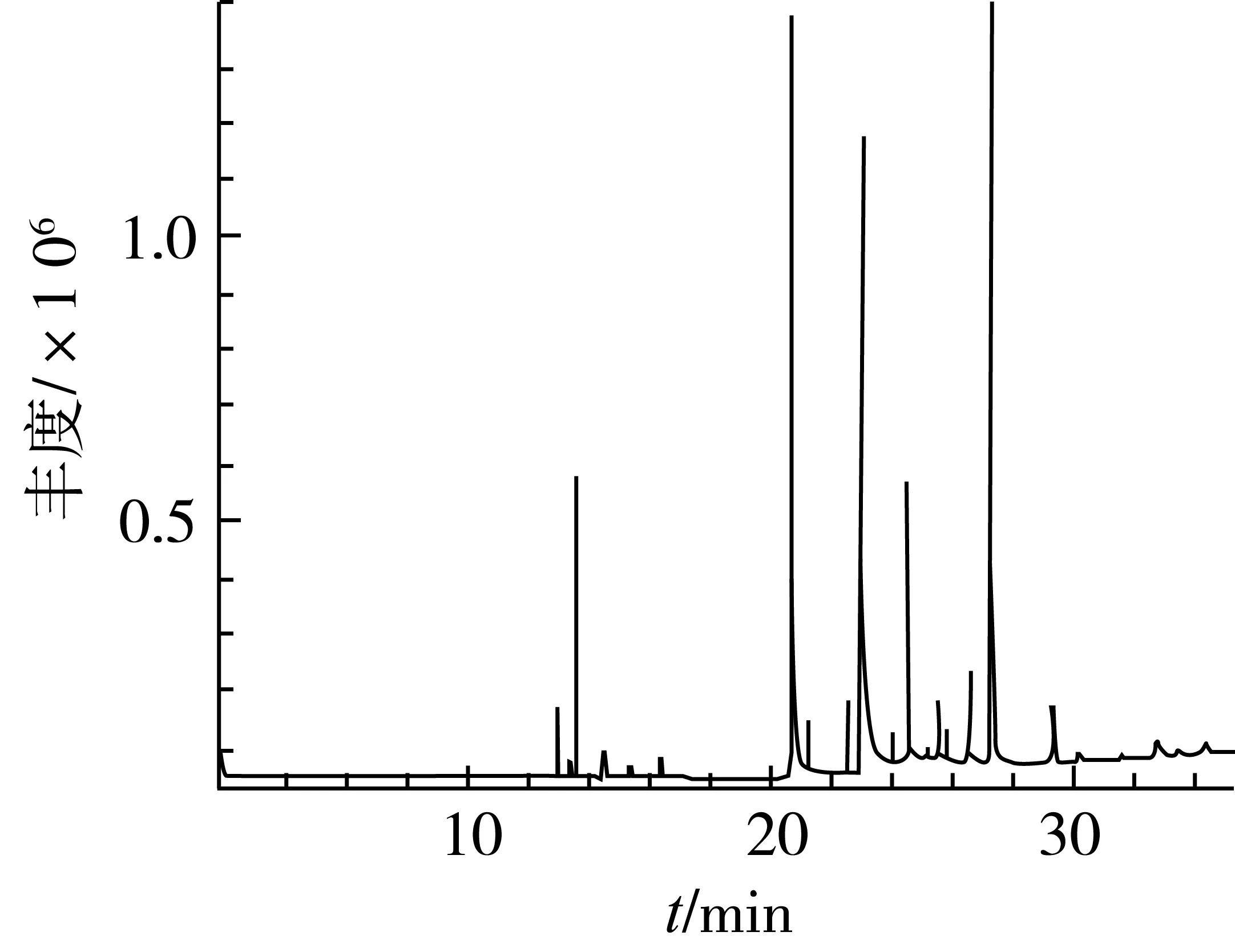
图1 广玉兰花精油的总离子流图
由表1可知,采用GC-MS分析技术共鉴定出广玉兰花香精油中主要成分为丁香烯(37.94%)、芳樟醇(11.06%)、香茅醇(9.94%)、桉叶油醇(3.95%)、2-甲基丁酸甲酯(3.86%)、β-榄香烯(3.02%)、β-蒎烯(2.67%)、α-古芸烯(2.55%)、甲基丁香油酚(2.19%)、匙叶桉叶烯醇(1.66%)、氧化芳樟醇(1.47%)、柠檬醛(1.40%)、愈创木烯(1.38%)等。本法提取的广玉兰花精油馥郁芳香,令人愉悦,与其含有的萜类化合物、萜醇类化合物、萜酯类衍生物、倍半萜化合物、倍半萜含氧衍生物等赋香成分有关。如丁香烯(37.94%)具有辛香、木香、柑橘香、樟脑香,温和的丁香香气;芳樟醇(11.06%)具有浓青带甜的似玫瑰木香气,柔和果香气息;2-甲基丁酸甲酯(3.86%),具有醚香、果香、青香,在极低浓度下有甜的苹果样味道,成熟水果的香气。甲基丁香油酚(2.19%)有清甜的丁香-茴香辛香气,似香石竹气息,香气较透发而持久;氧化芳樟醇(1.47%)具强的花香、萜香、青香气,还带有清凉气息,是一种多香韵的香料;柠檬醛(1.40%)柠檬醛具有柠檬芳香味。本试验用乙醚提取后用乙醇纯化的提取物在常温下为淡黄色膏状,而不是油状。从成分可见与其含有酯类、酸类、高级醇类有关,与Li等[13]的报道有一定的差别,这可能是采收时间、地点以及提取方法不同等因素所致。
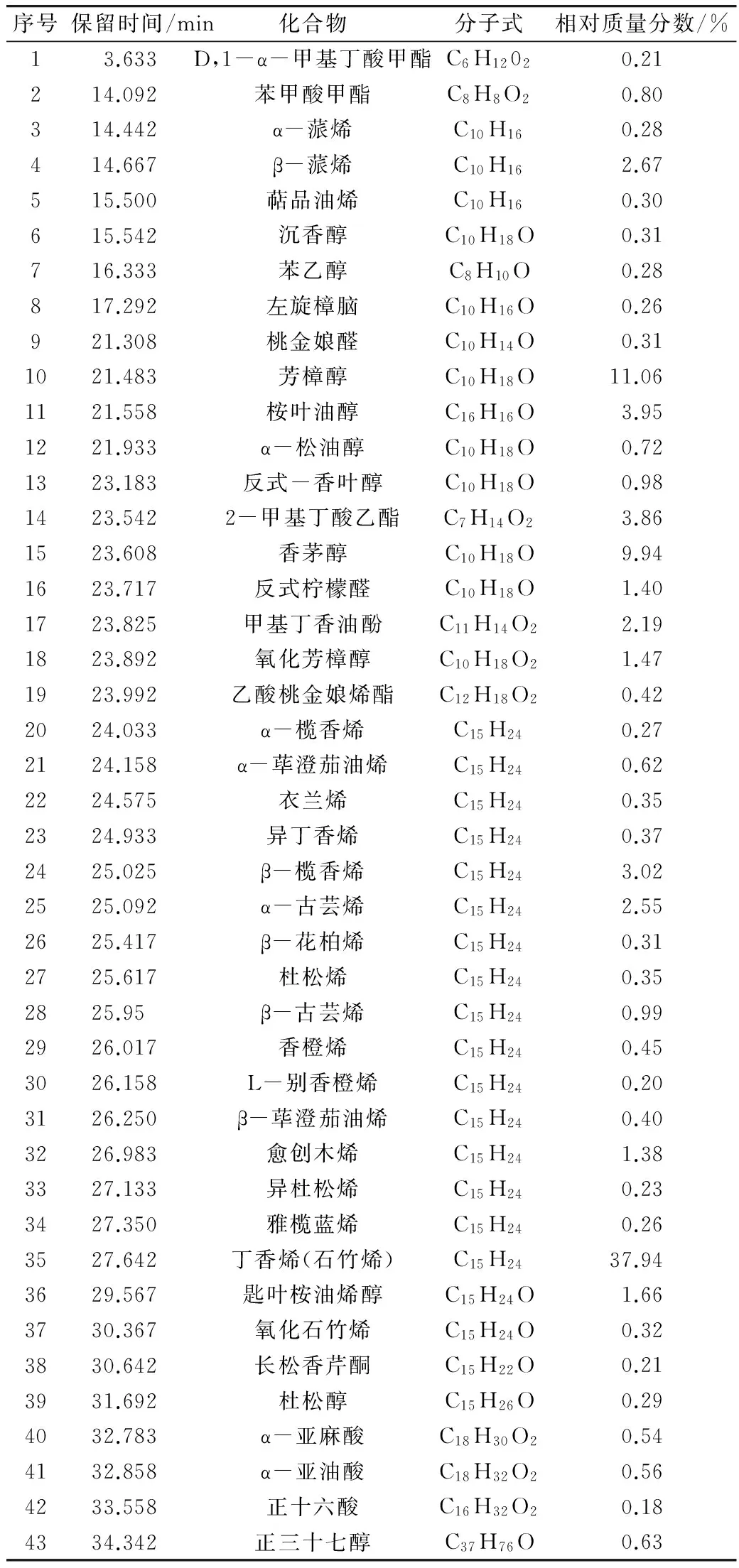
表1 广玉兰花精油的化学成分
2.2 精油对有机自由基DPPH抑制率
以分析纯的抗坏血酸为对照,测定了广玉兰精油和抗坏血酸对有机自由基DPPH的清除率,结果如图2所示。从图2可看出,广玉兰精油有很强的清除自由基的能力,当质量浓度达到20 μg/mL时,去除率与抗坏血酸相当。Viuda-Martos等[1]、唐晖慧等[6]研究表明含有单萜氧化物或倍半萜的精油一般都有较好的抗氧化活性。广玉兰精油中(见表1)含有较丰富的萜类氧化物和萜类化合物如芳樟醇(11.06%),香茅醇(9.94%)、桉叶油醇(3.95%)、丁香烯(37.94%)、β-蒎烯(2.67%)等含有亚甲基、羟基的基团的化合物化学性质活泼,易氧化而使精油具有抗氧化活性。所以精油有很强的对自由基的清除作用。

图2 精油与抗坏血酸对DPPH清除率比较
2.3 精油的抑菌效果
2.3.1 精油对细菌的抑制作用
10 μL各浓度精油对大肠杆菌、金黄色葡萄球菌、枯草芽胞杆菌的抑菌效果如表2所示,从表2可看出,精油对3种细菌均有抑制作用,对大肠杆菌的抑制作用较强。对金黄色葡萄球菌抑制作用次之,对枯草芽胞杆菌也有抑制作用,但抑制作用较弱。从表2还看出随着精油浓度的减小,抑菌圈直径减小。
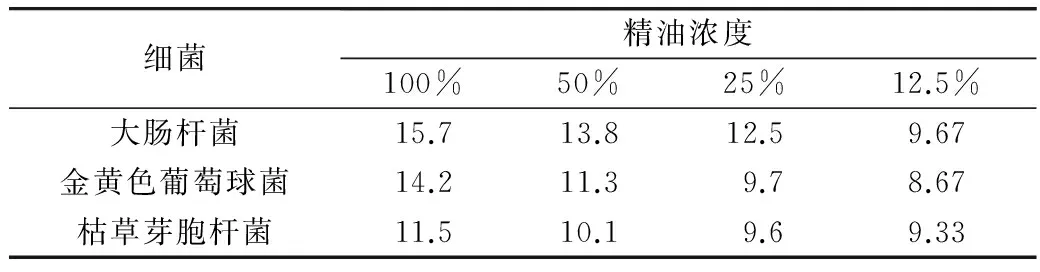
表2 广玉兰花精油对细菌的抑菌活性/mm
2.3.2 精油对真菌的抑制作用
从表3可看出,与对照比较,精油对供试的真菌生长有抑制作用。其中对红酵母的抑制作用最强,30 ℃ 培养48 h观察到当培养基中精油质量浓度达1.25 mg/mL时,各皿均没有红酵母菌落生长;8 d时5 mg/mL精油的平板中仍然无红酵母菌落生长,说明此浓度的精油能杀灭红酵母。30 ℃培养48 h黑曲霉菌种各精油浓度的平板中均有菌落生长,但精油质量浓度大于1.25 mg/mL的各平板中黑曲霉菌落比对照中小,菌丝也短。表明对黑曲霉菌丝生长有抑制作用;8 d时各浓度平板中均长满黑色孢子。培养48 h时,根霉菌种各精油浓度平板中根霉菌丝均长满平板,但对照平板菌丝生长茂盛抵达皿盖,而加有不同浓度精油的各平板中菌丝很短且细而弯曲,只达平板培养基的表面,说明当培养基中加入0.625 mg/mL精油时对根霉的菌丝生长有明显的抑制作用;8 d时观察,各浓度精油的根霉平板中菌丝长长,但呈绒毛状,质量浓度大于1.25 mg/mL的平板中菌丝均未抵达皿盖。从精油对黑曲霉、根霉的抑制作用说明,精油没有抑制霉菌孢子的萌发,但对菌丝的生长有抑制作用。
精油对细菌和真菌的抑制作用与精油中的成分有关[11-12],如β-古芸烯具有抗炎镇痛及清热解表之功效,对大肠杆菌有较强的抑制作用;β-榄香烯广泛用于肿瘤的临床治疗,其临床应用已有广泛研究;香茅醇(9.94%)具有抑制金黄色葡萄球菌及伤寒杆菌活性和曲霉、青霉菌丝生长作用;桉叶油醇(3.95%),有樟脑气息和清凉的草药味道,香气强烈而不持久,有一定防霉及杀菌防腐作用,反式-香叶醇(0.98%)有抗细菌和真菌作用。
3 讨论与结论
用乙醚提取广玉兰花精油的得率为1.98%,比蔡桂香等[18]用水蒸气提取的得率高。乙醚把花中脂溶性成分充分萃取出来,包括花中的大分子物质如革质、蜡质等,用乙醇低温静置,使萃取物中不溶于乙醇的成分去除,得到浅黄色的浸膏状物而不是油状。利用GC-MS联用仪分析技术对广玉兰花精油进行了分析和鉴定,共鉴定出43个化合物,占精油总量的95.49%。广玉兰花香精油中主要成分为丁香烯(37.94%)、芳樟醇(11.06%)、香茅醇(9.94%)、桉叶油醇(3.95%)、2-甲基丁酸甲酯(3.86%)、β-榄香烯(3.02%)、β-蒎烯(2.67%)、α-古芸烯(2.55%)、甲基丁香油酚(2.19%)、匙叶桉叶烯醇(1.66%)、氧化芳樟醇(1.47%)、柠檬醛(1.40%)、愈创木烯(1.38%)等。
广玉兰精油有很强的清除自由基的能力,当质量浓度达到20 μg/mL时,去除率与抗坏血酸相当。广玉兰花精油含有较丰富的萜类氧化物和萜类化合物如芳樟醇(11.06%)、香茅醇(9.94%)、桉叶油醇(3.95%)、丁香烯(37.94%)、β-蒎烯(2.67%)等含有亚甲基、羟基的化合物化学性质活泼,易氧化而使精油具有抗氧化活性。精油的易氧化性质要求精油在保存时用棕色瓶且避光低温密闭保存。否则赋香、抗氧化、抑菌等活性成分易被破坏。
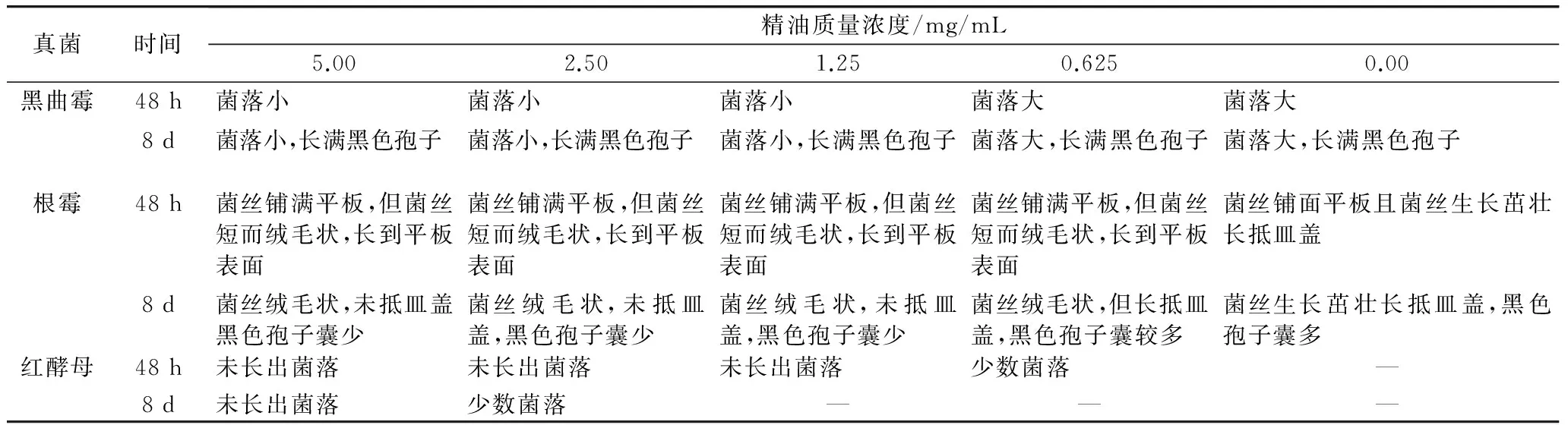
表3 广玉兰花精油对真菌的抑制作用
注:表中“—”表示无法计数。
广玉兰花精油对细菌、真菌均有抑制作用,特别是对红酵母有强的抑制作用。当培养基中精油质量浓度5.00 mg/mL时能完全抑制培养基中的红酵母生长,红酵母在自然界中分布广,是使食品腐败的微生物之一,特别易使含糖高的食品腐败变质。广玉兰花精油用于食品工业不仅可作香料还具有防腐保鲜效果,因此广玉兰花精油有一定的开发和利用价值。
[1]Viuda-Martos M, Mohamady M A, Fernández-López J, et al.Invitroantioxidant and antibacterial activities of essentials oils obtained from Egyptian aromatic plants[J]. Food Control, 2011, 22(11): 1715-1722
[2]钟瑞敏,张振明,肖仔君,等. 华南五种木兰科植物精油成分和抗氧化活性[J].云南植物研究,2006,28(2):208-214 Zhong Ruimin,Zhang Zhenming,Xiao Zijun, et al.Chemical composition and antioxidant activities of the essential oils of five Magnoliaceae species from South China[J]Acta Botanica Yunnanica,2006,28(2):208-214
[3]余丹丹,邵兴锋,许凤,等.茶树精油在果实采后保鲜中的作用及其机制研究进展[J].果树学报,2014,31(2):313-319 Yu Dandan,Shao Xingfeng,Xu Feng,et al.Review on effects and mechanism of tea tree oil applied in fruit preservation[J]Journal of Fruit Science, 2014,31(2):313-319
[4]周江菊,任永权,雷启义.樗叶花椒叶精油化学成分分析及其抗氧化活性测定[J].食品科学,2014,35(6):137-141 Zhou Jiangju, Ren Yongquan, Lei Qiyi.Chemical composition and antioxidant activities of the essential oil from leaves ofZanthoxylumailanthoidesSieb. Et Zucc.[J]Food Science,2014,35(6):137-141
[5]程永芳,宗磊,赵莉,等.广玉兰叶乙醇提取物对植物病原真菌抑菌活性研究[J].中国农学通报,2010,26(4):267-270 Cheng Yongfang, Zong Lei, Zhao Li,et al.Antifungal activity of ethanol Extract fromMagnoliagrandiflora[J]Chinese Agricultural Science Bulletin,2010,26(4):267-270
[6]唐晖慧,金美东.琼产艾纳香叶精油的抗氧化与抗菌活性[J].食品与发酵工业,2013,39(6): 47-52 Tang Huihui,Jin Meidong. Antioxidant and antimicrobial activities of essential oil ofBlumeabalsamifera( L. ) DC. leaves cultivated in Hainan province in China[J]. Food and Fermentation Industries,2013,39(6): 47-52
[7]Jardim C M, Jham G N, Dhingra O D, et al. Composition and antifungal activity of the essential oil of the BrazilianChenopodiumambrosioidesL.[J]. Journal of Chemical Ecology, 2008, 34(9): 1213-1218
[8]Demirci F, Guven K, Demirci B, et al. Antibacterial activity of two Phlomis essential oils against food pathogens[J]. Food Control, 2008, 19(12): 1159-1164
[9]Bajpai V K, Yoon J I, Kang S C. Antifungal potential of essential oil and various organic extracts of Nandina domestica Thunb. against skin infectious fungal pathogens[J]. Applied Microbiology and Biotechnology, 2009, 83(6): 1127-1133
[10]Elaissi A, Salah K H, Mabrouk S, et al. Antibacterial activity and chemical composition of 20 Eucalyptus species’ essential oils[J].Food Chemistry, 2011, 129(4): 1427-1434
[11]王倩,谢明杰.木犀草素对金黄色葡萄球菌的抑菌活性及其机制[J].微生物学报,2010,50(9): 1180-1184 Wang Qian, Xie Mingjie.Antibacterial activity and mechanism of Luteolin onStaphylococcusaureus.[J]. Acta Microbiologica Sinica,2010,50(9): 1180-1184
[12]陈建烟,李永裕,吴少华.植物精油生物活性作用机理研究进展[J].天然产物研究与开发,2012,24: 1312-1318 Chen Jianyan,Li Yongyu,Wu Shaohua.Advances in mechanism of biological activities of plant essential oils[J] Natural Product Research and Development, 2012,24: 1312-1318
[13]Li W R, Shi Q S, Liang Q, et al. Antifungal effect and mechanism of garlic oil onPenicilliumfuniculosum[J]. Applied Microbiology and Biotechnology, 2014, 98(19): 8337-8346
[14]Burt S.Essential oils: their antibacterial properties and potential applications in foods-a review[J]. International Journal of Food Microbiology, 2004, 94(3): 223-253
[15]陈炳华,王明兹,刘剑秋.乐东拟单性木兰花部挥发油的化学成分其抑菌活性[J].武汉植物学研究,2002,20(3):229-232. Chen Binghua, Wang Mingzi, Liu Jianqiu. Chemical constituents of the volatile oil ofParakmerialotungensisflower and its antibacterial activitiesinvitro[J] Journal of Wuhan Botanical Research, 2002,20(3):229-232
[16]何开跃,李晓储,樊亚苏,等.广玉兰叶片抗氧化活性评价[J]林业科学研究,2007,20 (5):644-649 He Kaiyue,Li Xiaochu,Fan Yasu,et al.Appraisal of antioxidation activity ofMagnoliaguandifloraleaves[J] Forest Research,2007,20(5):644-649
[17]Jung K Y, Oh S R, Park S H. Anticomplement activity of tiliroside from the flower buds ofMagnoliafargesii[J].Biol Pharm Bull,1998,21(10):1077-1078
[18]蔡桂香,刘应煊,胡卫兵.广玉兰花香精油的化学成分及抗氧化活性研究[J].生物与化学工程,2012,29(9):91-94 Cai Guixiang,Liu Yingxuan,Hu Weibing.Study on chemical constituents and antioxidant activity of the essential oil of flowers ofMagnoliaGrandifloraL.[J]. Chemistry & Bioengineering,2012,29(9):91-94.
Analysis on Chemical Composition, Antioxidant and Antimicrobical Activities of the Essential Oils from the Flower ofMagnoliaGrandifloraL.
Ye Shengmei Sun Junfeng Pang Kuanzhuang Zhang Rongli
(College of Biological and Engineering, Anhui Polytechnic University, Wuhu 241000)
The essential oil from the flower ofMagnoliaGrandifloraL.was extracted using Soxhlet with ether. The chemical consitituents and the relative contents were identified by GC-MS by separation and analysis;forty-three compounds were qualitatively determined which accounted for 95.49% of essential oils. The antioxidant activities were analyzed by DPPH radical scavenging method; the essential oils show antioxidant activity to DPPH radical scavenging at a concentration of 20 μg /mL or more. The antimicrobical activities were identified by inhibition zone diameter and colony growth method;agar diffusion method and agar dilution method showed that the essential oils had antimicrobial activity to bacterial and fungi,it possessed stronger inhibition capacity onRhodotorula, when the essential oils to 5.00 mg/mL in the medium the red yeast growth were inhibited completely. The above results domenstrated that the essential oils from the flower ofMagnoliaGrandifloraL.were not only the spice of the food ingredient but also had a preservative effect for the food industry.Therefore,the essential oil had potential development and utilization value in the area of food, cosmetic and medicine.
MagnoliaGrandifloraL, essential oils, chemical composition, antioxidant activity, antbacterial activity
国家自然科学基金(21504001),安徽省教育厅自然科学基金(KJ2010A349),安徽省大学生创新训练(AH201410363148)
2016-05-17
叶生梅,女,1963年出生,高级实验师,微生物菌种选育及生理生化
Q949.93
:A
:1003-0174(2017)08-0071-06
