三种猪病疫苗不同免疫组合对猪血清中部分细胞因子表达水平的影响
2017-09-15马长宾胡圣伟
马长宾,崔 蕾,胡圣伟,倪 伟
(1. 新疆建设兵团第六师五家渠市畜牧兽医工作站,新疆五家渠 831300;2. 石河子大学生命科学学院,新疆石河子 831000)
三种猪病疫苗不同免疫组合对猪血清中部分细胞因子表达水平的影响
马长宾1,崔 蕾1,胡圣伟2,倪 伟2
(1. 新疆建设兵团第六师五家渠市畜牧兽医工作站,新疆五家渠 831300;2. 石河子大学生命科学学院,新疆石河子 831000)
[目的] 探讨猪瘟(CSF)、高致病性猪蓝耳病(HP-PRRS)、口蹄疫(FMD)3种疫苗不同免疫组合,对猪免疫机能及其相关细胞因子表达量的影响。[方法] 采用ELISA方法,检测猪血清中IL-1、IL-2、IFN-γ表达量的动态变化,分析免疫后3种细胞因子动态变化规律。[结果] 免疫后猪血清中的IL-1、IL-2、IFN-γ含量变化不一致。其中:IL-1表达量出现“波浪线”变化,且各试验组之间差异不显著;CSF、HP-PRRS、FMD 3种疫苗同步联合免疫组与对照组(C组)相比,二免后60 d和90 d的IL-2表达量差异显著;IFN-γ表达量呈现上升状态,3种疫苗同步联合免疫组与对照组(C组)相比,各时间点的IFN-γ表达量差异均显著(P<0.05),且维持在较高水平。[结论] CSF、HP-PRRS、FMD 3种疫苗不同免疫组合可引起猪免疫机能的变化,且对免疫机能的影响较为复杂;整个免疫过程中各细胞因子的变化不是单纯的上升和下降,而是一个动态的变化过程。
猪瘟;高致病性猪蓝耳病;口蹄疫;免疫组合;细胞因子
细胞因子在机体免疫中发挥着重要作用[1]。白细胞介素l(IL-l)是单核细胞-巨噬细胞产生的细胞因子,促进多种免疫分子的表达,增强单核-巨噬细胞功能。IL-l可介导天然性免疫和获得性免疫,既能刺激T、B淋巴细胞增殖,又能调节免疫反应[2]。白细胞介素2(IL-2)是由活化的Thl细胞和部分B细胞产生的,是体内最主要、最强的T细胞生长因子,是机体免疫调节网络中的核心物质。IL-2 可提高辅助性 T 细胞的数量和活性,增强整体的免疫功能,诱导和增强自然杀伤细胞(Natural killer cell,NK)和细胞毒性T淋巴细胞(Cytotoxic lymphocyte,CTL)的效应,并可促进细胞的增殖和分化,促进多种细胞因子及其受体的表达,因此IL-2 在细胞及体液免疫中均有重要调节作用[3]。干扰素-γ(IFN-γ)为II型干扰素的一种,是在免疫应答中由活化的T淋巴细胞和NK细胞产生的促炎性细胞因子,其与机体抗病毒感染有关。IFN-γ通过调节参与抗原加工和递呈的重要辅助分子,如抗原肽转运蛋白、蛋白酶体和对刺激T细胞和识别细胞毒性T淋巴细胞必需的主要组织相容性复合物(MHC)的表达,从而调节宿主免疫应答[4]。
本实验选择以上3种细胞因子,采用酶联免疫吸附试验(ELISA)方法,采集CSF、PRRS、FMD 3种疫苗不同组合免疫试验猪血清进行检测,以掌握IL-l、IL-2、IFN-γ表达量的动态变化,从细胞因子的角度,探讨不同疫苗联合免疫对猪免疫应答的影响,从而了解主要相关细胞因子的动态变化规律,为科学评价免疫效果提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验动物。选择品种一致(杜洛克、长白、大约克夏三元杂交),体重、日龄相近(30日龄左右)的仔猪作为试验猪,由某规模化养殖场提供。
1.1.2 疫苗。FMD、CSF和HP-PRRS(弱毒苗)疫苗均为第六师五家渠市政府采购疫苗。
1.1.3 检测试剂。IL-l、IL-2、IFN-γ酶联免疫分析检测试剂盒。其他试剂和设备,由第六师五家渠市畜牧兽医工作站兽医实验室提供。
1.2 方法
1.2.1 试验分组与处理。本研究以30 日龄仔猪为研究对象,随机选择雌雄不限,体重基本一致的仔猪30头,随机分成3个组:A组,先免HPPRRS,7 d后“FMD+ CSF”同时分点免疫组;B组,“FMD+CSF+HP-PRRS”同步联合免疫组;C组(对照组),FMD、CSF、HP-PRRS分别单独免疫,每次间隔7 d。每组10次重复,每次重复1头猪。

表1 各组免疫程序、免疫剂量
1.2.2 动物免疫。记录经检查保存完好的FMD、CSF和HP-PRRS疫苗的批次、批号,充分摇匀后备用。免疫猪保定后,在耳根后颈部和腿部内侧严格消毒后,注射疫苗,且每头更换针头。
1.2.3 样品采集。首免30 d后第1次采血,同时进行加强免疫。在加强免疫后30 d、60 d、90 d分别采血。采用常规方法分离血清,记录编号后,将其置-20 ℃冰柜保存备用。
1.2.4 试验指标测定。对各细胞因子指标的检测,严格按照试剂盒说明书操作,基本操作如下:在试剂恢复到室温后,打开包装,旋转混匀;取出酶标板,按要求进行标准品的稀释和加样;按要求加入稀释液和待测样品;用封板膜封板后,置37 ℃温育30 min,洗涤;在所有孔(空白孔除外)中加入酶标试剂,按要求在恒温箱中37 ℃温育30 min;洗板后,每孔加入底物A、B液,避光孵育后,加入终止液,终止反应。15 min内于波长450 mn的酶标仪上读取各孔的OD值。每个样品按要求做2~3个重复。细胞因子结果计算:以标准品浓度为横坐标,对应OD值为纵坐标,绘制标准品线性回归曲线,按曲线方程计算各样本浓度值。
1.2.5 数据分析。将试验数据经Excel 2003初步整理后,对检测结果以平均数±标准差(X±SD)表示,采用SPSS17.0软件统计分析;两组间比较采用配对样本T检验,多组之间比较采用单样本方差分析。显著性差异水平为P<0.05。
2 结果及分析
2.1 不同时间点的IL-l、IL-2、IFN-γ表达量
IL-1、IL-2、IFN-γ试剂盒检测范围分别为18~800 ng/L、13~300 ng/L、30~1 000 pg/mL,检测结果有效(表2、表3、表4)。

表2 各组免疫后不同时间点IL-1表达量检测结果(单位:ng/L)

表3 各组免疫后不同时间段IL-2表达量(单位:ng/L)

表4 各组免疫后不同时间段IFN-γ表达量(单位:pg/ml)
免疫后,各试验组之间的IL-1表达量差异不显著。与对照组相比,B组的IL-2的表达量在二免后60 d(P<0.05)、90 d(P<0.05)显著提高,显著高于A组。与对照组相比,A组的IFN-γ表达量在二免后60 d(P<0.05)、90 d(P<0.05)显著提高;B组的IFN-γ的表达量在首免后30 d(P<0.05),二免后30 d(P<0.05)、60 d(P<0.05)、90d(P<0.05)显著上升,并维持在较高水平;首免后30 d,B组的IFN-γ表达量显著高于A组。
2.2 相关细胞因子表达量动态变化规律
疫苗免疫后,各组IL-1浓度的变化趋势一致,均在二免后60 d达到峰值,二免后30 d和90 d出现下降(图1)。
从变化趋势看,B组的IL-2浓度与对照组(C组)一致,即首免后30 d至二免后60 d,浓度含量一直呈上升趋势,二免后60 d开始下降;A组在整个试验期一直呈上升趋势,但上升幅度较小。从浓度含量看,B组>C组>A组(图2)。
各组的γ-干扰素浓度变化趋势一致,在整个试验期均呈上升趋势,但C组上升幅度平缓(图3)。
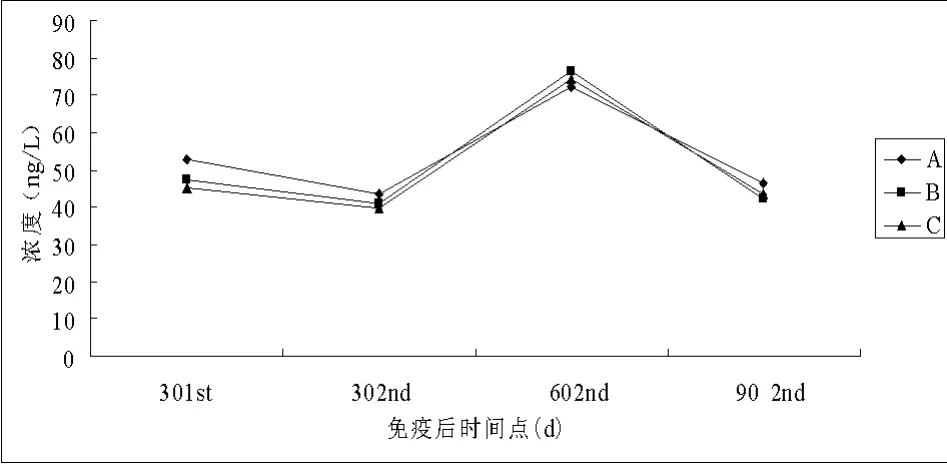
图1 各试验组猪血清中IL-1浓度变化曲线

图2 各试验组猪血清中IL-2浓度变化曲线

图3 各试验组猪血清中IL-3浓度变化曲线
3 讨论
IL-1是机体免疫系统中起中心作用的细胞因子,可以明显促进淋巴细胞增殖与分化,促进 NK细胞的增殖分化。本试验中各试验组仔猪在疫苗接种后IL-1表达量均出现“波浪线”变化趋势,在二免后60 d达到峰值,并且各组之间差异不显著,说明不同免疫组合不影响IL-1的表达量,这间接反映了不同疫苗联合注射是可行的。
IL-2为Thl类细胞因子中的一种,主要由活化的T淋巴细胞产生,是引起T细胞增殖的主要细胞因子。T细胞在胸腺中发育时,IL-2参与T-regs细胞的成熟过程[5-6]。本试验中各试验组仔猪在疫苗接种后,免疫B组和对照组(C组)的IL-2表达量在首免后30 d开始上升,至二免后60 d达到峰值,以后开始下降,而免疫A组的IL-2表达量一直呈缓慢上升趋势,说明各试验组之间的变化趋势并不一致。本试验结果显示,免疫B组与对照组(C组)相比,二免后60 d和90 d的IL-2表达量差异显著;免疫A组与免疫B组相比,二免后60 d和90 d的IL-2表达量差异显著,说明各试验组之间的IL-2表达量存在差异,这间接反映了不同疫苗联合注射既可以促进,也可以抑制IL-2的表达。
IFN-γ主要由抗原和有丝分裂原刺激的CD4+和CD8+T细胞产生。CD4+和CD8+是记忆性辅助性T细胞,能够针对记忆性抗原或多克隆T细胞刺激产生高水平的IFN-γ[7-8]。IFN-γ作为免疫活性细胞分泌的细胞因子,具有广谱抗病毒、抗肿瘤和双向免疫调节作用。疫苗免疫后机体产生IFN-γ水平实际上反映了辅助性T细胞的活性,因此检测IFN-γ的水平就是间接检测辅助性T细胞的活性。本试验中各试验组仔猪在疫苗接种后的IFN-γ表达量持续上升,说明疫苗能够激发淋巴细胞的免疫活性而引起IFN-γ水平的升高,这间接反映了疫苗能够诱导机体增强细胞的免疫应答。本试验结果显示:免疫B组与对照组(C组)相比,各时间点的IFN-γ表达量差异均显著,且维持在较高水平;免疫A组与对照组(C组)相比,二免后60 d和90 d的IFN-γ表达量差异显著;免疫A组与免疫B组相比,首免后30 d的IFN-γ表达量差异显著,说明各试验组之间的IFN-γ表达量存在差异,从而间接反映了不同疫苗联合注射可以促进IFN-γ的表达。
4 结论
以上试验结果表明:不同疫苗联合免疫对仔猪免疫细胞因子表达水平有影响;免疫应激过程中,各细胞因子的变化不是单纯的上升和下降,而是一个动态的过程,在相互作用的过程中影响了动物机体的健康状态,间接反映了不同疫苗联合免疫对免疫应答的影响;虽然关系复杂,但先免HPPRRS,7 d后“FMD+ CSF”同时分点免疫和“FMD+ CSF+HP-PRRS”同步联合免疫是可行的。
[1] 马玉媛,郭逸,颜奇坡,等. 猪IL-2,IL-4,IL-10和IFN-γ的TaqMan实时定量RT-PCR检测体系的建立[[J]. 中国预防兽医学报,2011,33(4):285-288.
[2] NIETO J,MACDONALD M,BRAIM A E P,et al. Effect of lipopolysaccharide infusion on gene expression of inflammatory cytokines in normal horses in vivo[J]. Equine veterinary journal,2009,41(7):717-719
[3] 赵倩,边爱平,许雅娟. 腹腔镜全子宫切除术对血清 IL-2/ IL-10 的影响[J]. 中国妇幼保健,2011,26:4018-4020.
[4] BOEHM U,KLAMP T,GROOT M. Cellular responses to interferon-γ[J]. Annu Rev Immunol,1997,15:749-795
[5] THORNTON A M,SHEVACH E M. CD4+CD25+immunoregulatory T cells suppress polyclonal T cell activation in vitro by inhibiting interleukin 2 production [J]. J Exp Med,1998,188(2):287-296.
[6] THORNTON A M,DONOVAN E E,PICCIRILLO C A,et al. Cuttingedge:IL-2 is critically required for the in vitro activation ofCD4+CD25+T cell suppressor function [J]. J Immunol,2004,172(11):6519-6523.
[7] SURADHAT S,INTRAKAMHAENG M,DAMRONGWATANAPOKIN S. The correlation of virusspecific interferon-gamma production and protection against classical swine fever virus infection[J]. Veterinary immunology and immunopathology,2001,83(3/4):177-189.
[8] RODRIGUEZ-CARRENO M P,LOPEZ-FUERTES L,REVILLA C,et al. Phenotypic characterization of porcine IFN-gamma-producing lymphocytes by flow cytometry[J]. Journal of immunological,2002,259(1/2):171-179.
(责任编辑:朱迪国)
Infuence on Different Vaccine Combination of CSF,HP-PRRS and FMD on Some Cytokines Expression in Swine Serum
Ma Changbin1,Cui Lei1,Hu Shengwei2,Ni Wei2
(1. Wujiaqu Animal husbandry and Veterinary Workstations of Sixth Divisions of Xinjiang Construction Corps,Wujiaqu,Xinjiang 831300;2. The Life Science College of Shihezi University,Shihezi,Xinjiang 831000)
[Objective] To investigate the influence of three vaccine combinations of CSF,HP-PRRS and FMD on immune response and expression of some cytokines in swine serum. [Methods] The dynamic change of IL-1,IL-2 and IFN-γ expression in swine serum were tested by ELISA. The dynamic change rule of the three kinds of cytokines after immunization were analyzed. [Results] The change trends of IL-1,IL-2 and IFN–γ content in swine serum after immunization were not the same. A “wave”trend was appeared in the expression of IL-1,and there was no significant difference between different groups. IL-2 change trend was not consistent with different groups,combined with the group immunized by CSF,HP–PRRS and FMD vaccine,compared with the control group(group C). The expression of IL-2 was significantly different at 60 d and 90 d after second immunization;Compared with group C,the expression of IFN–γ in the group immunized by CSF,HP–PRRS and FMD vaccine was increasing. Expressions of IFN–γ were significantly different at each time point(P <0.05),and was always at a high level. [Conclusion] Different immune combinations of CSF,HP-PRRS and FMD vaccine may cause different immune responses to swine,and the changes of cytokines throughout the immune process were not simply rising and falling,but a relatively complex dynamic change process.
CSF;HP-PRRS;FMD;immune combination;cytokines
S852.65
A
1005-944X(2017)09-0083-04
10.3969/j.issn.1005-944X.2017.09.023
新疆建设兵团农六师五家渠市科技计划和重大科技专项(2012年1214号)
