1997—2010年上海市猪源大肠杆菌耐药性和产ESBLs菌的基因型检测
2017-09-15沈莉萍张维谊
沈莉萍,徐 锋,张维谊,王 建
(上海市动物疫病预防控制中心,上海 201103)
1997—2010年上海市猪源大肠杆菌耐药性和产ESBLs菌的基因型检测
沈莉萍,徐 锋,张维谊,王 建
(上海市动物疫病预防控制中心,上海 201103)
[目的]了解1997—2010年上海市猪源大肠杆菌的耐药情况和产ESBLs大肠杆菌的基因型分布。[方法]采用K-B法对199株猪源大肠杆菌进行药敏试验,采用PCR方法对TEM、CTX-M、SHV和OXA等4种基因型进行检测。[结果]199株猪源大肠杆菌对20种抗菌药物均表现出不同程度的耐药性。耐药率最低的为大观霉素(7.04%),其次为头孢曲松(10.55%)、头孢哌酮(12.56%),最高的为林可霉素(100%),对阿莫西林和复方新诺明的耐药率分别高于80%和93.33%。5~15耐的菌株占88.94%。15种抗菌药物之间均存在不同程度交叉耐药性。共检出15株产ESBLs菌株(7.54%),其中2株TEM型,5株CTX-M型,7株同时携带TEM、CTX-M型。[结论]上海市猪源大肠杆菌分离株耐药谱广、耐药率高;对抗菌药物的交叉耐药现象严重,交叉耐药率有的相似,有的差异大。猪源大肠杆菌ESBLs基因型主要以TEM型和CTX-M型为主,尚无SHV型和OXA型。
猪;大肠杆菌;耐药性;ESBLs;基因型;上海
猪大肠杆菌病是由致病性大肠杆菌引起的一类在养猪业中具有重要意义的疾病。其血清型众多、抗原复杂;且多与病毒性疾病和其他细菌性疾病并发,加大了防控难度。超广谱β-内酰胺酶(ESBLs)由质粒编码,能通过结合、转化和传导等形式,造成耐药基因在细菌间扩散,使敏感菌变成耐药菌。随着抗菌药物的广泛应用或不规范使用,产ESBLs的大肠杆菌菌株逐年增多。产ESBLs菌株在菌株间的传播,更增强了细菌的耐药性,导致兽医临床中的大肠杆菌耐药现象也越来越普遍。大肠杆菌是人及动物体内的主要共生菌,其耐药性是抗菌药物压力的指示器,也是耐药基因的潜在来源库[1],因此开展大肠杆菌耐药性检测具有十分重要的公共卫生意义。
本试验对上海市1997—2010年的199株临床分离保存的猪源大肠杆菌进行了耐药性检测,并筛选出产ESBLs菌株,旨在了解和掌握上海市猪源大肠杆菌临床分离株的耐药情况和产ESBLs大肠杆菌的基因型分布,为临床合理用药提供科学依据。
1 材料与方法
1.1 材料
1.1.1 菌株。199株猪源大肠杆菌由本实验室从1997—2010年临床分离鉴定保存;质控菌株大肠埃希氏菌ATCC25922、肺炎克雷伯氏菌ATCC700603,购自中国兽医药品监察所。
1.1.2 培养基。哥伦比亚羊血琼脂、MHB、MHA等,购自北京陆桥技术有限公司,并按常规法配制。
1.1.3 药敏纸片。共20种,包括强力霉素(DOX)、氨苄青霉素(AMP)、阿莫西林(AMX)、头孢曲松(CRO)、头孢拉定(CED)、头孢哌酮(CFP)、恩诺沙星(ENR)、环丙沙星(CIP)、氧氟沙星(OFX)、氟哌酸(NOR)、阿米卡星(AMK)、卡那霉素(KAN)、庆大霉素(GEN)、壮观霉素(SPT)、链霉素(STR)、新霉素(NEO)、复方新诺明(SXT)、氯霉素(CHL)、四环素(TCY)、林可霉素(LIN),均购自杭州滨和微生物试剂有限公司。
1.1.4 试剂。Marker 、Tax remix、Loading Buffer,购自宝生物工程(大连)有限公司。
1.1.5 引物。由上海桑尼生物科技有限公司合成。
1.2 方法
1.2.1 药敏试验。按照K-B法进行,试验结果按2012 CLSI药敏试验标准进行判断,并用WHONET5.6版本统计分析数据。
1.2.2 ESBLs表型筛选试验。选用头孢他啶、头孢噻肟、头孢曲松药敏纸片,用MH琼脂35 ℃ 18 h培养,观察结果。凡头孢他啶的抑菌圈直径≤22 mm、头孢曲松≤25 mm、头孢噻肟≤27 mm,为可疑ESBLs菌株[2]。
1.2.3 ESBLs表型确证试验。用头孢他啶和头孢他啶/克拉维酸,头孢噻肟和头孢噻肟/克拉维酸2组纸片做确证试验,含克拉维酸与其相应不含克拉维酸的纸片抑菌圈直径差值≥5 mm的确定为产ESBLs菌株[2]。
1.2.4 交叉耐药。A抗菌药物对B抗菌药物的交叉耐药率(%)=同时耐A、B抗菌药物的菌株数量/总的耐B抗菌药物的菌株数量×100%。当交叉耐药率为0时,表示A、B这2种抗菌药物之间不存在交叉耐药性;交叉耐药率越高,说明菌株对B抗菌药物产生耐药时,对A抗菌药物产生耐药性的机会就越大[3];这里A、B抗菌药物是指任意2种不同的抗菌药物。
1.2.5 细菌DNA提取。从36 ℃过夜培养的LB营养琼脂平板中挑取2~3个菌落,将其放入100 µL灭菌蒸馏水中,100 ℃煮沸10 min,12 000 r/min,离心5 min,留取上清液作为模板。
1.2.6 PCR扩增引物。参照李凤娟[4]设计的TEM、CTX-M、SHV、OXA 4对引物,引物序列、扩增长度和退火温度见表1。

表1 PCR引物序列
1.2.7 PCR反应体系。共25 µL:Tax remix 12.5 µL,上下游引物各0.5 µL,模板DNA 1 µL,灭菌蒸馏水10.5 µL。
1.2.8 PCR反应参数。94 ℃预变性5 min,94 ℃变性45 s、退火45 s(退火温度见表1)、72 ℃延伸1 min,扩增30个循环,72 ℃延伸10 min。PCR反应产物用1%琼脂糖电泳,利用凝胶成像系统观察结果。
2 结果
2.1 大肠杆菌药敏试验结果
猪源大肠杆菌对7种抗菌药物的耐药率低于31%,其中对3种抗菌药物的耐药率低于13%,分别为CFP(12.56%)、CRO(10.55%)和SPT(7.04%);有5种抗菌药物的耐药率在49.25%~67.34%之间;对KAN(73.87%)、ENR(77.39%)和CHL(79.40%)的耐药率高于70%,对AMP(93.47%)、SXT(96.98%)和TCY(99.50%)的耐药率高于90%,对LIN的耐药率为100%(表2)。
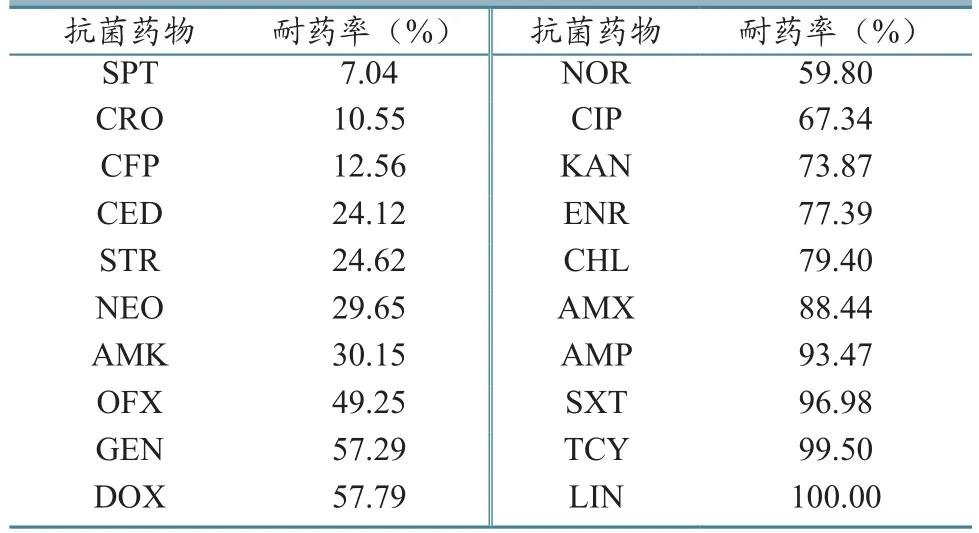
表2 199株猪源大肠杆菌对20种抗菌药物的药敏试验结果
按照耐药谱分析,5~15耐的菌株有177株(88.94%),其中12耐菌株有27株,所占比例最大(13.57%),其次为11耐(12.56%)、13耐(11.56%),2耐和3耐的菌株均有4株(2.01%),最高18耐的菌株只有1株(0.50%)(图1)。

图1 199株猪源大肠杆菌耐药谱
按不同年代猪源大肠杆菌对14种抗菌药物的耐药情况进行分析,结果发现1997—2010年,猪源大肠杆菌对14种抗菌药物的耐药率均有变化。对β内酰胺类抗菌药物中CFP和CRO的耐药率在28%以内。2006年出现对CFP耐药菌株,耐药率为20.00%,对AMX的耐药率高于80%,1997—2006年对CED的耐药率一直维持在10%左右,但到2010年上升到53.33%;在氨基糖苷类抗菌药物中,对SPT耐药率低于16%,对KAN在60%~92%之间,1997—1999年对AMK的耐药率为6.67%,在2002—2010年为30%~40%;对4种喹诺酮类抗菌药物的耐药率在40%~90%;对DOX的耐药率在50%~70%,对SXT的耐药率高于93.00%(表3)。

表3 不同年代猪源大肠杆菌对14种抗菌药物的药敏试验结果
根据大肠杆菌药敏试验结果,计算15种抗菌药物间的交叉耐药率,结果所有的抗菌药物之间均存在交叉耐药性。其中,SPT对SXT的交叉耐药率最低(6.63%),而SXT对CRO、NOR、AMK、GEN、SPT和CFP、AMP对CRO、CED、AMK、SPT和CFP、CED对CRO和CFP、 ENR对OFX和SPT、CFP对CRO等的交叉耐药率均为100%;AMP(OFX除外)、AMX、SXT(ENR除外)分别对其余抗菌药物的交叉耐药率均高于90%;喹诺酮类对其余14种抗菌药物的交叉耐药率均高于50%;仅壮观霉素对其余14种抗菌药物的交叉耐药率均小于28%。CIP对SPT的交叉耐药率为90.63%,而SPT对CIP的交叉耐药率为8.71%,说明当某1株大肠杆菌对SPT产生耐药性时,对CIP的耐药机会为90.63%;相反,当某1株大肠杆菌对CIP产生耐药性时,对SPT的耐药机会仅为8.71%(表4)。
2.2 产ESBLs大肠杆菌的表型和基因型检测结果
199株猪源大肠杆菌经表型筛选和确证试验,共检出15株产ESBLs菌株(7.54%)。对产ESBLs菌株经TEM、CTX-M、SHV、OXA型引物扩增,结果TEM型阳性2株,CTX-M型阳性5株,同时携带TEM、CTX-M型7株,未检测到SHV、OXA型,有1株ESBLs阳性菌株没有检测到上述4种基因型。
2.3 产ESBLs菌株和非产ESBLs菌株耐药情况比较
对比分析15株产ESBLs和184株非产ESBLs菌株对20种抗菌药物的耐药情况,结果发现产ESBLs菌株对SPT和STR这2种抗菌药物的耐药率均低于35%,而对其余的抗菌药物的耐药率均高于50%,尤其对NOR、ENR、SXT、TCY、AMP、AMX和LIN等7种抗菌药物的耐药率均为100%;非产ESBLs菌株对SPT、CRO和CFP等3种抗菌药物的耐药率均低于10%,对STR、NEO、AMK和CED等4种抗菌药物均低于30%,对DOX、GEN和NOR等3种抗菌药物均高于50%、对SXT、TCY和AMP等3种抗菌药物均高于90%,仅对LIN的耐药率为100%。产ESBLs和非产ESBLs菌株之间对CRO、CFP、CED和NOR等4种抗菌药物的耐药率相差40%以上、对CHL、TCY和LIN等3种抗菌药物的耐药率接近(表5)。
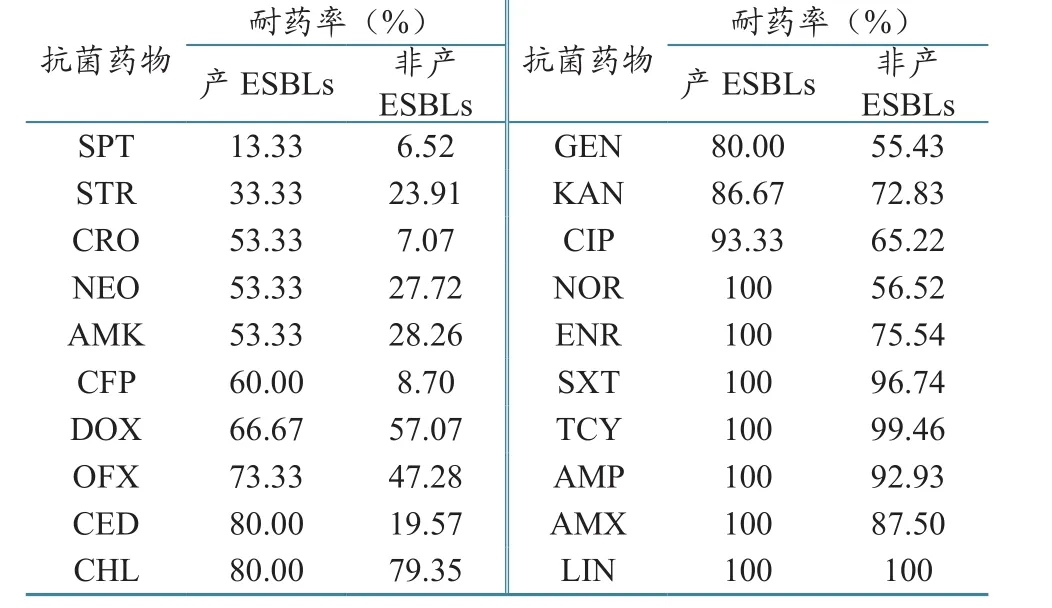
表5 猪源大肠杆菌产ESBLs菌株和非产ESBLs菌株药敏试验结果
按耐药谱分析,产ESBLs和非产ESBLs菌株多重耐药现象均严重。产ESBLs菌株为9~17耐,其中15耐所占比例最大(33.33%)。非产ESBLs菌株耐药谱广,为2~18耐(17耐除外),以11~13耐为主,占40.22%,18耐1株,占0.54%(表6)。
3 讨论
本次调查结果表明,猪源大肠杆菌耐药现象严重,以多重耐药为主,耐药谱广。但十多年来对大观霉素的耐药率一直低于10%,究其原因是由于大观霉素一直没有兽用的注射剂,仅有盐酸大观-林可霉素可溶性粉剂,也没有原料粉剂,因此大肠杆菌不易对大观霉素产生耐药性。将本次调查结果与金凌艳等[6]的调查结果进行比较,发现2008年上海市猪源大肠杆菌的耐药率明显高于其他动物源大肠杆菌,这是由于其他动物源大肠杆菌是从养殖场健康动物的泄殖腔棉拭分离到的。通常养殖场在饲料中添加的是预防用量的抗生素,而本次调查中的大肠杆菌是从病死猪内脏分离到的,对其使用的是治疗剂量的抗生素,而且养殖场的猪一旦发病,场主往往超剂量或滥用抗生素,不遵守用药原则,因此,细菌很快对使用的抗生素产生耐药性。据姚琼芬等[7]对牛源大肠杆菌的耐药性调查表明,牛源大肠杆菌耐药率比较低,且不存在较大的耐药风险,这是由于相关部门对奶制品的监督严格,在牛饲养过程中降低了抗菌药物的使用。本次调查发现,在1997—2010年,上海市养殖场由于长期大剂量使用KAN、AMX、SXT、DOX和ENR等抗菌药物,对这些药物的耐药率均高于50%,尤其对SXT在的耐药率1997—2010年均大于93%,说明大肠杆菌对SXT耐药性一旦产生,很难消除,建议猪场少用或停用SXT。国家相关职能部门应加强对兽药的管理,规范在动物生产过程中各个环节的兽药使用,加强监督,禁止滥用抗生素,尤其要禁止使用第三代头孢菌素。养殖场应采取联合用药、轮换用药的方式,增强疗效,降低细菌耐药性的几率。

表4 大肠杆菌对2种药物的交叉耐药率(%)
将199株大肠杆菌对15种抗菌药物的交叉耐药性进行分析,结果发现它们之间均存在着不同程度的交叉耐药性。同一类型或不同类型的2种抗菌药物之间的2个交叉耐药率有的基本一致,如β内酰胺类抗菌药物中,AMP对AMX、AMX对AMP的交叉耐药率分别为98.87%、94.00%,DOX对GEN、GEN对DOX的交叉耐药率分别为65.50%、64.37%;有的则差异很大,如β内酰胺类抗菌药物中,CED对CRO、CFP的交叉耐药率均为100%,CRO、CFP对CED的交叉耐药率分别为43.40%、42.39%。因此,不同抗菌药物之间的交叉耐药性有的相似,有的差异较大。
喹诺酮类药物是养殖场普遍使用的一类抗菌药物。通常如果分离菌株对1种喹诺酮类药物耐药,对其他喹诺酮类药物也会表现为耐药或敏感性降低。环丙沙星对肠杆菌科菌株具有明显抗菌活性[8],这就提示在日常的检测工作中,如果环丙沙星对大肠杆菌产生耐药性,那么对其他喹诺酮类药物的敏感性也非常低,因此,应尽可能避免使用其他喹诺酮类药物。
产ESBLs菌株的基因型检测表明2010年之前上海市产ESBLs猪源大肠杆菌的基因型以TEM型和CTX-M型为主,尚无SHV型和OXA型,这与刘雅妮等[9]的研究结果一致。本次试验没有检测到SHV型基因,说明上海市猪源大肠杆菌可能未通过质粒进行细菌间耐药基因的交换。15株产ESBLs菌株中有1株未检测到上述4种基因型,可能是含有4种基因型以外的其他基因。
产ESBLs猪源大肠杆菌对多种抗菌药物耐药率均较高,多重耐药现象严重。除β内酰胺类耐药外,对喹诺酮类、氨基糖苷类的耐药率明显高于非产ESBLs菌株,说明产ESBLs是大肠杆菌对此类药物耐药的主要原因。在所有检测的大肠杆菌中,
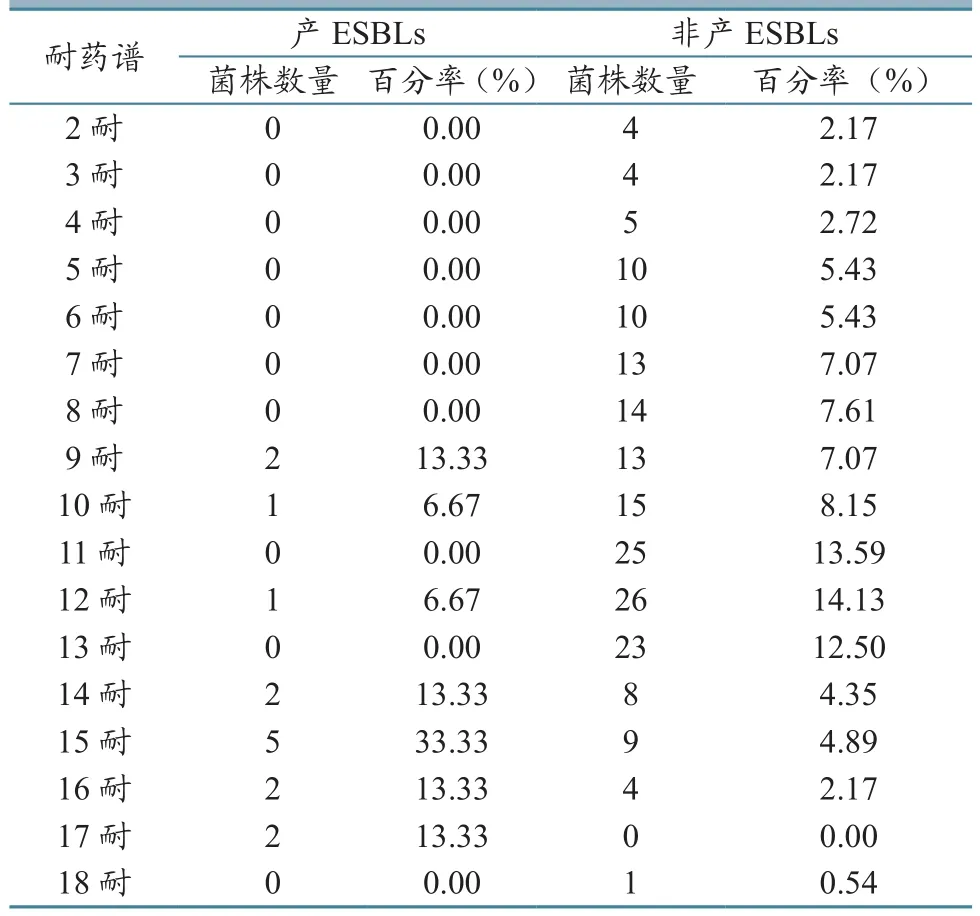
表6 猪源大肠杆菌产ESBLs菌株和非产ESBLs菌株耐药谱
有1株非产ESBLs菌株对18种抗菌药物都产生耐药性,这有可能是该大肠杆菌的耐药基因不同,下一步将对此进行研究。
[1] 薛原,张秀英,陈建飞,等. 猪源大肠杆菌多重耐药性的检测与分析[J]. 中国兽医杂志,2010,46(3):41-43.
[2] 程训民,李敏,徐元宏,等. 产超广谱β-内酰胺酶大肠杆菌耐药性及基因型检测[J]. 第三军医大学报,2006,28(16):1685-1687.
[3] 潘渭涓,陈祥,王晓泉,等. 1993—2008年禽源大肠杆菌和沙门氏菌对喹诺酮类药物耐药性分析[J]. 中国人兽共患病学报,2009,25(7):631-632.
[4] 李凤娟.鸭源大肠杆菌ESBLs的基因型检测[D].郑州:河南农业大学,2009.
[5] 张春辉,张晓风,张晓根,等. 猪、鸡大肠杆菌ESBLs的基因型检测[J]. 中国农学通报,2009,25(1):8-11.
[6] 金凌艳,顾欣,蔡金华,等. 2008年上海市动物源大肠杆菌耐药性监测[J]. 上海畜牧兽医通讯,2009(3):31-32.
[7] 姚琼芬,陈孝杰,田伟,等. 猪源和牛源大肠杆菌耐药性比较试验[J]. 中国兽医杂志,2011,47(8):32-34.
[8] 马越,李景云,金少鸿,等. 细菌耐药性监测分析中应注意的问题[J]. 中国抗生素杂志,2005,30(12):762-769.
[9] 刘雅妮,商军,郭士博,等. 猪源分离大肠埃希氏菌产ESBLs的基因型及耐药性分析[J]. 中国兽药杂志,2011,45(9):19-22.
(责任编辑:杜宪)
Drug Resistance of Escherichia coli Isolated from Swine in Shanghai City from 1997 to 2010 and Genotype Detection of Strains Expressing ESBLs
Shen Liping,Xu Feng,Zhang Weiyi,Wang Jian
(Shanghai Animal Disease Prevention and Control Center,Shanghai 201103)
[Objective]To investigate the drug resistance of E. coli from swine in Shanghai from 1997 to 2010 and genotype distribution of strains expressing ESBLs. [Methods]The antimicrobial susceptibility of 199 strains of E. coli isolated from swine was determined by K-B method,and the genotypes of TEM,CTX-M,SHV and OXA genes were analyzed by PCR. [Results]199 strains of E. coli isolated from swine showed different degrees of resistance to 20 kinds of antibiotics. The lowest rate of drug resistance was spectinomycin(7.04%),followed by ceftriaxone(10.55%) and cefoperazone(12.56%),the highest was lincomycin(100%),and the resistance rates to amoxicillin and compound sulfamethoxazole were greater than 80% and 93.33%,respectively. 88.94% of the isolates exhibited multiple resistance from 5 to 15. There was cross-resistance among the 15 kinds of antibiotics. There were 15 strains expressing ESBLs and the detection rate was 7.54%,including 2 strains expressing TEM gene,5 strains expressing CTX-M gene,and 7 strains expressing both TEM gene and CTX-M gene. [Conclusion]The isolates of E. coli from swine in Shanghai had wide spectrum of resistance and high resistance rates. Cross-resistance of antibiotics was serious. Cross-resistance rate was somewhat similar,but some were different. TEM type and CTX-M type were predominant genotypes of ESBLs in E. coli strains,and both SHV type and OXA weren´t detected.
swine;E.coli;drug-resistance;ESBLs;genotype;Shanghai
S852.612
A
1005-944X(2017)09-0026-06
10.3969/j.issn.1005-944X.2017.09.008
上海市农业基础性项目(沪农科攻字〔2014〕第7-3-3号)
王 建
