基因水平下调PP2A水平可显著抑制海马神经元轴突生长
2017-09-15郑红云申复进童永清李艳
郑红云 申复进 童永清 李艳
·论 著·
基因水平下调PP2A水平可显著抑制海马神经元轴突生长
郑红云 申复进 童永清 李艳
目的 探讨基因水平下调PP2A对胎鼠海马神经元轴突生成的影响。方法 选取体外培养原代海马神经元为研究模型,首先构建PP2A催化亚基特异性干扰RNA及其对照(si-PP2A/ssi-PP2A)质粒,选择在种植前下调PP2A水平,观察其对海马神经元轴突生成是否有作用;原代细胞采用Amaxa大鼠神经元核电转试剂盒分别转染EGFP-ssiPP2Ac和EGFP-siPP2Ac,神经元种植培养48 h后固定做免疫荧光双标,分别标记轴突特异性标记物Tau-1和树突特异性标记物MAP-2,观察基因下调PP2A水平对神经元轴突生成的影响。结果 原代海马神经元转染48 h后对照转染组海马神经元神经元轴突和树突均已形成,而干扰RNA转染组神经元轴突生长受到显著抑制,而树突生长未受到明显影响;si-PP2A转染组(干扰转染组)神经元轴突长度仅为对照转染组的38%,单个神经元的平均轴突数目也从正常1.0/neuron下降到0.5/neuron。结论基因下调PP2A水平显著抑制了原代海马神经元轴突生成,结合前期药物下调研究结果提示维持细胞内正常PP2A水平在海马神经元轴突生成中起重要作用。
蛋白磷酸酯酶2A 海马神经元 轴突 干扰RNA 转染
轴突生成是指神经元发育和再生过程中轴突的生长和产生,神经元轴突生成对维持神经元极性结构起重要作用。神经元发生发展到最后成熟需要经历6个阶段:神经元自圆形细胞球开始,胞体周围开始伸出伪足(种植后很短时间内,4 h,stage 1);之后伪足逐渐形成小的突起(12~24 h,stage 2),此时神经元突起上出现动力生长锥,在这个期的神经元突起呈现生长与回缩的特征;神经元突起继续生长,众多突起中有一个突起迅速生长成为轴突时,我们称该神经元极性已经形成(24~48 h,stage 3)。因此,神经元极性形成的标志就是其轴突的生成。
虽然轴突的运输模式及其正常的生理功能已经被研究得较为清楚,但有关神经元轴突生成的相关机制还知之甚少。胎鼠海马神经元培养是研究神经元极性的良好模型。在许多神经退行性疾病神经损伤以及运动神经元功能障碍疾病中共同的病理变化之一是神经元轴突营养障碍,最后导致神经元死亡。因此,寻找可以促进神经元轴突生成的有效作用分子不仅有助于了解生理状态下轴突生长的相关机制,而且也对促进疾病状态下受损轴突的再生意义重大。目前的研究表明多种蛋白磷酸激酶参与了神经元轴突生成和极性建立,如糖原合成酶激酶-3β(GSK-3β)[1]、PI3K[2]、微管亲和性调节激酶(MARK2)[3]、Rho蛋白激酶[4]、SAD激酶[5]和JNK[6]均参与了神经元轴突生成和极性形成的调节,但有关蛋白磷酸酯酶参与神经元轴突生成及极性建立的研究较少。前期研究表明药物抑制PP2A活性可抑制神经元轴突生成,但其特异性尚未明确,本研究拟从基因水平特异性下调PP2A水平,进而观察其对神经元轴突生成的影响。
1 材料与方法
1.1 动物 孕18 d的SD大白鼠(由华中科技大学同济医学院实验动物学部提供)。
1.2 试剂及抗体 干扰PP2Ac(siPP2A)及其对照质粒(ssi-PP2A)均由华中科技大学同济医学院神经系统重大疾病重点实验室提供。单克隆Tau-1抗体和多克隆MAP2抗体均购自Millipore (Temecula, CA);Cy5标记的羊抗鼠和Rhodamine Red-X-标记的羊抗兔二抗购自Molecular Probes (Eugene,OR,USA)。
1.3 原代海马神经元的培养[7]无菌条件下取出孕18 d胎鼠的完整脑组织, 剔除脑膜和血管,钝性分离出双侧海马;将海马剪成1 mm3的组织块(以上均在冰上进行),置入解剖液(含3%~6%葡萄糖D-Hanks)中,0.125%胰蛋白酶(GIBCO, USA),37 ℃消化15 min,加入种植培养液(含10%胎牛血清的DMEM培养基)终止反应,滴管吹打后经200目筛网滤过,1500转/min离心5min,加入适当的种植培养液重悬,细胞计数,调至1×107/L,接种于预铺多聚赖氨酸的培养板或培养瓶中,于 37 ℃、5%CO2培养箱中培养;4小时后换成维持培养基(1% Glutamate/2% B27/97% Neurobasal Media)。
1.4 PC12细胞培养 未分化PC12是微贴壁细胞,一般用胶原或0.1%PLL包被;培养基选用85%DMEM (pH7.4,高糖), 加入10%灭活马血清及5% FBS,再加1%双抗;因为该细胞贴壁不牢,故无需用胰酶消化,只需用滴管轻轻吹下细胞,然后收集细胞于10 mL离心管(无菌)中,低速离心(1000 r/min离心5 min);移除上清培养基,接着用新鲜完全培养基重新悬浮细胞,最后接种于培养瓶置于培养箱即可;siPP2A质粒转染在12孔板中进行,细胞丰度为80%,转染质粒浓度均为1 ug/uL,每孔质粒用量0.2 uL,转染脂质体用量2 uL。
1.5 原代海马神经元Amax核电转法 原代海马神经元是原代细胞中比较难转染的细胞,为了得到比较高的转染效率,我们选用了Amaxa Biosysterms公司NucleofectorⅡ电转仪以及Rat Neuron Nucleofector Kit对刚分离的海马神经元进行核转染[8];原代海马神经元进行核电转siPP2A质粒前必须进行细胞计数,每个反应要保证4~5×106个细胞;转染质粒浓度均为2 ug/uL,要求1~3 μg DNA(溶于1 ~5 μl H2O或TE),实际电转质粒用量为1.5 uL,选择程序为O-03/O-003或G-13/G-013,细胞成功电转后种植于12孔板。
1.6 Cy5/罗丹明(Rhodamine)免疫荧光双重标记[9]海马神经元电转染后种植于培养皿培养48 h,然后固定做免疫荧光;PBS漂洗后加入4%多聚甲醛常温固定15~20 min或4 ℃固定30 min;PBS-0.1%Triton漂洗,然后PBS-0.5%Triton破膜5~10 min, PBS-0.1%Triton漂洗, 5%BSA封闭1 h,分别滴加兔抗MAP2(1∶200)、鼠抗Tau-1(1∶200),于4 ℃孵育过夜,漂洗后加入Cy5或Rhodamine荧光标记Ⅱ抗于室温孵育1 h,漂洗后于共聚焦显微镜下观察。

2 结 果
2.1 转染特异性干扰RNA质粒(si-PP2A)抑制PP2A水平的有效性验证
为证实siPP2A干扰PP2Ac有效,我们在大鼠肾上腺髓质嗜铬瘤未分化细胞株(PC12)细胞上分别转染EGFP-ssiPP2Ac和EGFP-siPP2Ac,转染48 h后免疫印迹检测PP2Ac的表达水平;转染siPP2A可明显降低PC12细胞内PP2Ac的蛋白表达水平(图1),转染siPP2A细胞内PP2A表达水平仅为对照转染组(ssiPP2A转染组)34%(P<0.05)(图1)。
2.1 转染特异性si-PP2A质粒抑制PP2A水平后抑制原代海马神经元轴突生成 在原代培养的胎鼠海马神经元种植于细胞培养皿之前,先采用Amaxa大鼠神经元核电转试剂盒分别转染EGFP-ssiPP2Ac和EGFP-siPP2Ac,神经元种植培养48 h后固定做免疫荧光双标,分别标记轴突特异性标记物Tau-1[10]和树突特异性标记物MAP-2[11]。如图2所示,对照组神经元培养48 h,同时表达特异性轴突分子Tau-1(图2,blue,1放大图)和树突分子MAP2(图2,red),而转染siPP2A的神经元则无轴突标志物Tau-1表达(图2,blue,2放大图);平均轴突长度(简称为轴突长度)和单个神经元平均轴突数目(简称为轴突数目),siPP2A下调PP2A水平后神经元轴突长度和数目均明显下降(表1)。
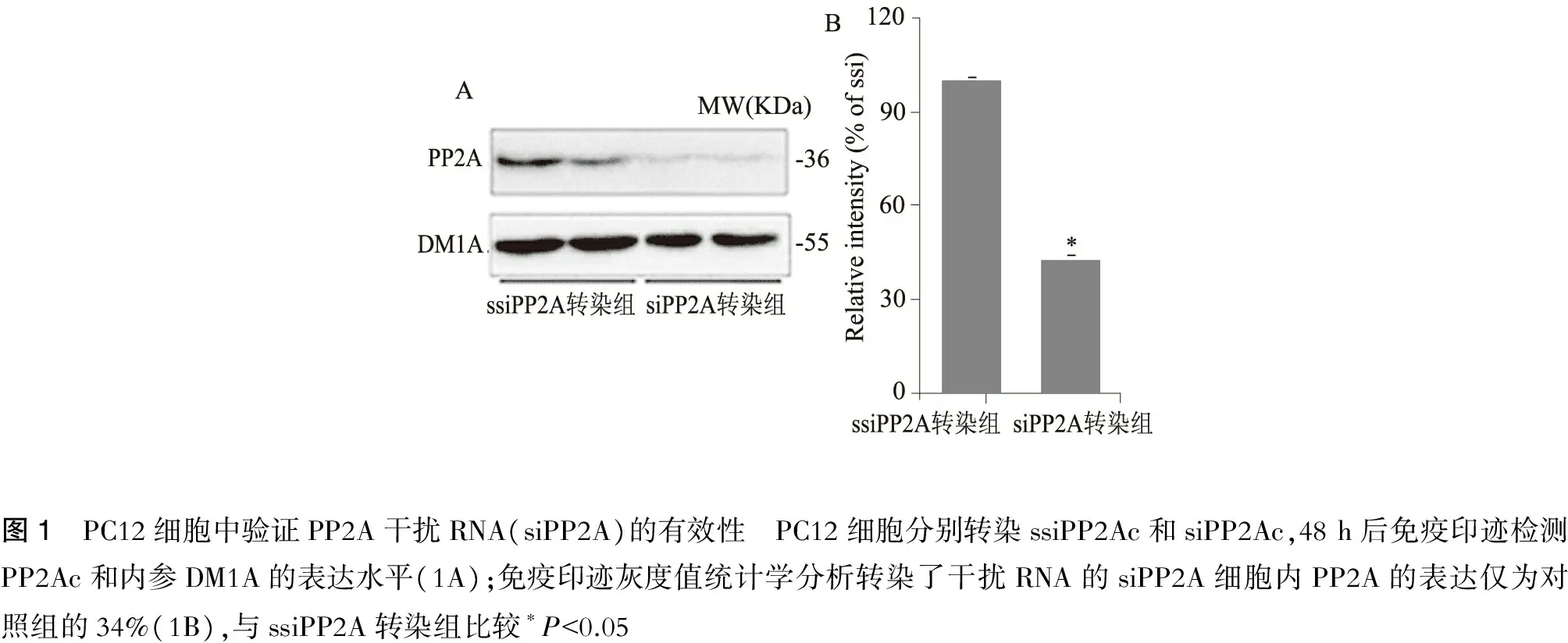
图1 PC12细胞中验证PP2A干扰RNA(siPP2A)的有效性 PC12细胞分别转染ssiPP2Ac和siPP2Ac,48h后免疫印迹检测PP2Ac和内参DM1A的表达水平(1A);免疫印迹灰度值统计学分析转染了干扰RNA的siPP2A细胞内PP2A的表达仅为对照组的34%(1B),与ssiPP2A转染组比较∗P<0.05
每组分别统计50个神经元轴突长度和数目,再分别计算每组神经元平均轴突长度和平均轴突数目,和对照组比较,si-PP2A转染组(干扰转染组)无论是平均轴突长度还是轴突数目均低于ssiPP2A转染组(P<0.05)(表1)。

图2 siPP2A下调PP2A水平后显著抑制神经元轴突的生成 原代海马神经元培养种植前采用细胞电转技术分别转染siPP2A和ssiPP2A质粒,种植培养48h后固定做免疫荧光,采用Tau⁃1抗体特异性识别轴突(可识别胞体和轴突远端),图中为蓝色荧光标记;MAP2抗体特异性识别树突(可识别树突、胞体和轴突近端),为红色荧光标记。与对照组相比,siPP2A转染组神经元轴突生长和数目均受到了明显的抑制,轴突生成障碍(比例尺:20μm)

表1 2组神经元平均轴突长度和轴突数目±s)
注:与ssiPP2A转染组比较,*P<0.05
3 讨 论
蛋白磷酸酯酶-2A(PP2A)是脑内最重要的丝氨酸/苏氨酸蛋白磷酸酯酶之一,PP2A主要调节细胞周期和细胞分化。PP2A 是由支架亚单位A(65kD)、调节亚单位B (50-130kD)和催化亚单位C(36 kD)构成的异三聚体[12]。抑制PP2A酶活性可导致神经元间接死亡,因此PP2A是胚胎发育必不可少的蛋白分子,但PP2A与神经元轴突发育关系仍然尚不清楚。
神经元极性形成对其功能的正常发挥至关重要,探索神经元极性形成的分子基础尤为迫切。对于一个神经元来说,树突往往是接受信息的部位,轴突往往是输出信息的部位。轴突生成是指神经元发育和再生过程中轴突的生长和产生,神经元轴突生成对维持神经元极性结构起重要作用。目前的研究表明越来越多的蛋白磷酸激酶参与了神经元轴突生成和极性建立,大量蛋白磷酸激酶参与了神经元轴突生成,如PI3K[13],Akt[14],GSK-3[15], SAD激酶[16],Rho GTP酶[17]及JNK[18]等是调节神经细胞极性的主要胞内信号分子,它们大多数是调节蛋白质特异位点磷酸化的蛋白激酶。PP2A是脑内最重要的丝氨酸/苏氨酸蛋白磷酸酯酶之一,前期研究表明药物下调PP2A活性可抑制海马神经元轴突生长[19],但其特异性尚不明确。海马神经元种植前分别转染EGFP-ssiPP2Ac和EGFP-siPP2Ac,种植培养48h后分别标记轴突特异性标记物Tau-1和树突特异性标记物MAP-2,结果显示对照转染组神经元培养48 h,同时表达特异性轴突分子Tau-1和树突分子MAP2,而转染siPP2A的神经元则无轴突标志物Tau-1表达;siPP2A下调PP2A水平后神经元轴突长度和数目均明显下降,提示种植前下调PP2A抑制了海马神经元轴突的生成。
在常见神经退行性疾病如Alzheimer病(AD)患者脑中PP2A活性明显降低,tau蛋白以高度磷酸化的形式存在,进而出现神经元极性的丧失并最终导致神经元的大量丢失,本研究结果提示维持正常细胞内PP2A水平对保持神经元正常轴突发育至关重要,因此上调PP2A活性对促进AD患者脑中神经元正常生存意义较大。
[1] Fang W,Gao G,Zhao H.et al:role of the Akt/GSK-3beta/CRMP-2 pathway in axon degeneration of dopaminergic neurons resulting from MPP+toxicity[J].Brain Res,2015,30(1602):9-19.
[2] Kortholt A,Bolourani P,Rehmann H,et al.A rap/phosphatidylinositol 3-kinase pathway controls pseudopod formation[J].Mol Biol Cell,2010,21(6):936-945.
[3] Mejia-Gervacio S,Murray K,Sapir TA,et al.MARK2/Par-1 guides the directionality of neuroblasts migrating to the olfactory bulb[J].Molecular and Cellular Neuroscience,2012,49(2):97-103.
[4] Peris B,Gonzalez-Granero S,Ballester-Lurbe B,et al.Neuronal polarization is impaired in mice lacking RhoE expression[J].J Neurochem,2012,121(6):903-914.
[5] Xing L,Newbern JM,Snider WD.Neuronal development: SAD kinases make happy axons[J].Current Biology,2013,23(17):R720-R723.
[6] Sun T,Yu N,Zhai LK,et al.c-Jun NH2-terminal kinase (JNK)-interacting protein-3 (JIP3) regulates neuronal Axon elongation in a kinesin- and JNK-dependent manner[J].J Biol Chem,2013,288(20):14531-14543.
[7] Zhu LQ,Zheng HY,Peng CX,et al.Protein phosphatase 2a facilitates axonogenesis by dephosphorylating CRMP2[J].Journal of Neuroscience,2010,30(10):3839-3848.
[8] 郑红云,李艳.大鼠胚胎原代海马神经元两种转染方法的比较[J].神经解剖学杂志,2011,27(6):689-692.
[9] Liu XP,Zheng HY,Qu M,et al.Upregulation of astrocytes protein phosphatase-2A stimulates astrocytes migration via inhibiting p38 MAPK in tg2576 mice[J].Glia,2012,60(9):1279-1288.
[10]郑红云,李艳,童永清.脑衰反应调节蛋白2(CRM P2)促进海马神经元轴突生长[J].卒中与神经疾病,2011,18(3):145-150.
[11]郑红云,童永清,李艳.冈田酸抑制神经元轴突生长[J].卒中与神经疾病,2011,18(6):329-331.
[12]Sontag JM,Sontag E.Protein phosphatase 2A dysfunction in Alzheimer's disease[J].Front Mol Neurosci,2014,7:16.
[13]Saijilafu,Hur EM,Liu CM,et al.PI3K-GSK3 signalling regulates mammalian axon regeneration by inducing the expression of Smad1[J].Nat Commun,2013,4:2690.
[14]Diez H,Garrido JJ,Wandosell F.Specific roles of Akt iso forms in apoptosis and Axon growth regulation in neurons[J].PLoS One,2012,7(4):e32715.
[15]Morgan-Smith M,Wu Y,Zhu X,et al.GSK-3 signaling in developing cortical neurons is essential for radial migration and dendritic orientation[Z],2014:e02663.
[16]Lilley BN,Pan YA,Sanes JR.SAD kinases sculpt axonal arbors of sensory neurons through long- and Short-Term responses to neurotrophin signals[J].Neuron,2013,79(1):39-53.
[17]Spillane M,Gallo G.Involvement of Rho-family GTPases in axon branching[J].Small GTPases,2014,5:e27974.
[18]Shin JE,Miller BR,Babetto E,et al.SCG10 is a JNK target in the axonal degeneration pathway[J].Proc Natl Acad Sci U S A,2012,109(52):E3696-E3705.
[19]郑红云,李艳.下调蛋白磷酸酯酶2A活性可抑制海马神经元轴突生长[J].卒中与神经疾病,2015,22(1):3.
(2016-04-19收稿)
Downregulation of PP2A level by gene knockout could inhibit hippocampal neuronal axon outgrowth significantly
ZhengHongyun*,ShenFujing,TongYongqing*,etal.
*DepartmentofClinicalLaboratory,RenminHospitalofWuhanUniversity,Wuhan430060
Objective To explore the effect of downregulation of PP2A level by gene konckout on fetal rat hippocampal neuronal axon outgrowth.Methods The primary hippocampal neuron systems was chose as the model for study. First the PP2A catalytic subunit specific RNA interference plasmid and its control (si-PP2A/ssi-PP2A) were built, and then the effect of siPP2A on the neuron axon formation was observed when the plasmids were transfected before cell plating. Primary hippocampal neurons were transfected with si-PP2A or ssi-PP2A by Amax rat neuron nuclear transfer kit, and the neurons were fixed by immunofluorescence after 48 h. Then the cells were labeled with axon specific marker Tau-1 and dendritic specific marker MAP-2. The effect of PP2A level on the axon formation was observed.Results Hippocampal neurons were transfected with si-PP2A or ssi-PP2A for 48h, then cells were measured the alterations of axons by using double immunofluorescence. Data showed that Axons were formed after culturing for 48h in ssi-PP2A transfected group under the present conditions. However, the formation of axons were inhibited significantly when transfected with siPP2A, and there was no effect on the dendrites formation. Further statistical analysis data showed that siPP2A-transfected axon average length were only 38% of control group (ssiPP2A), and the average number of axons of single neuron also dropped from the normal 1.0/neuron to 0.5/neuron.Conclusion Gene downregulation of PP2A significantly inhibited axon formation in primary cultured hippocampal neurons, combined of preliminary study results, thus results indicated that maintaining the normal level of PP2A in the cells played an important role in the axon formation of hippocampal neurons.
PP2A Hippocampal neuron Axon siRNA Transfection
国家自然科学基金资助项目(81100959);国家临床重点专科建设项目(财社[2010]305号);湖北省自然科学基金面上项目(2015CFB185)
430060 武汉大学人民医院检验科[郑红云 童永清 李艳(通信作者)],妇科(申复进)
R742
A
1007-0478(2017)04-0282-04
10.3969/j.issn.1007-0478.2017.04.002
