重症急性胰腺炎并发肠道免疫功能障碍的实验研究
2017-09-13周淼兑丹华敖宇代静静
周淼,兑丹华,敖宇,代静静
(遵义医学院附属医院 普通外科,贵州 遵义 563000)
重症急性胰腺炎并发肠道免疫功能障碍的实验研究
周淼,兑丹华,敖宇,代静静
(遵义医学院附属医院 普通外科,贵州 遵义 563000)
目的:探讨重症急性胰腺炎大鼠肠道免疫损伤的状况。方法:将48只SD大鼠随机分成假手术组(A组)和重症急性胰腺炎(severe acute pancreatitis,SAP)组(B组),各24只。A组开腹后仅翻动肠管;B组采用胰胆管逆行注射5%硫磺胆酸钠[0.1 ml·(100 g-1)]建立SAP模型。造模后6、12、24 h每组取8只大鼠,开腹取胰腺组织、回肠做病理学切片,光镜观察胰腺病理变化,光镜及电镜观察肠黏膜病理变化。酶联免疫吸附试验(ELISA)检测血清IL- 1、IL- 10的浓度,收集回肠Peyer’s结,流式细胞术行CD3+、CD4+、CD8+细胞凋亡检测,RT- PCR检测回肠HMGB1mRNA含量。结果:B组各时间点胰腺病理学评分较A组升高(均P<0.01),B组随时间延长胰腺病理学评分逐渐升高(均P<0.05)。B组各时间点回肠HMGB1mRNA表达量均较假手术组升高(P<0.01或P<0.05),各时间点CD3+、CD4+、CD8+细胞的凋亡率较假手术组上升(P<0.01或P<0.05),回肠病理损伤较假手术组加重。结论:SAP大鼠并发肠道免疫功能障碍。
重症急性胰腺炎; 肠道免疫屏障; 高迁移率蛋白1; 淋巴细胞; 大鼠
重症急性胰腺炎(severe acute pancreatitis,SAP)是临床上常见的急腹症,具有较高的发病率和病死率[1]。临床上大多数患者病程呈自限性,20%~30%患者病情较凶险,总体病死率为5%~10%[2]。SAP发生后炎症因子大量释放,随后机体会代偿产生大量抑炎因子,使机体处于免疫麻痹状态[3],此时肠道免疫功能受到抑制,肠道内细菌、内毒素等移位导致继发感染,甚至导致多器官功能衰竭。因此,加强肠道免疫功能的保护成为研究的关键。本研究采用胰胆管逆行注射5%硫磺胆酸钠建立SAP模型,探讨SAP大鼠肠道免疫屏障变化情况。
1 材料与方法
1.1 主要材料
牛磺胆酸钠购买于美国Sigma公司,10%水合氯醛由遵义医学院提供,SD大鼠购自重庆第三军医大学[证书编号为Scxk(渝)2012- 0005],引物设计与合成购自上海生工生物工程技术服务有限公司,荧光定量PCR试剂盒(提取RNA、逆转录、扩增)均购于宝生物工程(大连)有限公司,流式细胞仪购于美国BECKMAN COULTER,CD3+、CD4+、CD8+抗体均购于Biolegend公司,大鼠IL- 1、IL- 10 ELISA试剂盒购于康宝生物有限公司。
1.2 方法
1.2.1 动物分组及模型建立 SD大鼠48只,体质量200~250 g,鼠龄8~10周,雌雄不限。将大鼠随机分为对照组(A组,24只)和SAP模型组(B组,24只)。术前禁食不禁水12 h,10%水合氯醛[0.33 ml·(100 g)-1]麻醉动物,A组大鼠开腹后仅翻动肠管,B组大鼠采用胆胰管逆行注射5%牛磺胆酸钠[0.1 ml·(100 g)-1]制作SAP模型。
1.2.2 标本采集和保存 两组于术后6、12、24 h麻醉后经原切口入腹,每个时间点取8只大鼠标本。酶联免疫吸附试验(ELISA)检测血清IL- 1、IL- 10的浓度,取部分回肠生理盐水冲洗干净,匀浆法提取RNA,逆转录成cDNA后于-80 ℃冰箱保存,备HMGB1基因的检查;取部分胰腺组织,10%中性福尔马林溶液中固定,4 μm连续切片供HE染色。
1.2.3 胰腺组织病理学评分 在光镜下比较各组胰腺病理学改变,按照镜下病理学评分标准由病理科医生进行双盲评分。
1.2.4 RT- PCR检测回肠组织中HMGB1mRNA的表达 参照TaKaRa公司RNAiso Reagent试剂盒说明提取组织中总RNA,并逆转录为cDNA。荧光定量PCR反应条件:95 ℃ 30 s;95 ℃ 5 s,57 ℃ 30 s,共40个循环;55 ℃ 10 min。HMGB1引物序列上游为5′- TGAGAAGCTGGCTGTAATGC- 3′,下游为5′- AAATGGCTTGGACAACTGGTA- 3′,扩增长度为222 bp;β- actin上游为5′- TGTCACCAACTGGGACGATA- 3′,下游为5′- GGGGTGTTGAAGGTCTCAAA- 3′,扩增长度为165 bp。
1.2.5 回肠组织的病理学检测 取末端回肠组织固定于10%中性甲醛缓冲液中,石蜡包埋,4 μm连续切片,HE染色,由专业病理医师观察切片。取一段回肠,暴露黏膜面,用预冷生理盐水彻底冲洗,切取5 mm×3 mm ×3 mm大小回肠组织,固定于4%戊二醛固定溶液,标本用逐级增高浓度的酒精(30%-50%-70%-80%-90%-100%)脱水2次,吸出乙醇,加入醋酸异戊酯与乙醇1∶1混合液,进行干燥及样品导电处理,最后行电镜扫描。
1.2.6 流式细胞术检测免疫细胞 收集回肠Peyer’s结制备成单细胞悬液,立即按CD3+、CD4+、CD8+流式抗体试剂盒说明(CD3+、CD4+、CD8+分别由PE、PE- Cy7、APC标记)及凋亡检测试剂盒说明(Annexin V- FITC/PI)行流式细胞术检测。
1.3 统计学处理
采用SPSS 17.0统计软件。定量资料以均数±标准差表示,组与组之间比较用t检验,多组间比较用单因素方差分析(one- way ANOVA)。P<0.05为差异有统计学意义。
2 结 果
2.1 胰腺的病理学评分
A组6、12、24 h 3个时间点胰腺病理学评分均为0,大鼠胰腺组织无充血、水肿及坏死(图1A);B组3个时间点病理学评分依次为7.00±0.82、11.00±0.82、13.5±0.5,胰腺腺泡肿胀、间质水肿,大片出血及坏死灶,大量炎症细胞浸润(图1B)。B组与A组相比胰腺病理学评分显著升高(P<0.01),B组随时间延长病理评分逐渐升高(P<0.05)。
2.2 回肠光镜下表现
光镜下A组回肠组织无水肿、出血及坏死,腺体结构完整(图2A);B组镜下见回肠组织结构紊乱、间质水肿、出血,大量中性粒细胞浸润,局部灶性坏死(图2B)。
电镜下A组肠黏膜表面微绒毛清晰,数目多,直立、凸起,排列整齐(图3A);B组微绒毛坏死、脱落、融合(图3B)。
2.3 两组大鼠不同时间点IL- 1、IL- 10的浓度
B组术后6、12、24 h 3个时间点血清IL- 1浓度分别为21.368 0±0.634 9、32.378 0±2.284 2、44.958 5±1.296 3,显著高于A组的14.497±0.5019(P<0.01);IL- 10浓度分别为13.360 6±0.522 6、14.983 5±0.879 0、19.039 3±1.199 2,显著高于A组的7.343 0±0.440 4(P<0.01)。B组IL- 1、IL- 10浓度随时间推移逐渐升高(P<0.01)。
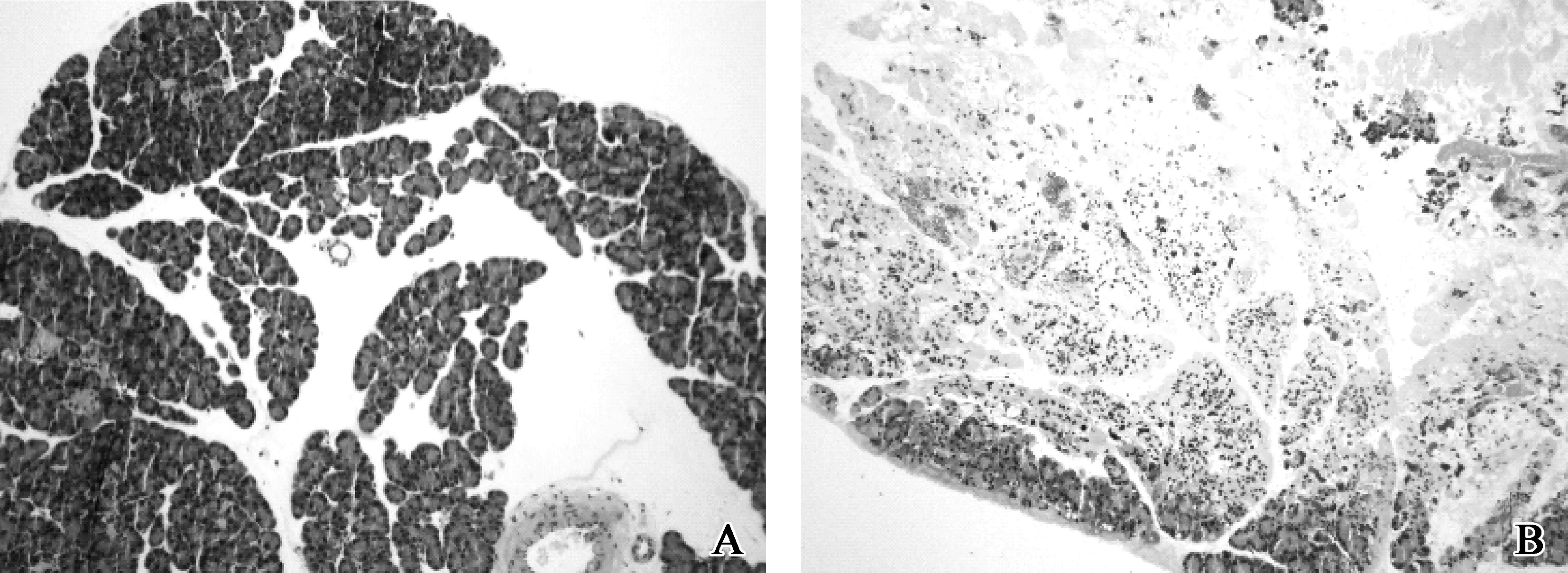
A.假手术组;B.SAP模型组
A.sham operation group; B.SAP model group
图1 术后6 h两组胰腺组织病理学检查(HE ×100)
Fig 1 Pathological examination of pancreas in two group at 6 h after operation (HE ×100)
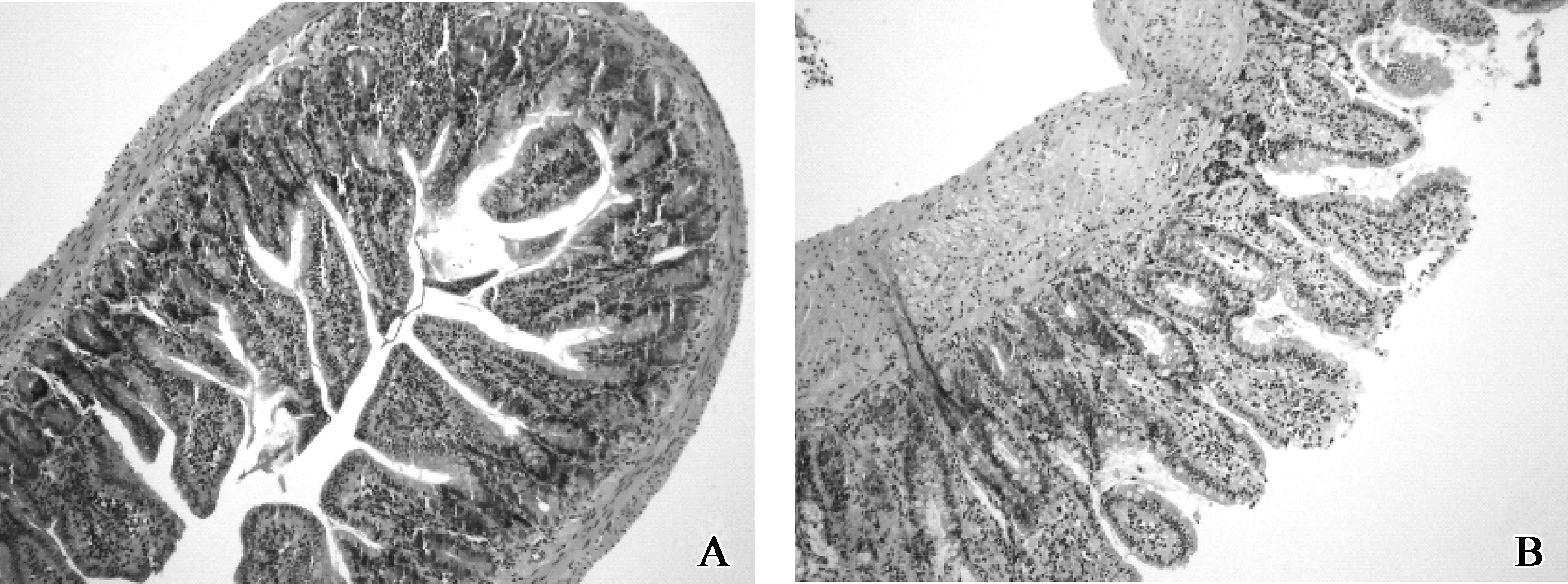
A.假手术组;B.SAP模型
A.sham operation group; B.SAP model group
图2 术后6 h两组回肠组织病理学检查(HE ×100)
Fig 2 Ileum pathological examination in two group at 6 h after operation(HE ×100)

A.假手术组;B.SAP模型组
A.sham operation group; B.SAP model group
图3 术后6 h两组电镜观察回肠组织(×10 000)
Fig 3 Ileal tissues were observed by electron microscope in two group at postoperative 6 h(×10 000)
2.4 各时间点回肠HMGB1 mRNA表达量
A组回肠HMGB1 mRNA表达量为1.039 6±0.562 6,B组术后6、12、24 h 3个时间点回肠HMGB1mRNA表达量依次为4.170 3±1.316 6、35.848 9±3.004 8、63.704 1±2.459 7,B组各时间点HMGB1 mRNA表达量相对A组显著增加(P<0.01),且随时间推移显著增高(P<0.01)。
2.5 各组大鼠CD3+、CD4+、CD8+淋巴细胞凋亡率
与A组相比,各时间点B组回肠组织CD3+、CD4+、CD8+淋巴细胞凋亡率均明显升高,且随时间呈上升趋势(P<0.05或P<0.01);CD8+淋巴细胞6 h和12 h相比时,虽升高,但差异无统计学意义。见表1。
3 讨 论
肠黏膜屏障一般由机械屏障、化学屏障、免疫屏障和生物屏障构成,其主要作用是阻止肠道内有害物质(如肠内的细菌及内毒素)进入体循环[4]。SAP时,大量炎症介质和细胞因子释放,使肠道出现微循环障碍,大量免疫细胞凋亡,导致肠道局部或全身免疫力下降,从而导致肠道发生免疫功能损伤。可见,发生SAP时,加强对肠道黏膜免疫屏障的保护,对肠黏膜屏障乃至对全身免疫功能都有积极作用。目前关于SAP时发生肠免疫屏障机制尚不清楚。
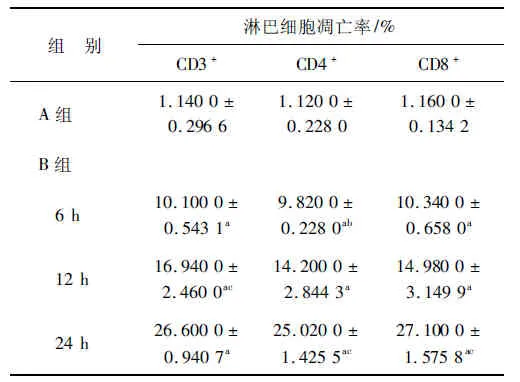
组 别淋巴细胞凋亡率/%CD3+CD4+CD8+A组1.1400±0.29661.1200±0.22801.1600±0.1342B组 6h10.1000±0.5431a9.8200±0.2280ab10.3400±0.6580a 12h16.9400±2.4600ac14.2000±2.8443a14.9800±3.1499a 24h26.6000±0.9407a25.0200±1.4255ac27.1000±1.5758ac
与A组比较,aP<0.01;B组同组相邻时间点比较,bP<0.05,cP<0.01
HMGB1作为一种晚期炎症因子[5],可介导肠黏膜屏障损伤而导致肠道通透性增加[6]。Wolfson等[7- 8]研究发现,用HMGB1处理肠上皮细胞和内皮细胞后可引起单层细胞屏障功能丧失。Luan等[9]的研究表明,AP大鼠肠黏膜中HMGB1含量明显升高。Yang等[10]的研究显示,含HMGB1的胆汁可破坏肠黏膜屏障。上述研究均证实,HMGB1介导了SAP时IBFD的发病过程,但其发病机制尚不十分明确。乔世峰等[11]研究SAP大鼠肠道免疫功能的变化发现,SAP发生后各期CD3+、CD4+、CD4+/CD8+细胞明显下降,说明大鼠早期即发现肠黏膜免疫功能明显下降。王兴鹏等[12]研究发现,ANP大鼠回肠Peyer集合淋巴结中存在大量凋亡淋巴细胞,亦证明了SAP大鼠存在肠道免疫屏障受损。本实验通过成功建立SAP大鼠模型发现,各时间点回肠组织CD3+、CD4+、CD8+细胞的凋亡率较假手术组明显提高(P<0.01或P<0.05),与文献报道相符,SAP大鼠肠黏膜免疫功能下降,且SAP模型组大鼠各时间点回肠HMGB1mRNA表达量均较假手术组上升(P<0.01或P<0.05),说明HMGB1与肠道黏膜免疫损伤存在一定关系。
HMGB1是众所周知的危险相关分子模式或警报素,能够激活先天性免疫反应。HMGB1可激活树突细胞并诱导树突细胞成熟[13- 14],成熟树突细胞通过淋巴管迁移到淋巴结,将其在外周组织获得的外源性抗原提呈给未致敏T细胞,从而启动免疫反应。其次,HMGB1及其功能域B盒具有免疫刺激信号活性分泌炎症因子TNF- α、IL- 1、IL- 6、IL- 8和IL- 12的功能[15],这些炎症介质的释放对SAP的发生发展至关重要。SAP时存在HMGB1的改变及细胞免疫功能的障碍[16]。前期实验[17]显示,SAP大鼠血清HMGB1随时间逐渐上升;本实验显示SAP大鼠血清IL- 1、IL- 10的浓度随着病程进展越来越高,与此同时SAP模型组大鼠各时间点回肠HMGB1 mRNA表达量也越来越多。
综上所述,SAP模型组胰腺病理评分与假手术组相比明显升高,模型复制成功;随着病程时间的延长,胰腺病理损伤越来越重;各时间点回肠HMGB1 mRNA表达量均上升,CD3+、CD4+、CD8+细胞凋亡率提高,IL- 1、IL- 10浓度越来越高,回肠病理损伤显著加重。HMGB1可能通过对肠道T淋巴细胞的调节,从细胞免疫途径介导了肠黏膜免疫功能障碍,加重SAP病情。
[1] 张恒斌.三种评分系统对急性胰腺炎病情及预后的评估价值[J].现代医学,2016,44(1):32- 36.
[2] 王兴鹏,李兆申,袁耀宗,等.中国急性胰腺炎诊治指南(2013,上海)[J].中国实用内科杂志,2013,13(2):73- 78.
[3] RAHMAN S H,AMMORI B J,HOLMFIELD J,et al.Intestinal hypoperfusion contributes to gut barrier failure in severe acute pancreatitis[J].J Gastrointest Surg,2003,7(1):26- 36.
[4] 汪冬,周其全.高原缺氧环境下肠道菌群紊乱与急性重症高原病[J].胃肠病学和肝病学杂志,2017,26(2):222- 226.
[5] SHEN X,LI W Q.High- mobility group box 1 protein and its role in severe acute pancreatitis[J].World J Gastroenterol,2015,21(5):1424- 1435.
[6] WANG H,YANG H,TRACEY K J.Extracellular role of HMGB1 in inflammation and sepsis- Wang- 2004- Journal of Internal Medicine- Wiley Online Library[J].J Intern Med,2004,255(3):320- 331.
[7] WOLFSON R K,CHIANG E T,GARCIA J G N.HMGB1 induces human lung endothelial cell cytoskeletal rearrangement and barrier disruption[J].Microvasc Res,2011,81(2):189- 197.
[8] DAI S,SODHI C,CETIN S,et al.Extracellular high mobility group box- 1 (HMGB1) inhibits enterocyte migration via activation of Toll- like receptor- 4 and increased cell- matrix adhesiveness[J].J Biol Chem,2010,285(7):4995- 5002.
[9] LUAN Z G,ZHANG H,MA X C,et al.Role of high- mobility group box 1 protein in the pathogenesis of intestinal barrier injury in rats with severe acute pancreatitis[J].Pancreas,2010,39(2):216- 223.
[10] YANG R,MIKI K,OKSALA N,et al.Bile high- mobility group box 1 contributes to gut barrier dysfunction in experimental endotoxemia[J].Am J Physiol Regul Integr Comp Physiol,2009,297(2):R362- 369.
[11] 乔世峰,孙家邦,李非,等.重症胰腺炎大鼠肠道免疫功能改变及精氨酸的调节作用[J].中国免疫学杂志,2006,22(8):761- 763.
[12] 王兴鹏,王冰娴,吴恺,等.细胞凋亡在急性坏死型胰腺炎早期肠黏膜上皮细胞死亡中的作用[J].中华消化杂志,2001,21(5):267- 270.
[13] AMMORI B J,CAIRNS A,DIXON M F,et al.Altered intestinal morphology and immunity in patients with acute necrotizing pancreatitis[J].J Hepatobiliary Pancreat Surg,2002,9(4):490- 496.
[14] MESSMER D,YANG H,TELUSMA G,et al.High mobility group box protein 1:an endogenous signal for dendritic cell maturation and Th1 polarization[J].J Immunol,2004,173(1):307- 313.
[15] ROVEREQUERINI P,CAPOBIANCO A,SCAFFIDI P,et al.HMGB1 is an endogenous immune adjuvant released by necrotic cells[J].Embo Reports,2004,5(8):825- 830.
[16] 姜良富,石承先,段泽艳.急性胰腺炎时T淋巴细胞亚群的改变与细菌移位的关系[J].海南医学院学报,2005,11(4):254- 257.
[17] 赵建锋,兑丹华,代静静,等.清胰Ⅱ号对重症急性胰腺炎大鼠胰腺损伤的保护作用及机制探讨[J].山东医药,2016,56(10):25- 26.
Experimental study of intestinal immune dysfunction in severe acute pancreatitis
ZHOU Miao,DUI Dan- hua,AO Yu,DAI Jing- jing
(DepartmentofGeneralSurgery,AffiliatedHospitalofZunyiMedicalCollege,Zunyi563000,China)
Objective: Objective:To investigate the status of intestinal immune damage in rats with severe acute pancreatitis. Methods: 48 SD rats were randomly divided into sham operation group (A), SAP group (B), 24 rats in each. group A
laparotomy only without injection; group B retrograde pancreatic duct injection of 5% sodium taurocholate [0.1 ml·(100 g)-1] to establish SAP model. After modeling, 6 h, 12 h, 24 h, pancreas tissue and ileum were taken for pathological section, then the pathological changes were observed under light and electron microscopy to observe the pathological changes of pancreas and intestinal mucosa. Enzyme linked immunosorbent assay (ELISA) was performed to detect the concentration of serum IL- 1, IL- 10, the ileum s’ Peyer nodes were collected, flow cytometry was performed for CD3+, CD4+, CD8+cells apoptosis detection, and finally RT- PCR was carried out to detect the HMGB1mRNA content of ileum. Results: The pancreatic pathological score in group B was higher than that in group A (P<0.01), and the pancreatic pathological score was higher in group 6- 24 h than in group B (P<0.05). HMGB1mRNA expression in ileum mucosa in group B at each time point was higher than that in the sham operation group (P<0.01 orP<0.05), the apoptosis rate of CD3+, CD4+and CD8+cells at each time point increased compared with the sham operation group (P<0.01 orP<0.05), ileum pathological injury increased compared with the sham operation group. Conclusion: Rats with severe acute pancreatitis have disturbance of intestinal immune function.
severe acute pancreatitis; intestinal immune barrier; HMGB1; lymphocyte; rats
2016- 11- 24
2017- 05- 07
贵州省优秀科技教育人才省长专项资金项目[黔省专合字(2008)106号];遵义市红花岗区科学技术项目
周淼(1989-),男,湖南衡阳人,在读硕士研究生。E- mail:zhoumiao113@qq.com
兑丹华 E- mail:2361169015@qq.com
周淼,兑丹华,敖宇,等.重症急性胰腺炎并发肠道免疫功能障碍的实验研究[J].东南大学学报:医学版,2017,36(4):559- 563.
R576
A
1671- 6264(2017)04- 0559- 05
10.3969/j.issn.1671- 6264.2017.04.012
