表达猪Viperin蛋白重组腺病毒的构建及其对PRRSV复制的抑制作用
2017-09-13方剑玉朱文豪郭小参白献晓李海利徐引弟郎利敏王治方王克领
方剑玉,朱文豪,郭小参,白献晓,李海利,徐引弟,郎利敏,王治方,王克领*
(1.河南省农业科学院 畜牧兽医研究所,河南 郑州 450002; 2.南京农业大学 动物医学院,江苏 南京 210095; 3.普莱柯生物工程股份有限公司,河南 洛阳 471000)
表达猪Viperin蛋白重组腺病毒的构建及其对PRRSV复制的抑制作用
方剑玉1,2,朱文豪1,郭小参3,白献晓1,李海利1,徐引弟1,郎利敏1,王治方1,王克领1*
(1.河南省农业科学院 畜牧兽医研究所,河南 郑州 450002; 2.南京农业大学 动物医学院,江苏 南京 210095; 3.普莱柯生物工程股份有限公司,河南 洛阳 471000)
为研究猪Viperin蛋白对猪繁殖与呼吸综合征病毒(PRRSV)复制的抑制作用,通过RT-PCR方法扩增猪Viperin基因,并克隆入腺病毒穿梭载体pAdTrack-CMV,经菌液PCR、酶切鉴定后进行测序。将PmeⅠ内切酶线性化的重组穿梭载体质粒(pAdTrack-sVIP)电转化大肠杆菌BJ5183,与腺病毒骨架载体pAdEasy-1进行同源重组,提取重组后的腺病毒质粒,经内切酶PacⅠ线性化后转染HEK-293A细胞,装配成完整的病毒粒子rAd-sVIP。重组腺病毒rAd-sVIP感染细胞后,可见绿色荧光蛋白的表达。RT-PCR、Western blot检测结果表明,重组腺病毒rAd-sVIP可正确表达猪Viperin蛋白,且表达的猪Viperin蛋白具有良好的反应原性,对PRRSV的复制具有明显的抑制作用。
猪Viperin蛋白; 重组腺病毒; 抗病毒活性; 猪繁殖与呼吸综合征病毒
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(PRRSV)引起的接触性传染病,1987年首次在美国发现,并于1990在欧洲出现。PRRSV目前已经蔓延至全球,给养猪业造成了重大的经济损失。PRRSV感染主要引起母猪流产、死胎、弱胎、木乃伊胎,以及仔猪呼吸困难、败血症、高死亡率等。PRRSV是单股正链RNA病毒,属于套式病毒目动脉炎病毒科动脉炎病毒属,根据基因型和血清型分为美洲型和欧洲型,该病毒基因组全长约15 kb,包括ORF1a、ORF1b、ORF2a、ORF2b、ORF3、ORF4、ORF5、ORF5a、ORF6、ORF7 10个开放性阅读框,病毒蛋白酶水解病毒多聚蛋白ORF1a和ORF1b成为14个非结构蛋白(NSPs)。NSPs主要调控病毒的复制和转录,且对病毒的致病性和先天性免疫有重要的调节作用[1]。目前,已研究开发出各种疫苗和药物对PRRSV进行预防和控制,主要包括灭活苗、弱毒活疫苗、重组亚单位疫苗和DNA疫苗等生物制品[2-3]。目前,养猪场主要采用细胞培养传代的各种弱毒活疫苗对该病毒进行预防,但疫苗不能清除感染猪体内病毒,存在免疫失败、免疫效果不佳等问题[4]。而且,活疫苗的使用存在疫苗毒力返强、不同毒株直接发生重组等问题,从而导致不断出现新流行毒株,造成PRRSV流行十分复杂。因此,研究有效的抗PRRSV药物十分必要。
Viperin蛋白为宿主细胞中重要的抗病毒蛋白, Viperin蛋白主要定位于内质网,在正常细胞内表达水平较低[5]。Viperin蛋白可被干扰素、脂多糖、聚肌胞苷酸等诱导表达。此外,多种病毒感染后可诱导Viperin蛋白表达,主要包括仙台病毒(Sendai virus)[6]、水泡性口炎病毒(VSV)[7]、日本乙型脑炎病毒(JEV)[8]、辛德毕斯病毒(SINV)[9]、西尼罗病毒(WNV)[10]、丙肝病毒(HCV)[11]、基孔肯雅病病毒(CHIKV)[12]、鼻病毒(rhinovirus)[13]、黄热病病毒[14]、淋巴细胞性脉络丛脑膜炎病毒(LCMV)[15]、呼吸道肠道病毒(reovirus)[16]、登革热病毒(DENV)[17]、PRRSV[18]等。Viperin蛋白包括361个氨基酸,其分子质量大约42 ku,N端的42位氨基酸组成1个双亲性的α螺旋,该螺旋结构与其在细胞内的定位有关;中间为S-腺苷甲硫氨酸酶活性区域,包含4个保守的SAM酶模体;C端为保守的区段,与其抗病毒活性有关。Viperin蛋白对多种病毒均具有抗病毒活性,但其对PRRSV的抗病毒活性目前仍不明确。鉴于此,构建了表达猪Viperin基因的复制缺陷型重组腺病毒,在HEK-293A细胞中包装成具有感染活性的重组腺病毒,扩增纯化后检测其对PRRSV的抗病毒活性,旨在为抗PRRSV药物的开发奠定基础。
1 材料和方法
1.1质粒、菌株、细胞与试剂
腺病毒穿梭载体pAdTrack-CMV、大肠杆菌BJ5183、DH5α感受态细胞、腺病毒骨架载体pAdEasy-1、阳性质粒pEASY-sVIP、rAD-wt野生型腺病毒、PRRSV(BB0907),以及MARC-145细胞、HEK-293A细胞均由南京农业大学动物医学院动物传染病学实验室保存。
琼脂糖凝胶回收试剂盒、质粒纯化试剂盒购自Axygen公司;限制性内切酶NheⅠ、XhoⅠ、T4 DNA连接酶均购自Takara生物公司;PmeⅠ和PacⅠ限制性内切酶购自NEB公司;Prime STAR SH高保真预混酶购自南京诺唯赞生物技术有限公司;羊抗鼠HRP-IgG、β-actin抗体购自碧云天生物公司;ECL化学发光试剂盒购自Pierce公司;RNA提取试剂盒购自OMEGA公司;M-MLV 反转录酶购自Promega公司;鼠抗猪Viperin多克隆抗体、PRRSV N单克隆抗体由南京农业大学动物医学院动物传染病实验室制备;DMEM细胞培养液、新生牛血清购自Gibco公司;其他常规试剂为国产或进口分析纯。
1.2引物设计与Viperin基因的PCR扩增
设计猪Viperin腺病毒表达引物,分别在上、下游引物加入Hind Ⅲ、XhoⅠ酶切位点,由Invitrogen公司合成,基因全长1 089 bp。引物序列如下,rAd-F:5′-CCGCTCGAGATGTGGACACTGGTACCTGTCAC-3′;rAd-R:5′-CCCAAGCTTTCACCAGTCCAGCTTCAGGTCCG-3′。以阳性质粒pEASY-sVIP为模板,PCR扩增猪Viperin序列,反应条件为:98 ℃预变性 1 min;98 ℃ 10 s,55 ℃ 5 s,72 ℃ 1 min,35个循环;72 ℃延伸10 min。将PCR产物进行0.8%琼脂糖凝胶电泳。
1.3重组腺病毒穿梭载体pAdTrack-sVIP的构建
将PCR产物进行琼脂糖凝胶电泳后,用凝胶回收试剂盒回收目的片段,回收片段和pAdTrack-CMV腺病毒穿梭载体分别用HindⅢ、XhoⅠ进行酶切后,将酶切产物进行琼脂糖凝胶电泳,用试剂盒回收目的片段和载体,并用T4 DNA连接酶于16 ℃连接过夜,同时设载体自身连接对照。将连接后产物转化DH5α感受态细胞,37 ℃培养过夜。挑取含氨苄青霉素的LB固体培养基平板的单克隆菌落,接种于含氨苄青霉素的液体LB培养基,振荡培养12~16 h,用质粒提取试剂盒提取重组质粒,用HindⅢ、XhoⅠ进行酶切鉴定。将鉴定阳性的质粒送Invitrogen公司测序,进行序列分析,将测序正确的质粒命名为pAdTrack-sVIP。
1.4重组穿梭载体与腺病毒骨架质粒在大肠杆菌BJ5183中的同源重组
将重组质粒pAdTrack-sVIP用PmeⅠ进行酶切线性化后,电转化含腺病毒骨架质粒pAdEasy-1的BJ5183感受态细胞。电转参数设置为:1.9 kV,25 μF,200 Ω;电转化后加入无抗生素LB液体培养基,于37 ℃振荡培养45 min,12 000 r/min离心1 min,将离心后的菌液涂布于含卡那霉素的LB固体培养基平板,培养36 h后,挑取针尖大小疑似阳性菌落,接种LB液体培养基过夜培养后,采用常规碱裂解法提取腺病毒重组质粒,用PacⅠ进行单酶切鉴定,37 ℃反应6 h后进行琼脂糖凝胶电泳,观察酶切片段。将重组阳性质粒命名为pAd-sVIP。
1.5重组腺病毒的包装
将获得的正确阳性重组腺病毒质粒pAd-sVIP用PacⅠ进行单酶切线性化后,将酶切产物用酚氯仿抽提回收DNA,并利用Lipofectamine 3000转染试剂将回收产物按照说明书方法转染生长至单层的HEK-293A细胞,转染后于37 ℃、5%CO2条件下培养,每天观察细胞直至细胞产生病变和出现特异性绿色荧光,如无病变产生,可将细胞于-20 ℃冻融收获后接种新的HEK-293A细胞,直至病变出现。当细胞出现明显病变后,将细胞冻融3次大量接种细胞培养瓶,传代培养以提高病毒滴度。
1.6表达猪Viperin蛋白的重组腺病毒的鉴定与滴度测定
1.6.1 RT-PCR鉴定重组腺病毒Viperin基因表达 取病变细胞反复冻融后,取300 μL提取细胞总RNA,按照M-MLV Reverse Transcripatase说明书利用Viperin基因下游引物rAd-R进行反转录,同时设置野生腺病毒对照组,获得cDNA后,以rAd-F、rAd-R为引物进行PCR扩增,反应条件为:98 ℃预变性 1 min;98 ℃ 10 s,55 ℃ 5 s,72 ℃ 1 min,共35个循环;72 ℃延伸10 min。
扩增片段进行1%琼脂糖凝胶电泳,以鉴定获得的腺病毒是否正确。
1.6.2 Western blot鉴定猪Viperin蛋白的表达 取接种重组腺病毒的HEK-293A细胞,进行Wes-tern blot试验,一抗为鼠抗猪Viperin多克隆抗体,稀释比例为1∶1 000;二抗采用1∶10 000稀释的羊抗鼠HRP-IgG。
1.6.3 重组腺病毒滴度的测定 将HEK-293A细胞接种96孔板,每孔5×104个细胞,待长成单层后,弃去上清。用无血清DMEM细胞培养液将腺病毒原液进行10倍比稀释接种细胞。每孔100 μL,8个重复,培养箱孵育1 h,弃去病毒液,加入含2%血清的DMEM细胞维持液。37 ℃、 5%CO2条件下培养3~5 d,逐日观察细胞病变,并按Reed-Muench方法计算病毒TCID50。
1.7腺病毒表达猪Viperin抗病毒效果测定
将猪肺泡巨噬细胞(PAM)接种24孔板,每孔分别接种10、30、50 MOI的重组腺病毒rAd-sVIP,同时设置rAD-wt野生型腺病毒对照。37 ℃、5%CO2条件下培养24 h,接种PRRSV(BB0907)病毒液(MOI=0.01),37 ℃培养48 h。分别收集细胞,用细胞裂解液充分裂解细胞,然后用BCA蛋白质定量试剂盒检测蛋白质浓度,Western blot检测PAM细胞内猪Viperin蛋白的表达和PRRSV在细胞内复制情况,以β-actin为内参。其中,一抗分别为鼠抗猪Viperin多克隆抗体、PRRSV N蛋白单克隆抗体、β-actin单克隆抗体,二抗为羊抗鼠HRP-IgG。
2 结果与分析
2.1猪Viperin基因PCR扩增结果
以pEASY-sVIP为模板,应用引物rAd-F、rAd-R进行PCR扩增,可见与预期大小一致的条带(图1)。

M.DNA Marker 5000; 1.PCR扩增产物图1 猪Viperin基因的扩增结果
2.2腺病毒穿梭载体pAdTrack-sVIP的构建与鉴定结果
构建的重组穿梭载体pAdTrack-sVIP经Hind Ⅲ和XhoⅠ进行酶切鉴定,酶切产物经1%琼脂糖凝胶电泳,可见约1 089 bp的目的片段,与预期片段大小相符(图2)。将酶切鉴定正确的重组穿梭载体pAdTrack-sVIP进行测序,测序结果采用DANStar软件与已知猪Viperin序列进行比较发现,成功构建了重组穿梭载体。

M.DNA Marker 5000; 1.pAdTrack-sVIP质粒图2 重组穿梭载体pAdTrack-sVIP的酶切鉴定结果
2.3重组腺病毒质粒pAd-sVIP的鉴定结果
将重组穿梭质粒pAdTrack-sVIP线性化后,电转化含腺病毒骨架质粒pADEasy-1的大肠杆菌感受态细胞BJ5183,提取质粒进行酶切鉴定,经1%琼脂糖凝胶电泳可见2个条带,与预期结果相符,表明已成功将Viperin基因克隆入腺病毒基因组(图3)。

M.DNA Marker 15000; 1.pAd-sVIP质粒图3 重组腺病毒质粒pAd-sVIP酶切鉴定结果
2.4重组腺病毒的转染与病毒收获
将线性化的重组腺病毒质粒pAd-sVIP转染HEK-293A细胞后,荧光显微镜观察可见绿色荧光蛋白表达(图4),同时,显微镜下可见特异性细胞病变。

A.转染pAd-sVIP质粒的HEK-293A细胞; B.空白HEK-293A细胞图4 重组腺病毒质粒pAd-sVIP转染HEK-293A细胞后的绿色荧光蛋白表达情况
2.5重组腺病毒rAd-sVIP外源基因的表达与鉴定
2.5.1 RT-PCR检测猪Viperin基因的表达 收集重组腺病毒和野生型腺病毒的病毒液,用RNA提取试剂盒提取总RNA,反转录成cDNA后进行PCR扩增,扩增产物进行1%的琼脂糖凝胶电泳,可观察到约1 089 bp大小的目的条带,而野生型腺病毒无条带(图5)。表明重组腺病毒可正确表达猪Viperin基因。

M.DNA Marker 5000; 1.野生型腺病毒rAd-wt对照; 2.重组腺病毒rAd-sVIP图5 PCR检测重组腺病毒rAd-sVIP猪Viperin基因表达情况
2.5.2 Western blot鉴定猪Viperin的表达 Wes-tern blot结果显示,重组腺病毒组出现特异性条带,而野生型腺病毒组无条带,表明重组腺病毒可正确表达猪Viperin蛋白(图6)。

图6 Western blot检测猪Viperin蛋白重组腺病毒在HEK-293A细胞中的表达结果
2.6重组腺病毒的传代与滴度测定结果
将病变细胞反复冻融3次后,转接新鲜HEK-293A单层细胞传代,以获得较高滴度病毒。经过检测计算,rAd-sVIP病毒滴度可达到5×106TCID50/mL。
2.7重组腺病毒表达猪Viperin蛋白对PRRSV复制的抑制作用
采用腺病毒表达系统表达外源猪Viperin蛋白,在PAM细胞上检测腺病毒表达猪Viperin蛋白对PRRSV复制的抑制作用,结果显示,腺病毒表达的猪Viperin蛋白在PAM细胞上对PRRSV具有显著的抗病毒活性,且抗病毒作用具有剂量依赖性(图7)。
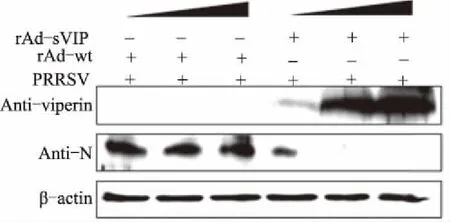
+表示感染;-表示未感染; 表示病毒感染量递增图7 重组腺病毒表达猪Viperin蛋白对PRRSV的抗病毒作用
3 结论与讨论
本研究成功构建了猪Viperin蛋白的腺病毒表达载体,并将腺病毒感染PAM细胞,证明携带猪Viperin基因的腺病毒表达载体可在真核细胞内稳定表达目的蛋白,腺病毒表达的猪Viperin蛋白在PAM细胞内可显著抑制PRRSV的复制。
Viperin蛋白具有广谱抑制DNA和RNA病毒复制的功能,但其抑制不同病毒复制的机制均有所不同,可通过抑制细胞内法尼基焦磷酸合成酶活性抑制病毒胆固醇等脂类物质合成,影响流感病毒等的释放[19];Viperin蛋白N端的α螺旋决定其在脂肪滴等细胞器中的定位,该蛋白质通过与HCV非结构蛋白NS5A竞争性地结合宿主蛋白而影响该病毒的复制[20]。研究表明,在巨噬细胞和树突细胞中缺失Viperin的表达可增强WNV的感染[10]。另外,在人成纤维细胞中表达Viperin可有效抑制人巨细胞病毒(HCMV)的复制,减少HCMV结构蛋白gB、pp65、pp28的表达[21]。此外,马Viperin蛋白可定位于细胞内质网,破坏细胞内质网的正常结构,抑制马传染性贫血病毒(EIAV)进入细胞、释放等[22]。
PAM细胞对Viperin真核表达载体的转染效率低,表达量也较低,将外源蛋白插入腺病毒表达载体,表达蛋白具有良好的生物学活性,且表达量较高[23]。故本研究构建了猪Viperin蛋白的腺病毒表达载体。腺病毒对外源基因的容纳性较好。将目的基因插入腺病毒穿梭载体pAdTrack-CMV后,在宿主菌BJ5183内与骨架质粒pEASY-1进行同源重组,重组后的腺病毒可以正确表达外源基因。缺陷型腺病毒由于其缺失早期转录1区(E1),不能自主复制,仅能在表达该区域的HEK-293A细胞上复制,所携带基因不整合到宿主细胞中,无插入突变激活癌基因的危险,生物安全性良好,很少发生突变,可携带容量大的外源基因,表达蛋白质接近成熟的蛋白质[24]。腺病毒宿主范围广,在许多疾病的治疗中已广泛应用[25]。本研究将猪Viperin基因克隆入腺病毒表达载体,成功获得了可以高效表达猪Viperin蛋白的重组腺病毒rAd-sVIP,且Western blot结果表明表达蛋白具有良好的生物学活性。
Viperin蛋白在抗病毒先天免疫中发挥了重要作用。前期研究表明,猴源Viperin蛋白在MARC-145细胞中对PRRSV具有显著的抗病毒作用[18]。PRRSV感染的主要靶细胞是PAM,了解猪源Viperin蛋白在PAM细胞上对PRRSV的抗病毒作用,明确猪源Viperin蛋白对PRRSV的抗病毒作用是否具有组织细胞依赖性,对阐明猪源Viperin蛋白对PRRSV的抗病毒作用具有重要意义。尽管Viperin蛋白在不同物种中相对保守,但猪源和猴源Viperin蛋白经过序列分析具有一定的差异(数据暂未发表)。本试验结果表明,猪源Viperin蛋白在PAM细胞上同样具有较好的抗病毒效果,且该效果具有剂量依赖性。
综上所述,利用腺病毒表达系统研究猪Viperin蛋白的抗病毒活性具有可行性, Western blot试验结果表明,表达猪Viperin蛋白在PAM细胞上具有较好的抗PRRSV效果,这为进一步研究猪Viperin蛋白在猪体内的抗病毒作用以及开发新的抗病毒药物提供了新的思路。
[1] Han M,Yoo D.Modulation of innate immune signaling by nonstructural protein 1(nsp1) in the family Arteriviridae[J].Virus Research,2014,194:100-109.
[2] Carter Q L,Curiel R E.Interleukin-12(IL-12) ameliorates the effects of porcine respiratory and reproductive syndrome virus(PRRSV) infection[J].Veterinary Immunology and Immunopathology,2005,107(1/2):105-118.
[3] Charerntantanakul W,Yamkanchoo S,Kasinrerk W.Plasmids expressing porcine interferon gamma up-regulate pro-inflammatory cytokine and co-stimulatory molecule expression which are suppressed by porcine reproductive and respiratory syndrome virus[J].Veterinary Immunology and Immunopathology,2013,153(1/2):107-117.
[4] Meier W A,Galeota J,Osorio F A,etal.Gradual development of the interferon-gamma response of swine to porcine reproductive and respiratory syndrome virus infection or vaccination[J].Virology,2003,309(1):18-31.
[5] Zhu H,Cong J P,Shenk T.Use of differential display analysis to assess the effect of human cytomegalovirus infection on the accumulation of cellular RNAs:Induction of interferon-responsive RNAs[J].Proceedings of the National Academy of Sciences of the United States of America,1997,94(25):13985-13990.
[6] Severa M,Coccia E M,Fitzgerald K A.Toll-like receptor-dependent and -independent viperin gene expression and counter-regulation by PRDI-binding factor-1/BLIMP1[J].The Journal of Biological Chemistry,2006,281(36):26188-26195.
[7] Boudinot P,Riffault S,Salhi S,etal.Vesicular stomatitis virus and pseudorabies virus induce a vig1/cig5 homologue in mouse dendritic cells via different pathways[J].The Journal of General Virology,2000,81(Pt 11):2675-2682.
[8] Chan Y L,Chang T H,Liao C L,etal.The cellular antiviral protein viperin is attenuated by proteasome-mediated protein degradation in Japanese encephalitis virus-infected cells[J].Journal of Virology,2008,82(21):10455-10464.
[9] Zhang Y,Burke C W,Ryman K D,etal.Identification and characterization of interferon-induced proteins that inhibit alphavirus replication[J].Journal of Virology,2007,81(20):11246-11255.
[10] Szretter K J,Brien J D,Thackray L B,etal.The interferon-inducible gene viperin restricts West Nile virus pathogenesis[J].Journal of Virology,2011,85(22):11557-11566.
[11] Helbig K J,Lau D T,Semendric L,etal.Analysis of ISG expression in chronic hepatitis C identifies viperin as a potential antiviral effector[J].Hepatology,2005,42(3):702-710.
[12] White L K,Sali T,Alvarado D,etal.Chikungunya virus induces IPS-1-dependent innate immune activation and protein kinase R-independent translational shut off[J].Journal of Virology,2011,85(1):606-620.
[13] Proud D,Turner R B,Winther B,etal.Gene expression profiles duringinvivohuman rhinovirus infection:Insights into the host response[J].American Journal of Respiratory and Critical Care Medicine,2008,178(9):962-968.
[14] Khaiboullina S F,Rizvanov A A,Holbrook M R,etal.Yellow fever virus strains Asibi and 17D-204 infect human umbilical cord endothelial cells and induce novel changes in gene expression[J].Virology,2005,342(2):167-176.
[15] Hinson E R,Joshi N S,Chen J H,etal.Viperin is highly induced in neutrophils and macrophages during acute and chronic lymphocytic choriomeningitis virus infection[J].Journal of Immunology,2010,184(10):5723-5731.
[16] Dixit E,Boulant S,Zhang Y,etal.Peroxisomes are signaling platforms for antiviral innate immunity[J].Cell,2010,141(4):668-681.
[17] Fink J,Gu F,Ling L,etal.Host gene expression profiling of dengue virus infection in cell lines and patients[J].PLoS Neglected Tropical Diseases,2007,1(2):e86.
[18] Fang J,Wang H,Bai J,etal.Monkey Viperin restricts porcine reproductive and respiratory syndrome virus replication[J].PLoS One,2016,11(5):e0156513.
[19] Wang X,Hinson E R,Cresswell P.The interferon-inducible protein viperin inhibits influenza virus release by perturbing lipid rafts[J].Cell Host & Microbe,2007,2(2):96-105.
[20] Helbig K J,Eyre N S,Yip E,etal.The antiviral protein viperin inhibits hepatitis C virus replicationviainteraction with nonstructural protein 5A[J].Hepatology,2011,54(5):1506-1517.
[21] Chin K C,Cresswell P.Viperin(cig5),an IFN-inducible antiviral protein directly induced by human cytomegalovirus[J].Proceedings of the National Academy of Sciences of the United States of America,2001,98(26):15125-15130.
[22] Tang Y D,Na L,Zhu C H,etal.Equine viperin restricts equine infectious anemia virus replication by inhibiting the production and/or release of viral Gag,Env,and receptor via distortion of the endoplasmic reticulum[J].Journal of Virology,2014,88(21):12296-12310.
[23] Jiang W,Jiang P,Li Y,etal.Recombinant adenovirus expressing GP5 and M fusion proteins of porcine reproductive and respiratory syndrome virus induce both humoral and cell-mediated immune responses in mice[J].Veterinary Immunology and Immunopathology,2006,113(1/2):169-180.
[24] Li G,Jiang P,Li Y,etal.Inhibition of porcine reproductive and respiratory syndrome virus replication by adenovirus-mediated RNA interference both in porcine alveolar macrophages and swine[J].Antiviral Research,2009,82(3):157-165.
[25] Wang G,Berk A J.Invivoassociation of adenovirus large E1A protein with the human mediator complex in adenovirus-infected and -transformed cells[J].Journal of Virology,2002,76(18):9186-9193.
Expression of Swine Viperin Protein in Recombinant Adenovirus and Study of Its Effect on PRRSV Replication
FANG Jianyu1,2,ZHU Wenhao1,GUO Xiaocan3,BAI Xianxiao1,LI Haili1,XU Yindi1,LANG Limin1,WANG Zhifang1,WANG Keling1*
(1.Animal Husbandry and Veterinary Research Institute,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China;2.College of Veterinary Medicine,Nanjing Agricultural University,Nanjing 210095,China;3.Pulike Biological Engineering,Inc.,Luoyang 471000,China)
To study the inhibitory effect of swine Viperin on PRRSV replication,the swine Viperin gene was amplified by RT-PCR and cloned into the adenovirus shuttle vector pAdTrack-CMV.The recombinant plasmid were identified by enzyme digestion and sequencing analysis.The pAdTrack-sVIP was linearized byPmeⅠ and homologous recombined with pAdEasy-1 backbone vector inE.coliBJ5183.The recombinant adenoviral genome DNA was extracted and digested byPacⅠ,then the DNA was transfected into the HEK-293A cells for packaging whole virus particle rAd-sVIP.The CPE and GFP fluorescence of cells were observed,the cells were harvested and adenoviral expressed recombinant swine Viperin protein were identified by RT-PCR and Western blot.The result showed that the swine Viperin was correctly expressed as expected.The expressed swine Viperin protein had good reactivity,and it could inhibit the PRRSV replication.
swine Viperin protein; recombinant adenovirus; antiviral activity; PRRSV
2017-04-06
国家自然科学基金项目(31672565)
方剑玉(1982-),女,河南林州人,助理研究员,博士,主要从事兽医免疫学研究。E-mail:fangjianyu2006@126.com
*通讯作者:王克领(1964-),男,河南柘城人,研究员,本科,主要从事动物传染病研究。E-mail:1449578205@qq.com
S855.3
: A
: 1004-3268(2017)09-0126-06
