独行菜法尼基焦磷酸合酶基因的克隆与原核表达
2017-09-13马利刚付小蝶冯卫生匡海学郑晓珂
马利刚,赵 乐,付小蝶,冯卫生,匡海学,郑晓珂*
(1.河南中医药大学 药学院,河南 郑州 450046; 2.呼吸疾病诊疗与新药研发河南省协同创新中心,河南 郑州 450046;3.黑龙江中医药大学 药学院,黑龙江 哈尔滨 150040)
独行菜法尼基焦磷酸合酶基因的克隆与原核表达
马利刚1,2,赵 乐1,2,付小蝶1,冯卫生1,2,匡海学3,郑晓珂1,2*
(1.河南中医药大学 药学院,河南 郑州 450046; 2.呼吸疾病诊疗与新药研发河南省协同创新中心,河南 郑州 450046;3.黑龙江中医药大学 药学院,黑龙江 哈尔滨 150040)
从独行菜(Lepidiumapetalum)中克隆强心苷合成途径的法尼基焦磷酸合酶(FPS)基因,并在大肠杆菌中表达,为进一步研究独行菜强心苷的合成途径提供参考。分析前期获得的独行菜幼苗转录组数据,选择其中注释为FPS且具有完整开放阅读框的序列,从独行菜叶片cDNA中通过PCR克隆该序列,并进行序列分析。结果表明,克隆得到独行菜FPS基因的cDNA序列,GenBank登录号KY366218,命名为LaFPS。序列长度为1 332 bp,含有1 161 bp的开放阅读框,推测编码386个氨基酸。LaFPS蛋白可能不含跨膜结构,定位于线粒体中,含有聚异戊二烯合成酶结构域。LaFPS蛋白氨基酸序列与拟南芥(Arabidopsisthaliana)FPS1蛋白相似性高达92%,进化树分析结果表明,LaFPS与同为十字花科的拟南芥FPS1、遏蓝菜(Noccaeacaerulescens)FPS1、高山南芥(Arabisalpina)FPS亲缘关系最近。构建的载体pET-32a-LaFPS可在大肠杆菌中成功诱导表达。表明成功克隆了独行菜FPS基因,并建立了其原核表达体系。
独行菜; 法尼基焦磷酸合酶; 基因克隆; 序列分析; 原核表达
中药葶苈子是独行菜(Lepidiumapetalum)或播娘蒿(Descurainiasophia)的干燥成熟种子,具有泻肺平喘、利水消肿的功效[1]。已从葶苈子中分离出强心苷、黄酮类、类萜等多种化学成分,其中强心苷类成分可以显著改善心血管功能[1]。有研究表明,葶苈苷(helveticoside)在北葶苈子[2]、南葶苈子[3]提取物中都是重要的活性成分。
强心苷类的生物合成主要包括萜类骨架合成、甾类合成、强心苷合成等阶段[4]。法尼基焦磷酸合酶(farnesyl pyrophosphate synthase,FPS,EC2.5.1.10)是萜类骨架合成的关键酶,可催化异戊烯基焦磷酸(isopentenyl diphosphate,IPP)、二甲基烯丙基焦磷酸(dimethylallyl diphosphate,DMAPP)缩合形成法尼基焦磷酸(farnesyl pyrophosphate,FPP)。两分子C15骨架的FPP再由鲨烯合酶(squalene synthase,SQS)催化形成C30骨架的鲨烯(squalene),而鲨烯是甾类物质合成的关键前体[5]。目前,已有多种植物的FPS基因被成功克隆,其中拟南芥[6-7]、黄花蒿[8-10]、雷公藤[11]、三七[12]、腊梅[13]、银杏[14]等植物的FPS基因功能和表达调控已有初步研究。而关于独行菜FPS基因的研究则未见报道。本研究根据独行菜幼苗转录组测序数据,通过PCR克隆得到独行菜FPS基因,并在大肠杆菌中成功诱导表达了该蛋白质,为后续研究独行菜FPS基因在强心苷合成途径中的功能奠定基础。
1 材料和方法
1.1材料
1.1.1 植物材料 独行菜种子采自河南伏牛山,由河南中医药大学药学院董诚明教授鉴定为独行菜干燥成熟种子。将独行菜种子播种于含有Hoagland’s营养液的蛭石中,在植物培养箱中(23 ℃,每天16 h光照、8 h黑暗)培养,光照强度3 000 lx。培养60 d后,采集独行菜幼嫩叶片,保存于-80 ℃备用。
1.1.2 试剂 植物总RNA提取、质粒提取、普通DNA产物纯化、普通琼脂糖凝胶DNA回收试剂盒购于天根生化科技(北京)有限公司。反转录试剂盒、大肠杆菌感受态细胞购于北京全式金生物技术有限公司。PrimeSTAR HS高保真酶、rTaq、pMD19-T载体、限制性核酸内切酶、T4 DNA连接酶、DNA Marker购于宝生物工程(大连)有限公司。Protein Ladder购于赛默飞世尔科技(中国)有限公司。pET-32a载体由河南中医药大学药学院中药化学实验室保存。其他试剂均为国产分析纯。引物合成由北京三博远志生物技术有限责任公司完成。
1.2方法
1.2.1 叶片总RNA的提取及cDNA的合成 取100 mg独行菜叶片,使用天根试剂盒提取总RNA,通过1%琼脂糖凝胶电泳检测RNA质量。然后以质量符合要求的总RNA为模板,oligo(dT)为引物,反转录合成得到独行菜叶片cDNA,分装后于-20 ℃保存备用。
1.2.2 独行菜FPS基因的克隆 从独行菜幼苗转录组数据中选择注释为FPS的序列,设计克隆引物LaFPS-F:5′-ATGGCAAAAGTTGTAAATAAGGT-3′,LaFPS-R:5′-GTTTGTTTCCCCTCAAAGC-3′。使用PrimeSTAR HS高保真酶从独行菜叶片cDNA模板中进行扩增,PCR程序为:95 ℃ 2 min;95 ℃ 10 s,54.7 ℃ 15 s,72 ℃ 1.5 min,35个循环。扩增片段经琼脂糖凝胶电泳分析确认与预期大小一致后,将目的片段切胶纯化连接到pMD19-T载体,热激转化至大肠杆菌Trans5α细胞。比较分析多个克隆的测序结果及转录组序列,确定其中序列正确的克隆,即为成功构建的pMD19-T-LaFPS。
1.2.3 序列分析 对于正确克隆的测序结果,采用ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)查找开放阅读框并获得其编码的蛋白质序列,用于后续分析。使用NCBI blastp比对nr数据库获得与其序列相似的其他蛋白质。使用ProtParam tool(http://web.expasy.org/protparam/)、TargetP 1.1(http://www.cbs.dtu.dk/services/TargetP/)、TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)、NCBI CD-Search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)、SWISS-MODEL(http://swissmodel.expasy.org/)等在线工具分析该蛋白质的理化性质、亚细胞定位、跨膜结构、保守结构域、三维结构。用MEGA 7软件进行序列比对,使用Phylogeny.fr软件(http://www.phylogeny.fr/index.cgi)构建进化树。
1.2.4 原核表达 根据LaFPS的ORF序列设计1对引物:5′-CGGGATCCATGAGTGTGAGTTATTG-3′,5′-CCGCTCGAGCTACTTCTGCCTCTTGT-3′。以pMD19-T-LaFPS质粒为模板进行扩增,用BamH Ⅰ和XhoⅠ对扩增片段和pET-32a载体分别进行双酶切,并纯化。将LaFPS基因片段连接至pET-32a载体,热激转化大肠杆菌Trans5α细胞。对转化菌斑培养并提取其质粒,用BamH Ⅰ和XhoⅠ双酶切鉴定,并送样测序。测序结果正确的克隆即为成功构建的pET-32a-LaFPS。
将构建的pET-32a-LaFPS质粒热激转化大肠杆菌BL21(DE3)细胞,挑取单斑于LB/Amp液体培养基中,37 ℃、220 r/min过夜培养。然后按照1∶100的比例稀释到新鲜的LB/Amp液体培养基中,相同条件下继续培养至A600为0.6时,加入IPTG至浓度为0.4 mmol/L,在28 ℃、160 r/min条件下诱导表达8 h。取2 mL诱导菌液12 000 r/min离心1 min,收集菌体,加入20 μL 5×SDS-PAGE上样缓冲液、80 μL双蒸水,重悬菌体后沸水浴15 min。12 000 r/min离心5 min后取20 μL样品进行SDS-PAGE(4%浓缩胶、12%分离胶)电泳检测。
2 结果与分析
2.1独行菜FPS基因的克隆
以独行菜叶片cDNA为模板,采用引物LaFPS-F和LaFPS-R成功扩增出与预期大小(1 332 bp)一致的PCR产物,电泳结果如图1所示。将该片段连至pMD19-T载体,转化大肠杆菌Trans5α感受态细胞。转化菌斑培养后的菌液先使用载体通用引物进行PCR鉴定,鉴定正确的菌液送北京三博远志生物技术有限责任公司测序,然后分析测序结果。
测序结果经Snapgene软件拼接后得到长度为1 332 bp的序列,其中包含一个1 161 bp的开放阅读框,编码386个氨基酸。该蛋白质与拟南芥FPS1蛋白的序列一致性达到92%。因此,将该基因命名为LaFPS(GenBank登录号KY366218)。
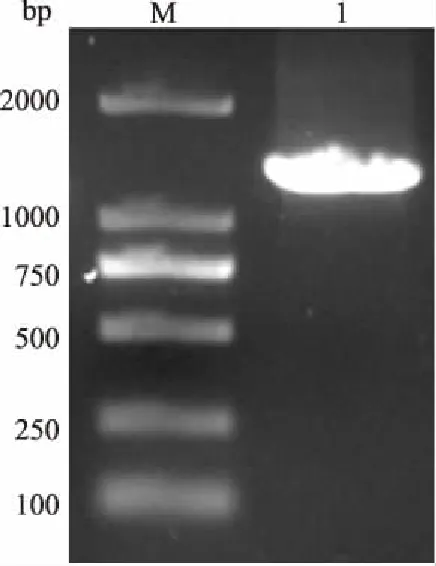
M:DL2000 DNA Marker; 1:PCR产物图1 PCR扩增LaFPS基因
2.2独行菜FPS蛋白的序列分析
利用ProtParam tool预测该蛋白质分子质量为44.58 ku,等电点为6.10。不稳定系数为40.07,属于不稳定蛋白。TargetP 1.1预测LaFPS蛋白定位于线粒体,含有长度为18个氨基酸的信号肽。TMHMM预测LaFPS无跨膜区。CD-Search分析LaFPS蛋白,在84—345位发现聚异戊二烯合成酶结构域(pfam00348,2.72e-99)。
在SWISS-MODEL服务器上以ArtemisiaspiciformisFPP/GFPP合酶(4kk2.1.A)为模板进行La-FPS蛋白的三维建模,LaFPS与模板序列的一致性为74.78%,用于建模的氨基酸残基范围为模板48—386位(图2)。
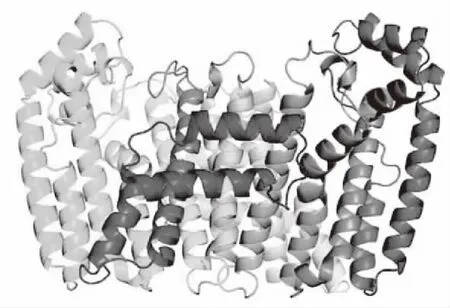
图2 LaFPS三维结构预测
依据NCBI网站上通过blastp比对nr蛋白质数据库的结果,LaFPS蛋白与拟南芥(Arabidopsisthaliana)FPS1(NP_199588.1,AtFPS1)序列一致性较高,其他序列一致性较高的蛋白质为甘蓝(Brassicaoleraceavar.oleracea)FPS2(92%,XP_013618156.1,BoFPS2)、萝卜(Raphanussativus)FPS2(92%,XP_018433596.1,RsFPS2)、芜菁(Brassicarapa)FPS2(92%,XP_009128999.1,BrFPS2)、遏蓝菜(Noccaeacaerulescens)FPS1(89%,JAU13831.1,NcFPS1)。使用MEGA 7软件对以上各FPS蛋白的序列进行比对,结果表明,FPS蛋白序列中N端信号肽区域序列差异较大,其他区域序列高度保守(图3)。
使用Phylogeny.fr软件的“One Click”模式对多种不同植物的FPS蛋白序列构建系统进化树(图4)。分析结果表明,LaFPS与同为十字花科的拟南芥FPS1、遏蓝菜FPS1、高山南芥(Arabisalpina)FPS亲缘关系最近。

图3 多种FPS蛋白的序列比对分析

图4 LaFPS与其他植物FPS蛋白的系统进化分析
2.3独行菜FPS蛋白的原核表达
将PCR扩增得到的LaFPS基因ORF片段连接至载体pET-32a,构建好的重组质粒用BamH Ⅰ和XhoⅠ双酶切鉴定,结果与预期一致(图5)。测序结果也表明,表达载体pET-32a-LaFPS构建成功。
对含有pET-32a-LaFPS质粒的大肠杆菌BL21(DE3)细胞进行诱导表达,当大肠杆菌培养至A600为0.6时,于0.4 mmol/L IPTG、28 ℃、160 r/min条件下诱导表达8 h,SDS-PAGE电泳检测。结果表明,该条件下成功诱导表达出与预期大小64 ku(融合蛋白包含大小约20 ku的pET-32a标签)一致的蛋白质,未诱导的对照样品中没有出现该蛋白条带(图6)。
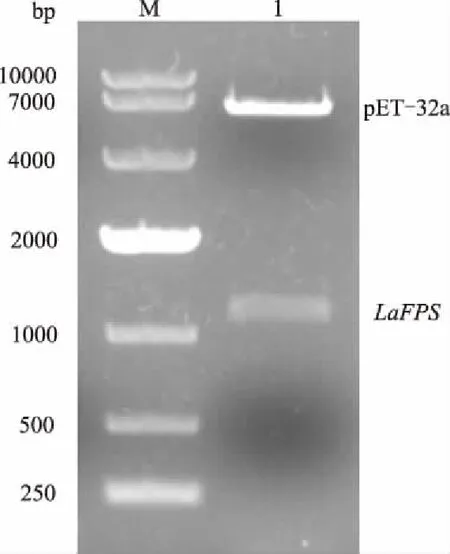
M:DL10000 DNA Marker; 1:质粒经双酶切后得到的 pET-32a载体与LaFPS基因片段图5 BamH Ⅰ和Xho Ⅰ双酶切鉴定pET-32a-LaFPS
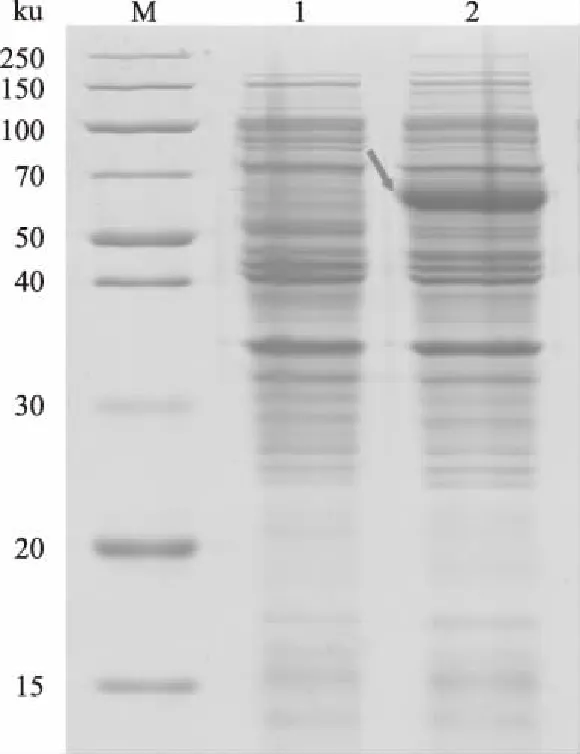
M:Protein Ladder;1.含pET-32a-LaFPS的大肠杆菌未 诱导时表达的总蛋白; 2.同样的大肠杆菌于0.4 mmol/L IPTG、 28 ℃条件下诱导8 h表达的总蛋白。箭头示目的蛋白条带图6 pET-32a-LaFPS的诱导表达
3 结论与讨论
独行菜植物体内的强心苷类物质含量不高,阻碍了相关药物的研究开发。植物基因工程技术是提高药用植物体内天然产物含量的可行途径,但是相关研究以目标天然产物合成途径的解析作为前提,而独行菜强心苷的合成途径目前并不清楚。独行菜FPS是三萜和甾类化合物合成途径中的重要酶,其编码基因的克隆和研究对于解析独行菜强心苷类物质的合成途径具有重要价值。通过对独行菜强心苷合成途径中FPS等关键酶编码基因的研究,可以采用基因工程技术来提高这些基因在独行菜体内的表达水平,从而增加强心苷类物质的含量,为该类药物的开发提供便利。
本研究通过PCR技术成功克隆得到LaFPS的全长cDNA片段。序列分析表明,LaFPS蛋白与拟南芥FPS1和FPS2亲缘关系较近,其中又与拟南芥FPS1序列更为接近。拟南芥FPS1基因编码2种不同大小的FPS蛋白,FPS1L比FPS1S在N端多了40个氨基酸组成的线粒体信号肽,FPS1L定位于线粒体,FPS1S则定位于细胞质[6-7]。TargetP分析结果表明,LaFPS蛋白可能同样具有N端线粒体信号肽并定位于线粒体中,因而可能具有与拟南芥FPS1L类似的功能。
LaFPS在大肠杆菌中的成功诱导表达,为后续通过体外催化试验鉴定该蛋白质的功能奠定了基础。拟南芥的FPS1与FPS2基因在种子发育过程中分别具有不同的功能,表达模式也不同[6]。在分析独行菜转录组数据时同样发现了另外1条FPS基因序列,但是其CDS不完整,后续将尝试克隆其全长cDNA序列,并比较研究这2个独行菜FPS基因的表达模式,以阐明其在独行菜强心苷合成途径中的作用。
[1] 周喜丹,唐力英,周国洪,等.南北葶苈子的最新研究进展[J].中国中药杂志,2014,139(24):4699-4708.
[2] Kim S J,Kim H Y,Lee Y J,etal.Ethanol extract ofLepidiumapetalumseed elicits contractile response and attenuates atrial natriuretic peptide secretion in beating rabbit atria[J].Evidence-Based Complementary and Alternative Medicine,2013.doi:10.1155/2013/404713.
[3] Kim B Y,Lee J,Kim N S.Helveticoside is a biologically active component of the seed extract ofDescurainiasophiaand induces reciprocal gene regulation in A549 human lung cancer cells [J].BMC Genomics,2015,16:713.
[4] Wu B,Li Y,Yan H,etal.Comprehensive transcriptome analysis reveals novel genes involved in cardiac glycoside biosynthesis and mlncRNAs associated with secondary metabolism and stress response inDigitalispurpurea[J].BMC Genomics,2012,13(1):1-22.
[5] Vranová E,Coman D,Gruissem W.Network analysis of the MVA and MEP pathways for isoprenoid synthesis [J].Annual Review of Plant Biology,2013,64(1):665-700.
[6] Keim V,Manzano D,Fernández F J,etal.Characterization ofArabidopsisFPS isozymes andFPSgene expression analysis provide insight into the biosynthesis of isoprenoid precursors in seeds[J].PLoS One,2012,7(11):e49109.
[7] Closa M,Vranová E,Bortolotti C,etal.TheArabidopsisthalianaFPP synthase isozymes have overlapping and specific functions in isoprenoid biosynthesis,and complete loss of FPP synthase activity causes early developmental arrest [J].The Plant Journal,2010,63(3):512-525.
[8] Chen Y,Shen Q,Wang Y,etal.The stacked over-expression ofFPS,CYP71AV1 andCPRgenes leads to the increase of artemisinin level inArtemisiaannuaL.[J].Plant Biotechnology Reports,2013,7(3):287-295.
[9] Wang Y,Jing F,Yu S,etal.Co-overexpression of theHMGRandFPSgenes enhances artemisinin content inArtemisiaannuaL.[J].Journal of Medicinal Plants Research,2011,5(15):3396-3403.
[10] Banyai W,Kirdmanee C,Mii M,etal.Overexpression of farnesyl pyrophosphate synthase(FPS) gene affected artemisinin content and growth ofArtemisiaannuaL.[J].Plant Cell Tissue and Organ Culture,2010,103(2):255-265.
[11] Zhao Y J,Chen X,Zhang M,etal.Molecular cloning and characterisation of farnesyl pyrophosphate synthase fromTripterygiumwilfordii[J].PLoS One,2015,10(5):e0125415.
[12] Niu Y,Luo H,Sun C,etal.Expression profiling of the triterpene saponin biosynthesis genesFPS,SS,SE,andDSin the medicinal plantPanaxnotoginseng[J].Gene,2014,533(1):295-303.
[13] Xiang L,Zhao K G,Chen L Q.Molecular cloning and expression ofChimonanthuspraecoxfarnesyl pyrophosphate synthase gene and its possible involvement in the biosynthesis of floral volatile sesquiterpenoids[J].Plant Physiology and Biochemistry,2010,48(10/11):845-850.
[14] Wang P,Liao Z,Guo L,etal.Cloning and functional analysis of a cDNA encodingGinkgobilobafarnesyl diphosphate synthase [J].Molecules and Cells,2004,18(2):150-156.
Cloning and Prokaryotic Expression of Farnesyl Pyrophosphate Synthase Gene fromLepidiumapetalum
MA Ligang1,2,ZHAO Le1,2,FU Xiaodie1,FENG Weisheng1,2,KUANG Haixue3,ZHENG Xiaoke1,2*
(1.School of Pharmacy,Henan University of Traditional Chinese Medicine,Zhengzhou 450046,China;2.Collaborative Innovation Center for Respiratory Disease Diagnosis and Treatment & Chinese Medicine Development of Henan Province,Zhengzhou 450046,China; 3.College of Pharmacy,Heilongjiang University of Chinese Medicine,Harbin 150040,China)
This study obtained the farnesyl pyrophosphate synthase gene involved in the cardiac glycosides biosynthesis fromLepidiumapetalum,analysed the sequence,and induced expression of the gene inE.coli,which provided new material for research of the biosynthetic pathway of cardiac glycoside inL.apetalum.Specific primers were designed for a gene fragment with complete ORF and annotated asFPSin the transcriptome data ofL.apetalum,and the fragment was cloned fromL.apetalumleaf cDNA template by PCR method.Then the sequence of cloned gene was analyzed.The cloned cDNA fragment ofLaFPS(GenBank accession No.KY366218) had an length of 1 332 bp,with an ORF of 1 161 bp encoding 386 amino acids.According to the sequence analysis result,LaFPS had no transmembrane helices,located in mitochondria,and had an polyprenyl synthetase domain.Sequence of LaFPS was 92% identical to that ofArabidopsisFPS1 protein.LaFPS was closest toArabidopsisFPS1,NoccaeacaerulescensFPS1,ArabisalpineFPS in the phylogeny tree analysis,and all the proteins were from the Brassicaceae family.Expression of LaFPS protein was successfully induced inE.colistrain BL21(DE3) with constructed expression vector pET-32a-LaFPS.LaFPSgene was cloned fromL.apetalum,and the prokaryotic expression system was established.
Lepidiumapetalum; farnesyl pyrophosphate synthase; gene cloning; sequence analysis; prokaryotic expression
2017-05-20
国家重点基础研究发展(973)计划项目(2013CB531802);河南中医学院博士科研基金项目(BSJJ2011-18)
马利刚(1983-),男,湖北襄阳人,讲师,博士,主要从事药用植物次生代谢途径及调控研究。 E-mail:maligang@outlook.com
*通讯作者:郑晓珂(1961-),女,河南开封人,教授,博士,主要从事中药活性成分及作用机制研究。 E-mail:zhengxk.2006@163.com
S567
: A
: 1004-3268(2017)09-0092-06
