马拉硫磷降解菌株MN-13的降解性能测定及其培养基优化
2017-09-13高小朋包本开杨佳娟
高小朋,包本开,杨佳娟,刘 蕊
(延安大学,陕西 延安 716000)
马拉硫磷降解菌株MN-13的降解性能测定及其培养基优化
高小朋,包本开,杨佳娟,刘 蕊
(延安大学,陕西 延安 716000)
为了利用微生物降解土壤中残留的有机磷农药,采用磷钼蓝比色法测定了菌株MN-13降解马拉硫磷及其他有机磷农药的性能,并通过单因素选择、正交优化试验对试验菌株的生长培养基进行了优化。结果表明,试验菌株MN-13对25%马拉硫磷、40%氧化乐果、50%乙基对硫磷的降解率分别达到91.52%、69.24%、49.68%。培养基优化中,通过单因素试验选择的碳源、氮源、NaCl及pH值的中心点分别为葡萄糖1.5%、牛肉膏1.0%、NaCl 0.5%、pH值8.0;以此为基础进行正交试验,优化后培养基组成为葡萄糖1.5%、牛肉膏1.2%、NaCl 0.6%、pH值8.5,菌体OD600比优化前提高了33.1%。综上,MN-13菌株可有效降解马拉硫磷等有机磷农药,其在优化后的培养基中生长量有所提高。
马拉硫磷; 微生物降解; MN-13菌株; 降解率; 培养基; 优化
有机磷农药是我国使用最为广泛的一类农药,其产量占整个农药产量的30%左右[1],然而此类农药在广泛应用的同时也带来了严重的环境问题。马拉硫磷是一种高效、高毒的有机磷杀虫剂,广泛用于农作物虫害的防治[2]。但其残留时间长,易污染环境,对人类健康具有潜在的威胁,其在环境中的残留已广受关注。
有研究表明,微生物对土壤、水体中残留的有机磷农药具有很好的降解作用,且不会造成二次污染[3]。目前已报道的有机磷农药降解菌主要有黄杆菌、芽孢杆菌等[4],对有机磷农药水解酶及其基因的研究也已有报道[5]。微生物法降解残留农药是治理农药残留污染的有效途径,具有广泛的应用前景。因此,研究马拉硫磷的微生物降解具有重要的意义。
延安大学生命科学学院微生物实验室前期从长期喷施马拉硫磷的土壤中分离得到1个可降解马拉硫磷的菌株MN-13[6],本研究对其降解马拉硫磷及其他有机磷农药的性能进行了测定和比较,并对其生长培养基进行了优化,以期为采用微生物法降解土壤中残留的有机磷农药提供参考。
1 材料和方法
1.1材料
1.1.1 试验菌株 MN-13菌株由延安大学生命科学学院微生物实验室提供。
1.1.2 试剂 试剂主要包括马拉硫磷乳油(25%,山东省联合农药工业有限公司)、氧化乐果乳油(40%,山东淄博张店农业有限公司)、乙基对硫磷(50%,天津市丰达化工有限公司)、氯化亚锡(分析纯,如皋市天成化工有限公司)、钼酸铵(分析纯,南京化学试剂有限公司)等。
1.1.3 仪器 仪器主要包括立式压力蒸汽灭菌器(LS-850L,江阴滨江医疗设备厂)、紫外分光光度计(UV2550,日本岛津公司)等。
1.1.4 培养基 参照文献[7]进行配制。LB培养基:胰蛋白胨10.0 g、酵母粉5.0 g、NaCl 10.0 g、去离子水1 000 mL,pH值7.2;无机盐培养基:NaNO32.0 g、KCl 0.5 g、MgSO40.02 g、CaCl20.04 g、去离子水1 000 mL,pH值6.5。
1.2方法
1.2.1 MN-13菌株对有机磷农药的降解率测定
1.2.1.1 磷标准曲线的绘制 采用磷钼蓝比色法[8-9],用分光光度计测定不同浓度的标准磷溶液在697 nm处的吸光度,以有机磷浓度为横坐标、OD697为纵坐标制作磷标准曲线。
1.2.1.2 有机磷农药降解率的测定 取无机盐培养基50 mL,分别加入25%马拉硫磷、40%氧化乐果、50%乙基对硫磷25 μL,以2%接种量接入活化好的MN-13菌液作为试验组,以不加菌液的处理作为对照组,在32 ℃、160 r/min条件下培养,分别在培养1、2、3、4、5、6、7 d时取样测定OD697,参照磷标准曲线得到磷含量,利用下面公式计算3种有机磷农药的降解率[10-11]。
有机磷降解率=(对照组磷含量-试验组磷含量)/对照组磷含量×100%。
1.2.2 MN-13菌株生长培养基的优化
1.2.2.1 单因素法确定各因素中心点 (1)以LB培养基为基础培养基,分别添加2.0%的乳糖、葡萄糖、蔗糖、麦芽糖作为碳源[12],以酵母粉作为对照,其他成分不变,按1%接种量接入活化好的菌液,在32 ℃、160 r/min条件下培养,24 h后测定菌体OD600,据此来进行碳源的选择。在确定最佳碳源的基础上分别选择1.0%、1.5%、2.0%、2.5%、3.0%的添加量进行培养,确定菌株MN-13生长最适的碳源含量。
(2)以LB培养基为基础培养基,分别添加1.0%的酵母膏、牛肉膏、硫酸铵、尿素作为氮源,以胰蛋白胨作为对照,其他成分不变,按1%接种量接入活化好的菌液,在32 ℃、160 r/min条件下培养,24 h后测定菌体OD600,据此进行氮源的选择。在确定最佳氮源的基础上分别选择0.6%、0.8%、1.0%、1.2%、1.4%的添加量进行培养,确定菌株MN-13生长最适的氮源含量。
(3) LB培养基中,其他成分不变,NaCl加入量分别设置为0.2%、0.3%、0.4%、0.5%、0.6%、0.7%,按1%接种量接入活化好的菌液,在32 ℃、160 r/min条件下培养,24 h后测定菌体OD600,确定菌株MN-13生长最适的NaCl含量。
(4)LB培养基中,其他成分不变,分别调节初始pH值为5.5、6.0、6.5、7.0、7.5、8.0、8.5,按1%接种量接入活化好的菌液,在32 ℃、160 r/min条件下培养,24 h后测定菌体OD600,确定菌株MN-13生长最适的pH值。
1.2.2.2 正交优化试验 根据以上单因素试验所得到的各因素的中心点,上下各取1个值,作为各因素的不同水平,利用L9(34)正交试验对培养基中的碳源、氮源、NaCl含量以及pH值进行优化。
1.2.2.3 优化结果验证试验 培养条件不变,将MN-13菌株分别接入优化前、后的培养基中进行培养,24 h后测定OD600,进行优化结果验证。
2 结果与分析
2.1MN-13菌株对马拉硫磷、氧化乐果、乙基对硫磷的降解性能
从图1可知,菌株MN-13对马拉硫磷、氧化乐果和乙基对硫磷均有降解能力,且随时间的推移,降解率逐渐增加,均在6 d时达到最大,分别为91.52%、69.24%、49.68%。培养3~7 d内,试验菌株对马拉硫磷的降解率明显高于其他2种农药。以上试验结果表明,MN-13是一株有机磷农药高效、广谱降解菌,除了能降解马拉硫磷外,还能较好地降解氧化乐果和乙基对硫磷。

图1 MN-13菌株对有机磷农药的降解性能
2.2MN-13菌株培养基优化单因素试验结果
2.2.1 不同碳源及其含量对MN-13菌株生长的影响
2.2.1.1 不同碳源的影响 由图2可知,菌株MN-13在以葡萄糖为碳源的培养基中生长最好,OD600为0.804,说明相比较其他4种碳源,葡萄糖能够更好地被MN-13菌株利用并促进其生长,因此确定葡萄糖为最佳碳源。

图2 不同碳源对MN-13菌株生长的影响
2.2.1.2 葡萄糖含量的影响 由图3可知,采用以葡萄糖为碳源的培养基进行培养,当其中的葡萄糖含量为1.5%时,MN-13菌株的生长量最大,OD600达到0.972。因此,选择1.5%葡萄糖设计后续正交试验。
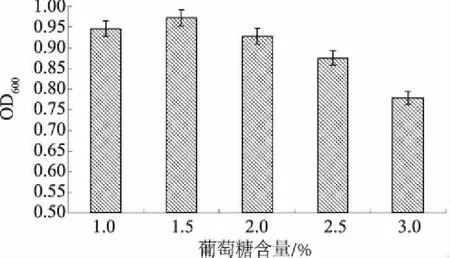
图3 葡萄糖含量对MN-13菌株生长的影响
2.2.2 不同氮源及其含量对MN-13菌株生长的影响
2.2.2.1 不同氮源的影响 从图4可以看出,与无机氮源相比,有机氮源更有利于试验菌株MN-13的生长,其在以牛肉膏为氮源的培养基中生长情况最好,OD600达到0.901。因此,确定牛肉膏为最佳氮源。

图4 不同氮源对MN-13菌株生长的影响
2.2.2.2 牛肉膏含量的影响 从图5可以看出,采用以牛肉膏为氮源的培养基培养,当牛肉膏含量为1.0%时,试验菌株MN-13的生长情况最好,OD600达到0.925。因此,选择1.0%牛肉膏进行后续正交试验设计。

图5 牛肉膏含量对MN-13菌株生长的影响
2.2.3 NaCl含量对MN-13菌株生长的影响 由图6可知,试验菌株MN-13在NaCl含量为0.5%时生长情况较好,OD600达到0.808。因此,选择0.5% NaCl进行后续正交试验设计。

图6 NaCl含量对MN-13菌株生长的影响
2.2.4 初始pH值对MN-13菌株生长的影响 由图7可知,培养基初始pH值过低,不利于MN-13菌株的生长,在初始pH值为8.0时,菌株生长情况最好,OD600达到0.887。因此,选择初始pH值8.0进行后续正交试验设计。

图7 不同初始pH值对MN-13菌株生长的影响
2.3MN-13菌株培养基优化正交试验结果
根据以上单因素试验的结果进行L9(34)正交试验,试验方案及结果见表1。由表1可知,在9个处理的直观分析中,第3个组合条件下菌株的生长情况最好,OD600为0.925;其次是第6个组合,OD600为0.875。通过分析可知,4个因素的R值大小依次为 D>A>B>C,说明在葡萄糖含量、牛肉膏含量、NaCl含量、pH值等4个因素中,对菌株生长量的影响大小依次是pH值>葡萄糖含量>牛肉膏含量>NaCl含量。从各个因素不同水平对菌株的生长效应分析来看,各因素影响菌株生长量的顺序分别是A2>A1>A3、B3>B2>B1、C3>C1>C2、D3>D2>D1,因此可以确定培养基最佳组合为A2B3C3D3,即葡萄糖1.5%、牛肉膏1.2%、NaCl 0.6%、pH值8.5。

表1 MN-13菌株培养基优化正交试验设计及结果
2.4MN-13菌株培养基优化验证试验结果
保持温度、转速等其他条件不变,分别采用优化前、后的培养基培养进行对比试验,结果显示,在优化前、后的培养基中培养24 h,试验菌株MN-13的OD600分别为0.831和1.106,优化后提高了33.1%。
3 结论与讨论
有机磷农药在我国使用量大、使用面广,易于在土壤中短时间积累,并在生物体内产生蓄积作用[13],对人类健康具有潜在的威胁,而微生物对土壤、水体中残留的有机磷农药均有很好的降解作用,且不会造成二次污染[3]。本研究使用的菌株MN-13对马拉硫磷的降解率达到91.52%,另外,其对40%氧化乐果的降解率为69.24%,对50%乙基对硫磷的降解率为49.68%,表明MN-13是一株有机磷农药的高效、广谱降解菌。
试验菌株投放到大田中降解残留农药会受到自然条件、菌体浓度、土壤中其他残留农药的影响,甚至受到拮抗而不能在该环境中长期生存[14],因此,本试验在研究菌株对马拉硫磷降解作用的同时,还研究了其对氧化乐果、乙基对硫磷等有机磷农药的降解情况,并对其培养条件进行了优化,目的是为了能大量生产,并在农业生产中得到有效推广。单因素试验和正交试验是培养基优化的常用方法。单因素法每次只能讨论1种因素的影响[15],而正交试验设计考虑了因素之间的相互作用。因此,本试验首先进行单因素分析以选出各因素的中心点,然后进一步进行正交试验优化。单因素试验结果表明,分别在葡萄糖1.5%、牛肉膏1.0%、NaCl 0.5%、pH值8.0的条件下,MN-13菌体生长较好。在此基础上进行了正交优化,确定菌株MN-13生长所需的最佳培养基组成为葡萄糖1.5%、牛肉膏1.2%、NaCl 0.6%、pH值 8.5,为该菌株的有效培养奠定了基础。
据分析,MN-13菌株降解有机磷农药过程中,是以马拉硫磷等有机磷为唯一的碳源和能源,通过矿化作用,将农药中的有机磷转化为无机磷[15-16],从而使农药失去毒性,同时把马拉硫磷降解产生的无机磷提供给植物,促进植物的生长。据报道,某些有机磷农药降解菌的降解基因在质粒上[17],降解酶可通过破坏有机磷农药的磷酯键而使其脱毒[18],关于菌株MN-13降解马拉硫磷的降解酶基因以及降解酶的作用机制和特性等问题,有待于进一步研究。
[1] 许育新,冯昭中,陆鹏,等.甲基对硫磷降解菌PF32的分离鉴定及其降解特性研究[J].农药学学报,2009,11(3):329-334.
[2] 华小梅,江希流.我国农药环境污染与危害的特点及控制对策[J].环境科学研究,2000,13(3):40-43.
[3] 张广志,张新建,扈进东.有机磷农药降解菌的筛选及降解能力测定[J].河南农业科学,2009(3):63-65.
[4] 徐培渝,吴德生.有机磷农药毒性研究新进展[J].预防医学情报杂志,2004,20(4):389-392.
[5] Singh B K,Walker A.Microbial degradation of oranophosphprous compounds[J].EMS Microbiol Rev,2006,30:428-471.
[6] 高小朋,马娜娜,杨佳娟.马拉硫磷降解菌研究初报[J].湖北农业科学,2011,50(18):3708-3710.
[7] 李健,郑庆柱,董爱荣,等.甲胺磷降解菌的筛选及降解速率[J].东北林业大学学报,2004,32(1):52-54.
[8] 李素琴,张军,王俊风,等.磷钼蓝光度法测定磷酸钙中的磷含量[J].无机盐工业,2008,40(3):55-56,60.
[9] 刘约权,李贵深.化学实验[M].2版.北京:高等教育出版社,2006:145-147.
[10] 黎小军,廖上铁,陈奉英,等.甲胺磷降解细菌的筛选与降解特性研究[J].西南农业学报,2010,23(1):197-200.
[11] 冯昭中,梁波,张隽,等.假黄单胞菌菌株XY3降解甲基对硫磷特性的研究[J].江苏农业科学,2010(4):375-378.
[12] 施大林,孙梅,陈秋红,等.嗜酸乳杆菌培养基的优化及高密度培养[J].食品与发酵科技,2011,47(2):60-63.
[13] 李俊叶,王筱兰,邹峥嵘.丙烯酰胺降解菌的筛选及优势菌株降解条件优化[J].江西师范大学学报(自然科学版),2012,36(1):35-39.
[14] 郑树生,孙海燕,李桂霞,等.污染土壤中农药的微生物降解研究进展[J].黑龙江八一农垦大学学报,2007,19(6):34-37.
[15] Wang C C,Lee C M,Lu C J,etal.Biodegradation of 2,4,6-trichlorophenol in the presence of primary substrate by immobilized pure culture bacteria[J].Chemosphere,2000,41(12):1873-1879.
[16] 高小朋,王海虹,郑荣,等.氧化乐果降解菌的筛选及其培养条件的优化[J].河南农业科学,2011,40(8):145-148.
[17] 伍宁丰,梁果义,邓敏捷,等.有机磷农药降解酶及其基因工程研究进展[J].生物技术通报,2003(5):9-12.
[18] Serdar C M,Gibson D T.Enzymatic hydrolysis of organophosphates:Cloning and expression of a parathion hydrolase gene fromPseudomonasdiminuta[J].Nature Biotechnology,1985,3(6):567-571.
Degradation Property Characterization and Culture Medium Optimization of Malathion-Degrading Strain MN-13
GAO Xiaopeng,BAO Benkai,YANG Jiajuan,LIU Rui
(Yan’an University,Yan’an 716000,China)
In order to solve the serious non-point source soil pollution problem caused by pesticides and use microbial strains to degrade organophosphorus residues in soil,molybdenum blue spectrophotometry was used to test the performance of strain MN-13 to degrade malathion and other organophosphorus pesticides.At the same time,the methods of single factor selection and orthogonal optimization were applied to optimize the medium.The experimental results showed that the degradation rates of strain MN-13 on 25% malathion,40% omethoate and 50% ethyl parathion were 91.52%,69.24% and 49.68% respectively.By single factor experiments,carbon source,nitrogen source,NaCl and pH of medium were preliminarily determined as glucose 1.5%,beef extract 1.0%,NaCl 0.5% and pH 8.0.After the orthogonal experiment,the medium composition was optimized as follows:glucose 1.5%,beef extract 1.2%,NaCl 0.6% and pH 8.5.The OD600value of this strain was increased by 33.1% after optimization.From the above results,it was concluded that the strain MN-13 could effectively degrade malathion and other organophosphorus pesticides,and it grew better after medium optimization.
malathion; microbial degradation; MN-13; degradation rate; medium; optimization
2017-03-27
国家大学生创新创业训练计划项目(201510719287);陕西省大学生创新创业训练计划项目(1447)
高小朋(1976-),男,陕西洛川人,副教授,硕士,主要从事资源与环境微生物学研究。 E-mail:gaoxiaopengyd@163.com
X592
: A
: 1004-3268(2017)09-0088-05
