亚麻油替代鱼油对杂交鲟生长、脂肪酸组成及脂肪代谢的影响
2017-09-12琳邢薇李铁梁刘洋马志宏姜娜李文通
罗 琳邢 薇李铁梁刘 洋马志宏姜 娜李文通
(1. 北京市水产科学研究所, 北京 100068; 2. 北京京朝花园农业发展中心, 北京 100018)
亚麻油替代鱼油对杂交鲟生长、脂肪酸组成及脂肪代谢的影响
罗 琳1邢 薇1李铁梁1刘 洋2马志宏1姜 娜1李文通1
(1. 北京市水产科学研究所, 北京 100068; 2. 北京京朝花园农业发展中心, 北京 100018)
为研究亚麻油替代不同水平的鱼油后对杂交鲟(Acipenser baeri Brandt♀×A. schrenckii Brandt♂)幼鱼[初均重(70.8±0.5) g]生长、脂肪酸组成、肝脏及肌肉脂肪沉积以及脂肪代谢的影响, 在油脂添加量为8%的饲料中用亚麻油分别替代0(LO0)、25%(LO25)、50%(LO50)、75%(LO75)和100%(LO100)的鱼油, 配制5种等氮(38.7%CP)等脂(10%CF)饲料。每组饲料随机设3个重复, 养殖周期为12周。结果表明,亚麻油替代100%的鱼油对杂交鲟幼鱼的生长没有显著影响, 而且随着饲料中亚麻油含量的上升, 饲料效率有所提高, 100%鱼油替代组的饲料效率明显高于100%鱼油组的(P<0.05); 但用亚麻油替代鱼油后, 肌肉和肝脏的粗脂肪含量以及血清中谷草转氨酶、谷丙转氨酶和乳酸脱氢酶活性明显升高(P<0.05); 肌肉亚麻酸和n-3多不饱和脂肪酸的含量与饲料中相应脂肪酸组成呈明显的线性相关关系(R2>0.69; P<0.05)。对于杂交鲟的脂肪代谢而言, 亚麻油的添加对血清中的游离脂肪酸、甘油三酯、高、低密度脂蛋白胆固醇的变化产生明显影响, 但亚麻油对血清总胆固醇和酮体影响不显著。考虑到亚麻油完全替代鱼油后, 肌肉中的EPA和DHA这两种长链高不饱和脂肪酸的含量仅下降了不到30%, 因此亚麻油应该是一种比较优质的鱼油替代品。
杂交鲟; 鱼油替代; 亚麻油; 生长性能; 餐后脂肪代谢
近年来, 鲟养殖发展迅速, 已成为鲤科鱼和鲑鳟等主要养殖品种的有力补充[1]。由于杂交表现出来的生长快和抗病力强等优点[2—4], 杂交鲟的养殖近十年来也发展迅速, 其中西伯利亚杂交鲟(Acipenser baeri♀×A. schrenckii♂)是常见的杂交品种之一[5]。随着养殖规模的扩大, 鲟的市场价格在1990至2010年间下降了十几倍[4], 而饲料原料的价格却节节攀升, 因此在不影响鱼体生长性能的前提下寻找合适的脂肪源, 在降低饲料成本的同时保证鱼肉品质已成为目前的研究热点。
鲟鱼肉因富含n-3高不饱和脂肪酸(HUFA)以及较高的n-3/n-6多不饱和脂肪酸(PUFA)比例而具有良好的营养价值[1,6]。但大量研究也表明, 鱼肉的脂肪酸组成是饲料脂肪酸组成的真实反映[7]。植物油因来源和价格稳定、没有二英和其他有机污染、含有较高的不饱和脂肪酸等优点, 已成为极具潜力的饲料脂肪源[8]。前期的研究表明, 在白鲟(Acipencer transmontanus)[9]、俄罗斯鲟(A. gueldenstaedtii)[10]、亚得里亚海鲟(A. naccarii)[11]和欧洲鳇(Huso huso)[12]等饲料中用植物油替代大部分或者全部的鱼油后, 对鱼体的生长性能、饲料效率或者繁殖性能没有明显的不良影响。由于植物油中缺乏花生四烯酸(C20:4n-6, AA)、二十碳五烯酸(C20:5n-3, EPA)和 二十二碳六烯酸(C22:6n-3, DHA)等长链高不饱和脂肪酸[13], 长期食用可能会影响到鱼肉的脂肪酸组成及鱼类正常的生理活动[14]。很明显, 不论是从鲟本身的生长性能和健康角度, 还是从鲟的营养价值角度考虑, 养殖户和消费者都想减少因在饲料中使用植物油对鲟肉质品质的影响。但目前的研究已经证实, 包括鲟在内的许多淡水鱼具有将亚油酸(18:2n-6)转化成AA, 以及将α-亚麻酸转化为EPA和DHA的能力[15]。因此, 研究植物油在鲟饲料的使用时, 为了保证鲟的健康和肉质品质, 应该考虑到以下几点: (1)避免过高的亚油酸含量以确保鱼肉中较高比例的n-3/n-6; (2)具有足够量的亚麻酸转化成EPA和DHA。亚麻油, 又名胡麻油, 其脂肪酸组成中83%为亚麻酸, 而且亚麻酸与亚油酸的比例接近10:1(表 2), 充分满足了上述2个条件, 因此亚麻油成为水产饲料潜在的优质脂肪源。
有关亚麻油在鲟饲料中的应用研究有少量文献报道。Zhu等[16]的研究表明, 从生长性能来看, 葵花籽油比亚麻油更适合在俄罗斯鲟饲料中替代鱼油使用。Li等[17]的研究则表明, 在俄罗斯鲟饲料中用亚麻油、葵花籽油和牛油混合油能让鱼体保持较好的生长性能和健康状况。但有关亚麻油在杂交鲟饲料中的应用还未见报道。本研究的目的是在饲料中以亚麻油分别替代0、25%、50%、75%和100%的鱼油, 探究其对杂交鲟摄食生长、鱼肉脂肪酸组成的影响, 同时关注在饲料中使用亚麻油替代不同比例的鱼油对鲟餐后24h内脂肪代谢规律的影响, 为亚麻油在杂交鲟饲料中的使用提供理论基础, 进而为实际生产提供指导。
1 材料与方法
1.1 饲料配方及制备
以秘鲁鱼粉为主要蛋白源, 以亚麻油分别替代0(LO0)、25%(LO25)、50%(LO50)、75%(LO75)和100%(LO100)的鱼油, 配制成5种等氮(38.7%)等脂(10.0%)和等能(180 MJ/kg)的饲料(表 1)。鱼油和亚麻油分别购自丹麦TripleNine鱼蛋白公司和内蒙古锡林郭勒盟红井源油脂有限责任公司。饲料中脂肪酸组成见表 2。
根据鱼生长过程中大小的变化, 饲料通过膨化挤压工艺制成直径3.0和4.0 mm两种不同粒径的沉性膨化颗粒料(膨化机型号MY56X2A, 牧羊集团,江苏, 中国)。所有饲料阴干后用双层塑料袋包装后贮存于–20℃冰箱保存备用。
1.2 实验鱼及养殖条件
养殖实验在北京京朝花园农业发展中心的工厂化循环水养殖车间进行。实验用鱼为该中心自行繁育的同批次的统一规格西伯利亚杂交鲟。在停食24h后, 初始体重(70.8±0.5) g的实验鱼被随机分到15个桶(700 L, 40尾/桶), 每种饲料设3个重复。每天饱食投喂3次(09:30、13:30和17:30), 养殖周期为12周。在养殖过程中, 水温为(20±1)℃, 溶氧在7 mg/L左右; 氨氮和亚硝酸盐含量均低于100.0 μg/L。
1.3 样品采集
在12周的投喂实验结束后, 所有鱼都饥饿48h以确保血清的脂肪水平维持在基准线上, 然后再饱食投喂一次。在这次饱食投喂后的0、4h、8h、12h、16h、20h和24h进行血液样本的采集。在每1个采血时间点, 迅速从每个养殖桶中随机取3尾鱼用0.30 mL/L的三氯叔丁醇麻醉, 分别称重后用2 mL的一次性注射器从尾静脉采血, 采集的血样放在2.5 mL离心管里, 1500 r/min离心5min后取1—1.5 mL血清保存于–80℃下用于后续指标的检测分析。在餐后24h取样点的每个桶中的3尾鱼采完血后分别取20 g左右背部肌肉和整个肝脏样品,分装并存于–80℃下用于后续指标的检测分析。
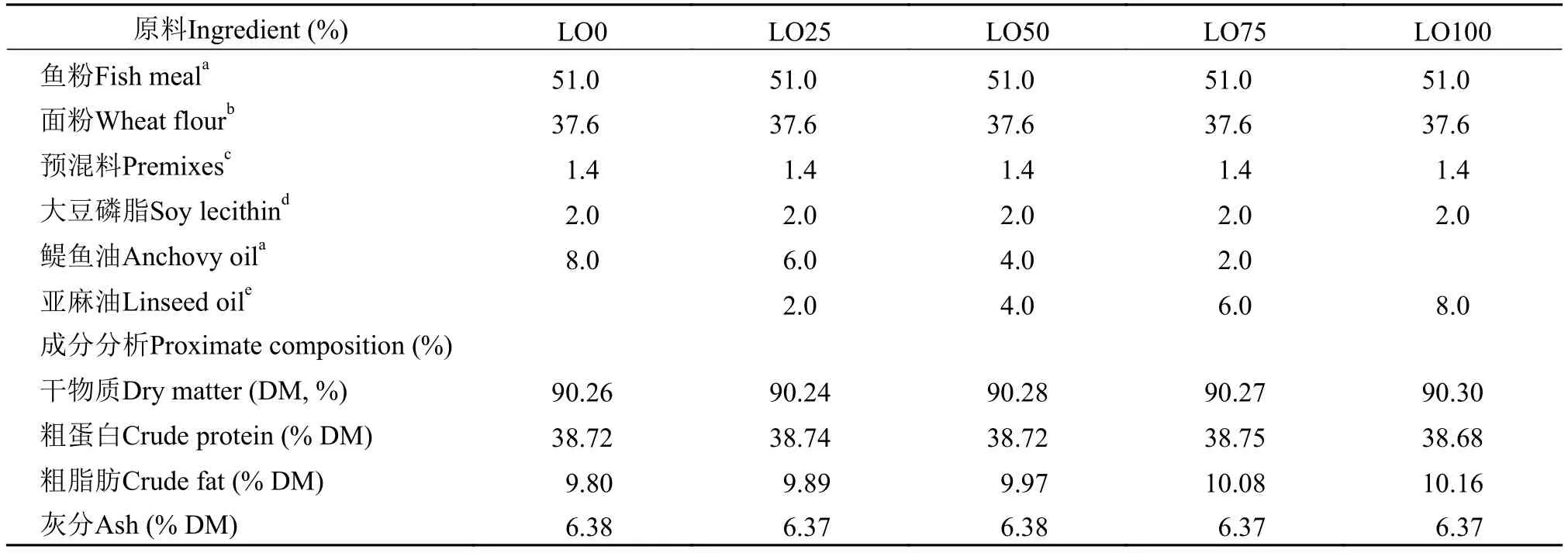
表 1 实验饲料配方和成分组成*Tab. 1 Formulation and proximate composition of experimental diets*
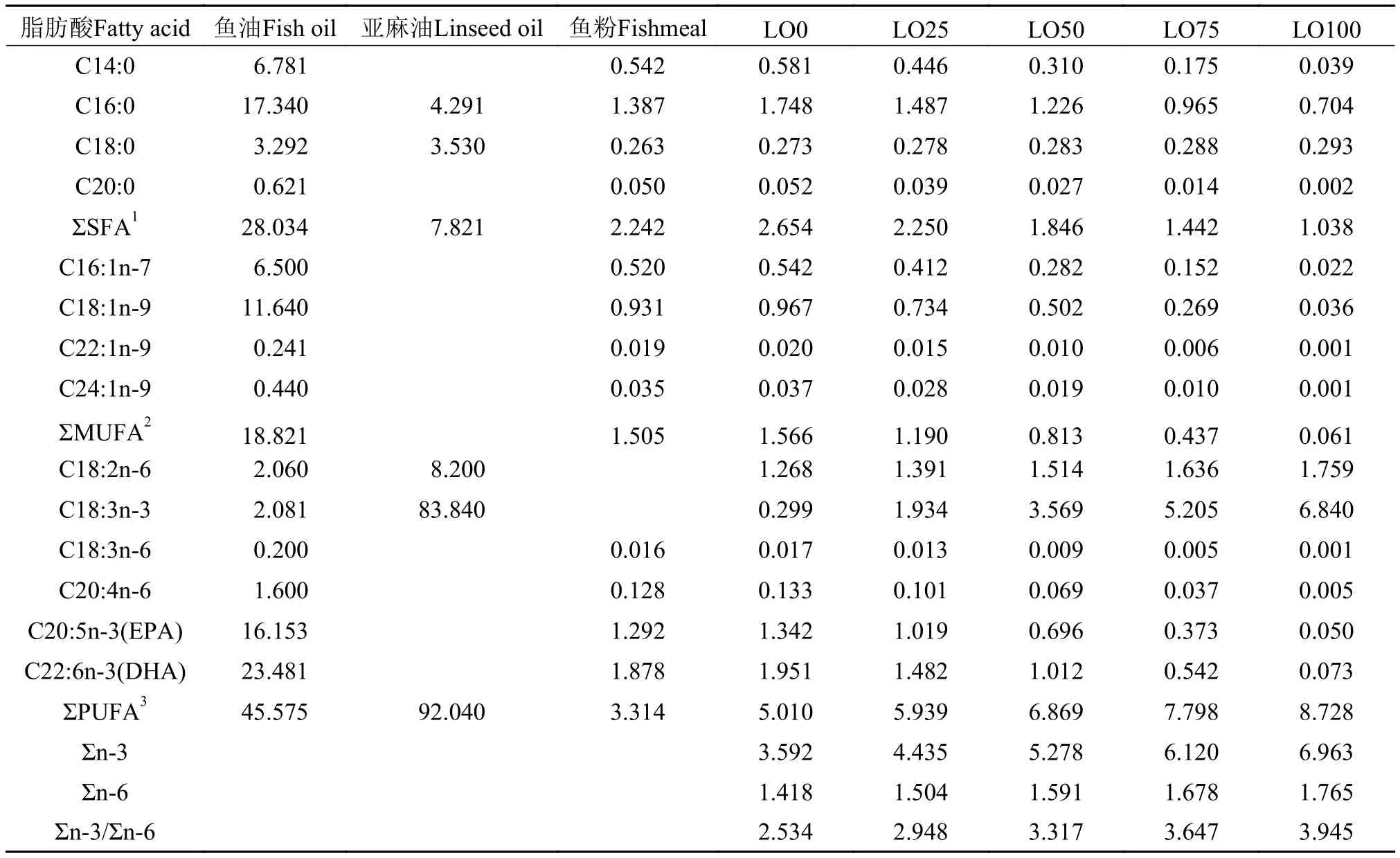
表 2 油源及饲料脂肪酸组成Tab. 2 Fatty acid composition of lipid source and diets (%)
1.4 饲料、肌肉、肝脏样品成分分析
体成分分析 饲料和肌肉均测定水分、粗蛋白、粗脂肪和灰分含量, 肝脏检测粗脂肪含量。样品在105℃烘干至恒重后求得水分含量, 然后进行生化组分分析[18]。粗蛋白采用凯氏定氮法、粗脂肪采用索氏抽提法、灰分采用马弗炉法。每份样品均重复测定3次。
饲料和肌肉的脂肪酸的测定参照Fontagné等[19]的方法进行。
血清成分分析 餐后0、4h、8h、12h、16h、20h和24h的血清用于检测甘油三酯(TG)、总胆固醇(T-Chol)、游离脂肪酸(NEFA)、高密度脂蛋白胆固醇(HDL-Chol)、低密度脂蛋白胆固醇(LDLChol)以及酮体。血清TG采用酶比色法、T-Chol采用比色法、HDL-Chol和LDL-Chol浓度采用均相酶比色法检测, 所有试剂均由德国罗氏诊断有限公司提供, 使用罗氏ROCHE/E601全自动生化分析仪测定。血清酮体和游离脂肪酸用南京建成生物工程研究所(中国, 南京)提供的商用试剂盒, 采用日立HITACHI7160自动生化分析仪进行检测。餐后24h的血清还用于检测乳酸脱氢酶(LDH)、谷草转氨酶(AST)和谷丙转氨酶(ALT), 这3项所用试剂盒均由德国罗氏诊断有限公司提供, 其中LDH和AST采用比色法, ALT采用IFCC法, 均用罗氏ROCHE/E601全自动生化分析仪测定。
1.5 计算方法和统计分析
存活率(%)=Nf×100/Ni
增重率(WGR, %)=100×(Wf–Wi)/Wi
特定生长率(SGR, %天)=100×(LnWf–LnWi)/t
摄食率(FI, %/天)=100×干饲料消耗量/ [(Wf+Wi)/2]/t
饲料效率(FE, %)=100×(Wf–Wi)/干饲料消耗量
其中, Wi和Wf代表初重和末重, Ni和Nf代表桶内初始鱼尾数和终末鱼尾数, t表示实验天数。
实验数据采用STATISTICA 7.0 (StatSoft Inc., Tulsa, OK, USA)软件进行统计分析, 在单因素方差分析(One-Way ANOVA)达到显著水平(P<0.05)时,采用Duncan’s检验进行多重比较, 数据表示为平均值±标准误。取样时间点与脂肪源双因子对鲟脂肪代谢的影响采用双因素方差分析(Two-Way ANOVA)。采用Linear regression and Pearson correlation进行饲料与肌肉脂肪酸组成的相关性分析, 当R2>0.5时显著相关。
2 结果
2.1 饲料亚麻油水平对杂交鲟幼鱼生长性能指标的影响
在整个养殖过程中, 没有出现实验鱼死亡的现象, 存活率为100%。从表 3可以看出, 在饲料中用不同水平的亚麻油替代鱼油后, 各实验组鲟的WGR和SGR均没有明显差异, 但随着亚麻油添加量的增加, 鲟的FI有所下降, 其中LO75组和LO100组的FI明显低于LO0、LO25和LO50组(P<0.05)。而各实验组的FE随着亚麻油添加量的增加呈上升趋势, 其中LO100组的饲料效率明显高于LO0组(P<0.05)。
2.2 饲料亚麻油水平对杂交鲟肌肉成分及肝脏脂肪含量的影响
如表 4所示, LO0组肌肉水分含量明显高于其余各实验组(P<0.05); LO75组肌肉粗蛋白水平明显高于LO0组和LO25组(P<0.05), 但与LO50组和LO100组差异不显著(P>0.05); LO100组肌肉的灰分明显高于其他各组(P<0.05); LO0组肌肉和肝脏脂肪含量明显低于其他各实验组(P<0.05)。
2.3 饲料亚麻油水平对杂交鲟肌肉脂肪酸组成的影响
从表 5可见, 随着饲料亚麻油水平升高, 杂交鲟肌肉的总饱和脂肪酸(SFA)、总单不饱和脂肪酸(MUFA)和总多不饱和脂肪酸(PUFA)含量均有所上升, 其中LO25、LO50两组的总SFA含量明显高于LO0组的; LO25、LO50和LO100组的MUFA与LO0组之间也差异显著, 而LO0组的总PUFA含量明显低于其余各组的(P<0.05)。杂交鲟肌肉亚麻酸含量随饲料中亚麻油的增加显著升高(P<0.05), 其增加的趋势与饲料中亚麻油的含量呈显著正相关关系(R2=0.84), 且肌肉中∑n-3PUFA及∑n-3/∑n-6的变化趋势也与饲料中相应含量变化呈正相关关系(表 6)。另一方面, 随着饲料中鱼油的减少, 肌肉中的EPA和DHA含量也呈下降趋势, 且LO50、LO75和LO100组的肌肉EPA和DHA含量明显低于LO0、LO25组(P<0.05)。
2.4 饲料亚麻油对杂交鲟血清中肝功能指标的影响
如表 7所示, 随着饲料中亚麻油水平的升高, 杂交鲟血清中的乳酸脱氢酶(LDH), 谷丙转氨酶(ALT)和谷草转氨酶(AST)的水平呈上升趋势, 其中LO50、LO75和LO100组的LDH明显高于LO0组的(P<0.05); LO75和LO100组的ALT明显高于LO0、LO25组的(P<0.05); 而LO0组的AST明显低于其余各组的(P<0.05)。
2.5 饲料亚麻油水平对杂交鲟餐后不同时间点脂肪代谢的影响
血清中的甘油三酯(TG)含量随亚麻油替代水平(P<0.05)及时间(P<0.01)的变化而明显变化, 而且替代水平和时间的互作对TG也有明显的影响(P<0.05)。从替代水平角度考虑, 随着亚麻油替代水平的升高, 血清中TG的含量呈下降趋势, LO100组的血清TG明显低于替代水平较低的LO0、LO25和LO50组(P<0.05); 从时间变化角度考虑, 血清中的TG在餐后4h达到峰值, 随后在12h降到较低水平,在16h达到另一个峰值, 然后一路下降至24h的最低值; 替代水平与时间的相互作用体现在LO0组在餐后4h的TG值最高, 而LO100组在餐后24h的TG值最低(图 1a)。
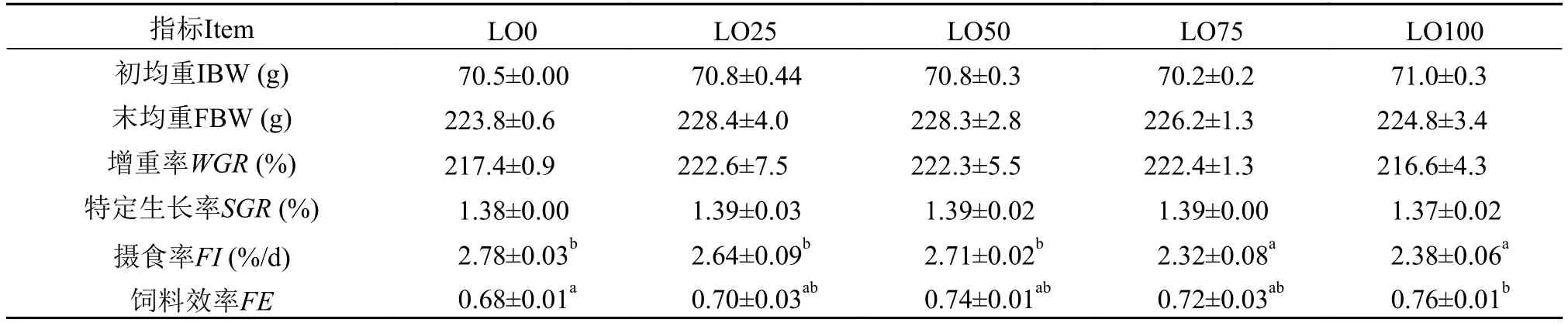
表 3 饲料亚麻油替代鱼油对杂交鲟生长性能及饲料利用的影响Tab. 3 Growth performance and feed utilization of hybrid sturgeon during12 weeks (n=3) of feeding trial
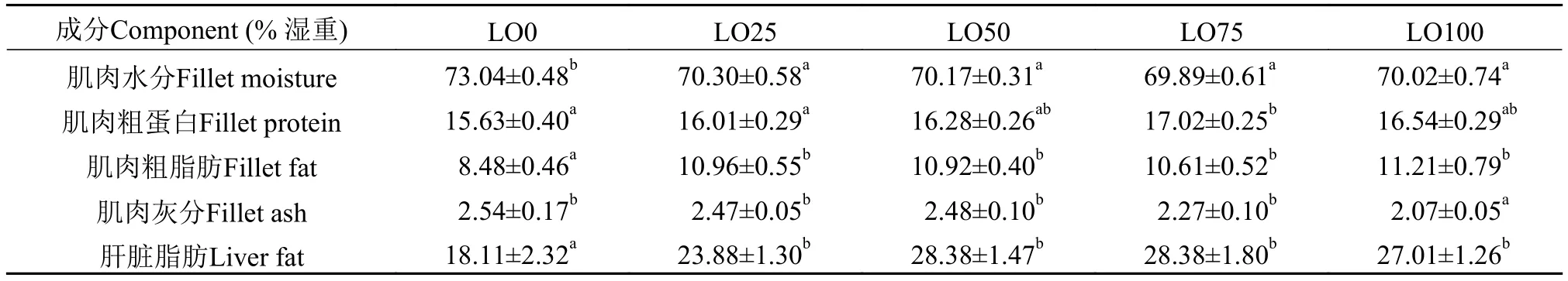
表 4 饲料亚麻油替代鱼油对杂交鲟肌肉成分和肝脏脂肪含量的影响Tab. 4 Effects of dietary graded linseed oil levels on fillet composition and liver lipid content of hybrid sturgeon over 12 weeks (n=3) period
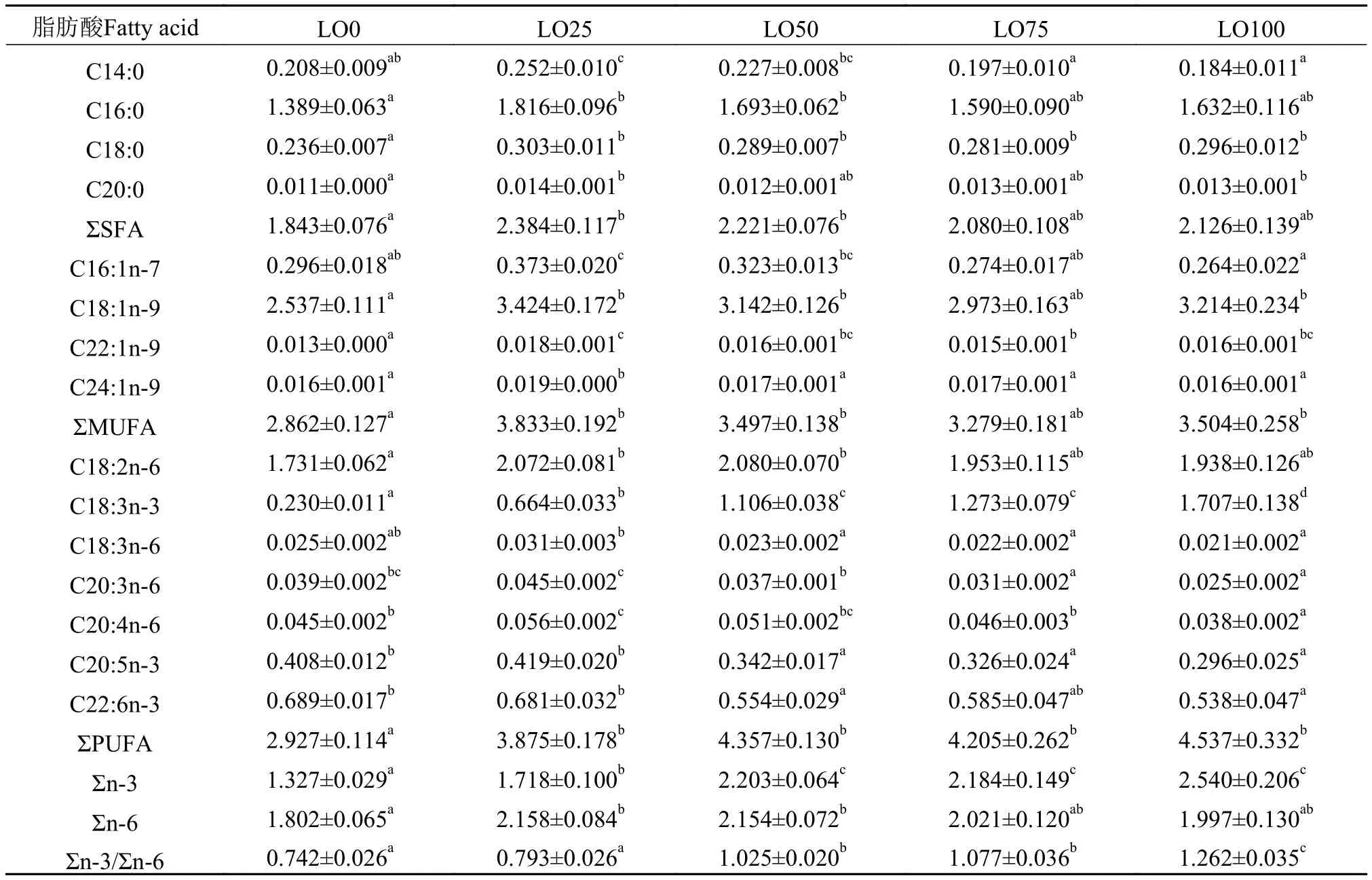
表 5 饲料亚麻油替代不同水平鱼油对杂交鲟肌肉脂肪酸组成的影响(%湿重)Tab. 5 Effects of dietary graded fish oil substitution by linseed oil on fillet fatty acid composition of hybrid sturgeon over 12 weeks (n=3, % wet weight)

表 6 肌肉和饲料脂肪酸组成的相关性分析Tab. 6 Correlation coefficients (R2) and P values of dietary vs. fillet fatty acid concentrations
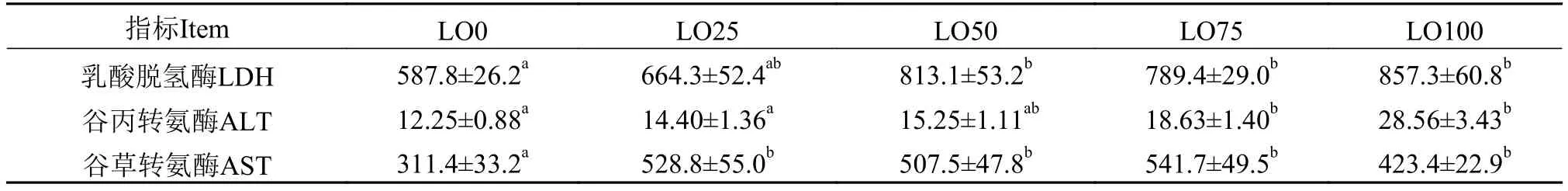
表 7 饲料亚麻油替代不同水平鱼油对杂交鲟血清中的肝功能指标的影响Tab. 7 Effects of dietary graded fish oil substitution by linseed oil on serum hepatic enzyme activity of hybrid sturgeon after 12 weeks feeding trial (U/L)
血清中的游离脂肪酸(NEFA)含量也随着饲料亚麻油替代水平及时间的变化, 以及两个因子的互作而明显变化(P<0.01)。从替代水平角度来看, LO0和LO25组的血清NEFA含量高于其余各组, 其中LO0组的血清NEFA与LO50、LO75和LO100组之间有显著差异(P<0.05); 而从时间上来看, 餐后4hNEFA达到峰值, 在8h降低到0h的水平, 随后略有升高, 但在24h降低至最低点(P<0.05); 双因子的互作显示, LO0组的NEFA在12h达到最高峰值, 随后有所降低但仍保持在比其他组略高的水, 而LO100组除了和其他各组一样在4h出现第一个峰值以外, 在20h达到最高值, 并在24h迅速降低到初始时的水平(图 2b)。
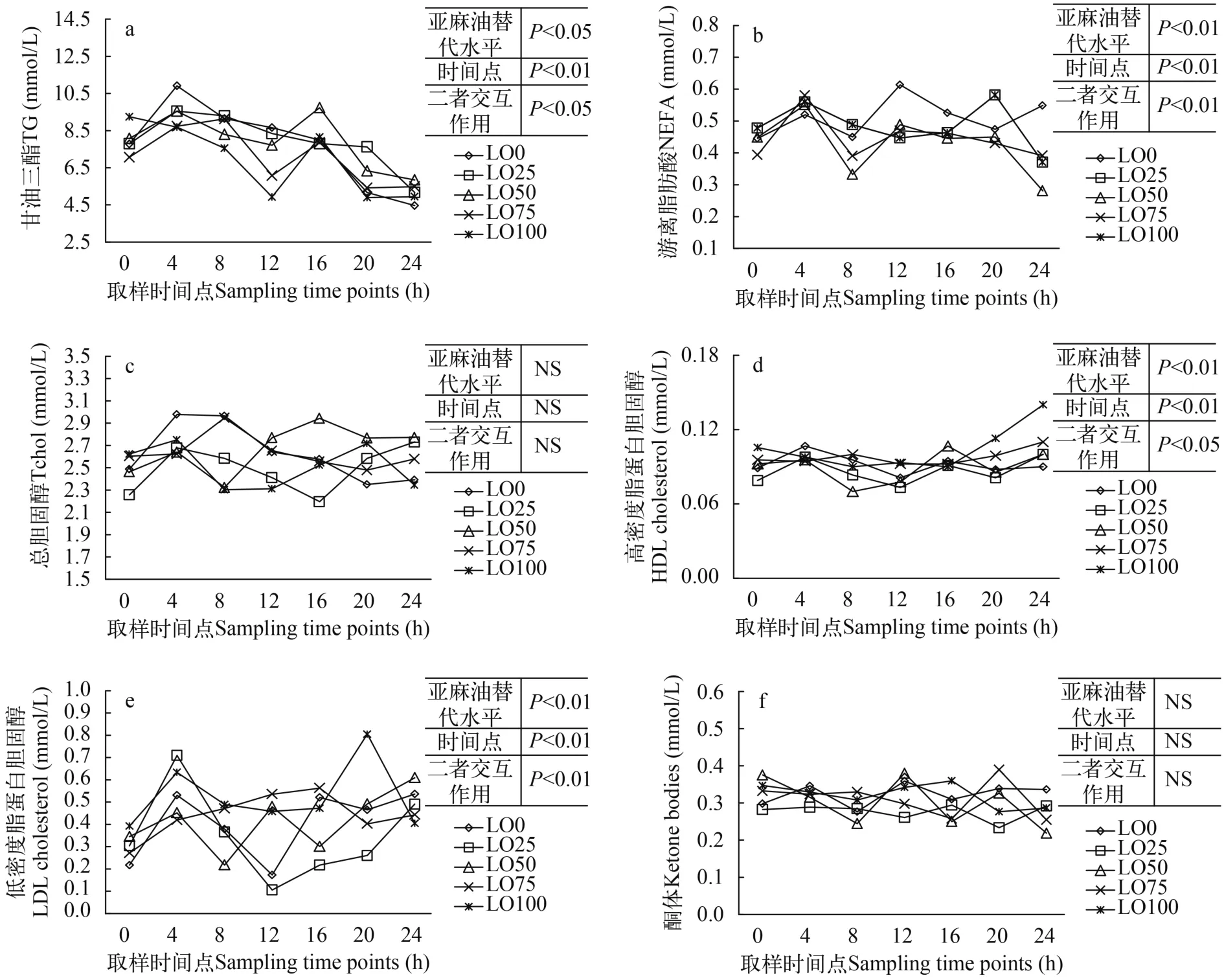
图 1 杂交鲟24h内的餐后血清脂肪代谢模式
血清中的总胆固醇和酮体含量并没有受到饲料亚麻油替代水平和时间变化以及二者交互作用的影响(P>0.05)(图 2c、f)。血清中的高密度脂蛋白胆固醇(HDL-Chol)和低密度脂蛋白胆固醇(LDHChol)均受到饲料亚麻油替代水平、时间变化以及二者互作的影响。HDL-Chol和LDH-Chol均随着饲料中亚麻油水平的上升而呈上升趋势, 其中摄食LO100组饲料的杂交鲟血清中的HDL-Chol和LDHChol均明显高于其他各组(P<0.01)。从时间变化上来看, 各实验组的HDL-Chol在餐后0—16h的变化不大, 但在20—24h期间, LO100组的HDL-Chol迅速上升至峰值且与其他各组之间差异显著(P<0.01) (图 2d)。各实验组的LDH-Chol从餐后0—4h迅速升高到峰值, 随后有所回落, 其中LO0组和LO25组的回落幅度较大, 在12h时降低到最低值, 随后慢慢回升, 到24h与其余各组保持在同一水平; 而LO100组在4h达到第一峰值后稍有回落, 但在20h达到了最高值, 然后迅速回落到与其他各组相同的水平上(图 2e)。
3 讨论
3.1 饲料亚麻油水平对杂交鲟幼鱼生长性能指标的影响
在本研究中, 各实验组存活率为100%和所有实验组之间生长性能没有显著差异说明亚麻油替代鱼油并未对杂交鲟的生长产生明显的不良影响,杂交鲟幼鱼对所有实验料的适应性均较好。这与前期有关鲟的研究结果相符。Xu等[9]在给白鲟(Acipenser transmontanus)投喂不同的脂肪源9周后发现, 白鲟幼鱼能很好地利用玉米油、鱼肝油、猪油、亚麻油、豆油、葵花籽油或者菜籽油。Sener等[10]建议在俄罗斯鲟(Acipenser gueldenstaedtii)饲料中可以用葵花籽油替代100%的鱼油。另一方面,随着亚麻油替代水平的升高, 杂交鲟的摄食率有所下降, 这可能是由于在所有实验料中鱼粉含量相同的情况下, 鱼油的诱食作用就突显出来, 因此随着鱼油的逐渐减少, 饲料的诱食作用减弱, 所以当亚麻油替代75%的鱼油以后, 鱼体的摄食率明显低于50%以下替代水平的。但由于所有组的生长率没有显著差异, 因此反映到饲料效率上, 是100%替代鱼油的LO100组的饲料效率最高, 且与100%鱼油的LO0组有显著差异。
3.2 饲料亚麻油水平对杂交鲟鱼体成分及肝脏功能的影响
虽然亚麻油替代对杂交鲟的生长性能没有显著影响, 但肌肉和肝脏的脂肪含量受饲料的影响较明显, 随着亚麻油替代水平的升高, 肌肉和肝脏的脂肪含量明显升高, 该结果暗示饲料高含量亚麻油促进了杂交鲟肌肉和肝脏脂肪沉积。同样的结果在之前的研究中也得到过证实: Wu等[20]发现摄食豆油后, 中华鲟(Acipenser sinensis Gray, 1835) 的肌肉粗脂肪含量明显高于鱼油组的。Li等[17]也发现摄食葵花籽油和亚麻油的俄罗斯鲟, 其鱼体的粗脂肪含量也明显高于摄食鱼油的。根据这些研究者的推断, 植物油中的高亚油酸(18:2n-6)含量会促进鱼体的脂肪蓄积。在本研究中, 饲料中的亚油酸含量随着亚麻油的增加而上升(表 2), 这可能是摄食亚麻油替代组饲料的杂交鲟其肌肉和肝脏脂肪含量明显偏高的原因之一。另外, 国内外许多研究表明, 在鱼类的脂肪营养需求中, n-3系列的长链PUFA如20:5n-3和22:6n-3, 要比18:2n-6和18:3n-3等具有更强的必需脂肪酸效力[21]。n-3长链PUFA在促进脂肪分解和抑制脂肪合成方面均有明显的作用效果[22,23]。在本研究中, 随着亚麻油替代鱼油水平的升高, 饲料中n-3长链PUFA的含量下降明显,因此肝脏的脂肪沉积可能还与饲料中n-3长链PUFA的明显减少有一定的关系。另一方面, AST, ALT和LDH的活性是评价肝功能的主要指标, 这些指标的上升往往预示着由于细胞损伤导致的肝脏退化、损伤、以及坏死[24—27]。在本研究中, 血清LDH、AST和LDH三种酶的活性均随着亚麻油水平的升高而上升(表 7), 说明亚麻油替代鱼油后, 对杂交鲟的肝脏功能造成了一定的负担, 虽然这种影响从生长性能指标上还没有表现出来, 但已经在肝功能酶活上有所体现。
3.3 饲料亚麻油水平对杂交鲟肌肉脂肪组成的影响
研究表明, 肌肉的脂肪酸在一定程度上会反映饲料的脂肪酸组成[7,28]。在本实验中, 饲料中脂肪酸的变化主要来自亚麻油, 而亚麻油中是亚麻酸18:3n-3的含量最丰富, 所以杂交鲟的肌肉亚麻酸与饲料的亚麻酸之间呈线性正相关关系(R2=0.84,表 6)是理所应当的。另一方面, Xu等[9]和Sener等[10]证实白鲟和俄罗斯鲟具有将亚麻酸延长和去饱和化转变为EPA和DHA的能力。在本研究中, 饲料的EPA和DHA含量随着鱼油含量的减少而明显下降, 其中不含鱼油的LO100组的EPA和DHA含量仅为LO0组的3.7%(表 2), 但其在肌肉中的含量却分别是LO0组的72.5%和78.1%, 并没有与饲料中的EPA和DHA含量成明显的线性相关关系, 原因之一可能就是杂交鲟也有能将18:3n-3转变成EPA和DHA的能力。在这一前提下, 亚麻油作为为数不多的富含n-3系列不饱和脂肪酸的植物油中的一种,将成为鱼油的适宜替代品而不影响肌肉的品质[7,29]。
3.4 饲料亚麻油水平对杂交鲟餐后不同时间点脂肪代谢的影响
本研究中血清甘油三酯(TG)的峰值出现在餐后4h, 这一结果比虹鳟鱼的餐后12h[30]和鲤鱼的餐后8h出现峰值[31]早。比虹鳟的峰值出现得早的原因之一可能是本实验20℃的养殖水温比虹鳟鱼实验中的17℃高, 而高水温能促进鱼体的脂肪吸收[32]。另一方面, 鲟血清TG峰值出现得比鲤鱼得早的原因之一可能是鲟为有胃鱼且偏肉食性, 因为鱼体消化酶的种类和分泌量与鱼类消化道的结构和食性相对应, 肉食性鱼类的消化道短, 蛋白酶和脂肪酶的活性高于杂食性鱼类, 因此其对脂肪的消化吸收能力可能比无胃且偏杂食性的鲤强[33]。另外, 摄食LO75和LO100组饲料的实验组的血清TG明显低于前3组。Lemaire等[34]报道说血清的TG会随着饲料中n-3HUFA含量的增加而下降。在本研究中, 随着亚麻酸添加量的增加, 饲料中的n-3HUFA含量明显增加(表 2), 所以可能导致n-3HUFA含量高的LO75和LO100组的血清TG含量下降。
脂肪经消化后的产物脂肪酸由肠黏膜细胞转化为TG, 后者和蛋白质一起包装成乳糜微粒, 乳糜微粒的组分TG在甘油三酯脂肪酶的作用下, 被水解成甘油和游离脂肪酸(NEFA), 被释出的NEFA进入血液, 并与白蛋白结合[35]。由于NEFA是来源于TG的分解, 因此其在血液中的峰值理应与TG的变化相一致。本研究的结果NEFA的第一个峰值跟TG一样出现在餐后4h, 说明随着TG的升高, 有更多的NEFA被分解释放到血液中, 而且NEFA在餐后24h内的变化走势与TG的大致相似, 符合脂肪的代谢规律。另一方面, 短链和中长链脂肪酸会绕过形成脂蛋白的途径而直接被吸收进血液[35]。在本研究中, LO0和LO25饲料中的C14和C16脂肪酸含量较高(表 2), 这可能是摄食这2种饲料的鲟血清NEFA含量较高的原因。
血清高密度脂蛋白能将胆固醇从血清运送到肝脏, 可以“清洗”动物组织中的胆固醇[36]。虹鳟在摄食富含PUFA的高含量鱼油组时, 其血清中的高密度脂蛋白胆固醇(HDL-chol)含量比摄食低含量鱼油或者椰子油的虹鳟高[30]。在本研究中, 摄食饲料LO75和LO100的两组鱼的血清HDL-chol比LO0、LO25、LO50三组的高, 其原因之一可能就是因为LO75和LO100组中的PUFA含量比前3组高(表 2)。另一方面, 低密度脂蛋白扮演着将胆固醇从肝脏运送到全身组织的角色。在本研究中, 血清的低密度脂蛋白胆固醇(LDL-chol)随着亚麻油替代水平的升高而升高, 这可能与饲料中EPA和DHA含量的减少有关。研究已经表明, 高不饱和脂肪酸,特别是EPA和DHA, 在降低血清胆固醇方面作用很强, 能抑制体内的胆固醇和甘油三酯形成, 增加脂蛋白脂肪酶的活性, 并通过移除LDL-chol来改善外周组织[37,38], 因此在EPA和DHA含量较高的高鱼油组, 血清LDL-chol的含量在EPA和DHA的作用下得到了“清理”, 而随着亚麻油替代水平的升高, 饲料中的EPA和DHA含量明显下降, 其作用减弱, 从而使血清中的LDL-chol含量明显升高。该结果与高姣露等[39]以及Huang等[40]的研究结果相一致。
4 结论
亚麻籽油替代100%的鱼油(饲料鱼油添加量为8%, 粗脂肪含量10%)对杂交鲟幼鱼的生长没有显著影响, 但对鱼肉亚麻酸和n-3多不饱和脂肪酸的含量有显著影响, 考虑到亚麻油完全替代鱼油后,鱼肉中的EPA和DHA这两种LC-HUFA的含量仅下降了30%左右, 对鲟肉质品质的影响不太大, 因此亚麻油应该是一种比较优质的鱼油替代品。
致谢:
感谢北京京朝花园农业发展中心刘建广和于凤翔先生为本实验提供的帮助。
[1]Garcia-Gallego M, Sanz A, Domezain A, et al. Age-size influence on tissue-lipid quality of the sturgeon Acipenser naccari from intensive culture [J]. Journal of Applied Ichthyology, 1999, 15(4-5): 261—264
[2]Bronzi P, Rosenthal H, Arlati G, et al. A brief overview on the status and prospects of sturgeon farming in Western and Central Europe [J]. Journal of Applied Ichthyology, 1999, 15(4-5): 224—227
[3]Williot P, Sabeau L, Gessner J, et al. Sturgeon farming in Western Europe: recent developments and perspectives [J]. Aquatic Living Resource, 2001, 14(6): 367—374
[4]Wei Q, He J, Yang D, et al. Status of sturgeon aquaculture and sturgeon trade in China: a review based on two recent nationwide surveys [J]. Journal of Applied Ichthyology, 2004, 20(5): 321—332
[5]Sun D J, Qu Q Z, Zhang Y, et al. Sturgeon Aquaculture in China [J]. Chinese Journal of Fisheries, 2011, 24(4): 67—70 [孙大江, 曲秋芝, 张颖, 等. 中国的鲟鱼养殖. 水产学杂志, 2011, 24(4): 67—70]
[6]Vaccaro A M, Buffa G, Messina C M, et al. Fatty acid composition of a cultured sturgeon hybrid, Acipenser naccarii × Acipenser baerii [J]. Food Chemistry, 2005, 93: 627—631
[7]Turchini G M, Torstensen B E, Ng W K. Fish oil replacement in finfish nutrition [J]. Reviews in Aquaculture, 2009, 1(1): 10—57
[8]Izquierdo M S, Obach A, Arantzamendi L, et al. Dietary lipid sources for seabream and seabass: growth performance, tissue composition and flesh quality [J]. Aquaculture Nutrition, 2003, 9(6): 397—407
[9]Xu R P, Hung S S O, Bruce German J. White sturgeon tissue fatty acid compositions are affected by dietary lipids [J]. Journal of Nutrition, 1993, 123(10): 1685—1692
[10]Sener E, Yildiz M, Savas E. Effects of dietary lipids on growth and fatty acid composition in Russian sturgeon (Acipenser gueldenstaedtii) juveniles [J]. The Turkish Journal of Veterinary and Animal Sciences, 2005, 29(5): 1101—1107
[11]McKenzie D J, Piraccini G, Agnisola C, et al. The influence of dietary fatty acid composition on the respiratory and cardiovascular physiology of Adriatic sturgeon (Acipenser naccarii): a review [J]. Journal of Applied Ichthyology, 1999, 15(4-5): 265—269
[12]Hosseini S V, Kenari A A. Effects of alternative dietary lipid sources on growth performance and fatty acid composition of Beluga sturgeon, Huso huso, juveniles [J]. Journal of the world Auqculture Society, 2010, 41(4): 471—489
[13]NRC (National Research Council). Nutrient requirements of Fish [M]. National Academy Press, Washington, DC. 2011, 304—322
[14]Ikonomou M G, Higgs D A, Gibbs M, et al. Flesh quality of market-size farmed and wild British Columbia salmon [J]. Environmental Sciences and Technology, 2004, 41(2): 437—443
[15]Tocher D R. Metabolism and functions of lipids and fatty acids in teleost fish [J]. Reviews in Fisheries Science, 2003, 11(2): 107—184
[16]Zhu H, Li Q, Wang H, et al. Growth, fatty acid composition and lipid deposition of Russian sturgeon (Acipenser gueldenstaedtii) fed different lipid sources [J]. Aquaculture Research, 2016: 1—7
[17]Li Q, Zhu H, Wei J J, et al. Effects of dietary lipid sources on growth performance, lipid metabolism and antioxidant status of juvenile Russian sturgeon Acipenser gueldenstaedtii [J]. Aquaculture Nutrition, 2016: 1—11
[18]AOAC (Association of Official Analytical Chemists). Official methods of analysis, Arlington, Virginal. USA, 1996
[19]Fontagné S, Pruszynski T, Corraze G, et al. Effect of coconut oil and tricaprylin vs. trioleni on survival, growth and fatty acid composition of common carp (Cyprinus carpio L.) larvae [J]. Aquaculture, 1999, 179(1—4): 241—251
[20]Wu F, Liu W, Wei Q W, et al. Effects of dietary lipid sources on growth performance, carcass composition, and blood parameters of juvenile Chinese sturgeon (Acipenser sinensis Gray, 1835) [J]. Journal of Applied Ichthyology, 2014, 30: 1620—1625
[21]Stickney R R. Lipid requirements of some warm water species [J]. Aquaculture, 1989, 79: 145—156
[22]Varga T, Czimmerer Z, Nagy L. PPARs are a unique set of fatty acid regulated transcription factors controlling both lipid metabolism and inflammation [J]. Biochimica et Biophysica Acta (BBA) -Molecular Basis of Disease, 2011, 1812: 1007—1022
[23]Yoshikawa T, Shimano H, Yahagi N, et al. Polyunsaturated fatty acids suppress sterol regulatory element-binding protein 1c promoter activity by inhibition of liver X receptor (LXR) binding to LXR response elements [J]. Journal of Biological Chemistry, 2002, 277: 1705—1711
[24]Wells R, McIntyre R, Morgan A, et al. Physiological stress responses in big gamefish after exposure: observation on plasma chemistry and blood factors [J]. Comparative biochemistry and physiology A, 1986, 64: 565—571
[25]Hasnain A. Ontogenetic changes and developmental adjustments in lactate dehydrogenase isozymes of an obligate air-breathing fish Channa punctatus during deprivation of air access [J]. Comparative Biochemistry and Physiology B, 2005, 140: 271—278
[26]Hyder M A, Hasan M, Mohieldein A H. Comparative levels of ALT, AST, ALP and GGT in liver associated diseases [J]. European Journal of Experimental Biology, 2013, 3(2): 280—284
[27]Akrami R, Gharaei A, Mansour M R, et al. Effects of dietary onion (Allium cepa) powder on growth, innate immune response and hematoebiochemical parameters of beluga (Huso huso Linnaeus, 1754) juvenile [J]. Fish & Shellfish Immunology, 2015, 45: 828—834
[28]Glencross B D. Exploring the nutritional demand for essential fatty acids by aquaculture species [J]. Review of Aquaculture, 2009, 1: 71—124
[29]Turchini G M, Francis D S. Fatty acid metabolism (desaturation, elongation and β-oxidation) in rainbow trout fed fish oil- or linseed oil- based diets [J]. British Journal of Nutrition, 2009, 102: 69—81
[30]Luo L, Xue M, Vachot C, et al. Dietary medium chain fatty acids from coconut oil have little effects on postprandial plasma metabolite profiles in rainbow trout (Oncorhynchus mykiss) [J]. Aquaculture, 2014, 420-421: 24—31
[31]Geurden I, Kaushik S, Corraze G. Dietary phosphatidylcholine affects postprandial plasma levels and digestibility of lipid in common carp (Cyprinus carpio) [J]. British Journal of Nutrition, 2008, 100: 512—517
[32]Wallaert C, Babin P J. Effects of temperature variations on dietary lipid absorption and plasma lipoprotein concentrations in trout (Oncorhynchus mykiss) [J]. Comparative Biochemistry and Physiology, 1994, 109B: 473—487
[33]Lin H R. Fish Physiology [M]. Guangzhou: Higher Education Press of Guangdong. 1999, 42 [林浩然. 鱼类生理学. 广州: 广东高能教育出版社. 1999, 42]
[34]Lemaire P, Drai P, Mathieu A, et al. Changes with different diets in plasma enzymes (GOT, GPT, LDH, ALP) and plasma lipids (Cholesterol, Triglycerides) of sea-bass (Dicentrarchus labrax) [J]. Aquaculture, 1991, 93: 63—75
[35]Wang J Y, Zhu S G, Xu C F. Biochemistry [M]. Beijing: Higher Education Press. 2002, 232 [王镜岩, 朱圣庚, 徐长法. 生物化学. 北京: 高等教育出版社. 2002, 232]
[36]Miller G J, Miller N E. Plasma high density lipoprotein concentration and development of ischaemic heart disease [J]. The Lancet, 1975, 1: 16—19
[37]Kang J X, Leaf A. The cardiac antiarrhythmic effects of polyunsaturated fatty acid [J]. Lipids, 1996, 31: s41—s44
[38]Nordoy A, Marchioli R, Arnesen H, et al. n-3polyunsaturated fatty acids and cardiovascular diseases [J]. Lipids, 2001, 31: s127—s129
[39]Gao L J, Shi Z H, Ai C X. Effect of dietary lipid sources on the serum biochemical indices of Acipenser schrenckii juvenile [J]. Marine Fisheries, 2005, 27: 319—323 [高露姣, 施兆鸿, 艾春香. 不同脂肪源对施氏鲟幼鱼血清生化指标的影响. 海洋渔业, 2005, 27: 319—323]
[40]Huang F, Jiang M, Wen W, et al. Effects of different dietary lipid sources on growth performance, tissue fatty acid composition and serum lipid indices of juvenile Amur sturgeon, Acipenser schrenckii Brandt, 1869 [J]. Journal of Applied Ichthyology, 2014, 30: 1602—1608
GROWTH PERFORMANCE, FATTY ACID COMPOSITION, AND LIPID METABOLISM IN JUVENILE HYBRID STURGEON (ACIPENSER SCHRENCKII BRANDT♀×A. BAERI BRANDT♂) FED DIETS OF FISH OIL SUBSTITUTED BY VARIOUS LEVELS OF LINSEED OIL
LUO Lin1, XING Wei1, LI Tie-Liang1, LIU Yang2, MA Zhi-Hong1, JIANG Na1and LI Wen-Tong1
(1. Beijing Fisheries Research Institute, Beijing 100068, China; 2. Chaoyang Hatchery and Aquaculture Farm, Beijing 100018, China)
A 12-week experiment was performed using juvenile hybrid sturgeon (70.8±0.5) g to study the effects of partial and total replacement of fish oil (FO) by linseed oil (LO). Five isonitrogenous (38.7% crude protein) and isoenergetic (10.0% crude lipid) experimental diets were formulated as follows: LO0 (100% FO); LO25 (75%FO+25% LO); LO50 (50% FO+50%LO); LO75 (25%FO+75%LO); and LO100 (100%LO). These diets were fed to triplicate groups of 40 hybrid sturgeon three times a day to apparent satiation at (22±1.0)℃. There were no significant differences in final body weight, weight gain rate (WGR), and specific growth rate (SGR) in all fish groups (P>0.05). Fish fed diets with LO0, LO25, and LO50 had significantly higher feed intake than fish fed diets with LO75 and LO100 (P<0.05). Fish fed diets with LO100 had significantly higher feed efficiency than fish fed a diet with LO0 (P<0.05). Fillet and liver lipid content, and serum lactate dehydrogenase (LDH), glutamic-oxalacetic transaminase (ALT) and glutamic-pyruvic transaminase (AST) activity showed an increasing trend as linseed oil increased (P<0.05). The linolenic acid (C18:3n3) content, the sum of n-3 and n-6, and the n-3:n-6 ratio in fillets showed a positive linear correlation with the diets. Lipid metabolism throughout the day for sturgeon on different levels of linseed oil replacement showed that the lipid source and time point, and the interaction of both of these factors had significant effects on serum non-esterified fatty acid (NEFA), triglyceride (TG), High-density lipoprotein cholesterol (HDL-Chol), and low-density lipoprotein cholesterol (LDL-Chol) (P<0.05). Serum total cholesterol and ketone bodies were not affected by the lipid source, time point, or interaction of both factors (P>0.05).
Hybrid sturgeon (Acipenser schrenckii Brandt♀×A. baeri Brandt♂); Fish oil replacement; Linseed oil; Growth performances; Postprandial lipid metabolite
S396
A
1000-3207(2017)05-1010-10
10.7541/2017.126
2016-09-06;
2017-01-16
北京市鲟鱼、鲑鳟创新团队(SCGWZJ 20161103-2)资助 [Supported by Beijing Technology System for Sturgeon and Salmonids Industries (SCGWZJ 20161103-2)]
罗琳, E-mail: luo_lin666@sina.com
