DPP-4抑制剂沙格列汀对2型糖尿病大鼠肾损伤的保护作用
2017-09-12蒋隽舒叶盛开孙晓红涂作玉戴永国陈海英
蒋隽舒,叶盛开,孙晓红,杜 楠,涂作玉,戴永国,陈海英,吕 莉
(1. 解放军第210医院 内分泌科,辽宁 大连 116021; 2. 大连市第三人民医院 科教科,辽宁 大连 116033; 3. 大连医科大学 药学院,辽宁 大连 116044)
论 著
DPP-4抑制剂沙格列汀对2型糖尿病大鼠肾损伤的保护作用
蒋隽舒1,2,叶盛开1,孙晓红1,杜 楠3,涂作玉3,戴永国3,陈海英1,吕 莉3
(1. 解放军第210医院 内分泌科,辽宁 大连 116021; 2. 大连市第三人民医院 科教科,辽宁 大连 116033; 3. 大连医科大学 药学院,辽宁 大连 116044)
目的 研究二肽基肽酶4(DPP-4)抑制剂沙格列汀对2型糖尿病大鼠肾脏损伤的保护作用并探讨其作用机制。 方法 将30只雄性SD大鼠,随机分成3组(每组10只):正常对照组(NC组)、2型糖尿病模型组(T2DM组)、模型+沙格列汀1.0 mg/kg治疗组(Sax组)。NC组大鼠饲以普通饲料;T2DM组及Sax组大鼠以高脂饮食联合链脲佐菌素(STZ)造2型糖尿病大鼠模型;Sax组大鼠每日1次灌胃给予沙格列汀1.0 mg/kg,NC组和T2DM组灌胃给予等容量生理盐水,连续给药12周后实验终止。记录大鼠体重,测定24 h摄食量、饮水量和24 h尿量;检测空腹血糖(GLU),血清中总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、血肌酐(Cr)和血尿素氮(BUN)水平;采用流式细胞术检测外周血T淋巴细胞亚群水平;取肾脏组织行HE染色观察肾组织病理学变化,免疫组化检测肾组织转化生长因子β(TFG-β)的表达水平;Western blot检测肾组织NF-κB p65、COX-2的蛋白表达水平,RT-PCR检测TNF-α、IL-6、FoxO1的mRNA表达水平。 结果 Sax组与T2DM组大鼠相比,GLU、TG、TC和LDL水平明显降低(P<0.05),HDL水平明显升高(P<0.05);大鼠饮水量、体重明显降低(P<0.05); Sax组较T2DM模型组大鼠肾小球肿胀、炎性浸润现象明显缓解,TFG-β表达水平降低(P<0.05);外周血T淋巴细胞亚群水平的失衡明显改善(P<0.05);下调炎症相关因子TNF-α、IL-6、FoxO1的mRNA表达水平及NF-κB p65、COX-2的蛋白表达水平(P<0.05)。 结论 DPP-4抑制剂沙格列汀具有保护大鼠2型糖尿病肾损害作用,其作用机制可能为抑制炎症的发生及参与免疫调节。
DPP-4抑制剂;沙格列汀;2型糖尿病肾病;肾损伤;免疫调节
糖尿病的并发症累及心、脑、眼、肾、皮肤、血管及神经系统等多组织和器官,而糖尿病肾病(diabetic nephropathy,DN)则是糖尿病患者最主要的死亡原因之一[1]。因此,积极寻找糖尿病肾病的发病机制,早期干预糖尿病肾病的进展意义重大。代谢异常、血流动力学紊乱、遗传因素以及炎症环境和氧化应激相互作用,促进了糖尿病肾病的发生发展,其中,免疫介导的炎症在糖尿病肾病的发生、发展中发挥重要作用[2-3]。
二肽基肽酶4(DPP-4)抑制剂,是一种基于肠促胰素的新型口服降糖药物,其通过抑制DPP-4的活性,减少肠促胰素的降解,使肠促胰素的水平及活性增高,进而促进胰岛素的分泌、抑制胰高血糖素的分泌以及抑制肠道分泌脂蛋白、延迟胃排空、促进胰岛β细胞再生而治疗糖尿病[4-5]。已有研究证实DPP-4抑制剂具有免疫调节及抗炎作用[6]。本研究旨在探讨DPP-4抑制剂沙格列汀对2型糖尿病大鼠肾脏的保护作用,并初步探讨其保护作用的可能机制。
1 材料和方法
1.1 材 料
1.1.1 药物及试剂
沙格列汀片(安立泽,saxagliptin,5 mg/片),中美上海施宝贵制药有限制药公司产品。链脲佐菌素(STZ),安徽Biosharp公司产品;破膜剂、固定剂、佛波酯[TPA、RBC Lysing buffer(10×)],北京四正柏生物科技有限公司产品;CD4 PerCP-eFluor 710抗体、Foxp3 FITC 25 抗体、CD25 PE-cys 抗体,eBioscience公司产品;一抗NF-κB p65、COX-2、GAPDH,武汉三鹰生物技术有限公司产品;RNAiso Plus、PrimeScript®RT reagent Kit with gDNA Eraser、SYBR®Premix Ex TaqTMII(Tli RNaseH Plus),大连宝生物工程有限公司产品。
1.1.2 动 物
SD大鼠,雄性,6周龄,由大连医科大学实验动物中心提供,SPF级,许可证号SCXK(辽)2013-0003。培养条件:湿度(55±10)%,室温(22±1)℃,12 h光照,水和鼠粮充足。
1.1.3 仪 器
SCP7OH低温超速离心机,日本HITACHI公司产品;Thermo-354酶标仪,美国ThermoFisher scientific公司产品;组织分散机,德国IKA公司产品;蛋白转印仪,美国Bio-RAD公司产品;凝胶成像系统,UVP Multispectral Imaging System产品;AU640全自动生化分析仪,日本OLYMPUS公司产品;BD FACSCalibur Flow Cytometer,美国BD公司产品;血糖仪、血糖试纸,均为德国罗氏诊断有限公司产品。
1.2 方 法
1.2.1 分组及给药:30只SD大鼠适应性预养1周后随机分成3组(每组10只):正常对照组(NC组)、2型糖尿病模型组(T2DM组)、模型+沙格列汀1.0 mg/kg治疗组(Sax组)。 NC组大鼠喂以普通饲料,T2DM组及Sax组大鼠给予高脂饲料喂养。适应性喂养4周后,T2DM组及Sax组大鼠按采用高脂饮食联合STZ复制2型糖尿病大鼠模型。Sax组大鼠每日1次灌胃给予沙格列汀1.0 mg/kg,NC组和T2DM组大鼠灌胃给予等容量生理盐水,连续给药12周后实验终止。
1.2.2 2型糖尿病大鼠模型的建立:采用高脂饮食联合链脲佐菌素(STZ)复制2型糖尿病大鼠模型。大鼠以高脂饲料(高脂饲料配方:胆固醇2%,猪油10%,蛋黄粉8.3%,奶粉13.7%,基础饲料66.0%)喂养,适应性喂养4周后禁食12 h,用新鲜配制的0.1 mmol/L柠檬酸盐缓冲液(pH 4.5)配置1% STZ,以单次腹腔注射STZ 55.0 mg/kg诱导建立2型糖尿病大鼠模型,注射后自由摄食进水。72 h后尾静脉采血测空腹血糖,空腹血糖≥16.4 mmol/L者确定为模型建立成功,纳入实验[7]。
1.3 指标测定
1.3.1 体重、食物摄取量、饮水量、尿量和血糖水平的测定:实验开始后每隔1天测量大鼠体重1次,记录体重数据;给药12周实验终止时,尾静脉采血于罗氏血糖仪中测空腹血糖;用代谢笼收集大鼠24 h尿液及随机尿液,记录尿量并测定尿蛋白(UAE)含量;测定24 h摄食量、饮水量,并记录数据。
1.3.2 样本采集:连续给药至12周后,大鼠禁食12 h,吸入乙醚麻醉,自腹主动脉取血,4 ℃过夜,3000 r/min离心10 min分离血清,置于-20 ℃冰箱保存备用。取肾脏组织,采用4%多聚甲醛固定,梯度乙醇脱水,常规石蜡包埋,均匀间断切片,切片厚度4~5 μm,室温保存;用于匀浆及免疫印迹法的肾脏组织置于-80 ℃冰箱中备用。
1.3.3 生化指标的测定:取血清样本在全自动生化分析仪中测定总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、血肌酐(Cr)和血尿素氮(BUN)水平。
1.3.4 肾组织病理学观察:将肾脏组织切片进行HE染色,于显微镜下观察组织病理学改变情况。
1.3.5 肾组织TFG-β表达水平:采用SP法,按试剂盒操作方法将肾组织切片进行免疫组化检测,光镜下随机选取5个高倍视野,观察并评分。判断标准为:阳性细胞数≤25%、25%~50%、51%~75%及>75%分别记为1分、2分、3分及4分,细胞浆无色、淡黄色、棕黄色及棕褐色分别记为0分、1分、2分及3分,二者相乘为最终评分。
1.3.6 外周血T淋巴细胞亚群(Tregs)水平:大鼠禁食12 h后眼眦取血200 μL抗凝血于EP管中,按试剂盒操作方法分别标记CD25及CD4,加入FoxP3,于流式细胞仪中检测,圈定CD4阳性细胞群后,计算细胞中CD25和Foxp3双阳性细胞表达率。
1.3.7 肾组织NF-κB p65、COX-2的蛋白表达水平:取肾皮质组织,提取蛋白,按试剂盒操作,采用Western blot法检测NF-κB p65、COX-2的蛋白表达水平。
1.3.8 肾组织TNF-α、IL-6和FoxO1的mRNA表达水平:取各组肾脏皮质部分提取总RNA后经逆转录反应,按试剂盒操作,采用RT-PCR法检测TNF-α、IL-6和FoxO1的mRNA 表达水平。
1.4 统计学方法
实验数据以mean±SD表示,采用SPSS 19.0软件进行统计学分析,两组间均数比较采用t检验,各组间均数比较采用单因素方差分析(one-way ANOVA),检验方法为SNK法。P<0.05表示差异具有统计学意义。
2 结 果
2.1 沙格列汀对糖尿病大鼠摄食量、饮水量、尿量的影响
如表1所示,与NC组相比,T2DM组大鼠的摄食量、饮水量及尿量均增多(P<0.01);Sax组较T2DM组摄食量、饮水量及尿量显著降低(P<0.05),但仍较NC组增多(P<0.01)。
表1 沙格列汀对糖尿病大鼠摄食量、饮水量、尿量的影响


组别动物数 摄食量(g) 饮水量(mL) 尿量(mL)NC组108.34±1.9211.00±2.526.62±1.68T2DM组1026.81±11.151)55.55±6.111)61.15±10.231)Sax组1022.82±9.301)2)34.75±14.891)2)45.10±12.661)2)
1)与NC组比较,P<0.01;2)与T2DM组比较,P<0.05
2.2 沙格列汀对糖尿病大鼠血糖、血脂水平的影响
如表2所示,与NC组相比,T2DM组大鼠的GLU、TC、TG、LDL明显升高,而HDL降低(P<0.01)。Sax组较T2DM组GLU、TC、TG显著降低,而HDL增高(P<0.05),且与NC组相比无明显差异。
表2 沙格列汀对糖尿病大鼠血糖、血脂水平的影响

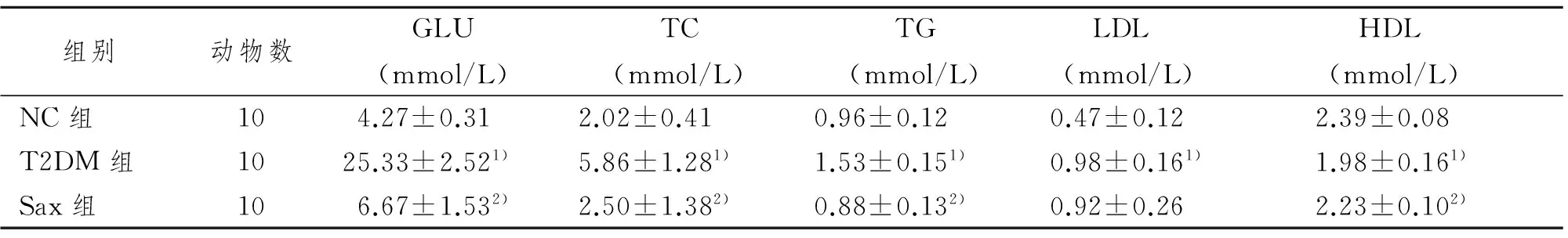
组别动物数GLU(mmol/L)TC(mmol/L)TG(mmol/L) LDL(mmol/L) HDL(mmol/L)NC组104.27±0.312.02±0.410.96±0.120.47±0.122.39±0.08T2DM组1025.33±2.521)5.86±1.281)1.53±0.151)0.98±0.161)1.98±0.161)Sax组106.67±1.532)2.50±1.382)0.88±0.132)0.92±0.262.23±0.102)
1)与NC组比较,P<0.01;2)与T2DM组比较,P<0.05
2.3 沙格列汀对糖尿病大鼠肾功能的影响
如表3所示,与NC组相比,T2DM组大鼠的体重、血肌酐(Cr)和血尿素氮(BUN)的水平明显增高(P<0.05),Sax组较T2DM组Cr和BUN水平明显降低(P<0.05),且与NC组相比体重、Cr和BUN水平无统计学差异。
表3 沙格列汀对糖尿病大鼠血Cr、BUN水平的影响


组别动物数 体重 (g) Cr(μmol/L) BUN(mmol/L)NC组10365.00±44.3453.33±12.473.50±0.41T2DM组10459.44±97.381)99.87±8.161)6.07±0.731)Sax组10468.80±73.6956.67±12.472)3.48±0.422)
1)与NC组比较,P<0.05;2)与T2DM组比较,P<0.05
2.4 沙格列汀对糖尿病大鼠肾组织病理学改变的影响
由图1可见,NC组肾小管和肾小管间质未见异常;T2DM组肾小球见明显肿胀,系膜区增宽;Sax组较T2DM组肾小球体积略小,较NC组无明显差异。
2.5 沙格列汀对糖尿病大鼠肾组织TFG-β表达水平的影响
由表4、图2可见,肾组织免疫组化结果显示,与NC组相比,T2DM组肾小管内TFG-β阳性表达显著增加(P<0.05);Sax组较T2DM组TFG-β阳性表达减少(P<0.05),且与NC组TFG-β阳性表达无统计学差异。
表4 沙格列汀对糖尿病大鼠肾组织TFG-β表达水平的影响

Tab 4 Effects of Saxagliptin on TFG-β expression in diabetic rats (±s)
1)与NC组比较,P<0.05;2)与T2DM组比较,P<0.05
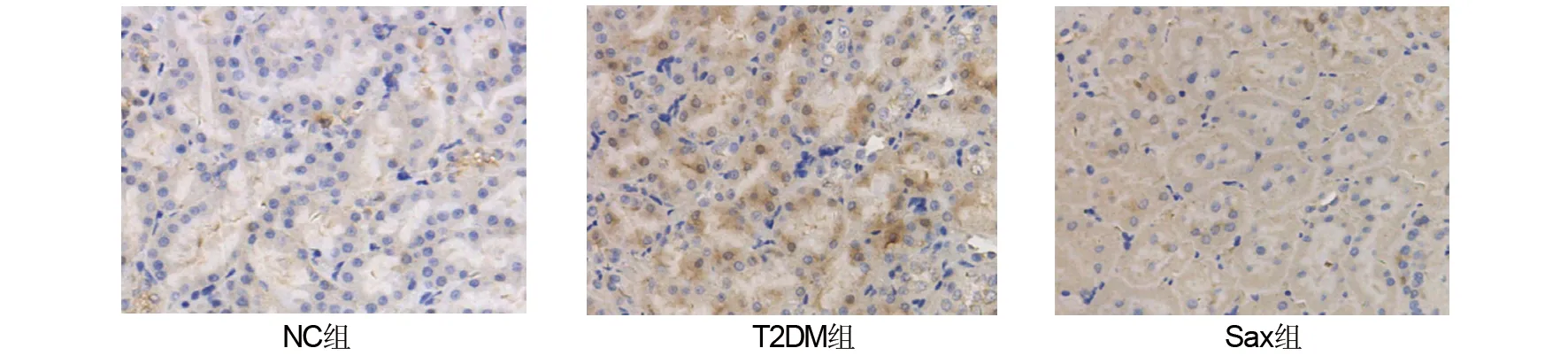
图2 各组肾组织TFG-β免疫组化染色(×200) Fig 2 TFG-β expression in renal tissue in three groups with immunohistochemistry(×200)
2.6 沙格列汀对糖尿病大鼠外周血T淋巴细胞亚群表达水平的影响
由表5、图3可见,与NC组相比,T2DM组CD4+CD25+Foxp3+表达水平显著降低(P<0.05);Sax组较T2DM组CD4+CD25+Foxp3+表达水平显著升高(P<0.05),与NC组无明显差异。
表5 沙格列汀对糖尿病大鼠外周血T淋巴细胞亚群表达水平的影响

Tab 5 Effects of Saxagliptin on regulatory T cells levels in diabetic rats (±s)
1)与NC组比较,P<0.05;2)与T2DM组比较,P<0.05
2.7 沙格列汀对糖尿病大鼠肾组织中NF-κB p65和COX-2表达水平的影响
由图4可见,与NC组相比,T2DM组NF-κB p65和COX-2蛋白表达增高(P<0.05);而Sax组较T2DM组NF-κB p65和COX-2蛋白表达水平明显降低(P<0.05),且与NC组相比无统计学差异。
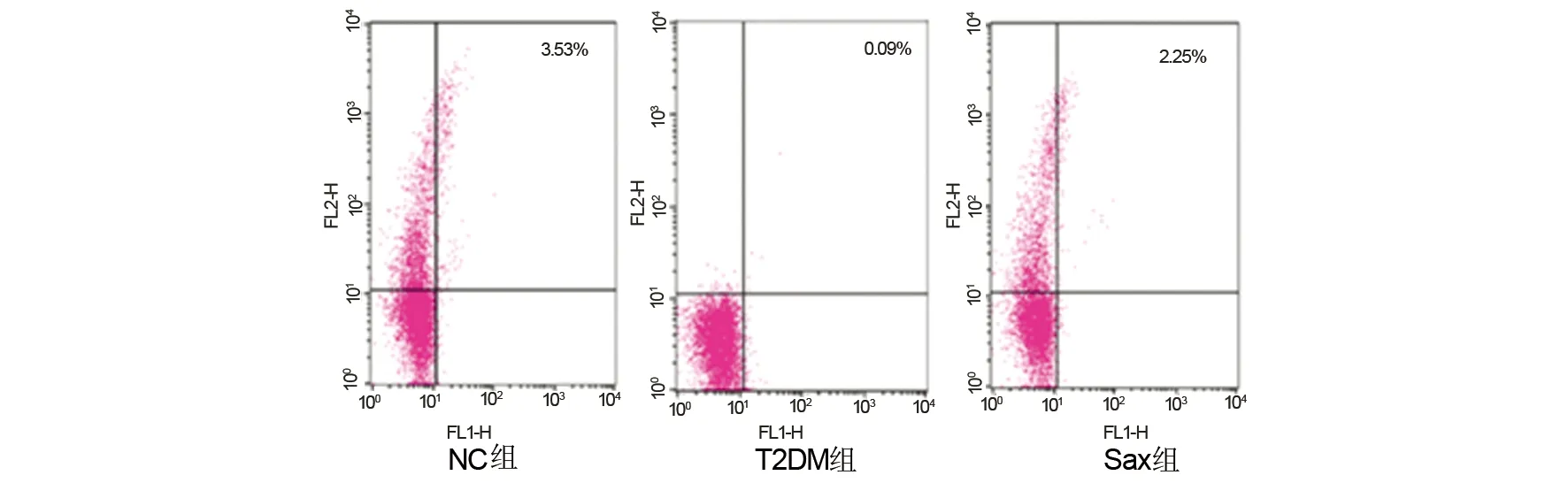
图3 各组外周血T淋巴细胞亚群(regulatory T cells,Tregs)水平Fig 3 Regulatory T cells levels in three groups
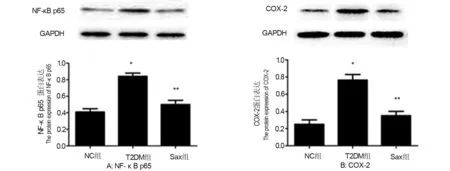
*与NC组比较,P<0.05;**与T2DM组比较,P<0.05图4 各组肾脏组织中NF-κB p65和COX-2蛋白表达水平Fig 4 The protein expression level of NF-κB p65 and COX-2 in three groups
2.8 沙格列汀对糖尿病大鼠肾组织中TNF-α、IL-6和FoxO1 mRNA表达水平的影响
由图5可见,与NC组相比,T2DM组TNF-α、IL-6和FoxO1 mRNA表达上调(P<0.05);而Sax组较T2DM组mRNA表达水平明显降低(P<0.05),且与NC组相比无统计学差异。
3 讨 论
近年研究发现,糖尿病患者肾脏组织损伤和肾功能性下降与肾脏炎症细胞的浸润有关[8],表明免疫介导的炎症在糖尿病肾病的发生、发展中发挥重要作用。已有研究表明,应用免疫抑制剂或中和抗体可以减轻糖尿病肾脏淋巴细胞的浸润和激活,延缓肾脏损伤[9],因此早期干预炎症反应,可能会延缓或逆转糖尿病肾病的发生、发展。
2型糖尿病发病过程中伴有糖代谢、脂代谢及肾脏功能紊乱[10]。本研究结果显示,沙格列汀可减轻多饮、多食、多尿症状;明显降低GLU、TG、TC、LDL水平,而升高HDL水平;降低血Cr和BUN水平,减轻2型糖尿病肾病的病理性改变。表明DPP-4抑制剂沙格列汀可通过改善糖代谢、脂代谢水平和肾脏功能而减缓2型糖尿病肾病的病程发展。
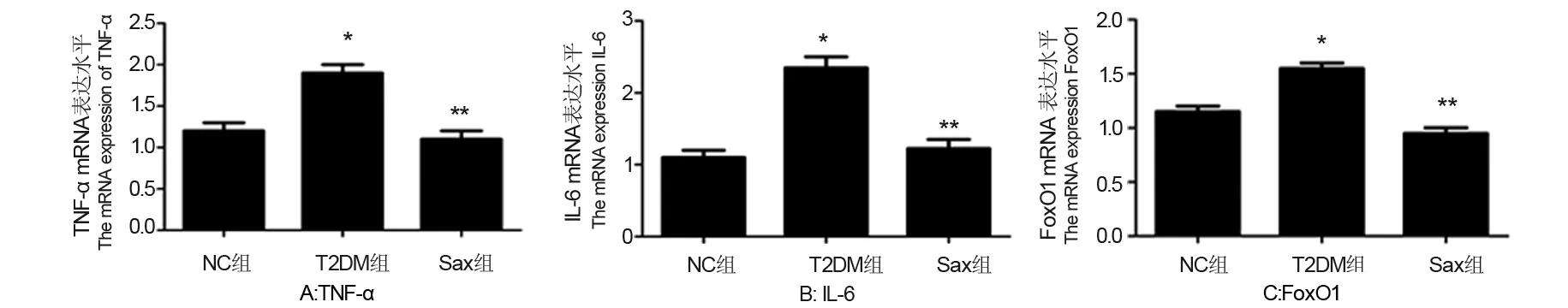
*与NC组比较,P<0.05;**与T2DM组比较,P<0.05图5 各组肾脏组织中TNF-α,IL-6和FoxO1 mRNA表达水平Fig 5 The mRNA expression level of TNF-α,IL-6 and FoxO1 in three groups
调节性T细胞为一类特殊的T淋巴细胞亚群,因能够有效抑制自体免疫活性、预防人类的自体免疫性疾病,Treg细胞通过对其他免疫细胞的负调节发挥维持免疫稳态的作用[11]。有研究发现2型糖尿病初诊时测得Treg细胞表达失衡,表现为CD4+CD25+Foxp3+Treg细胞比例低于正常水平[12]。另有研究显示Treg细胞的表达率与2型糖尿病肾病病程呈负相关[13]。本研究结果表明,2型糖尿病肾病组CD4+CD25+Foxp3+Treg细胞百分比低于正常组,而沙格列汀治疗组外周血具有潜在免疫调节活性的CD4+CD25+Foxp3+Treg细胞百分比水平高于模型组。提示DPP-4抑制剂沙格列汀可能通过调节CD4+CD25+Foxp3+Treg细胞比例,抑制2型糖尿病肾病自体免疫活性而发挥维持免疫稳态的作用。
NF-κB是一类重要的核转录因子,是由p50及p65两个亚单位构成的异源二聚体,通常以非活性形式存在于几乎所有类型的细胞中,可通过调节促炎因子的表达调控免疫及炎症反应,包括TNF-α、IL-6、趋化因子及细胞黏附分子等。COX-2是环氧化酶(COX)的同功异构酶,参与多种应激和病理过程,其启动子序列可与NF-κB序列特异性结合,促进COX-2基因转录[14]。本研究结果显示,与正常对照组相比,模型组肾组织NF-κB p65表达升高,同时炎性因子COX-2、TNF-α、IL-6和FoxO1的mRNA表达也呈升高趋势;与模型组相比,沙格列汀可明显下调上述表达增高的因子的表达水平。提示DPP-4抑制剂沙格列汀可能通过免疫调节机制中相关因子的表达而改善2型糖尿病大鼠肾脏炎症的损伤。
综上,DPP-4抑制剂沙格列汀能改善2型糖尿病引起的代谢紊乱和肾脏组织病理学改变,调节外周血T细胞亚群水平,下调炎症因子的表达。DPP-4抑制剂沙格列汀对糖尿病肾脏损害具有保护作用的原因可能是抑制炎症的发生及参与免疫调节,但其具体机制还有待深入研究。
[1] Ohnuma K,Hosono O,Dang NH,et al. Dipeptidyl peptidase in autoimmune pathophysiology[J]. Adv Clin Chem,2011,53(2):51-84.
[2] Lambeir AM, Durinx C,Scharpe S,et al. Dipeptidyl- peptidase IV from bench to bedside: an update on structural properties, functions, and clinical aspects of the enzyme DPP IV[J]. Crit Rev Clin Lab Sci,2003,40(1):209-294.
[3] Bengsch B, Seigel B, Flecken T,et al. Human Th17 cells express high levels of enzymatically active dipeptidylpeptidase IV (CD26) [J]. J Immunol,2012,188(54):38-47.
[4] Alter ML,Ott IM,von Websky K, et al. DPP-4 inhibition on top of angiotensin receptor blockade offers a new therapeutic approach for diabetic nephropathy[J].Kidney Blood Press Res,2012,36(1):119-130.
[5] Saito T, Ohnuma K, Suzuki H, et al. Polyarthropathy in type 2 diabetes patients treated with DPP4 inhibitors[J]. Diabetes Res Clin Pract, 2013, 102(1):E8-E12.
[6] Noack M, Miossec P. Th17 and regulatory T cell balance in autoimmune and inflammatory diseases[J]. Autoimmun Rev,2014,13(6):68-77.
[7] Yang J, Campitelli J, Hu G, et al. Increase in DPP-IV in the intestine, liver and kidney of the rat treated with high fat diet and streptozotocin[J]. Life Sci,2007, 81(4):272-279.
[8] Liu WJ, Xie SH, Liu YN, et al. Dipeptidyl peptidase IV inhibitor attenuates kidney injury in streptozotocin-induced diabetic rats[J]. J Pharmacol Exp Ther, 2012, 340(2): 248-255.
[9] Mega C,de Lemos ET,Vala H,et al. Diabetic nephropathy amelioration by low-dose sitagliptin in an animal model of type 2 diabetes (Zucker diabetic fatty rat) [J]. Exp Diabetes Res,2011,16(2):90-92.
[10] Amori RE,Lau J,Pittas AG. Efficacy and safety of incretin therapy in type 2 diabetes: systematic review and meta-analysis[J]. JAMA,2007,29(8):194-206.
[11] Mallat Z,Ait-Oufella H,Tedgui A.Regulatory T-cell immunity in atherosclerosis[J]. Trends Cardiovasc Med,2007,17(11):3-8.
[12] Mori H, Okada Y, Arao T, et al. Sitagliptin improves albuminuria in patients with type 2 diabetes mellitus[J]. J Diabetes Investig, 2014, 5(3):313-319.
[13] Sasaki T,Hiki Y,Nagumo S,et al. Acute onset of rheumatoid arthritis associated with administration of a dipeptidyl peptidase-4 (DPP-4) inhibitor to patients with diabetes mellitus[J]. Diabetol Int,2010,1(9):1-2.
[14] Kim W, Egan J M. The role of incretins in glucose homeostasis and diabetes treatment[J]. Pharmacol Rev, 2008, 60(4):470-512.
Effects of the DPP-4 inhibitor Saxagliptin against kidney injury in type 2 diabetes mellitus rats
JIANG Junshu1,2,YE Shengkai1,SUN Xiaohong1,DU Nan3,TU Zuoyu3,DAI Yongguo3, CHEN Haiying1,LYU Li3
(1. Department of Endocrinology, the 210th Hospital of PLA, Dalian 116021, China; 2. Department of Medical Affairs, the Third People's Hospital of Dalian, Dalian 116033, China;3. College of Pharmacy, Dalian Medical University, Dalian 116044, China)
Objective To investigate the effects of Saxagliptin, a DPP-4 inhibitor, against kidney injury in type 2 diabetes mellitus rats. Methods Thirty male Sprague-Dawley rats were divided into 3 groups randomly (n=10): control group, type 2 diabetes mellitus (T2DM) group, T2DM+Saxagliptin 1.0 mg/kg (Sax) group. The rats of T2DM group and Sax group were fed with a high-fat diet and given STZ to establish experimental type 2 diabetes model, while the rats of control group were fed with a normal diet. The rats of Sax group were administered Saxagliptin 1.0 mg/kg once a day for 12 weeks and the rats of control group and T2DM group were given equal volume of saline. Blood glucose was measured in a blood glucose meter. TC, TG, LDL, HDL, Cr, BUN were measured in a blood automatic analyzer. The level of Tregs were measured by flow cytometry. Kidney tissues were examined with HE staining. TFG-β expression was detected by immunohistochemistry. The expression level of TNF-α, IL-6, FoxO1, NF-κB p65, COX-2 were determined by western blotting and Real-time PCR. Results Saxagliptin decreased blood glucose, reduced food/water intakes and body weight, decreased serum lipid parameters (TC, TG, LDL), ameliorated Cr, BUN, INF-γ/IL-10, Tregs levels. Saxagliptin significantly down-regulated the expressions of TFG-β, TNF-α, IL-6, FoxO1, NF-κB p65, COX-2. Conclusion DPP-4 inhibitor Saxagliptin could lessen kidney injury in type 2 diabetes mellitus rats by inhibiting inflammation and regulating immune function.
DPP-4 inhibitor; Saxagliptin; type 2 diabetes mellitus; kidney injury; immune function
大连市医学卫生科学研究计划项目(大卫科发[2014]142号);中华医学会医学教育分会中国高等教育学会医学教育专业委员会医学教育研究项目(2016B-YX013)
蒋隽舒(1990-),女,硕士研究生。E-mail:592346293@qq.com
陈海英,副主任医师。E-mail:jjhchy@163.com
10.11724/jdmu.2017.04.03
R977.1+5
A
1671-7295(2017)04-0323-06
蒋隽舒,叶盛开,孙晓红,等.DPP-4抑制剂沙格列汀对2型糖尿病大鼠肾损伤的保护作用[J].大连医科大学学报,2017,39(4):323-328,333.
2017-06-02;
2017-06-25)
