MIF抗体对大肠癌癌前病变及大肠癌 MIF、VEGF、PDGF表达的影响
2017-09-12沈媛媛王爱丽张冉冉刘成霞
沈媛媛,王爱丽,程 凯,张冉冉,刘成霞
山东省滨州医学院附属医院1.消化内科;2.甲状腺乳腺外科,山东滨州256600
MIF抗体对大肠癌癌前病变及大肠癌 MIF、VEGF、PDGF表达的影响
沈媛媛1,王爱丽1,程 凯2,张冉冉1,刘成霞1
山东省滨州医学院附属医院1.消化内科;2.甲状腺乳腺外科,山东滨州256600
目的 通过二甲基肼建立大鼠大肠癌前病变及大肠癌模型,从血管新生的角度初步探讨巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)抗体对大肠变异隐窝病灶(aberrant crypt foci,ACF)及大肠癌中MIF、VEGF、PDGF表达的影响。方法 通过二甲基肼诱导大鼠发生大肠癌癌前病变ACF及大肠癌模型,采用ELISA及免疫组化方法研究MIF抗体对大鼠早期癌变肠黏膜及大肠癌形成后癌瘤中MIF表达的影响,并观察MIF抗体对ACF、癌瘤的数量及VEGF、PDGF表达的影响。结果 MIF抗体可显著抑制ACF数量及癌瘤的数量(P<0.01),并且显著抑制MIF、VEGF、PDGF的表达。结论 MIF抗体在二甲基肼诱导的大鼠大肠癌癌变过程中有抑制作用,这种作用可能与抑制ACF生成及MIF、VEGF、PDGF表达有关,因此,MIF抗体可能成为大肠肿瘤抗血管生成治疗的新靶点。
MIF抗体;大肠变异隐窝病灶;大肠癌;血管生成
大肠癌是全球最常见的恶性肿瘤之一,严重威胁人类健康,提高大肠癌治愈率的关键是早期发现和治疗大肠癌癌前病变。研究报道,变异隐窝区(aberrant crypt foci,ACF)是镜下可见的最早的黏膜损伤[1],其数量与大肠肿瘤性腺瘤的发生有明显相关性[2]。肿瘤的发生、发展依赖血管新生[3],巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)作为一种炎症核心因子,在肿瘤血管新生中亦发挥重要作用[4]。本实验通过二甲基肼诱导大鼠癌前病变大肠异常隐窝及大肠癌模型,在血清学与组织学水平上观察MIF与血管新生有关的细胞因子血管内皮生长因子(vascular endothelial growth factor,VEGF)、血小板源性生长因子(platelet-derived growth factor,PDGF)的关系,并初步研究MIF抗体对ACF数量、大肠癌发生的影响及对MIF、VEGF和PDGF表达的影响。
1 材料与方法
1.1 动物模型 实验用Wistar大鼠100只(雌雄各半,平均年龄5周龄,平均体质量70 g,由滨州医学院动物实验室提供),在温度24℃、湿度50%左右的条件下饲养,喂以常规饲料,适应1周后,随机分为5组,具体如下:空白组:每周腹腔内注射生理盐水1 ml/100 g;ACF对照组:腹腔注射二甲基肼25 mg/kg+生理盐水1 ml/100 g,每周1次,连续12周;大肠癌对照组:腹腔注射二甲基肼25 mg/kg+生理盐水1 ml/100 g,每周1次,连续20周;MIF抗体ACF治疗组:腹腔注射二甲基肼25 mg/kg+生理盐水1 ml/100 g+MIF抗体400 μg/只,连续12周;MIF抗体大肠癌治疗组:腹腔注射二甲基肼25 mg/kg+生理盐水1 ml/100 g+MIF抗体400 μg/只,连续20周。以上大鼠每周称重1次,并根据体质量改变生理盐水、二甲基肼剂量。
1.2 大鼠ACF检测 实验第13周,随机选取空白组大鼠10只及全部20只ACF对照组大鼠、20只MIF抗体ACF治疗组大鼠用于ACF检测。100 g/L水合氯醛麻醉,腹主动脉取血后断头处死大鼠,快速分离大肠并切下,参照Bird的方法[5]固定标本和染色,具体如下:用生理盐水冲洗肠内容物,将整根大肠铺平夹于两层滤纸之间,固定于100 g/L中性缓冲福尔马林溶液中,至少24 h。固定好的标本用2 g/L美蓝染色3~5 min,立即在40×光学显微镜下观察并计数ACF数量。比较空白组、ACF对照组和MIF抗体ACF治疗组ACF数量变化。
1.3 大鼠大肠癌检测 实验第21周,将剩余10只空白组大鼠及全部20只大肠癌对照组大鼠、20只MIF抗体大肠癌治疗组大鼠用腹腔注射100 g/L水合氯醛,腹主动脉取血后断头处死,快速分离大肠并切下,纵向剖开,用生理盐水冲洗肠内容物,展开铺于玻璃板上,计算每只大鼠大肠癌瘤数量,最后用100 g/L中性缓冲福尔马林溶液固定。固定后,梯度酒精脱水,石蜡包埋并5 mm切片,每组选取2张进行常规HE染色。
1.4 ELISA及免疫组化 将各组血标本离心并取血液上清,冻存于-80℃冰箱备用。在进行ELISA前将各组血液上清复温,并按照ELISA试剂盒说明书检测MIF。
将各组石蜡标本5 mm切片后,随机选取2张进行MIF、VEGF、PDGF免疫组化染色,严格按照说明书进行,所有试剂盒均购自武汉博士德公司。以已知阳性结果作为阳性对照,PBS液作为阴性对照。
1.5 统计学分析 采用SPSS 19.0统计学软件分析数据,计数资料组间比较采用χ2检验,计量资料组间比较采用t检验。分类变量间相关性检验采用Pearson等级相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 MIF抗体对大鼠ACF形成的影响 实验第13周,处死的10只空白组大鼠大肠中无ACF形成,20只ACF对照组大鼠及20只MIF抗体ACF治疗组大鼠的大肠中均有ACF形成(见图1)。MIF抗体ACF治疗组每只大鼠的大肠ACF总数明显低于ACF对照组大鼠(P <0.01,见表1)。
2.2 MIF抗体对大鼠大肠癌发生的影响 实验第21周,处死的10只空白组大鼠大肠中无大肠癌发生,20只大肠癌对照组大鼠及20只MIF抗体大肠癌治疗组大鼠的大肠中均有大肠癌形成(见图2)。与大肠癌对照组相比,MIF抗体大肠癌治疗组的大鼠大肠癌发生率明显受抑制(P<0.01,见表2)。
表1 MIF抗体对大鼠ACF的影响(±s)Tab 1 Effect of MIF antibody on ACF formation in rats(±s)

表1 MIF抗体对大鼠ACF的影响(±s)Tab 1 Effect of MIF antibody on ACF formation in rats(±s)
注:与ACF对照组比较,*P<0.01。
组别 只数 ACF总数 抑制率(%)空白组 10 0—ACF对照组 20 115.20±14.12 —MIF抗体ACF治疗组 20 52.40±7.35*54.5
2.3 MIF抗体对大鼠大肠癌癌变过程中MIF表达的影响 ELISA检测各组血清MIF含量,与空白组相比,ACF对照组、MIF抗体ACF治疗组、大肠癌对照组及MIF抗体大肠癌治疗组大鼠血清MIF含量明显升高(P<0.01);ACF对照组MIF含量明显高于MIF抗体ACF治疗组(P<0.01);大肠癌对照组MIF含量明显高于MIF抗体大肠癌治疗组(P<0.01);大肠癌对照组MIF含量明显高于ACF对照组(P<0.01,见表3)。
表3 各组血清MIF含量(±s,pg/ml)Tab 3 Expression of MIF in serum in each group(±s,pg/ml)

表3 各组血清MIF含量(±s,pg/ml)Tab 3 Expression of MIF in serum in each group(±s,pg/ml)
注:与空白组相比,aP<0.05;与 ACF对照组相比,bP<0.05;与大肠癌对照组,cP<0.05。
组别MIF空白组1.6±0.3 ACF对照组 20.1±4.8aMIF抗体ACF治疗组 12.7±3.6ab大肠癌对照组 78.0±7.5abMIF抗体大肠癌治疗组 51.2±8.5ac
2.4 MIF抗体对大肠癌癌变过程中 MIF、VEGF、PDGF表达影响 免疫组化法检测各组MIF表达,实验第13周,MIF、VEGF、PDGF在 ACF对照组及 MIF抗体ACF治疗组均有表达(见图3),MIF抗体ACF治疗组可明显抑制MIF、VEGF、PDGF表达,使用Pearson相关分析发现,MIF与VEGF、PDGF表达呈显著正相关(P <0.05);实验第21周,MIF、VEGF、PDGF在大肠癌对照组及MIF抗体大肠癌治疗组呈高表达(见图4),且MIF抗体大肠癌治疗组可显著抑制MIF、VEGF、PDGF,使用 Pearson相关分析发现,MIF与 VEGF、PDGF表达呈显著正相关(P<0.05)。

图1 大鼠ACF形成(HE 400×) A:ACF对照组;B:MIF抗体ACF治疗组;图2 大鼠大肠癌形成(HE 400×) A:大肠癌对照组;B:MIF抗体大肠癌治疗组Fig 1 The formation of ACF in rats(HE 400×) A:ACF control group;B:MIF-antibody ACF treatment group;Fig 2 The formation of colorectal cancer in rats(HE 400×) A:colorectal cancer control group;B:MIF-antibody colorectal cancer treatment group
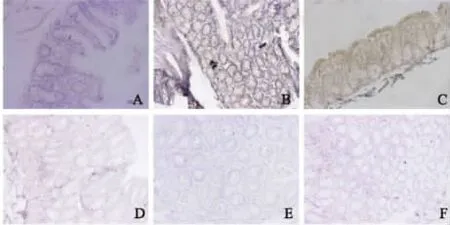
图3 免疫组化法检测各组13周时MIF、PDGF、VEGF表达(200×) A:ACF对照组MIF表达;B:MIF抗体ACF治疗组MTF表达;C:ACF对照组PDGF表达;D:MIF抗体ACF治疗组PDGF表达;E:ACF对照组VEGF表达;F:MIF抗体ACF治疗组VEGF表达Fig 3 Expressions of MIF,PDGF,VEGF in each group at the 13 rd week by immunochemical staining(200×) A:MIF expression in ACF control group;B:MIF expression in MIF antibody ACF treatment group;C:PDGF expression in ACF control group;D:PDGF expression in MIF antibody ACF treatment group;E:VEGF expression in ACF control group;F:VEGF in MIF antibody ACF treatment group
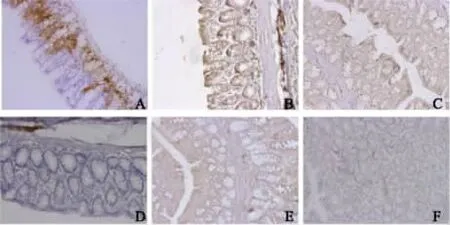
图4 免疫组化检测各组21周时 MIF、PDGF、VEGF表达(400×) A:大肠癌对照组MIF表达;B:MIF抗体大肠癌治疗组MIF表达;C:大肠癌对照组PDGF表达;D:MIF抗体大肠癌治疗组PDGF表达;E:大肠癌对照组VEGF表达;F:MIF抗体大肠癌治疗组VEGF表达Fig 4 MIF,PDGF,VEGF expressions in each group at the 21st week by immunochemical staining(400×) A:MIF expression of colorectal cancer control group;B:MIF expression in MIF antibody colorectal cancer treatment group;C:PDGF expression of colorectal cancer control group;D:PDGF expression in MIF antibody colorectal cancer treatment group;E:VEGF expression of colorectal cancer control group;F:VEGF in MIF antibody colorectal cancer treatment group
3 讨论
大肠癌是世界范围内的常见恶性疾病,虽然我国发病率低于发达国家,但随着国民生活水平的提高及饮食结构的改变,大肠癌的发病率在我国有逐年上升的趋势。大肠癌癌变学说包括:“腺瘤 -癌”学说、“denovo癌”学说、“锯齿状腺瘤 -腺癌”学说[6-8]。最广为接受的学说为“正常上皮-增生上皮-腺瘤-癌-转移癌”途径。自1987年Bird利用实体镜在大肠癌动物模型中首次发现了ACF,在随后一系列临床及动物研究中发现,ACF是大肠癌发病路径中显微镜下发现的最早的黏膜损伤,它的出现明显早于不典型增生及腺瘤,并在遗传、表观遗传、免疫组化和组织病理等方面的改变影响着肿瘤发生,且ACF的数量与结直肠高危肿瘤(即直径>1 cm和/或绒毛状、和/或重度不典型增生、浸润癌)的发生有明显的相关性,因此,它被称为最早的大肠癌癌前病变[9],通过放大内镜、染色内镜或普通内镜下应用亚甲蓝或靛胭脂染色都可不同程度显示,其不同于正常肠腺之处在于染色后腺管颜色加深、面积扩大;光镜下腺管管腔口呈椭圆、锯齿、裂隙状等不规则改变,上皮层增厚并轻微隆起,将这样的单个或聚集成灶的异常隐窝称为ACF[10]。大肠癌及大肠癌癌前病变动物模型的建立,目前除人类瘤株移植裸鼠外,各种化学物质诱发的动物模型也比较常见,二甲基肼是一类经典的致癌剂,常用剂量在不同作用时间能够诱导大鼠形成ACF及大肠癌[11],该模型已成功用于检测和评价大肠癌化学预防和早期治疗的机制研究。
恶性肿瘤的发生、发展、转移是一个复杂过程,涉及多个因素,其中新生血管形成是关键步骤[12]。肿瘤组织的增殖及生长需要新生血管为其提供氧气和养料并清除代谢产物,如果血管中断,则肿瘤生长不会超过1 mm3。抑制肿瘤新生血管生成的关键是抑制血管内皮细胞,目前已知VEGF、FGF、PDGF等多种肿瘤血管生长因子作用于肿瘤血管内皮细胞,通过促进其增殖和迁移、血管基底膜及内皮细胞胞外基质的降解和毛细血管形成等在血管新生中发挥作用,因此,这些细胞因子常作为抑制血管形成的作用靶点。其中,VEGF是迄今研究最成熟的细胞因子,它对肿瘤血管新生有着肯定的作用,通过与内皮细胞表面特定的跨膜受体FLK-1、KDR结合,诱导酪氨酸磷酸化和血管内信号传导并刺激有丝分裂,从而促进新生血管生成;虽然PDGF具体机制尚不明确,但目前研究认为,它可能通过降低抑制内皮细胞的胸苷水平而促进血管生成,并通过对血管周细胞增殖和迁移的调控参与血管的新生和成熟过程。在大肠癌及癌前病变中两者的含量有明显的差异[13]。VEGF和PDGF可从血管生成角度反映大肠癌的发生、发展过程。
MIF作为一种传统的免疫炎性因子,近年来研究发现,在结肠癌、肝癌、乳腺癌等多种肿瘤中高表达,并通过信号通路CD74/CD44受体结合来活化细胞外信号调节 ERK1/2 MAPK信号途径,并与 CXCR2和CXCR4结合,发挥其在肿瘤增殖、分化及血管生成方面的作用[14]。目前已发现,抗MIF抗体可抑制体外人脐静脉上皮细胞增殖,向C26荷瘤小鼠注射后,明显抑制肿瘤生长[15];在人正常大肠黏膜、大肠腺瘤和大肠癌组织及相应患者的血清中,MIF的表达依次增加,且与大肠癌的淋巴转移、肝转移密切相关[16];在小鼠大肠肝转移模型中,靶向MIF siRNA能显著降低肝转移的发生率,可能与下调VEGF及减少微血管密度有关[17]。因此,以MIF作为大肠癌预防、治疗、防治转移及预后判断有着潜在的发展前景。
综上所述,大鼠大肠癌模型、ACF模型血清及组织学中MIF、VEGF、PDGF均显著高于正常对照大鼠血清及组织,且大肠癌模型血清及组织学中MIF、VEGF、PDGF表达明显高于ACF模型组血清及组织学。应用MIF抗体作用于大鼠大肠癌及ACF模型后,能显著抑制 MIF、VEGF及 PDGF的表达,且 MIF与 VEGF、PDGF呈正相关。因此,抗MIF抗体可能通过抑制肿瘤的血管生成而抑制大肠癌癌前病变的产生及大肠癌的发展,为大肠癌的早诊、早治提供新靶点。
[1]Wargovich MJ,Jimenez A,McKee K,et al.Efficacy of potential chemopreventive agents on rat colon aberrant crypt formation and progression[J].Carcinogenesis,2000,21(6):1149-1155.
[2]Seike K,Koda K,Oda K,et al.Assessment of rectal aberrant crypt foci by standard chromoscopy and its predictive valve for colonic advanced neoplasms[J].Am J Gastroenterol,2006,101(6):1362-1369.
[3]Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med,1971,285(21):1182-1186.
[4]Shun CT,Lin JT,Huang SP,et al.Expression of macrophage migration inhibitory factor is associated with enhanced angiogenesis and advanced stage in gastric carcinomas[J].World J Gastroenterol,2005,11(24):3767-3771.
[5]Bird RP.Observation and quantification of aberrant crypts in the murine colon treated with a colon carcinogen:preliminary findings[J].Cancer Lett,1987,37(2):147-151.
[6]Muto T,Bussey HJ,Morson BC.The evolution of cancer of the colon and rectum[J].Cancer,1975,36(6):2251-2270.
[7]Spratt JS Jr,Ackerman LV,Moyer CA.Relationship of polyps of the colon to colonic cancer[J].Ann Surg,1958,148(4):682-698.
[8]Leggett B,Whitehall V.Role of the serrated pathway in colorectal cancer pathogenesis[J].Gastroenterology,2010,138(6):2088-2100.
[9]Luo L,Shen GQ,Stiffler KA,et al.Loss of heterozygosity in human aberrant crypt foci(ACF),a putative precursor of colon cancer[J].Carcinogenesis,2006,27(6):1153-1159.
[10]Caderni G,Pewelli MG,Cecchini F,et al.Enhanced growth of colorectal aberrant crypt foci in fasted/refed rats involves changes in TGF21 and p21CIP expressions[J].Carcinogenesis,2002,23(2):323-327.
[11]Inamine M,Suzui M,Morioka T,et al.Inhibitory effect of dietary monoglucosylceramide 1-O-beta-glucosyl-N-2'-hydroxyarachidoyl-4,8-sphingadienine on two different categories of colon preneoplastic lesions induced by 1,2-dimethylhydrazine in F344 rats [J].Cancer Sci,2005,96(12):876-881.
[12]Hsu AW,Sodhi A,Eberhart C,et al.Regression of chorooidal neovascularization in response to systematic chemotherapy for cancer[J].Canadian J Ophthalmol,2013,48(4),e 80-82.
[13]Bellone G,Gramigni C,Vizio B,et al.Abnormal expression of Endoglin and its receptor complex(TGF-β1 and TGF-β receptorⅡ)as early angiogenic switch indicator in premalignant lesions of the colon mucosa[J].Int J Oncol,2010,37(5):1153-1165.
[14]Baron N,Deuster O,Noelker C,et al.Role of macrophage migration inhibitory factor in primary glioblastoma multiforme cells[J].J Neurosci Res,2011,89(5):711-717.
[15]Shun CT,Lin JT,Huang SP,et al.Expression of macrophage migration inhibitory factor is associated with enhanced angiogenesis and advanced stage in gastric carcinomas[J].World J Gastroenterol,2005,11(24):3767-3771.
[16]何兴祥,李晓宇,郝元涛,等.巨噬细胞移动抑制因子与大肠癌肝转移的关系[J].中华普通外科杂志,2007,22(11):855-858.He XX,Li XY,Hao YT,et al.The relationship between MIF expression and hepatic metastasis inpatients of colorectal carcinoma[J].Chin J Gen Surg,2007,22(11):855-858.
[17]杨荣娇,王丽京,臧林泉,等.靶向巨噬细胞移动抑制因子的siRNA对小鼠大肠癌肝转移的影响[J].中华实验外科杂志,2011,28(9):1495-1497.Yang RJ,Wang LJ,Zang LQ,et al.Effects of macrophage migration inhibitory factor siRNA on hepatic metastasis of mouse colonic cancer[J].Chin J Exp Surg,2011,28(9):1495-1497.
Effects of MIF antibody on expressions of MIF,VEGF and PDGF in precancerous lesions and colorectal cancer
SHEN Yuanyuan1,WANG Aili1,CHENG Kai2,ZHANG Ranran1,LIU Chengxia1
1.Department of Gastroenterology;2.Department of Thyroid and Breast Surgery,Affiliated Hospital of Binzhou Medical University,Binzhou 256600,China
ObjectiveTo investigate the significance of MIF antibody on anti-vascular mechanism and expressions of MIF,VEGF and PDGF in 1,2-dimethylhydrazine(DMH)-induced colorectal aberrant crypt foci(ACF)and colorectal cancer rats model.MethodsColorectal ACF and colorectal cancer model were induced by DMH.The expressions of MIF was detected by ELISA and immunohistory-chemistry,and the ACF amounts,cancer genesis and the expressions of VEGF and PDGF affected by MIF antibody were observed.ResultsThe amounts of ACF and cancer were significantly inhibited by MIF antibody(P<0.01).The expressions of MIF,VEGF and PDGF were significantly inhibited by MIF antibody.ConclusionMIF antibody can inhibit the canceration of colorectal cancer by the possible cause of decreasing the amount of ACF and the expressions of MIF,VEGF and PDGF.As a result,MIF antibody may become the new target of anti-vascular treatment of colorectal cancer.
MIF antibody;Colorectal aberrant crypt foci;Colorectal cancer;Angiogenesis
R735.3+4
A
1006-5709(2017)08-0869-04
2017-04-02
10.3969/j.issn.1006-5709.2017.08.008
滨州医学院科技计划项目(BY2013KJ11)
沈媛媛,主治医师,医学硕士,研究方向:消化道肿瘤的早诊、早治。E-mail:shaoshen8307@163.com
刘成霞,医学博士,主任医师,研究方向:消化道肿瘤的发生机制研究。E-mail:byfylcx@163.com
