不同寄主来源轮枝孢菌的交互致病性1
2017-09-12张园园张贵张键张光周洪友赵君
张园园,张贵,张键,张光,周洪友,赵君*
(1.内蒙古农业大学农学院,呼和浩特010018;2.乌拉特前旗农业技术推广中心,内蒙古乌拉特前旗014400)
不同寄主来源轮枝孢菌的交互致病性1
张园园1,张贵1,张键1,张光2,周洪友1,赵君1*
(1.内蒙古农业大学农学院,呼和浩特010018;2.乌拉特前旗农业技术推广中心,内蒙古乌拉特前旗014400)
为了明确不同寄主来源的轮枝孢菌是否存在交互致病性,对来源于向日葵、棉花、茄子、生菜和马铃薯5种不同寄主植物上的10株轮枝孢菌的生物学特性,如菌落形态、生长速度、生理小种、交配型和致病力分化进行研究,并利用大丽轮枝孢菌不同生理小种和交配型的特异引物对供试大丽轮枝孢菌菌株进行聚合酶链式反应(polymerase chain reaction,PCR)检测。结果表明,不同寄主来源的轮枝孢菌在菌落形态和生长速度上存在显著差异。PCR检测结果表明:除了来自生菜的大丽轮枝孢菌Ls16-1为1号生理小种外,其余8株不同寄主来源的大丽轮枝孢菌均为2号生理小种;所有供试大丽轮枝孢菌菌株的交配型均为MAT1-2-1型。此外,采用纸钵撕底蘸根法将不同寄主来源的轮枝孢菌分别接种向日葵、棉花、茄子和马铃薯。结果显示,不同寄主来源的菌株对上述不同寄主均表现出不同程度的致病力,但都对自身分离寄主的致病性表现最强。综上表明,不同寄主来源的轮枝孢菌对不同寄主存在交互致病性,但均对其分离寄主的致病性表现最强。
轮枝孢菌;交互致病性;生理小种;交配型
SummaryVerticillium spp.is a group of soil-borne pathogen causing a yellow wilt disease on different kinds of hosts, such as cottons,potatoes,sunflowers and egg-plants,etc.So far,Verticillium dahliae and Verticillium alboatrum have been the most dominant species isolated from different diseased hosts.
In this study,V.dahliae from sunflower,cotton,eggplant,lettuce and potato and V.alboatrum from potato were selected to study the colonial morphology,growth speed,and pathogenic specificity.Their race and mating types were also identified by specific primers.
The results showed that variable colonial morphology and growth speed were observed in all the tested isolates.Four different kinds of colonial morphologies were classified based on the amount of aerial mycelium and the number of microsclerotia.However,the difference on the morphology of conidiophores and conidia was not obvious among all the tested isolates.The growth speed was also variable after 10 d of culture on potato D-glucose agar(PDA)medium.The strain Ls17-6 from lettuce grew the fastest,while Hn-1 from cotton grew the slowest.The difference of growth speed was alsoobserved among the isolates obtained from the same host.For example,Hn-1 isolated from cotton was significantly lower compared with the other two isolates.All the tested isolates were characterized as race 2,except for Ls16-1 isolated from lettuce as race 1;the mating type of all the tested strains was MAT1-2-1.The pathogenic specificity was studied using root dipping inoculation way.Twenty-one days post-inoculation(dpi),the pathogenicity of isolates always showed the highest virulence on its own host.For example,Sx5 which was isolated from sunflower showed the highest disease index of 52.50, followed by the isolate V991 from cotton with the disease index of 41.25.The same result was also obtained on cotton.For example,the isolate V991 showed the highest pathogenicity,and Icd3-33 also from cotton listed in the second position among all the tested isolates.
In conclusion,the pathogenicity of Verticillium spp.on the different hosts is variable,but shows the strongest pathogenicity in the specific host.Besides,the isolates from lettuce always showed the lowest virulence on all the tested hosts,indicating lettuce may be used as a rotation host for other crops to control the yellow wilt in the future.
引起植物黄萎病的病原菌统称为黄萎病菌,包括大丽轮枝孢菌(Verticillium dahliae Kleb.)、黑白轮枝孢菌(Verticillium alboatrum Reinke&Berthold)、三体轮枝孢菌(Verticillium tricorpus Isaac)、云状轮枝孢菌(Verticillium nubilum Pethybr.)、鳄梨根腐病原菌(Verticillium theobromae Turc.)[1],以及大丽轮枝孢菌长孢变种(Verticillium dahliae var.longisporum Stark)、变黑轮枝孢菌(Verticillium nigrescens Pethybr.)等[2-3];但是引起作物黄萎病的病原菌只有大丽轮枝孢菌和黑白轮枝孢菌2种[4-5]。目前,黄萎病菌在马铃薯(Solanum tuberosum)[6]、向日葵(Helianthus annuus L.)[7]、茄子(Solanum melongena L.)[8]、花椰菜(Brassica oleracea L.)、陆地棉(Gossypium hirsutum L.)[9]、生菜(Lactuca sativa var. ramosa)[10]等寄主上造成的危害均有报道。如我国云南省茄子黄萎病呈现出逐年加重的趋势,严重时产量损失达80%以上[8];我国新疆棉花黄萎病发病田占棉花总播种面积的58.2%,其中病情指数达5.0以上的棉田占28.1%[9];我国内蒙古地区向日葵黄萎病的发生面积占向日葵总播种面积的7%左右[11],而在宁夏部分地区的发生面积占向日葵播种面积高达46.9%[12],严重影响向日葵的产量和品质;美国南部地区马铃薯黄萎病严重影响马铃薯块茎的质量,造成马铃薯减产[6]。
尽管黄萎病菌的寄主范围十分广泛,但是它在不同寄主上表现出的致病力不同,如从可可(Theobroma cacao L.)和草莓(Fragaria spp.)上分离得到的大丽轮枝孢菌对可可和草莓的致病力强于对其他寄主植物的致病力[13-14];从胡椒(Piper nigrum L.)、薄荷(Mentha haplocalyx L.)和烟草(Nicotiana tabacum L.)等寄主植物上分离到的大丽轮枝孢菌[4,10,13-14]以及从紫花苜蓿(Medicago sativa L.)和啤酒花(Humulus lupulus L.)寄主植物上分离得到的黑白轮枝孢菌对寄主都表现出一定的寄生专化性[15-16]。此外,从朝鲜蓟(Cynara scolymus L.)、甜椒(Capsicum annuum var.grossum)、油橄榄(Olea europaea L.)、辣椒(Capsicum annuum L.)、陆地棉、茄子、薄荷、生菜、马铃薯、草莓、番茄(Lycopersicon esculentum L.)、西瓜(Citrullus lanatus L.)上分离到的轮枝孢菌也有交互侵染的报道[4]。但是,向日葵黄萎病菌(大丽轮枝孢菌)在马铃薯、茄子、棉花等轮作作物上的致病力分化研究尚未有报道。
已有研究结果表明,不同寄主来源的大丽轮枝孢菌只有1号和2号2个生理小种。USAMI等[17]和SCHAIBLE等[18]分别对番茄和生菜的大丽轮枝孢菌遗传多样性进行了研究,开发出1号和2号生理小种的特异引物,并利用这些引物鉴定表明,生菜和番茄大丽轮枝孢菌都存在着1号和2号生理小种的分化[17-19]。由于大丽轮枝孢菌的1号生理小种只在缺少抗病基因的寄主上具有致病性,而2号生理小种能够克服抗病基因所介导的抗病性[20-21],因此,国际上利用Ve1基因设计引物,通过聚合酶链式反应来检测寄主基因组中是否含有Ve1基因,从而快速鉴别侵染这些寄主的大丽轮枝孢菌的生理小种类型。同时,国外还利用含有Ve1基因的番茄品种“ACE VF”与不含Ve1基因的番茄品种“Early pak 7”、含有Vr1基因的生菜品种“Momotaro”与不含有Vr1基因的生菜品种“Oogata-fukuju”作为生理小种的鉴别寄主,分别鉴定了番茄和生菜中大丽轮枝孢菌的生理小种类型[19]。
子囊菌的有性生殖由配位型基因MAT来调控。配位型基因编码的蛋白往往是一种能够调控与有性交配相关基因表达的转录因子[22]。大丽轮枝孢菌是一种具有MAT1-1-1和MAT1-2-1 2种交配型(mating type)的异宗配合真菌[17]。如果2株大丽轮枝孢菌菌株要进行有性生殖,它们必须分别携带有MAT1-1和MAT1-2配位基因[23-25]。ATALLAH等[26]的研究结果表明,在美国加利福尼亚州采集的生菜大丽轮枝孢菌种群中MAT1-1-1所占的比例仅为30%,其余菌株的交配型均为MAT1-2-1,表明在大丽轮枝孢菌群体中存在着MAT1-1-1和MAT1-2-1 2种交配型。
本研究以分离自向日葵、马铃薯、茄子、生菜以及棉花的轮枝孢菌为研究材料,通过对比不同寄主来源轮枝孢菌的形态学特征,确定不同寄主来源的轮枝孢菌的生理小种及交配型,评价轮枝孢菌在向日葵、马铃薯、茄子、棉花等寄主之间的交互侵染能力,进而明确其在不同寄主间是否存在致病力分化现象,旨在填补我国向日葵黄萎病菌的研究空白,也为不同作物黄萎病综合防控措施中轮作对象的选择提供理论依据。
1 材料与方法
1.1 材料
供试菌株:Sx5(Verticillium dahliae)由内蒙古农业大学农学院分子植物病理室向日葵病害菌种库保存;Pt1(Verticillium dahliae)、Pt2(Verticillium dahliae)、Pt3(Verticilium alboatrum)由内蒙古农业大学农学院周洪友教授提供;V991(Verticillium dahliae)、Hn-1(Verticillium dahliae)、Icd3-33(Verticillium dahliae)由西北农林科技大学肖恩时研究员提供;Xn由内蒙古农业大学农学院景岚教授提供。以来源于生菜的轮枝孢菌菌株为参考菌株,由美国加利福尼亚大学戴维斯分校SUBBARAO教授惠赠,其中:菌株Ls16-1(Verticilliumdahliae)是1号生理小种,交配型是MAT1-2-1型;菌株Ls17-6(Verticillium dahliae)是2号生理小种,交配型是MAT1-2-1型。上述菌株中除了Pt3为黑白轮枝孢菌(Verticillium alboatrum)外,其余9株均为大丽轮枝孢菌(Verticillium dahliae)。供试轮枝孢菌菌株的具体信息如表1所示。
表1 轮枝孢菌菌株代码及其寄主信息Table 1Codes of Verticillium isolates and their hosts
供试的寄主材料均为市售品种,其中:向日葵品种为食葵杂交种“LD5009”;棉花品种为“石抗”;茄子品种为“快圆茄”;马铃薯品种为“夏坡地”。
马铃薯葡萄糖琼脂培养基(potato D-glucose agar,PDA):马铃薯200 g、葡萄糖20 g、琼脂粉15 g、水1 000 mL。麦麸培养基:麦麸经蒸馏水浸润后分装于300 mL的罐头瓶中,121℃高温灭菌30 min。
供试试剂:10×Taq缓冲液、dNTPs、Taq酶和DL2000分子质量标准(均购于北京天根生物科技有限公司);聚合酶链式反应(polymerase chain reaction,PCR)引物(由北京厚生博泰科技有限公司合成)。
供试仪器:TC-25H PCR扩增仪(杭州博日科技有限公司生产)。
1.2 方法
1.2.1 不同寄主来源的轮枝孢菌菌落形态和生长速度的测定
将10个不同寄主来源的轮枝孢菌菌株接种在PDA培养基上,25℃活化7~10 d,在菌落边缘的幼嫩菌丝处用直径为9 mm的灭菌打孔器打出菌饼,接种在PDA培养基中央,25℃恒温培养,观察其菌落形态。利用十字交叉法测量并记录培养5、10、15和18 d的菌落直径。每个处理重复5次。
1.2.2 不同寄主来源的轮枝孢菌生理小种的鉴定
用CTAB法提取大丽轮枝孢菌的基因组DNA[27],采用特异引物对不同寄主来源的大丽轮枝孢菌进行PCR扩增。大丽轮枝孢菌1号生理小种的特异引物对[24]如下。vdr1:5'-TGAAGTAGCCGATAGCTTT GTCTTGCCCG-3';vdr2:5'-TGTCTGGATTAATCGCC GCAATAGAGACG-3'。2号生理小种的特异引物对[19]如下。vd2F:5'-ACTTAACGAAAGCATGCGC-3';vd2R:5'-CTTGACTTGCCGGCTCC-3'。
PCR反应体系(25 μL):ddH2O 19 μL,10×Taq缓冲液2.5 μL,dNTPs(各2.5 mmol/L)1.25 μL,引物对(10 μmol/L)各0.5 μL,Taq酶(2.5 U/μL)0.25 μL,模板DNA 1 μL。PCR反应条件:94℃预变性5 min;94℃变性45 s,退火45 s(其中引物vdr1/vdr2的退火温度为59℃,vd2F/vd2R的退火温度为58℃),72℃延伸45 s,35个循环;最后72℃延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测,通过观察是否扩增出与正对照相同位置的条带来确定其生理小种的类型。1.2.3不同寄主来源轮枝孢菌交配型的鉴定
大丽轮枝孢菌的交配型鉴定[3,25]可分别通过MAT1-1-1型的特异引物(Alf3:5'-CGATCGCGATATCG GCAAGG-3';MAT11r:5'-CAGTCAGATCCAACCTGC TGGCC-3')和MAT1-2-1型的特异引物(HMG21f:5'-CGGCCGCCCAATTCGTACATCC-3';MAT21r:5'-CATGCCTTCCATGCCATTAGTAGCC-3')[18]完成。DNA提取方法和PCR反应体系(除MAT1-1-1和MAT1-2-1的退火温度均为57℃外)同1.2.2节。PCR扩增产物经1%琼脂糖凝胶电泳检测:MAT1-1-1型目的片段大小约为600 bp;MAT1-2-1的片段大小约为300 bp。
1.2.4 不同寄主来源轮枝孢菌致病力的测定
将不同寄主来源的轮枝孢菌经PDA平板活化5~7 d后,从菌落边缘挑取菌块接入麦麸培养基中,于25℃培养7~14 d。用无菌水冲洗麦麸培养基,4层灭菌纱布过滤后获得分生孢子液。用血球计数板计数,将分生孢子液的浓度调至1×107mL-1后备用。
用70%的乙醇浸泡向日葵、棉花、茄子种子5 min后,用无菌水冲洗2~3遍,播种到装有灭菌土的营养钵(高10 cm,直径10 cm)中;马铃薯块茎切块后也播种到装有灭菌土的营养钵中。当向日葵、棉花、茄子幼苗长到2~4片真叶时,将准备好的分生孢子液采用纸钵撕底蘸根法[28]进行人工接种。其中:对于向日葵、棉花、茄子,每个菌株分别接种5钵,每钵4株幼苗,1钵幼苗作为空白对照;对于马铃薯寄主,每个菌株接种10钵幼苗(每钵2株),2钵幼苗作为空白对照。接种后的幼苗置于22~23℃温室条件下继续培养。分别记录接种后第7、14、21和28天时各寄主植物的发病等级[29],并计算病情指数。以21 d的病情指数绘制表格。
黄萎病发病程度分级标准[29]如下。0级:健株,无症状;1级:25%(含25%)以下的叶片表现褪绿、黄化、萎蔫、枯死等症状;2级:25%~50%(含50%)的叶片表现症状,植株矮化;3级:50%~75%(含75%)的叶片表现症状,植株矮化;4级:75%以上的叶片表现出严重症状,植株枯萎死亡。
病情指数=[∑(各级病株数×相应级别)/(调查总株数×4)]×100。试验重复3次。
1.3 数据分析
利用SAS 9.0软件对所有数据进行统计分析,采用邓肯新复极差法进行差异显著性检验。
2 结果与分析
2.1 不同寄主来源轮枝孢菌菌落形态的比较
所有供试菌株培养7 d后的菌落近圆形,其菌丝特别是气生菌丝的生长量与微菌核形成数量呈现明显的差异。由图1可见:以Ls16-1、Ls17-6和Pt3为代表的菌株其菌落能够产生茂密的白色气生菌丝,但没有微菌核产生;而菌株Sx5、V991、Hn-1、Icd3-33和Xn的菌落既能产生白色气生菌丝又能产生一定数量的微菌核,其中,菌株Sx5、V991、Hn-1能够形成比较密集的气生菌丝,菌株Icd3-33和Xn能形成稀疏的气生菌丝和一定量的微菌核;而菌株Pt1和Pt2能够产生大量的微菌核和少量、稀疏的气生菌丝。不同寄主来源的轮枝孢菌菌株产生的分生孢子形态相似,均为无色、单孢、椭圆形、近椭圆形;分生孢子梗均呈现轮枝状排列。

图1 不同寄主来源的轮枝孢菌菌株的菌落形态Fig.1Colonial morphology of Verticillium spp.isolated from different hosts
2.2 不同寄主来源轮枝孢菌菌落生长速度的比较
由图2可见:不同寄主来源的轮枝孢菌菌株的生长速度在培养10 d后差异显著。其中:来自生菜的Ls17-6菌株生长速度最快,菌落直径为4.15 cm;其次是来源茄子的菌株Xn,菌落直径为3.86 cm;来自棉花的菌株Hn-1的生长速度最慢,菌落直径仅为2.99 cm。培养到第15天时,从茄子上分离到的轮枝孢菌菌株Xn的生长速度明显加快,菌落直径为4.71 cm;其次是来源于生菜的菌株Ls17-6,菌落直径为4.65 cm;从棉花上分离到的轮枝孢菌菌株Hn-1的生长速度最慢,菌落直径仅有3.69 cm。当培养到第18天时,来自不同寄主的各菌株之间生长速度差异无统计学意义。
从图2也可以看出,采集于不同地点的相同寄主来源的轮枝孢菌,其生长速度也表现出一定的差异。其中:来自棉花的3个菌株在培养5、10和15 d时的生长速度均表现出明显的差异,相对于其他2个菌株,菌株Hn-1的生长速度一直为最慢;而来自生菜的2个菌株在培养第10天时就表现出差异,其中LS17-6的生长速度略快于LS16-1;来源于马铃薯的3个菌株的生长速度也在培养第10天时出现一定的差异,菌株Pt2的生长速度略快于其他2个菌株,而来自马铃薯的黑白轮枝孢菌Pt3的生长速度和相同寄主的大丽轮枝孢菌Pt1的生长速度相同,差异无统计学意义。
2.3 不同寄主来源轮枝孢菌生理小种的鉴定
利用国际通用的轮枝孢菌的生理小种1和生理小种2的特异引物对不同寄主来源轮枝孢菌的生理小种进行鉴定,结果如图3所示。除了生菜黄萎病菌Ls16-1为1号生理小种外,其余8株不同寄主来源的黄萎病菌均为2号生理小种。
2.4 不同寄主来源轮枝孢菌的交配型鉴定
利用大丽轮枝孢菌的交配型MAT1-1-1和MAT1-2-1的特异引物对不同寄主来源大丽轮枝孢菌的交配型进行鉴定。结果表明,所有不同寄主来源的大丽轮枝孢菌均为MAT1-2-1交配型(图4)。说明MAT1-2-1交配型是不同寄主来源大丽轮枝孢菌的优势交配型。
2.5 不同寄主来源轮枝孢菌的致病力测定
为了比较不同寄主来源的轮枝孢菌菌株在不同寄主植物的交互侵染能力,采用伤根接种法进行人工接种,并调查了接种7、14、21和28 d后的植株发病情况,计算病情指数。其中,接种21 d后不同寄主的病情指数如表2所示。结果表明,不同寄主来源的轮枝孢菌菌株对不同寄主植物的致病力存在统计学上的显著差异(P<0.05)。根据不同寄主对供试菌株的抗性反应,对不同寄主来源的轮枝孢菌的致病力进行测定,结果归纳如下。

图2 不同寄主来源轮枝孢菌菌株生长速度比较Fig.2Comparison of the growth speed of Verticillium spp.isolated from different hosts
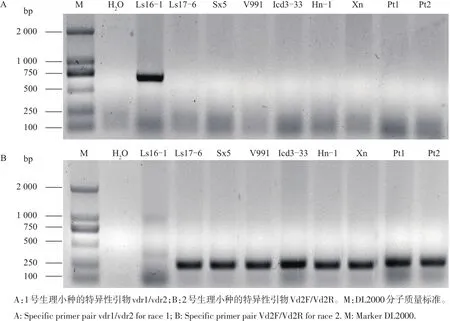
图3 不同寄主来源大丽轮枝孢菌生理小种的PCR鉴定Fig.3Race type identification of Verticillium dahliae isolated from different hosts by PCR

图4 不同寄主来源大丽轮枝孢菌MAT1-2-1交配型的PCR鉴定Fig.4Identification of mating type MAT1-2-1 in Verticillium dahliae isolated from different hosts by PCR
向日葵寄主:接种2周后,下部叶片首先开始出现症状,叶尖或叶缘局部黄化,随着组织失调、青萎,开始向叶脉组织发展,最后变褐、干枯,茎基部和叶柄微管束呈褐色。后期发病株的全部叶片都有显著病变,干枯矮化。所有供试轮枝孢菌菌株都能侵染向日葵品种“LD5009”,但发病程度呈现出一定的差异。其中,来自向日葵的菌株Sx5对向日葵品种“LD5009”表现出最强的致病力,病情指数高达52.50,其次为棉花菌株V991,病情指数为41.25。来源于生菜的菌株Ls16-1和Ls17-6表现出最弱的致病力,病情指数分别为16.67和25.00。来自茄子的菌株Xn在向日葵上表现出的致病力居中,病情指数为40.00。来自马铃薯的3个菌株在向日葵上表现出的致病力仅次于向日葵SX5、棉花V991和茄子菌株Xn,这3株马铃薯菌株的病情指数介于33.75和38.75之间,相互间差异不显著。而来自棉花的3个菌株在向日葵上呈现出致病力分化现象,其中菌株V991在向日葵寄主上表现出的致病力高于其他2份菌株。
棉花寄主:接种1周后,植株下层叶片出现褪绿黄化病斑,随着病情的发展可形成枯叶、光秆,维管束则部分褐变,植株矮化、萎蔫。所有供试菌株均能够侵染棉花品种“石抗”。其中:来源于棉花的菌株V991的致病力最强,病情指数为80.00;其次为来源于棉花的另一个菌株Icd3-33,病情指数为62.50。来自马铃薯的3株菌Pt1、Pt2和Pt3在棉花上的病情指数分别为55.00、57.50和40.00,其致病力仅次于来自棉花的菌株Icd3-33。来自棉花的菌株Hn-1在棉花上表现出的致病力最弱,病情指数仅为12.50。在马铃薯的3个供试菌株中,黑白轮枝孢菌Pt3的致病力在棉花上最弱,病情指数为40.00。来源于茄子的黄萎病菌Xn在棉花上也表现出相对较弱的致病力,病情指数为41.67。与向日葵寄主测定结果相似,来源于生菜的菌株Ls16-1和Ls17-6的致病力最弱,其病情指数分别为15.00和10.00。
茄子寄主:接种1周后,叶缘及叶脉间出现褪绿黄化病斑,病斑不断扩大和联合,颜色也由黄色变为褐色,并不断由下部向上部发展至整株;有时只半边叶或半边植株发病,即俗称的“半边疯”。所有供试菌株在茄子寄主上表现出的病情指数都低于50.00。其中:从茄子寄主分离到的菌株Xn对茄子的致病力最强,病情指数为43.75;其次为来自生菜的1号生理小种菌株Ls16-1,病情指数为36.67,而来自生菜的2号生理小种Ls17-6的病指仅为22.50。来自马铃薯的Pt1、Pt2和Pt3菌株在茄子寄主上的表现和前面2个寄主截然不同,其中黑白轮枝孢菌Pt3表现出的致病力最强,病情指数为36.67。致病力表现最弱的菌株是来自棉花的V991,其病情指数仅为14.58,而这一菌株在棉花、向日葵和马铃薯上都表现出极强的致病力。

表2 不同寄主来源的轮枝孢菌对不同寄主的致病力测定结果Table 2Cross pathogenicity test of Verticillium spp.isolated from different hosts
马铃薯寄主:接种2周后,叶片的侧脉之间变黄,逐渐转褐,有时叶片稍往上卷,自顶端或边缘起枯死;轻病植株生长缓慢,下部叶片变褐干枯,严重的整个植株萎蔫枯死,剖茎可见维管束变成褐色。来自马铃薯的黑白轮枝孢菌Pt3表现出最强的致病力,病情指数为54.17;其次为来自茄子的菌株Xn,病情指数为47.08;表现最弱的为生菜菌株Ls16-1以及棉花黄萎病菌株Hn-1,其病情指数均为25.00。
3 讨论
本试验不同寄主来源的10株轮枝孢菌按菌落形态可初步分为4种培养类型:第1类以菌株Ls16-1、Ls17-6和Pt3为代表,能够产生茂密的白色气生菌丝,但没有微菌核产生;第2类以菌株Sx5、V991、Hn-1为代表,能够形成比较密集的气生菌丝和一定数量的微菌核;第3类以菌株Icd3-33和Xn为代表,只能形成稀疏的气生菌丝和一定量的微菌核;第4类以菌株Pt1和Pt2为代表,能够产生大量的微菌核和少量、稀疏的气生菌丝。在PDA培养基上生长到10 d时,不同寄主来源的供试菌株的生长速度差异显著;而不同培养型菌株的生长速度与其致病力没有明显的相关性。这与任杰等[30]的研究结果一致,即不同培养型的向日葵黄萎病菌存在致病力的分化,且菌株的致病力强弱与其生长速度没有相关性。
已有的研究表明,生理小种的种群结构与其地理位置有相关性。GURUNG等[19]研究发现,所有来自美国沃森维尔地区的黄萎病菌株均为2号生理小种,而所有来自萨利纳斯地区的黄萎病菌株均为1号生理小种。而本研究结果表明,除SUBBARAO教授惠赠的美国生菜大丽轮枝孢菌菌株LS16-1为1号生理小种外,其余8株不同寄主且不同地域来源的大丽轮枝孢菌均为2号生理小种:说明大丽轮枝孢菌的寄主类型、采样地点与其生理小种类型无明显相关性。由于我国不同寄主植物来源的轮枝孢菌的优势小种都是2号生理小种,且所有供试菌株的交配型均被鉴定为MAT1-2-1交配型,说明无性生殖是我国不同寄主轮枝孢菌的主要繁殖方式。这一结论与USAMI等[17]对329株生菜黄萎病菌的研究结果一致,即:311株病菌为1号生理小种,占供试菌株的94.52%;328株病菌为MAT1-2-1交配型,占供试菌株的99.69%。
目前对大丽轮枝孢菌(V.dahliae)以及黑白轮枝孢菌(V.alboatrum)寄主专化性已有广泛的报道[1,7,10,31-32]。有研究指出,来自番茄和萝卜(Raphanus sativus L.)的黄萎病菌均可侵染薄荷,但来自马铃薯、茄子、黄秋葵(Abelmoschus esculentus L.)和甜瓜(Cucumis melo L.)的黄萎病菌株则对薄荷没有致病性。同样,棉花黄萎病菌株虽然不能侵染豇豆(Vigna unguiculata L.)、甜瓜和西瓜,但对棉花、番茄和红花(Carthamus tinctorius L.)具有不同程度的致病性[33]。本实验的研究结果和上述研究结果一致,如向日葵黄萎病菌株Sx5既可以侵染向日葵,也可以侵染棉花、茄子和马铃薯,但在不同寄主上的致病性却不尽相同。供试菌株对各自寄主均表现出最强的致病力,而对寄主以外的其他寄主则表现出不同程度的致病力,说明从不同寄主上分离到的黄萎病菌具有一定的寄生专化性,但在其他不同的寄主上存在着致病力分化的现象。这与BHAT等[10]在番茄、茄子、甜椒和十字花科植物上发现的黄萎病菌存在寄生专化性的结果一致。不同寄主来源的黄萎病菌在不同寄主上表现出致病性分化的现象,可能是长期进化过程中菌株与寄主植物之间相互作用的结果。类似这种黄萎病菌-寄主植物相互作用的模式已经在马铃薯、向日葵、棉花上进行了相关报道[34-35]。
在本研究中,我国不同寄主来源的轮枝孢菌生理小种是单一类型,即2号生理小种,以及单一的交配型MAT1-2-1。本实验室通过对全国各地分离到的向日葵黄萎病菌生理小种和交配型进行鉴定后发现,所有向日葵黄萎病菌生理小种都是2号小种且交配型都是MAT1-2-1型(待发表),说明无性繁殖可能是目前我国不同作物黄萎病菌的主要繁殖方式,这也预示我国黄萎病菌的遗传变异程度较小。而不同寄主来源的轮枝孢菌能够进行交互侵染,且在其分离寄主上表现出强致病性,该结果为今后作物黄萎病综合防控措施中轮作对象的选择提供了一定的理论依据。
4 结论
通过对向日葵、棉花、茄子、生菜和马铃薯5种不同寄主来源的大丽轮枝孢菌(V.dahliae)和马铃薯的黑白轮枝孢菌(V.alboatrum)在不同寄主上交互侵染力进行研究发现,除来源于生菜的大丽轮枝孢菌外,其他供试菌株对各自寄主都表现出最强的致病性,对寄主以外的其他寄主表现出不同程度的致病性:说明大丽轮枝孢菌具有一定程度的寄生专化性。除生菜黄萎病菌株LS16-1为1号生理小种外,其余8株不同寄主来源的大丽轮枝孢菌均被鉴定为2号生理小种:说明大丽轮枝孢菌的寄主来源、采集样点和其生理小种类型没有明显的相关性。由于我国不同寄主植物大丽轮枝孢菌的优势小种都是2号生理小种,且所有供试菌株的交配型均被鉴定为MAT1-2-1交配型:说明无性繁殖可能是供试的不同寄主大丽轮枝孢菌的主要繁殖形式。
[1]KLOSTERMAN S J,ATALLAH Z K,VALLAD G E,et al. Diversity,pathogenicity,and management of Verticillium species. Annual Review of Phytopathology,2009,47:39-62.
[2]BARBARA D J,CLEWES E.Plant pathogenic Verticillium species:Howmanyofthemarethere?MolecularPlant Pathology,2003,4(4):297-305.
[3]INDERBITIZIN P,BOSTOCK R M,DAVIS R M,et al. Phylogenetics and taxonomy of the fungal vascular wilt pathogen Verticillium with the descriptions of five new species.PLoS One, 2011,6(12):e28341.
[4]QIN Q M,VALLAD G E,WU B M,et al.Phylogenetic analyses of phytopathogenic isolates of Verticillium spp.Phytopathology, 2006,96(6):582-592.
[5]QIN Q M,VALLED G E,SUBBARAO K V.Characterization of Verticillium dahliae and V.tricorpus isolates from lettuce and artichoke.Plant Disease,2008,92(1):69-77.
[6]ROWE R C,POWELSON M L.Potato early dying:Management challenges in a changing production environment.Plant Disease, 2002,86(11):1184-1193.
[7]曹雄,孟庆林,刘继霞,等.不同向日葵品种资源对黄萎病抗性的田间鉴定.作物杂志,2014(1):67-72. CAO X,MENG Q L,LIU J X,et al.The identification of resistance of different sunflower varieties to sunflower Verticilium wilt in fields.Crops,2014(1):67-72.(in Chinese with English abstract)
[8]王顺党.茄子黄萎病综合防治技术探讨.蔬菜,2009(7):20-21. WANG S D.Study on integrated control technique of eggplant Verticillium wilt.Vegetables,2009(7):20-21.(in Chinese)
[9]刘海洋,王伟,张仁福,等.新疆主要棉区棉花黄萎病发生概况.植物保护学报,2015,41(3):138-142. LIU H Y,WANG W,ZHANG R F,et al.Occurrence overviews of cotton Verticillium wilt in Xinjiang.Plant Protection,2015,41(3): 138-142.(in Chinese with English abstract)
[10]BHAT R G,SUBBARAO K V.Host range specificity in Verticillium dahliae.Phytopathology,1999,89(12):1218-1225.
[11]曹丽霞,徐利敏,云晓鹏,等.内蒙古地区向日葵主要病虫害发生现状及研究建议.内蒙古农业科技,2009(6):83-85. CAO L X,XU L M,YUN X P,et al.Occurrence of main diseases and pests on sunflower in Inner Mongolia and some suggestion for futureresearch.InnerMongoliaAgriculturalScienceand Technology,2009(6):83-85.(in Chinese with English abstract)
[12]王玲,王淑红,何建国,等.向日葵病害发生原因与防治对策.甘肃科技,2010,26(7):162-163. WANG L,WANG S H,HE J G,et al.Occurrence reasons and control strategies of sunflower diseases.Gansu Science and Technology,2010,26(7):162-163.(in Chinese)
[13]RESENDE M L V,FLOOD J,COOPER R M.Host specialization of Verticillium dahliae,with emphasis on isolates from cocoa (Theobroma cacao).Plant Pathology,1994,43(1):104-111.
[14]GORDON T R,KIRKPATRICK S C,HANSEN J,et al. Response of strawberry genotypes to inoculation with isolates of Verticillium dahliae differing in host origin.Plant Pathology, 2006,55(6):766-769.
[15]OKOLI C A N,CARDER J H,BARBARA D J.Restriction fragment length polymorphisms(RFLPs)and the relationships of somehost-adaptedisolatesofVerticilliumdahliae.Plant Pathology,1994,43(1):33-40.
[16]CORRELL J C,GORDON T R,MCCAIN A H.Vegetative compatibilityandpathogenicityofVerticilliumalboatrum. Phytopathology,1988,78(8):1017-1021.
[17]USAMI T,ITOH M,MORII S,et al.Involvement of two different types of Verticillium dahliae in lettuce wilt in Ibaraki Prefecture, Japan.Journal of General Plant Pathology,2012,78(5):348-352.
[18]SCHAIBLE L,CANNON O S,WADDOUPS V.Inheritance of resistance to Verticillium wilt in a tomato cross.Phytopathology, 1951,41(11):986-990.
[19]GURUNG S,SHORT D P,ATALLAH Z K,et al.Clonal expansion of Verticillium dahliae in lettuce.Phytopathology, 2014,104(6):641-649.
[20]VALLAD G E,QIN Q M,GRUBE R,et al.Characterization of race-specific interactions among isolates of Verticillium dahliae pathogenic on lettuce.Phytopathology,2006,96(12):1380-1387.
[21]HAYES R J,MARUTHACHALAM K,VALLAD G E,et al. Selection for resistance to Verticillium wilt caused by race 2 isolates of Verticillium dahliae in accessions of lettuce(Lactuca sativa L.).HortScience,2011,46(2):201-206.
[22]METZENBERG R L,GLASS N L.Mating type and mating strategies in Neurospora.BioEssays,1990,12(2):53-59.
[23]TURGEON B G,YODER O C.Proposed nomenclature for mating type genes of filamentous ascomycetes.Fungal Genetics and Biology,2000,31(1):1-5.
[24]DE JONGE R,VAN ESSE H P,MARUTHACHALAM K,et al. Tomato immune receptor Ve1 recognizes effector of multiple fungal pathogens uncovered by genome and RNA sequencing. Proceedings of the National Academy of Sciences of the USA,2012, 109(13):5110-5115.
[25]USAMI T,ITOH M,AMEMIYA Y.Asexual fungus Verticillium dahliae is potentially heterothallic.Journal of General Plant Pathology,2009,75(6):422-427.
[26]ATALLAH Z K,MARUTHACHALAM K,DU TOIT L,et al. Population analyses of the vascular plant pathogen Verticillium dahliae detect recombination and transcontinental gene flow. Fungal Genetics and Biology,2010,47(5):416-422.
[27]STEWARTT C N J,VIA L E.A rapid CTAB DNA isolation technique useful for RAPD fingerprinting and other PCR applications.Biotechniques,1993,14(5):748-750.
[28]石磊岩,王波,文学.我国棉花黄萎病菌类型分化及培养特性研究.植物保护学报,1993,20(3):247-252. SHI L Y,WANG B,WEN X.Study on the type differentiation and cultural characteristics of cotton Verticillium wilt in China. Acta Phytophylacica Sinica,1993,20(3):247-252.(in Chinese with English abstract)
[29]FLOOD J,ISAAC L,MILTON J M.Reactions of some cultivars of lucerne to various isolates of Verticillium alboatrum.Plant Pathology,1978,27(4):166-169.
[30]任杰,张贵,曹雄,等.向日葵黄萎病菌不同培养型产毒能力和致病力分化.中国油料作物学报,2014,36(3):393-397. REN J,ZHANG G,CAO X,et al.Crude toxin production ability andpathogenicitydifferentiationonsunflowerVerticillium dahliae.Chinese Journal of Oil Crop Sciences,2014,36(3):393-397.(in Chinese with English abstract)
[31]CHANG R J,EASTBURN D M.Host range of Verticillium dahliae from horseradish and pathogenicity of strains.Plant Disease,1994,78(5):503-506.
[32]GOUD J C,TERMORSHUIZEN A J.Pathogenicity and virulence of the two Dutch VCGs of Verticillium dahliae to woody ornamentals.European Journal of Plant Pathology,2002,108(8): 771-782.
[33]SCHNATHORSTWC,MATHREDE.Hostrangeand differentiation of a severe form of Verticillium alboatrum in cotton.Phytopathology,1966,56(10):1155-1161.
[34]ALKHER H,HADRAMI A E,RASHID K Y,et al.CrosspathogenicityofVerticilliumdahliaebetweenpotatoand sunflower.European Journal of Plant Pathology,2009,124(3): 505-519.
[35]KOROLEV N,PEREZ-ARTES E,MERCADO-BLANCO J,et al. Vegetative compatibility of cotton-defoliating Verticillium dahliae in Israel and its pathogenicity to various crop plants.European Journal of Plant Pathology,2008,122(4):603-617.
Cross pathogenicity of Verticillium spp.isolated from different hosts.
Journal of Zhejiang University (Agric.&Life Sci.),2017,43(4):483-492
ZHANG Yuanyuan1,ZHANG Gui1,ZHANG Jian1,ZHANG Guang2,ZHOU Hongyou1,ZHAO Jun1*(1.College of Agronomy, Inner Mongolia Agricultural University,Hohhot 010018,China;2.Wulateqianqi Agricultural Department,Wulateqianqi 014400,Inner Mongolia,China)
Verticillium spp.;cross pathogenicity;race type;mating type
S 432.44
A
10.3785/j.issn.1008-9209.2016.09.281
国家向日葵产业技术体系项目(CARS-16);国家公益性行业(农业)科研专项(201103016)。
赵君(http://orcid.org/0000-0001-7207-9289),E-mail:zhaojun@imau.edu.cn
(First author):张园园(http://orcid.org/0000-0003-4656-2001),E-mail:1092403865@qq.com
2016-09-28;接受日期(Accepted):2016-12-16
