羟基红花黄色素A在结直肠癌发生发展中的影响及其机制*
2017-09-11熊慧生巫桁锞
文 军 熊慧生 巫桁锞 蒋 参 王 维
(重庆市肿瘤研究所,重庆市肿瘤医院,重庆市癌症中心,重庆 400030)
羟基红花黄色素A在结直肠癌发生发展中的影响及其机制*
文 军 熊慧生 巫桁锞 蒋 参 王 维△
(重庆市肿瘤研究所,重庆市肿瘤医院,重庆市癌症中心,重庆 400030)
目的 观察羟基红花黄色素A(HSYA)对结直肠癌细胞增殖、侵袭、迁移和凋亡的影响及其分子机制。方法 采用HSYA低、中、高剂量作用于HT-29细胞,在24 h、48 h、72 h用MTT法检测细胞抑制率,Transwell实验分析HT-29细胞迁移和侵袭情况,流式细胞术分析HSYA对HT-29细胞凋亡及周期分布的影响;免疫印迹法 (western blot)检测E-cad、Vi、FN、TGF-β、Smad2和α-SMA蛋白的表达水平。结果 HSYA作用于HT-29细胞后,HT-29细胞体外增殖均受到抑制(均P<0.05),其抑制细胞增殖的效果与HSYA的浓度和作用时间有关。HSYA明显抑制HT-29细胞的侵袭和转移(均P<0.05),同时HT-29细胞凋亡率也均增高(均P<0.05),表现为G0/G1期细胞比例增加(均P<0.05),S期细胞比例降低(均P<0.05)。HSYA能够通过增加E-cad蛋白表达(均P<0.05)和减少Vi和FN蛋白表达(均P<0.05)抑制HT-29细胞上皮间质化(EMT)过程的影响。随着HSYA的浓度升高,TGF-β、Smad2和α-SMA蛋白表达均下降(均P<0.05)。结论 HSYA能够抑制结直肠癌细胞增殖、侵袭、迁移、EMT和促进结直肠癌细胞凋亡,其机制可能与抑制TGF-β信号通路激活有关,HSYA可能成为结直肠癌的治疗靶点。
羟基红花黄色素A HT-29细胞 增殖 细胞周期 凋亡 TGF-β
结直肠癌(CRC)是全球常见的恶性肿瘤之一,是癌症死亡的主要病因之一[1]。尽管诊疗技术不断提高,但CRC转移性强、复发率高等特点,导致其生存率仍较低,其发病机制尚不清楚。临床上主要采用抗血管生成和抗表皮生长因子受体联合靶向治疗的方案,但效果欠佳。因此,癌症细胞生长和转移的分子基础受到了广泛的关注[2]。中草药红花作为传统草药,被用于治疗心脑血管疾病、骨质疏松症和妇科疾病等[3-4]。目前已分离并鉴定出100余种成分,羟基红花黄色素A(HSYA)是其主要活性成分,具有活血化瘀的功效,在抗氧化、抗炎症反应和抗肿瘤活性等方面效果较好[5-6]。研究发现,在肝细胞癌和胃腺癌中,HSY可以抑制肿瘤血管的生成而抑制肿瘤的侵袭和转移[7]。但是HSYA在结直肠癌中的研究尚不明确。本实验通过采用HSYA低、中、高剂量作用于HT-29细胞,旨在探讨HSYA对CRC细胞增殖、侵袭、迁移和凋亡的影响及其分子机制,为临床采用HSYA治疗CRC提供一定的理论依据。现报告如下。
1 材料与方法
1.1 试剂与仪器 HSYA由北京市心肺血管疾病研究所提供,纯度为98.9%;DMEM:F12细胞培养基和E-cad、Vi、FN、TGFβ、Smad2、α-SMA单抗购自 Sigma公司;Transwell小室购自Chemicon公司;基质胶购自BD公司;碘化丙啶、链霉素、青霉素、BCA蛋白蛋白定量试剂盒、蛋白提取试剂盒、Annexin V-FITC/PI双染法细胞凋亡试剂盒和MTT试剂盒购自江苏碧云天生物技术研究所。CO2培养箱(SANYO),超净工作台(苏州净化设备公司),酶标测定仪(BIO-RAD),倒置相差显微镜(NIKON),恒温烤箱(格兰仕),台式低速离心机(北京医用离心机厂),分析天平(BOSCH),低温高速离心机(HITACHI),24孔及96孔培养板(Cellstar),低温冰箱(SANYO),流式细胞仪(COWTER),细胞培养瓶(GLOSTAR),转移槽(Bio-Rad),摇床(武汉医疗仪器厂),蛋白电泳槽(Bio-Rad),凝胶成像仪(Bio-Rad)。
1.2 细胞培养及分组 HT-29细胞购自中国科学院上海细胞生物研究所,在含有10%FBS的DMEM:F12细胞培养基中培养,培养箱为37℃、5%CO2、饱和湿度,根据细胞生长情况1~2 d进行换液或传代。将HT-29细胞分为实验组和对照组,实验组分为HSYA低(0.2 μg/mL)、中(2 μg/mL)和高剂量组(20 μg/mL),空白对照组采用等量生理盐水。每组总有5个副孔。
1.3 MTT法检测细胞增殖抑制率 取对数生长期的HT-29细胞,以1×105个密度接种到96孔板中,加入培养基后各组细胞继续分别培养24 h、48 h、72 h后入MTT 20 μL,然后再培养4 h后停止培养,弃去上清,在每孔中加入150 μL DMSO后进行震荡,使得结晶被溶解。在570 nm波长下用酶联免疫监测仪测量吸光度(OD)值。其中细胞增殖抑制率=(对照组OD值-实验组OD值)/对照组OD值×100%[8]。
1.4 Transwell实验检测细胞迁移和侵袭 各组细胞培养48 h后,以1×105个/孔接种于24孔板Transwell中,每组设置5个复孔,并在上室加入200 μL DMEM:F12培养基,下室加入600 μL DMEM:F12培养基,在37℃细胞培养箱中培养48 h后取出上室,并吸取下室中培养液,加入结晶紫染色液100 μL/孔,染色10 min,PBS洗涤2遍,400倍显微镜下选取5个视野观察细胞并计算平均值。在侵袭分析中,小室以基质膜包被,后续步骤同迁移分析。
1.5 流式法检测细胞周期及凋亡 各组细胞培养48 h后并进行收集,0.01 mol/L PBS 0.5 mL重悬细胞,加70%乙醇1 mL,-20℃固定24 h,加入PI(终浓度为50 μg/mL)和RNA酶 (终浓度为0.25 mg/mL),室温下避光孵育30 min后,采用流式细胞仪检测,ModFit LT软件分析并计算各时相细胞的百分比。500 μL的PBS重悬细胞,然后加入Annexin V-FITC/PI避光孵育15 min,再加入PI 5 min,使用流式细胞仪检测细胞凋亡率。
1.6 Westrn blot法检测E-cad、Vi、FN、TGFβ、Smad2、α-SMA蛋白表达 各组细胞培养48 h后并进行收集,采用PBS进行漂洗2次,然后经裂解和离心,收集上清液,即为细胞总蛋白,再调节每份样品的蛋白浓度,在上样缓冲液中加入等量的蛋白,进行煮沸,在SDS聚丙烯酰胺凝胶中进行电泳,然后电转至PVDF膜,封闭液室温封闭3 h,分别E-cad、Vi、FN、TGFβ、Smad2、α-SMA和GAPDH一抗4℃过夜,HRP标记二抗,室温孵育2 h,ECL发光剂发光。图片经吸光度图像扫描仪扫描,采用Image J软件对条带进行灰度值的分析。结果以GAPDH作内参,采用相对于正常组蛋白表达量的倍数表示。
1.7 统计学处理 应用SPSS20.0统计软件。计量资料以(±s)表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 HSYA对HT-29细胞增殖抑制的影响 见表1。结果示,采用低、中、高3个浓度的HSYA分别作用于体外培养的HT-29细胞24、48、72 h,观察其细胞增殖抑制率情况。随着培养时间增加,HT-29细胞增殖抑制率也增加,HSYA低、中、高剂量组作用HT-29细胞时间为48 h与24 h比较,其抑制率均明显增加(均P<0.05),作用HT-29细胞时间为48 h与72 h比较,其抑制率均差别不大(均P>0.05)。随着HSYA浓度增加,HT-29细胞增殖抑制率也增加,HSYA中、高剂量组对HT-29细胞增殖抑制率均高于HSYA低剂量组(均P<0.05),同时HSYA高剂量组对HT-29细胞增殖抑制率高于HSYA中剂量组(P<0.05)。
表1 MTT法检测HSYA对HT-29细胞增殖抑制的影响(%,±s)
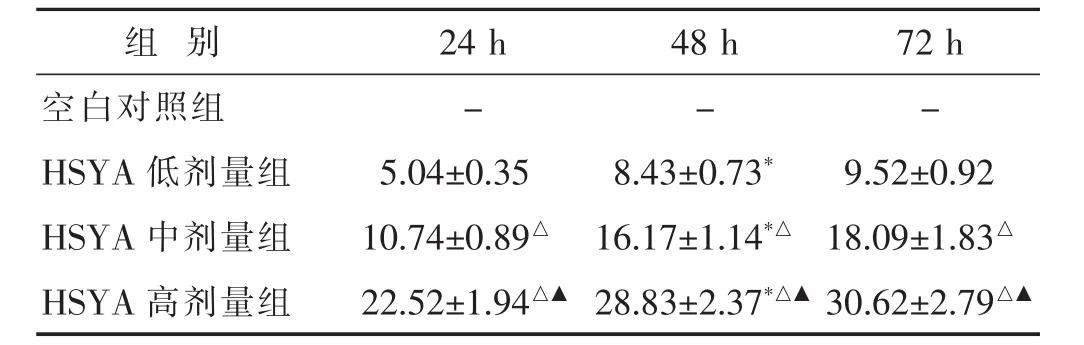
表1 MTT法检测HSYA对HT-29细胞增殖抑制的影响(%,±s)
与本组24 h比较,*P<0.05;与HSYA低剂量组比较,△P<0.05;与HSYA中剂量组比较,▲P<0.05。
组别24 h 48 h 72 h空白对照组-HSYA低剂量组 9.52±0.92 HSYA中剂量组 18.09±1.83△--5.04±0.35 8.43±0.73*10.74±0.89△16.17±1.14*△HSYA高剂量组 30.62±2.79△▲22.52±1.94△▲28.83±2.37*△▲
2.2 HSYA对HT-29细胞侵袭和转移的影响 见表2。结果示,在不同浓度HSYA作用于HT-29细胞48 h后,HSYA低、中、高剂量组中侵袭和迁移细胞数均低于空白对照组(均P<0.05),HSYA中、高剂量组中侵袭和迁移细胞数均低于HSYA低剂量组(均P<0.05),同时HSYA高剂量组中侵袭和迁移细胞数均低于HSYA中剂量组(均P<0.05)。
表2 HSYA对HT-29细胞侵袭和转移的影响(±s)

表2 HSYA对HT-29细胞侵袭和转移的影响(±s)
与空白对照组比较,*P<0.05;与HSYA低剂量组比较,△P<0.05;与HSYA中剂量组比较,▲P<0.05。下同。
组别 侵袭细胞数 迁移细胞数空白对照组HSYA低剂量组HSYA中剂量组197±17 236±21 153±14*182±16*121±11*△146±12*△HSYA高剂量组85±7*△▲113±10*△▲
2.3 HSYA对HT-29细胞周期分布和凋亡率的影响见表 3。结果示,空白对照细胞凋亡率很低(2.16± 0.23)%,采用HSYA干预48 h后,细胞凋亡率则明显升高,与空白对照组比较,HSYA低、中、高剂量组中细胞凋亡率高于空白对照组 (均P<0.05),HSYA中、高剂量组中细胞凋亡率均高于HSYA低剂量组 (均P<0.05),同时HSYA高剂量组中细胞凋亡率高于HSYA中剂量组(P<0.05)。细胞周期分析结果示,HSYA能够增加G0/G1期细胞比例,减少S期细胞比例,与空白对照组比较,HSYA低、中、高剂量组中G0/G1期细胞比例增加 (均P<0.05),S期细胞比例降低 (均P<0.05);HSYA中、高剂量组中G0/G1期细胞比例均高于HSYA低剂量组(均P<0.05),S期细胞比例均低于HSYA低剂量组(均P<0.05);同时HSYA高剂量组中G0/G1期细胞比例高于HSYA中剂量组 (P<0.05),S期细胞比例低于HSYA中剂量组(P<0.05)。
表3 HSYA对HT-29细胞周期分布和凋亡率的影响(±s)

表3 HSYA对HT-29细胞周期分布和凋亡率的影响(±s)
组别G0/G1期 S期G2/M期 凋亡率空白对照组HSYA低剂量组HSYA中剂量组34.05±2.84 56.08±4.26 47.83±3.26*35.13±2.72*53.28±4.63*△27.18±2.08*△7.38±1.24 2.16±0.23 6.84±0.95 8.17±0.62*7.11±1.17 15.42±1.37*△HSYA高剂量组60.31±5.25*△▲21.56±1.74*△▲6.74±0.92△▲28.48±2.29*△▲
2.4 HSYA对HT-29细胞EMT过程的影响 见表4和图1。结果示,与空白对照组比较,HSYA低、中、高剂量组中E-cad蛋白的表达增加 (均P<0.05),Vi和FN蛋白的表达均降低(均P<0.05);与HSYA低剂量组比较,HSYA中、高剂量组中E-cad蛋白的表达均增加(均P<0.05),Vi和FN蛋白的表达均降低(均P<0.05);同时HSYA高剂量组E-cad蛋白高于HSYA中剂量组(P<0.05),Vi和FN蛋白低于HSYA中剂量组(P<0.05)。
表4 HSYA对HT-29细胞EMT过程的影响(±s)

表4 HSYA对HT-29细胞EMT过程的影响(±s)
组别E-cad Vi FN空白对照组 0.962±0.091 HSYA低剂量组 0.625±0.057*HSYA中剂量组 0.417±0.035*△0.986±0.093 0.954±0.089 1.250±0.108*0.739±0.061*1.437±0.126*△0.532±0.046*△HSYA高剂量组 0.304±0.024*△▲1.582±0.135*△▲0.408±0.038*△▲

图1 HSYA对E-cad、Vi和FN蛋白表达的影响
2.5 HSYA对HT-29细胞中TGFβ、Smad2和α-SMA蛋白表达的影响 见表5和图2。结果示,与空白对照组比较,HSYA低、中、高剂量组中TGFβ、Smad2和α-SMA蛋白的表达均降低(均P<0.05),与HSYA低剂量组比较,HSYA中、高剂量组中TGFβ、Smad2和α-SMA蛋白的表达均降低(均P<0.05);同时HSYA高剂量组TGFβ、Smad2和α-SMA蛋白低于HSYA中剂量组(P<0.05)。
表5 HSYA对HT-29细胞中TGFβ、Smad2和α-SMA蛋白表达的影响(±s)
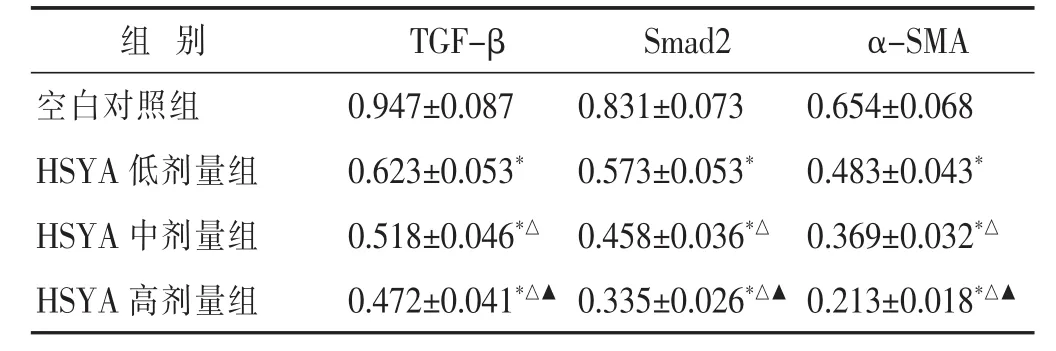
表5 HSYA对HT-29细胞中TGFβ、Smad2和α-SMA蛋白表达的影响(±s)
组别TGF-β Smad2α-SMA空白对照组 0.654±0.068 HSYA低剂量组 0.483±0.043*HSYA中剂量组 0.369±0.032*△0.947±0.087 0.831±0.073 0.623±0.053*0.573±0.053*0.518±0.046*△0.458±0.036*△HSYA高剂量组 0.213±0.018*△▲0.472±0.041*△▲0.335±0.026*△▲
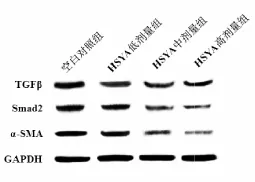
图2 HSYA对TGFβ、Smad2和α-SMA蛋白表达的影响
3 讨 论
CRC是世界三大恶性肿瘤之一,其5年生存率不足40%,给患者家庭和社会以沉重的经济负担和压力[9-10]。随着中医药学的不断发展和进步,在肿瘤的治疗方面取得了较大的进展。HSYA参与细胞生长和分化,与癌细胞粘附、侵袭和迁移及肿瘤血管生成密切相关[11]。研究发现,HSYA可以抑制肿瘤的活性[12],然而HSYA在CRC中的作用及其机制尚不明确,对此本研究通过不同浓度HSYA处理HT-29细胞,分析HSYA对CRC细胞增殖、侵袭、迁移和凋亡的影响。
本研究中采用HSYA低(0.2 μg/mL)、中(2 μg/mL)和高剂量组 (20 μg/mL)3个浓度处理HT-29细胞24 h、48 h、72 h,MTT结果显示,随着培养时间增加,HT-29细胞增殖抑制率也增加,HSYA低、中、高剂量组作用HT-29细胞时间为48 h与24 h比较,其抑制率均增加,随着HSYA浓度增加,HT-29细胞增殖抑制率也增加,HSYA中、高剂量组对HT-29细胞增殖抑制率高于HSYA低剂量组。这说明HSYA抑制细胞增殖的效果与其浓度和作用时间有关。为进一步分析HSYA对HT-29细胞侵袭和转移的影响,在不同浓度HSYA作用于HT-29细胞48 h后,HSYA低、中、高剂量组中侵袭和迁移细胞数均低于空白对照组,这体现HSYA不仅能够抑制HT-29细胞增殖,还能够抑制HT-29细胞侵袭和转移过程。这一结果和之前研究HSYA对胃癌发生发展影响结果接近[12]。
在观察HSYA对HT-29细胞周期分布和凋亡率的影响干预中,空白对照细胞凋亡率很低(2.16±0.23)%,采用HSYA干预48 h后,细胞凋亡率则升高,与空白对照组比较,HSYA低、中、高剂量组中细胞凋亡率均高于空白对照组,G0/G1期细胞比例明显增加,S期细胞比例明显降低。这说明HSYA能够通过阻滞HT-29细胞停于G0/G1期比例增高,减少S期细胞比例,从而诱导细胞凋亡。这一结果和HSYA对其它肿瘤作用结果接近[6,13]。肿瘤细胞的重要特点是细胞凋亡受阻和细胞增殖加快,多种抗肿瘤药物就是通过促进肿瘤凋亡和延缓细胞增殖发挥作用。这一点也正好说明HSYA可能成为CRC治疗的潜在靶点。
上皮间质转化(EMT)是指在细胞外基质微环境发生改变时,上皮细胞向间质细胞分化的过程,参与肿瘤的侵袭和转移[14]。上皮细胞通过细胞间粘附而紧密连接,可以阻止细胞迁移;间质细胞缺乏稳定的细胞间连接,使细胞具有运动和迁移。EMT使肿瘤细胞摆脱细胞间的连接,更易于侵袭和转移。E-cadherin蛋白具有维持细胞间连接稳定性的作用,是上皮细胞的特征性蛋白,下调E-cadherin蛋白,上皮细胞间的粘附功能丧失,促进EMT的发生;Vimentin是间质细胞的特征性表型蛋白,肿瘤发生EMT,会上调Vimentin蛋白,促进上皮细胞与间质粘附,加强细胞运动[15]。在本研究中探讨了HSYA对HT-29细胞EMT过程的影响,结果示与空白对照组比较,HSYA低、中、高剂量组中E-cad蛋白的表达增加,而Vi和FN蛋白表达降低,说明HSYA可减少CRC的EMT过程,延缓肿瘤进展。
TGF-β具有促进血管生成的作用,参与EMT过程,从而促进肿瘤的侵袭[16]。EMT使肿瘤从原发部位转移到血液循环,TGF-β1作为调节细胞外基质形成和细胞生成的细胞因子之一,表达增强促进EMT的发生。研究表明上调TGF-β促进血管侵袭与转移,与加快肿瘤的恶性程度,使患者的生存时间变短[17]。本研究结果示HSYA低、中、高剂量组中TGFβ、Smad2和α-SMA蛋白的表达均降低,这体现HSYA通过抑制TGF-β信号转导,抑制肿瘤的转移。TGF-β主要通过下游Smads家族传递信号[18]。TβRII是具有丝氨酸/苏氨酸激酶结构域的蛋白,在上皮细胞膜与TGF-β1紧密结合,使信号传导蛋白Smad2磷酸化,Smad2与Smad4结合并转运到细胞核,参与EMT相关基因的激活。因此,TGF-β/Smad信号通路是EMT过程中的重要信号通路,在CRC转移过程中至关重要。
综上所述,HSYA能够抑制结直肠癌细胞增殖、侵袭、迁移、EMT和促进结直肠癌细胞凋亡,其机制可能与抑制TGFβ信号通路激活有关,HSYA可能成为结直肠癌的治疗靶点。
[1] Cho T,Shiozawa E,Urushibara F,et al.The role of microvessel density,lymph node metastasis,and tumor size as prognostic factors of distant metastasis in colorectal cancer[J]. Oncol Lett,2017,13(6):4327-4333.
[2] Prieur A,Cappellini M,Habif G,et al.Targeting the Wnt pathway and cancer stem cells with anti-progastrin humanized antibodies:a major breakthrough for K-RAS mutated colorectalcancertreatment[J].Clin CancerRes,2017(16):428-430.
[3] Han D,Wei J,Zhang R,et al.Hydroxysafflor yellow A alleviates myocardial ischemia/reperfusion in hyperlipidemic animals through the suppression of TLR4 signaling[J].Sci Rep,2016(6):35319.
[4] Wang X,Ma Z,Fu Z,et al.Hydroxysafflor yellow A protects neurons from excitotoxic death through inhibition of NMDARs[J].ASN Neuro,2016,8(2):180-188.
[5] Chen M,Wang M,Yang Q,et al.Antioxidant effects of hydroxysafflor yellow A and acetyl-11-keto-beta-boswellic acid in combination on isoproterenol-induced myocardial injury in rats[J].Int J Mol Med,2016,37(6):1501-1510.
[6] Yang F,Li J,Zhu J,et al.Hydroxysafflor yellow A inhibits angiogenesis of hepatocellular carcinoma via blocking ERK/ MAPK and NF-kappaB signaling pathway in H22 tumorbearing mice[J].Eur J Pharmacol,2015(754):105-114.
[7] Xi SY,Zhang Q,Liu CY,et al.Effects of hydroxy safflower yellow-A on tumor capillary angiogenesis in transplanted human gastric adenocarcinoma BGC-823 tumors in nude mice[J].J Tradit Chin Med,2012,32(2):243-248.
[8] Van Meerloo J,Kaspers G J,Cloos J.Cell sensitivity assays:the MTT assay[J].Methods Mol Biol,2011,731:237-245.
[9] Hernandez-Arranz S,Sanchez-Hevia D,Rojo F,et al.Effect of Crc and Hfq proteins on the transcription,processing,and stability of the pseudomonas putida CrcZ sRNA[J].RNA,2016,22(12):1902-1917.
[10]Liu YP,Zhu HF,Liu DL,et al.DcR3 induces epithelial-mesenchymal transition through activation of the TGF-beta3/ SMADsignalingpathwayinCRC[J].Oncotarget,2016,7(47):77306-77318.
[11]Pei J P,Fan L H,Nan K,et al.HSYA alleviates secondary neuronal death through attenuating oxidative stress,inflammatory response,and neural apoptosis in SD rat spinal cord compression injury[J].J Neuroinflammation,2017,14(1):97.
[12]奚胜艳,张前,刘朝阳,等.羟基红花黄色素A对裸鼠人胃腺癌BGC-823移植瘤抑制作用的研究[J].北京中医药大学学报,2009,32(05):331-335.
[13]张静宇,杨芳芳,李京敏,等.羟基红花黄色素A抑制H22小鼠肝癌移植瘤血管生成及减少MMP-3的表达[J].基础医学与临床,2017,37(1):71-75.
[14]Yu L,Zhang Y,Zhang H,et al.SOCS3 overexpression inhibits advanced glycation end product-induced EMT in proximal tubule epithelial cells[J].Exp Ther Med,2017,13(6):3109-3115.
[15]Mahmood MQ,Ward C,Muller HK,et al.Epithelial mesenchymal transition (EMT)and non-small cell lung cancer(NSCLC):a mutual association with airway disease[J].Med Oncol,2017,34(3):45.
[16]Zinski J,Tajer B,Mullins MC.TGF-beta family signaling in early vertebrate development[J].Cold Spring Harb Perspect Biol,2017(15):38-39.
[17]Zhu L,Fu X,Chen X,et al.M2 macrophages induce EMT through the TGF-beta/Smad2 signaling pathway[J].Cell Biol Int,2017(128):88-80.
[18]Chu H,Shi Y,Jiang S,et al.Treatment effects of the traditional Chinese medicine Shenks in bleomycin-induced lung fibrosis through regulation of TGF-beta/Smad3 signaling and oxidative stress[J].Sci Rep,2017,7(1):2252.
Effects of Hydroxysafflor Yellow A on the Development and Progression in Colorectal Cancer and Its Mechanism
WEN Jun.Chongqing Cancer Institute/Hospital/Cancer Center,Chongqing 400030,China.
Objective:To study the effects of hydroxysafflor yellow A(HSYA)on the proliferation,invasion,migration and apoptosis in colorectal cancer cell and its mechanism.Methods:The low,middle and high dose HSYA were applied to treat HT-29 cells.The MTT assay was used to observe the inhibiting effects of HSYA on the cell proliferation at 24 h,48 h and 72 h.Transwell experiment was used to investigate the migration and invasion in HT-29 cells.The flow cytometry(FCM)was adopted to investigate the influence of HSYA on the HT-29 cells apoptosis and cell cycle.Western blot was used to measure the expression level of E-cad,Vi,FN,TGF-β,Smad2 and α-SMA in cells.Results:After HT-29 cells were disposed by HSYA,significantly inhibiting effects on the proliferation of HT-29 cell were observed(all P<0.05).The effect was correlated with the density and action time of HSYA.HSYA could significantly inhibit the migration and invasion in HT-29 cells(all P<0.05),induce the apoptosis of HT-29 cell(all P<0.05)and change cell cycle which showed mainly the percentage of HT-29 cell increased in stage G0/G1(all P<0.05)and decreased in stage S(all P<0.05).HSYA promoted E-cad protein expression(all P<0.05)and decreased protein expression of Vi and FN(all P<0.05)to inhibit epithelial to mesenchymal transition in HT-29 cells.Moreover,with the increase of HSYA concentrations,it significantly increased the protein expression level of TGF-β,Smad2 and α-SMA(all P<0.05).Conclusions:HSYA can inhibit the proliferation,invasion,migration and EMT of colorectal cancer cell,and promote the apoptosis of colorectal cancer cells.The mechanism may be related to the inhibition of TGF-β signaling pathway activation,and HSYA may be a therapeutic target for colorectal cancer.
Hydroxysafflor yellow A;HT-29 cell;Proliferation;Cell cycle;Apoptosis;TGF-β
R285.5
A
1004-745X(2017)08-1347-05
10.3969/j.issn.1004-745X.2017.08.010
2017-06-12)
重庆市卫生和计生委中医药科技项目(zy201402144)
△通信作者(电子邮箱:wj3389479@sina.com)
