肾移植术后抗体介导排斥反应合并膜性肾病
2017-09-10李雪张明超陈劲松徐峰倪雪峰程东瑞季曙明文吉秋南京大学医学院附属金陵医院南京军区南京总医院肾脏科国家肾脏疾病临床医学研究中心全军肾脏病研究所江苏南京210016
李雪,张明超,陈劲松,徐峰,倪雪峰,程东瑞,季曙明,文吉秋(南京大学医学院附属金陵医院,南京军区南京总医院肾脏科,国家肾脏疾病临床医学研究中心,全军肾脏病研究所,江苏 南京 210016)
肾移植是终末期肾病的最佳治疗手段[1]。抗体介导的排斥反应(antibody mediated rejection,AMR)是影响移植肾远期预后的首要因素[2],而膜性肾病(membranous nephropathy,MN)是移植后最常见的肾小球肾炎之一,可分为复发的MN和新发的MN[3]。肾移植术后AMR合并膜性肾病在临床上并非罕见。AMR与MN关系密切,对于复发的MN,AMR可能会加快疾病的进程,降低移植肾的存活时间[4];而对于新发的MN,AMR可能是其原因之一,参与疾病的发生与发展[5-6]。目前,国内尚缺乏AMR合并MN的相关报道。本研究报道了2例AMR合并MN的临床及病理资料,对AMR与MN的不同类型进行分析。
1 对象和方法
1.1 研究对象:南京军区南京总医院国家肾脏疾病临床医学中心诊断为AMR合并MN 2例患者。AMR的诊断主要根据Banff 2013标准[7],包括血清中存在供者特异性抗体(donor-specific antibody,DSA)、DSA与血管内皮之间的相互作用、最终导致组织损伤;MN的诊断主要根据移植肾组织光镜、免疫荧光和电镜的结果。
1.2 研究方法:观察患者的一般情况如性别、年龄、肾脏病病程,包括原发病发展至终末期肾脏病(end stage renal disease,ESRD)的病程。
实验室检查及定义24小时尿蛋白定量采用双缩脲法 (正常<0.4 g/24 h)。肾功能不全: 血肌酐>109.62 μmol/L。
1.2.1 肾脏组织病理检查:所有患者均在B超引导下行经皮肾穿刺活检术。肾穿刺方法采用斜角进针负压吸引法。所取肾组织分别送光镜、免疫病理检查。光镜用石蜡切片行HE、PAS、PASM、Masson三色染色。观察项目包括小管炎、小球炎、管周毛细血管炎和动脉内膜炎等,肾间质纤维化、肾小管萎缩、内膜纤维性增厚作为慢性损伤的标志。所有损伤的分级依照 Banff 2007[8]。
1.2.2 免疫荧光:应用冰冻组织切片行IgG、IgA、IgM、C3、C4、C4d染色和血清抗磷酸酯酶A2受体(serum anti-phospholipase A2 receptor, PLA2R)染色,并对IgG亚型染色(IgG1、IgG2、IgG3、IgG4)。C4d沉积范围量化评分依照Banff 2007[8]。
1.2.3 免疫组化:应用免疫组化法行肾组织CD4,CD8, CD20, CD68, 人类白细胞抗原 -DR(human leukocyte antigen-DR, HLA-DR)和白细胞介素-2R(interleukin-2R, IL-2R)检查。
2 研究结果
2.1 病例1临床病史:患者男性,2010年10月(19岁)因浮肿查尿蛋白++++,尿蛋白定量10.8 g/24 h,尿隐血++,行移植肾活检示膜性肾病,先后予泼尼松、环磷酰胺、来氟米特、霉酚酸酯、他克莫司、雷公藤多苷片等治疗,蛋白无改善。2012年开始行血液透析治疗。2015年7月行亲属供肾肾移植术,手术顺利,术后血肌酐恢复正常。2015年8月出现尿蛋白++。2016年1月本院查血肌酐121.11 μmol/L,尿蛋白定量0.8 g/24 h,入院行经皮移植肾活检(临床病理结果参见表1)。
2.1.1 光镜结果(图1):22个肾小球,正切体积增大,毛细血管袢开放好、僵硬,袢腔内见少量单个核细胞浸润,系膜区未见明确增宽,囊壁节段增厚。PASM-Masson:肾小球上皮侧较多嗜复红物沉积。肾小管间质轻度慢性病变伴急性病变,小灶性肾小管萎缩、基膜增厚,散在肾小管上皮细胞刷状缘脱落,间质多处浸润细胞灶性分布,以单个核细胞为主,邻近伴小管炎(<4个/切面),见管周毛细血管炎。动脉弹力层分层,小动脉节段透明变性、偶见中膜层透明变性,见炎细胞向动脉内膜贴附。
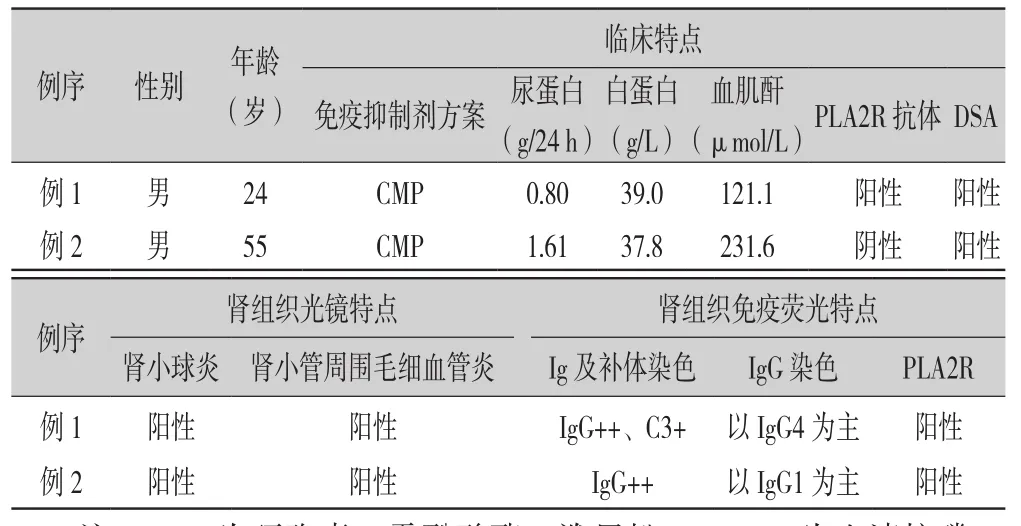
表1 2例患者临床病理特点
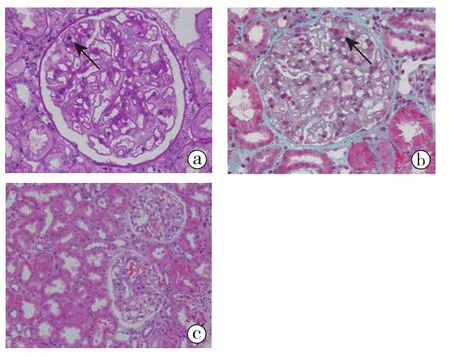
图1 病例1移植肾活检光镜a.毛细血管袢开放好、僵硬,袢腔见少量单个核细胞浸润(箭头,PAS高倍放大);b.肾小球上皮侧较多嗜复红物沉积(箭头,Masson高 倍 放 大 );c.间质多处浸润细胞灶性分布,见管周毛细血管炎(HE高倍放大)
2.1.2 免疫荧光结果(图2):肾小球9个,其中1/9为硬化球。冰冻切片荧光染色IgG++、C3+,弥漫分布,呈颗粒状沉积于血管袢。IgM+,节段分布,呈颗粒状沉积于血管袢。IgA、C1q阴性。C4d管间毛细血管弥漫阳性。荧光染色IgG1++、IgG2+、IgG4+++,弥漫分布,呈颗粒状沉积于血管袢。IgG3阴性。肾组织切片PLA2R荧光染色阳性,弥漫呈颗粒状沉积于血管袢。
2.1.3 电镜结果(图3):电镜下观察1个肾小球。肾小球毛细血管袢开放好,节段毛细血管袢基膜上皮侧散在偏高电子密度的致密物,偶见内皮细胞成对,袢腔内见单核细胞浸润。肾小球系膜区未见明显增宽;肾小球系膜区、毛细血管袢基膜内皮下均未见电子致密物分布。肾小球毛细血管袢基膜厚约449~741 nm。肾小球足细胞足突广泛融合(80%~90%),胞浆少量微绒毛化。间质管周毛细血管内见较多炎细胞浸润。
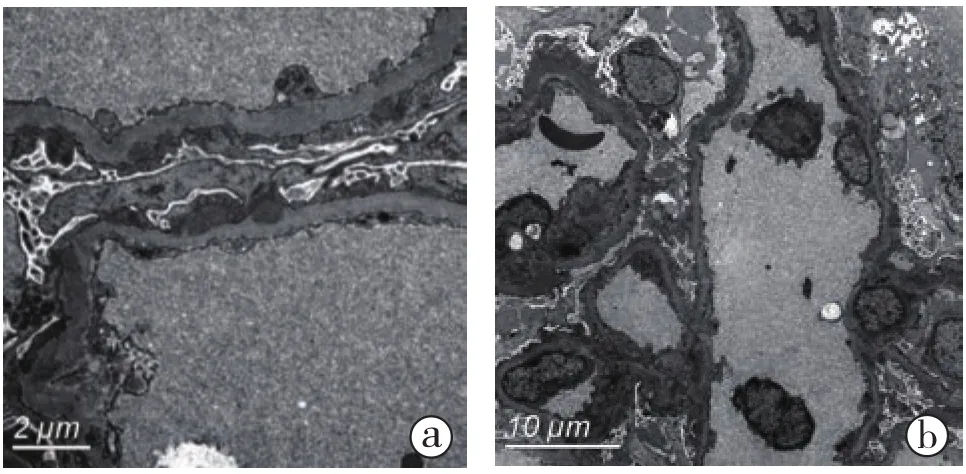
图3 病例1移植肾活检电镜 节段毛细血管袢基膜上皮侧散在偏高电子密度的致密物,肾小球足细胞足突广泛融合
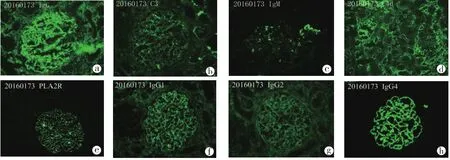
图2 病例1移植肾活检免疫荧光 IgG++、C3+,弥漫分布,呈颗粒状沉积于血管袢(a、b),IgM+,节段分布,呈颗粒状沉积于血管袢(c),C4d管间毛细血管弥漫阳性(d),PLA2R荧光染色阳性,弥漫呈颗粒状沉积于血管袢(e),IgG1+++(f)、IgG2+(g)、IgG4+++(h)弥漫分布,呈颗粒状沉积于血管袢
2.2 病例2临床病史:患者男性,2008年11月(50岁)因原发性醛固酮增多症、慢性肾功能不全(chrinic kidney disease,CKD) 5D期行肾移植术,手术顺利,术后应用霉酚酸酯、环孢素、强的松免疫抑制治疗,术后血肌酐降至正常。2013年4月出现乏力、纳差,血肌酐升高至256.36 μmol/l,尿蛋白+~++,予甲泼尼龙0.5 g qd冲击治疗3天,血肌酐降至194.48 μmol/L。2013年5月查血肌酐231.61 μmol/L,尿蛋白定量1.61 g/24 h,来本院行经皮移植肾活检。
2.2.1 光镜结果(图4):皮质、皮髓、髓质肾组织各1条。16个肾小球中1个球性废弃,1个节段硬化,硬化处袢内泡沫细胞。余肾小球系膜区增宽不明显,毛细血管袢开放好,单个核细胞浸润1~6个/球,囊壁节段增厚。PASM-Masson:肾小球未见明确嗜复红物沉积。灶性小管上皮细胞扁平,刷状缘脱落,甚至胞体脱落,裸膜形成,见细胞核增大,较多小管炎(多数>4个/切面),灶性小管萎缩,间质灶性增宽,灶性单个核细胞及浆细胞浸润,少量出血,间质纤维化。小动脉偶见透明变性,内皮细胞肿胀。
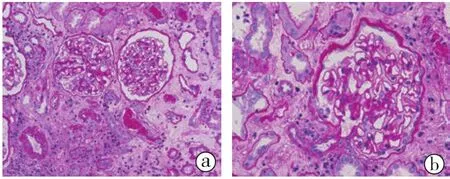
图4 病例2 移植肾活检光镜 间质多处浸润细胞灶性分布(a),肾小球腔内见单个核细胞浸润(b),PAS高倍度放大
2.2.2 免疫荧光(图5):肾小球3个。冰冻切片荧光染色IgG++,弥漫分布(IgG1++、IgG2+、IgG3+、IgG4+),呈颗粒状沉积于血管袢。IgA、IgM、C3、C1q阴性。髓质区C4d管间毛细血管弥漫阳性。
2.2.3 电镜(图6):电镜下观察1个肾小球。肾小球毛细血管袢开放好,病变主要在肾小球基膜,基膜上皮侧较多中-高电子密度的致密物沉积,致密物被钉突分隔。肾小球袢腔内偶见单核细胞浸润。肾小球系膜区轻度增宽,系膜区、基膜内皮下未见电子致密物沉积。足细胞足突融合约10%~20%,较多胞浆微绒毛化。肾小管上皮细胞见淋巴细胞浸润。管周毛细血管分层小于3层。
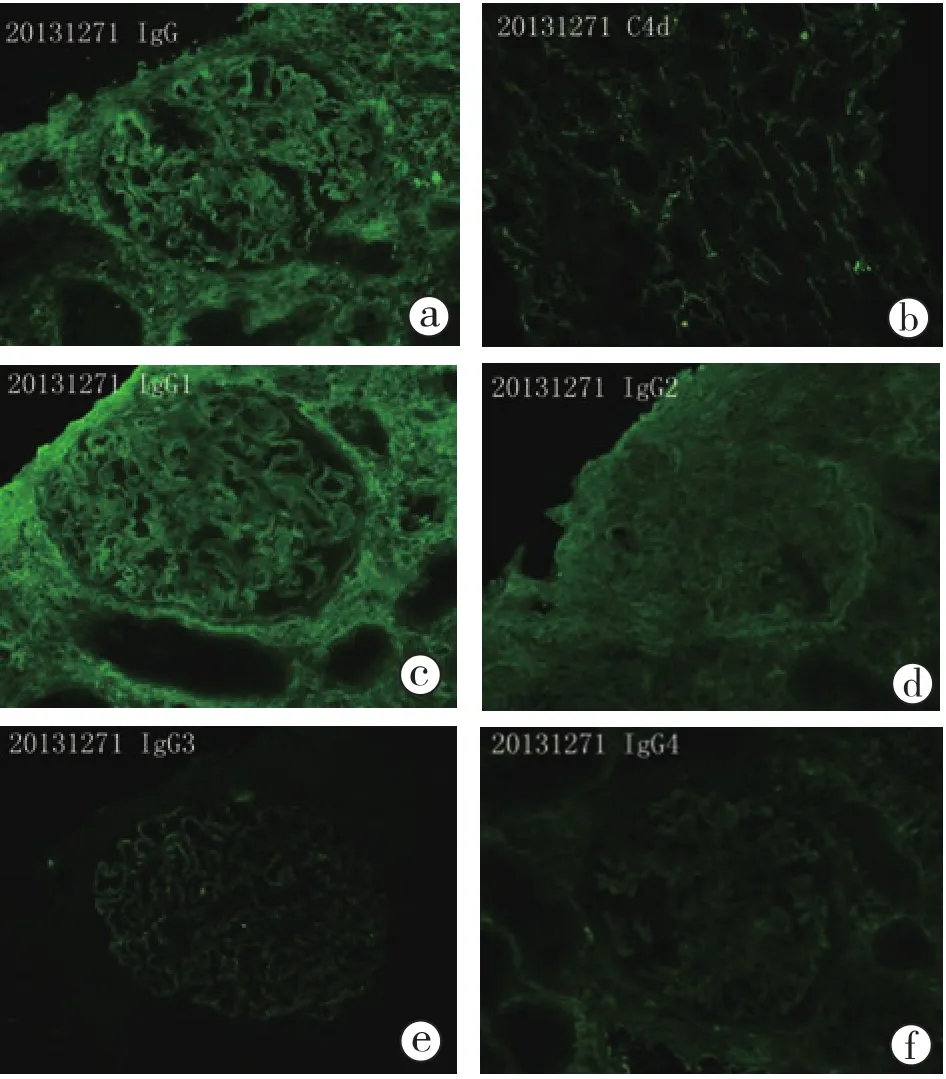
图5 病例2 移植肾活检免疫荧光 IgG+++(a~f),弥漫分布,呈颗粒状沉积于血管袢,髓质区C4d管间毛细血管弥漫阳性
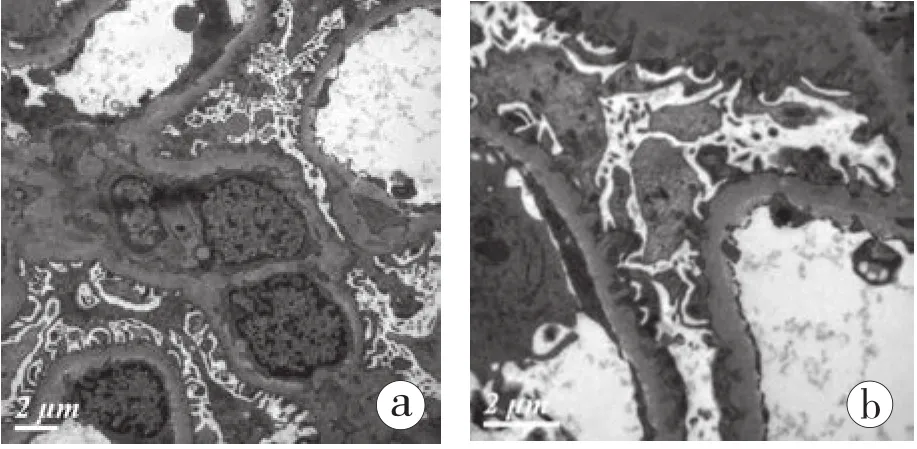
图6 移植肾活检电镜 肾小球基膜上皮侧较多中-高电子密度的致密物沉积,致密物被钉突分隔,肾小管上皮细胞见淋巴浸润,管周毛细血管分层小于3层(a、b)
3 讨 论
MN是移植后最常见的肾小球肾炎之一,常与AMR相伴随。有报道MN的复发率为33%~44%[9]。复发的MN对移植肾的影响存在很多变异,Liebl等[4]的研究表明,60%~65%的复发性MN患者在诊断4年后进入ESRD,合并AMR会严重影响MN的预后。特发性膜性肾病复发的可能机制与患者循环中的自身抗体反应(PLA2R)相关。2010年,Stahl等[10]报道1例MN复发及病情变化与PLA2R抗体有明显相关性,治疗缓解后抗体转阴,由此证实PLA2R抗体在MN复发中起重要作用。病例1原发病MN诊断明确,PLA2R阳性,可以诊断为复发性MN合并AMR。
移植后新发MN的原因仍不明确。但目前多项研究表明,过度的抗原暴露和并发的抗原-抗体反应可能是新发MN的病因之一。细菌或病毒感染是导致MN的重要原因,早期散在的病例报道认为肾移植术后新发MN与肾移植后肝炎有关,包括丙型肝炎和乙型肝炎病毒感染[11-14]。移植后新发MN的发病机制可能不同于复发MN的PLA2R途径,而可能更多地与发生于足细胞的同种异体免疫反应相关。El Kossi等[15]报道了1例移植后新发的MN,其蛋白尿水平与DSA水平相关,说明DSA可能参与了移植后新发MN的发生和发展。
目前认为B细胞和浆细胞活化产生DSA,后者与内皮细胞上的HLA或非HLA分子结合造成内皮细胞的损伤是AMR的主要机制[16]。血管内皮细胞表面的抗原抗体复合物脱落后进入血液循环并进一步沉积于移植肾血管基底膜内皮下,导致MN,可能是移植后新发MN的重要成因。
因此,肾移植术后AMR与MN可同时存在,二者临床及病理表现相似,既可能是平行关系,也可能是因果关系,需要通过原发病及血清抗磷脂酶A2抗体等鉴别诊断。
