术前供者特异性抗体分层分析在致敏肾移植患者中的应用
2017-09-10赵杰付迎欣冯刚莫春柏天津市第一中心医院器官移植中心天津市器官移植重点实验室天津300192
赵杰,付迎欣,冯刚,莫春柏(天津市第一中心医院器官移植中心,天津市器官移植重点实验室,天津 300192)
肾移植是治疗终末期肾病首选和有效手段[1-2]。高致敏患者体内预存的供者特异性抗体(donor specific antibody,DSA)是术后早期发生抗体介导排斥(antibody mediated rejection,AMR)和移植肾失功的主要危险因素[3]。致敏患者术前等待合适供体时间长,因此,准确判断患者术前抗体水平和类别非常重要。目前采用的单抗原磁珠法检测人类白细胞抗原(human leucocyte antigen,HLA)抗体方法比传统的交叉反应敏感性高[4],能在交叉反应阴性的患者或者脱敏治疗后交叉反应转阴的患者中检测到DSA[5]。采用敏感的单抗原磁珠法检测HLA抗体,术前确定不能接受的供者抗原,减少了AMR的发生风险[6]。然而也有应用该方法检测到术前存在DSA的患者成功进行了移植的报道[7-8]。并且单抗原磁珠法检测DSA的荧光强度的阈值尚不统一,各移植中心报道的与抗体介导排斥反应荧光强度的阈值为3 000~10 000不等[9-11]。在淋巴细胞毒阴性的患者中应用敏感的单抗原磁珠法检测到的预存DSA对肾移植的影响报道尚不统一[12]。因此,有必要对应用单抗原磁珠法检测到的术前预存的DSA进行危险性分层分析,增加高致敏患者接受肾移植的机会。
本研究通过回顾性分析致敏肾移植患者术前预存DSA对临床结果的影响,进一步分层分析DSA抗体的类别及平均免疫荧光强度(mean fluorescent intensity, MFI)与预后的关系,从而增加高致敏患者接受肾移植的机会。
1 材料与方法
1.1 研究对象:回顾性分析2011年1月-2014年1月天津市第一中心医院30例术前致敏的肾移植患者,其中男性13例,女性17例,平均年龄(45±12)岁。酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测术前群体反应性抗体(panel reactive antibody, PRA)水平均大于20%。其中二次肾移植患者17例。亲体肾移植2例,其余均为尸体肾移植。24例术前接受脱敏治疗,其中15例二重滤过,9例蛋白A免疫吸附。术前淋巴细胞毒交叉配合实验阴性。
1.2 Luminex技术检测术前HLA抗体:脱敏治疗患者留取脱敏治疗后血清,其余留取术前血清,冻存于-20℃冰箱。将待测血清12 000 rpm〔(8 000~10 000)×g〕离心15分钟,在96孔板中每孔中加入2 μl微珠,然后每孔加入14 μl磷酸盐缓冲液(phosphate buffered saline, PBS)。孔中加入 7 μl血清样本,样本 1:3 稀释后总体积为 21 μl,混匀。室温避光孵育30分钟,孵育结束后,每孔加入180 μl Labscreen洗液清洗3次。每孔加入50 μl二抗,混匀。室温避光孵育30分钟,二次孵育后,3 500 rpm(1 500×g) 离心5分钟,清洗2次后,每孔加入60 μl PBS,混匀后将样本转移到读板中,上机读取结果。将读取到的数据导入HLA Fusion软件分析结果。
检测结果以MFI表示,大于1000为阳性,其中1 000<MFI<8 000定义为轻至中度阳性,MFI≥8000定义为强阳性,将检出阳性的抗体位点与供者HLA位点进行比对,分析是否为DSA。
1.3 AMR的诊断:移植后根据患者的临床症状、体征、实验室检查指标、移植肾病理表现,C4d结果,进行综合判断。
1.4 免疫诱导方案及AMR的治疗:所有患者均采用兔抗人胸腺细胞免疫球蛋白(1.5 mg/(kg·d),共用4天),甲强龙术中1 000 mg, 术后3天之内为500 mg/d。诊断为AMR后给予血浆置换4次+甲泼尼龙冲击治疗(500 mg,3 天)
1.5 统计学分析:采用SPSS 16.0进行统计学分析,符合正态分布的计量资料以均数±标准差 (x±s)表示,采用t检验,计数资料比较采用卡方检验。P<0.05为差异有统计学意义。
2 结 果
2.1 术前DSA与术后AMR结果(表1):30例PRA阳性患者中,22例(占73.3%)患者术前存在DSA,其中单纯Ⅰ类抗体阳性9例, 单纯Ⅱ类抗体阳性7例,Ⅰ、Ⅱ类抗体均为阳性6例。含有Ⅰ类强阳性(MFI≥8 000)DSA的患者有7例,Ⅱ类强阳性(MFI≥8 000)DSA的患者10例。术前DSA阳性患者中有10例(占45.5%)术后早期发生AMR。而8例术前DSA阴性患者术后均未发生AMR。术前DSA阳性组与DSA阴性组在受者年龄、术前PRA水平、HLA错配、冷缺血时间、移植肾功能延迟恢复(delayed graft function,DGF)、急性细胞性排斥反应(acute cellular rejection,ACR)、1年移植肾存活率方面差异无统计学意义(P>0.05)。
2.2 对术前DSA阳性患者进行分层分析(表2):根据术后早期是否发生AMR,将术前DSA阳性的22例患者分为2组,比较两组的临床资料。受者性别、 受者年龄、 移植次数、 HLA错配数、 冷缺血时间、PRA水平差异无统计学意义。AMR阳性组Ⅰ类DSA MFI值高于AMR阴性组(11 504±4 494比 5 205±3 786,P=0.012),而两组Ⅱ类DSA MFI值分别为 13 814±4 481、11 066±4 920,差异无统计学意义(P=0.362)。AMR阳性组和AMR阴性组Ⅰ类强阳性DSA(MFI ≥8 000)患者比例,差异有统计学意义 (75%比14.3%,P=0.04)。而两组之间Ⅱ类强阳性DSA患者差异无统计学意义 (100%比66.7%, P=0.497)。
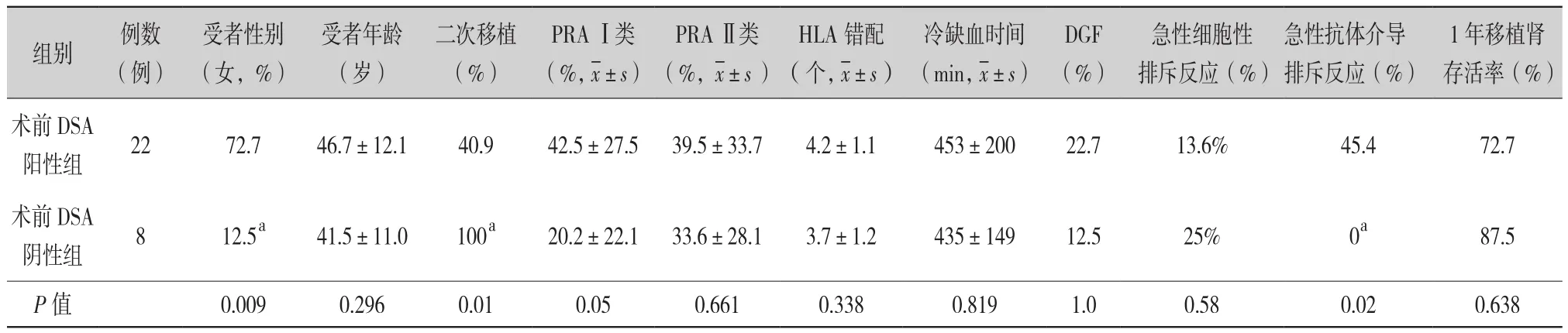
表1 DSA阳性组与DSA阴性组患者基线资料
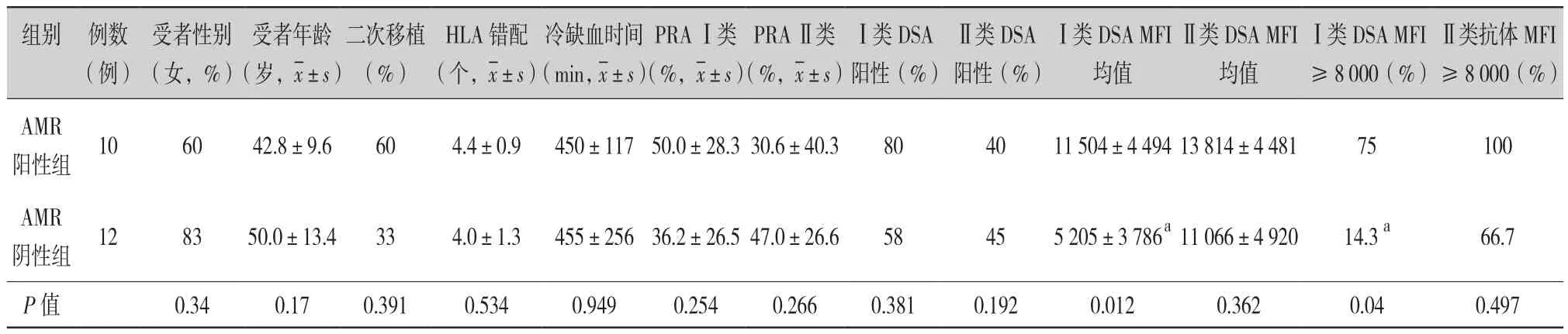
表2 AMR阳性组与AMR阴性组各项指标差别
2.3 术前Ⅰ类强阳性DSA对术后AMR的预测价值:术前含有Ⅰ类强阳性DSA患者有7例,其中6例(占85.7%)发生AMR,而术前Ⅰ类DSA轻至中度阳性(1 000<MFI<8 000)8例患者中有2例(占25%) 发生AMR,两者差异有统计学意义(P=0.04)。术前Ⅰ类强阳性DSA预测AMR的敏感度为75%,特异度为85.7%,阳性预测值为85.7%,阴性预测值为75%。
2.4 预后:术前DSA阳性的22例患者中,3例因AMR导致移植肾失功,这3例均有Ⅰ类强阳性的DSA。1例术后9个月死于肺感染,1例因肾周感染行移植肾切除术,1例死于脑出血,术后1年的移植肾存活率为72.7%。8例术前DSA阴性的患者中,1例因移植肾周感染、移植肾动脉破裂出血行移植肾切除术,术后1年移植肾存活率为87.5%。
3 讨 论
高致敏患者移植后发生急性AMR的风险高,仍为移植界的难题,尽管近来有多种脱敏方案,但效果仍然不理想,急性AMR的发生率为20%~50%[7]。目前大多数移植中心是通过检测受者PRA及补体依赖的细胞毒性试验(complement dependent cytotoxicity, CDC)来判断受者体内的致敏状况, CDC交叉反应阳性是肾移植的绝对禁忌证。而CDC阴性患者中,采用敏感的单抗原磁珠法检测到的术前预存的DSA的临床相关性仍存在争论[12]。因此,评价高致敏患者体内预存抗体情况,例如抗体类别、抗体强度等与术后AMR以及预后的相关性至关重要。
大多数研究认为,术前预存的DSA是术后发生AMR的危险因素,术前DSA阳性患者的预后比DSA阴性患者差。然而也有研究显示,在淋巴毒阴性的患者中,术前有没有DSA,急性排斥反应、DGF,1年的移植物存活没有显著差别[13]。另外一项大型的回顾性研究表明,移植肾丢失与单抗原磁珠法检测到的抗HLA抗体没有相关性[14]。说明不是所有应用单抗原磁珠法检测到的DSA都有同样的临床作用,不同类别和不同强度的DSA可能发挥不同作用,分析原因可能是IgG抗体存在不同的亚型(IgG1、 IgG2、 IgG3、 IgG4),IgG1/IgG3 能结合补体,而IgG2/ IgG4结合补体的能力差。
Mujtaba等[5]报道了 DSA 的 MFI值是预测AMR较好的指标。发生AMR组Ⅰ类DSA比例高,与MFI<9 500组相比,MFI>9 500组具有更高的AMR发生率和更差的3年移植肾存活率。DSA的MFI值大于9 500预测AMR的敏感度为94%,特异度为76%。同样Gloor等[15]报道DSA的MFI>10 000比低水平的DSA具有更高的AMR的发生率。而这些研究没有关于抗体类别与术后抗体介导排斥反应发生的报道。本组研究发现AMR阳性组与AMR阴性组相比,Ⅰ类DSA的MFI、强阳性的Ⅰ类DSA比例差异有统计学意义,而Ⅱ类DSA差异无统计学意义,表明Ⅰ类DSA具有更大的危害性。强阳性的Ⅰ类DSA预测AMR的敏感度为75%, 特异度85.7%,阳性预测值为85.7%。
因此笔者认为在淋巴细胞毒阴性的患者中术前应用单抗原磁珠法检测到DSA不是肾移植的绝对禁忌证,而是一个危险因素,应该进一步的分层分析。为致敏患者选择供体时,应该术前对预存的HLA抗体进行危险性分层分析,一定要避开Ⅰ类强阳性的HLA位点,可以大大降低术后AMR的发生,同时可减少高致敏患者等待时间。
本研究为小样本、回顾性研究,并且随访期短,存在一定的局限性,需进一步多中心、大样本、长期的深入研究。应用单抗原磁珠法检测HLA抗体具有重要的作用,有利于高致敏患者寻找合适供体,减少术后AMR。
