新疆莎车1号扁桃仁2S-清蛋白的纯化及特性研究
2017-09-09李述刚陆健康马美湖
李述刚,陆健康*,王 萍,马美湖*
(1.湖北工业大学生物工程与食品学院,湖北工业发酵协同创新中心,菲利普斯亲水胶体研究中心,湖北 武汉 430068;2.塔里木大学生命科学学院,南疆特色农产品深加工兵团重点实验室,新疆 阿拉尔 843300;3.华中农业大学食品科学技术学院,湖北 武汉 430070)
新疆莎车1号扁桃仁2S-清蛋白的纯化及特性研究
李述刚1,陆健康2,*,王 萍2,马美湖3,*
(1.湖北工业大学生物工程与食品学院,湖北工业发酵协同创新中心,菲利普斯亲水胶体研究中心,湖北 武汉 430068;2.塔里木大学生命科学学院,南疆特色农产品深加工兵团重点实验室,新疆 阿拉尔 843300;3.华中农业大学食品科学技术学院,湖北 武汉 430070)
清蛋白是扁桃种仁中主要蛋白质,为揭示扁桃仁主要蛋白质组成及结构特性,以新疆莎车1号(SC-1)扁桃仁为研究对象,对其种仁中2S-清蛋白进行分离纯化和结构特性研究,即经有机溶剂多次沉淀提取,获得扁桃仁清蛋白的粗提物,再经Q Sepharose FF分离纯化,获得扁桃仁2S-清蛋白。经高效液相色谱-质谱联用分析表明,纯化后的扁桃仁2S-清蛋白准确分子质量为31.40 kD,其在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳结果中显示为18.0 kD和19.5 kD 2 个条带,表明其由两个不同的亚基通过二硫键结合而成。扁桃仁2S-清蛋白中谷氨酸(Glu)、天冬氨酸(Asp)和精氨酸(Arg)的含量最高;其二级结构中主要为β-折叠,占65.9%;扁桃仁2S-清蛋白羰基含量为4.45 nmol/mg、活性巯基含量为39.95 μmol/g、总巯基含量为57.11 μmol/g、表面疏水性为23.45 μg;变性温度为43.3 ℃。研究结果可为新疆扁桃仁的开发利用提供理论依据。
扁桃仁;2S-清蛋白;纯化;结构特性
李述刚, 陆健康, 王萍, 等. 新疆莎车1号扁桃仁2S-清蛋白的纯化及特性研究[J]. 食品科学, 2017, 38(17): 36-41. DOI:10.7506/spkx1002-6630-201717007. http://www.spkx.net.cn
LI Shugang, LU Jiankang, WANG Ping, et al. Purifi cation and characteristics of 2S-albumin in shache No. 1 almond from Xinjiang[J]. Food Science, 2017, 38(17): 36-41. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201717007. http://www.spkx.net.cn
扁桃(almond,Prunus dulcis)又名巴旦木和美国大杏仁,是树坚果品种的重要成员,全球的主产地为澳大利亚、美国(加州)、西班牙和中国等地,是重要经济作物之一[1]。扁桃在我国的种植主要集中于新疆,其种植面积近100万 亩,占全国总量的90%,年产值已突破6亿元,对区域经济和社会发展起到了重要的促进作用[2]。植物种子在形成过程中会积累大量的植物蛋白质,这些植物种子为人类提供了相对廉价的蛋白质来源[3]。蛋白质在人类营养中发挥着重要的作用,人类必须通过摄入足够的蛋白质来保证机体新陈代谢的正常进行[4]。
扁桃仁清蛋白是扁桃仁中含量最高的蛋白质,其中包含2S-清蛋白等诸多蛋白组分。目前国内对于扁桃清蛋白的研究较少,而国外对扁桃仁清蛋白的研究大多集中于其致敏性及抗原表位的鉴定等[5-6]。本研究以新疆地区新疆莎车1号(Shache-1,SC-1)扁桃仁脱脂粉为原料,采用盐提以及有机溶剂沉淀法制备扁桃仁清蛋白粗提物,并进一步通过Q Sepharose FF离子交换层析法对其进行纯化,获得扁桃仁2S-清蛋白组分;采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、高效液相色谱-质谱联用(high performance liquid chromatography-mass spectrum,HPLC-MS)技术、圆二色谱(circular dichroism,CD)、差示扫描量热(differential scanning calorimetry,DSC)法等对2S-清蛋白的分子特性进行研究,以期为深入了解扁桃仁2S-清蛋白的特性及其生物学活性提供科学依据,对该类食品的加工贮藏以及新疆扁桃开发利用和产业发展具有参考意义和应用价值。
1 材料与方法
1.1 材料与试剂
SC-1扁桃仁购于新疆南疆喀什地区的莎车县扁桃农场。
Q Sepharose Fast Flow阴离子交换层析填料、丙烯酰胺、SDS(纯度98.5%)、四甲基乙二胺(纯度99%)、5,5 -二硫双(2-硝基苯甲酸)(纯度98%) 美国Sigma公司;丙酮、HCl、乙醇、乙酸乙酯(均为分析纯)天津市致远化学试剂有限公司;溴酚蓝(指示剂级)、2,4-二硝基苯肼(分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
756型紫外-可见分光光度计 上海菁华科技仪器有限公司;FA/JA2004N型电子天平 上海精密科学仪器有限公司;pH211C型酸度计 北京哈纳科仪科技有限公司;GL-22LM型高速冷冻离心机 湖南星科科学仪器有限公司;FD-1D-50型冷冻干燥机 北京博医康实验仪器有限公司;STA 449F3型TG-DSC热分析系统 耐驰科学仪器商贸(上海)有限公司;ChemiDocTMXRS+凝胶成像系统 美国Bio-Rad公司;TU-1900双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司;715型CD仪 日本分光株式会社;L-8800全自动氨基酸分析仪 日本日立公司;UHPLC LC-30A 日本岛津公司;Triple-TOF 5600+质谱仪 美国AB Sciex公司。
1.3 方法
1.3.1 样品处理
称取400 g成熟的扁桃仁,经搅拌器充分磨碎,然后在高速搅拌中用丙酮处理2 次(V(丙酮)∶m(扁桃仁样品)=10∶1),由此得到蛋白质沉淀物;然后在室温条件下,再用石油醚(m(浓缩物)∶V(溶剂)=10∶1)提取2 次,除去溶剂,在室温条件下风干,即得扁桃仁总蛋白,并在-20 ℃贮存。
1.3.2 2S-清蛋白提取
取20 g扁桃仁总蛋白提取物,用200 mL含有0.5 mmol苯甲基磺酰氟的磷酸盐缓冲液(phosphate buffered saline,PBS,pH 7.4)溶解,然后在磁力搅拌器中搅拌2 h(4 ℃),使其充分溶解,然后4 ℃、10 000×g离心30 min除去少量不溶物;收集上清液冷却至0 ℃,然后添加冷甲醇,使甲醇最终体积分数达到60%,充分混合后13 500×g离心30 min;再次收集上清液,加入3 倍体积的丙酮,在-20 ℃处理16 h,然后离心,收集沉淀;将沉淀溶于水,4 ℃条件下用透析袋透析72 h,冷冻干燥,即得扁桃仁清蛋白粗提物[6]。
1.3.3 Q Sepharose FF离子交换层析
采用Q Sepharose FF作为固定相,纯化的色谱条件为:先用平衡缓冲液(0.025 mol/L pH 7.5的Tris-HCl溶液)进行洗脱,洗脱体积为120 mL;再用初始浓度0 mol/L、最高浓度0.5 mol/L氯化钠的0.025 mol/L pH 7.5的Tris-HCl缓冲液进行线性梯度洗脱,洗脱液体积为600 mL;最后用2 mol/L氯化钠、0.025mol/L pH 7.5的Tris-HCl缓冲液洗脱,洗脱液体积为150 mL;洗脱处理温度为25 ℃,流速为1 mL/min;采用自动部分收集器收集洗脱液,6 mL/管,收集后测定每管溶液的A280nm值,绘制洗脱曲线[7]。将收集得到的蛋白溶液于4 ℃截留分子质量为8 000 D的透析带中透析72 h,每6 h更换1 次透析液。透析完毕后收集蛋白溶液,-20 ℃冷冻过夜后真空冷冻干燥,收集冻干粉于4 ℃条件下保存备用。
1.3.4 SDS-PAGE分析
制备12%分离胶、5%浓缩胶,电极缓冲液为0.05 mol/L Tris-HCl、10% SDS、0.384 mol/L甘氨酸的缓冲溶液。样品蛋白质量浓度为2 mg/mL,上样量为10 μL。样品在浓缩胶中电压为40 V,进入分离胶之后将其增至100 V。电泳完毕后染色6 h,最后脱色至背景透明[8]。
1.3.5 氨基酸组成分析
准确称取一定量样品(使样品蛋白质含量在10~20 mg范围内)于水解管中,在水解管内加6 mol/L HCl 10~15 mL,加入新蒸蒸馏水的酚酞3~4 滴,再将水解管放入冷冻剂中,冷冻3~5 min,抽真空后充入高纯氮气,重复3 次后,在充氮气状态下封口,将已封口的水解管置于(110±1) ℃的恒温干燥箱内水解22 h,打开水解管待水解液冷却后过滤并转移到50 mL容量瓶内,用去离子水多次冲洗水解管,将洗液全部转入容量瓶内用去离子水定容。吸取滤液1 mL于5 mL容量瓶内,用真空干燥器在49~50 ℃条件下干燥,残留物用1~2 mL水溶解,再干燥,反复进行2 次,最后蒸干,再加入0.02 mol/L的HCl,溶解后用氨基酸分析仪分析[9]。
1.3.6 HPLC-MS分析
色谱条件:样品首先通过超高效液相色谱系统UHPLC LC-30A进行分离;流动相A液为0.1%甲酸水溶液,B液为0.1%甲酸乙腈溶液,色谱柱为Zorbax RRHD 300SB C3柱(2.1 mm×100 mm,1.8 μm);样品由自动进样器上样,再经色谱柱分离,流速为0.3 mL/min,检测波长214 nm,柱温70 ℃;线性梯度范围3%~97%乙腈。
质谱条件:液相用Triple-TOF 5600+质谱仪进行质谱分析,分析时长为11 min,检测方式为正离子模式,母离子扫描范围m/z为350~4 000。
原始数据由ProMass 2.8软件处理,参数设定:Smooth width为7,Noise threshold为2,原始质谱数据经处理后得到扁桃仁清蛋白分子质量谱图[10-11]。
1.3.7 CD分析
参数设定:狭缝宽度为1.0 nm,响应时间为4 s,敏感度为标准模式,扫描范围为190~250 nm,数据精度为0.1 nm,扫描速率为50 nm/min,扫描次数为2 次,样品池长度为0.1 cm,温度为室温。
空白扫描:以20 mmol/L的硼酸盐缓冲液为空白溶液;将供试品杯用2 mol/L硝酸浸泡过夜,去离子水冲洗干净后晾干,加入20 mmol/L硼酸盐缓冲液350 μL,按照以上参数进行190~250 nm的远紫外扫描并采集数据,作为空白参考。
样品测试:供试品杯清洗晾干,分别加入用20 mmol/L磷酸盐缓冲液和质量浓度为0.2 mg/mL的蛋白溶液溶解,按上述参数进行190~250 nm的远紫外扫描并采集数据。
对扫描后的所有图谱用软件Jwstda 32进行Smoothing处理,然后采用Protein SSE软件对扁桃仁清蛋白的二级结构进行拟合计算,参考标准曲线采用软件自带的标准α-螺旋、β-折叠、β-转角和无规卷曲曲线[12]。
1.3.8 羰基含量测定
参考吴大伟等[13]测定羰基含量的方法。在1.5 mL的离心管中分别加入0.2 mL蛋白质溶液和0.5 mL的含有10 mmol/L 2,4-二硝基苯肼的2 mol/L HCl溶液,混合均匀后于20 ℃条件下水浴2 h;另取0.2 mL蛋白质溶液和0.5 mL不含有2,4-二硝基苯肼的2 mol/L HCl溶液混合,在20 ℃条件下水浴2 h,作为空白对照;然后分别往各离心管中加0.5 mL 40%的三氯乙酸,剧烈振荡,摇匀后静置20 min,10 000 r/min离心10 min后弃上清液,并用1 mL的乙醇-乙酸乙酯(1∶1,V/V)溶液洗涤沉淀3 次;将洗涤后的蛋白质沉淀悬浮于0.6 mol/L盐酸胍溶液中,在37 ℃条件下水浴30 min,测定A370nm,以不加2,4-二硝基苯肼试剂时的样品为对照,计算每毫克蛋白质的羰基物质的量,其计算公式见式(1)。
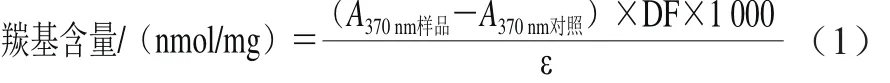
式中:DF为样品稀释系数;ε为摩尔消光系数22 000 L/(mol•cm)。
1.3.9 表面疏水性的测定
将样品溶于20 mmol/L pH 7.0的磷酸盐缓冲溶液中,使蛋白质量浓度为5 mg/mL。取1 mL蛋白溶液,加入200 μL 1 mg/mL溴酚蓝,以无蛋白的磷酸盐溶液为对照。6 000×g离心15 min,取上清液稀释10 倍,测定其表面疏水性用溴酚蓝结合量表示,其计算公式见式(2)。
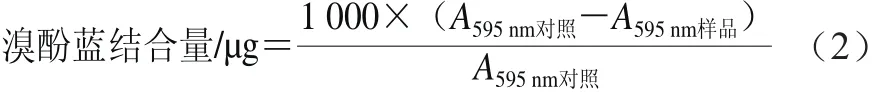
1.3.10 巯基含量测定
蛋白质活性巯基含量的测定参考许晶等[15]改进的Ellman试剂法,并做适当的调整。取2 mL蛋白溶液,加入5 mL Tris-甘氨酸缓冲液(0.086 mol/L Tris、0.09 mol/L甘氨酸、4 mmol/L Na2•EDTA,pH 8.0)中,再加入4 mg/mL 5,5 -二硫双(2-硝基苯甲酸)的Ellman试剂0.1 mL,漩涡混匀后于25 ℃条件下反应15 min,测定其A412nm,以不加Ellman试剂的溶液作为对照,每组样品测定3 次取平均值。
总巯基含量的测定:取2 mL蛋白溶液,加入5 mL Tris-甘氨酸-8 mol/L Urea-0.5% SDS溶液中,再加入4 mg/mL 5,5 -二硫双(2-硝基苯甲酸)的Ellman试剂0.1 mL,漩涡混匀后于25 ℃条件下反应15 min,测定其A412nm,以不加Ellman试剂的溶液作为对照,每组样品测定3 次取平均值。二硫键含量为总巯基含量与活性巯基含量差值的1/2。总巯基含量计算公式见式(3)。
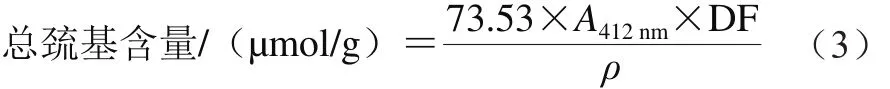
式中:DF为样品稀释系数;ρ为样品的蛋白质最终质量浓度/(mg/mL)。
1.3.11 热性质分析
采用DSC测定扁桃分离蛋白的热变性温度。将8 mg左右样品置于氧化铝坩埚中并盖好坩埚盖,以空氧化铝坩埚作为参比,氮气作为保护气,温度扫描范围为15~100 ℃,扫描速率为5 ℃/min[16]。
2 结果与分析
2.1 扁桃仁清蛋白的提取和纯化
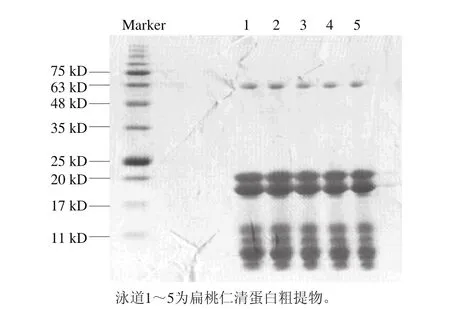
图 1 扁桃仁清蛋白粗提物SDS-PAGE电泳图Fig. 1 SDS-PAGE pattern of crude albumin extract
经多步有机溶剂沉淀提取,获得扁桃仁清蛋白的粗提物,为考察提取效果,对粗提物进行了SDS-PAGE分析。由图1可知,样品在凝胶上的条带清晰可见,扁桃仁清蛋白粗提物在凝胶上共显示为7 个主要的条带,分子质量介于8~75 kD之间,依次为8、9、10、12、18.5、20 kD和63 kD,其中9、18.5 kD和20 kD 3 个条带灰度值较高,说明这3 个条带的组分含量高。文献报道扁桃仁清蛋白主要包含3 个组分[17],其分子质量与含量较高的3 个条带一一对应,表明粗提效果较好。
2.2 阴离子交换层析纯化扁桃仁2S-清蛋白图谱及SDS-PAGE分析
Q Sepharose FF是一种流速特性好的强阴离子交换剂,具有适用性强、分离效果好等优点[18]。实验采用Q Sepharose FF离子交换色谱纯化扁桃仁2S-清蛋白,上样质量浓度为25 mg/mL,上样量为5 mL,结果如图2所示。
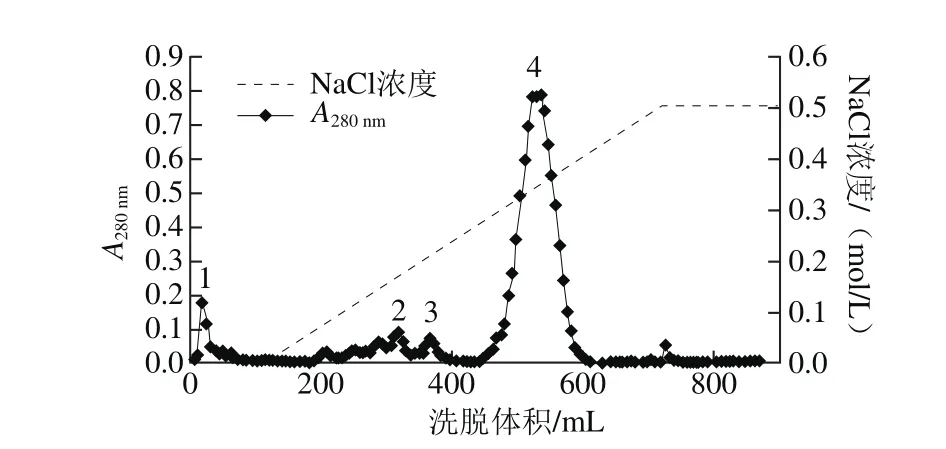
图 2 扁桃仁清蛋白阴离子交换层析Fig. 2 Ion exchange chromatography of crude albumin extract
由图2可知,扁桃仁清蛋白粗提物经层析后分离为4 个主要的洗脱峰,其中洗脱峰4吸光度最高,收集峰4组分进行后续分析,该组分即为2S-清蛋白。
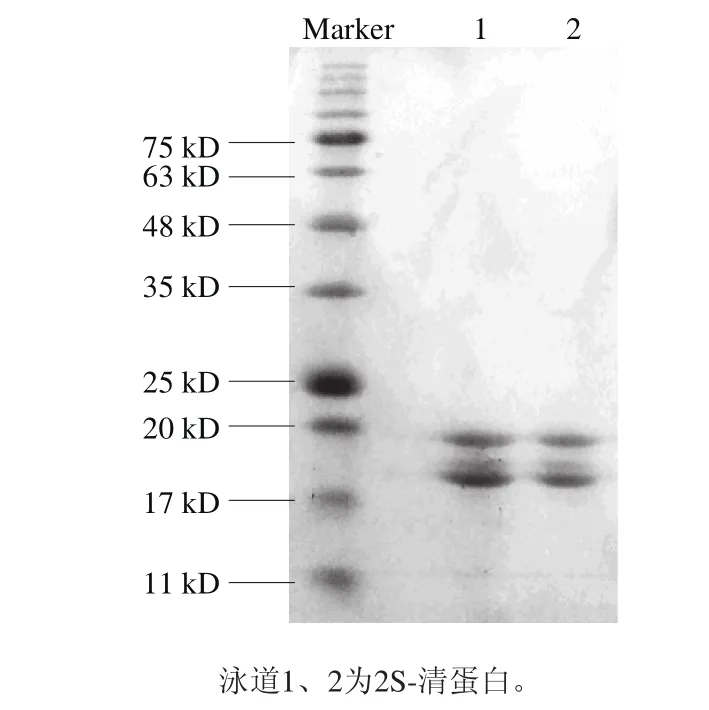
图 3 扁桃仁清蛋白SDS-PAGE电泳图Fig. 3 SDS-PAGE pattern of 2S-albumin
将收集的洗脱峰4经透析脱盐冻干后进行SDS-PAGE电泳分析。由图3可知,经离子交换层析纯化后,2S-清蛋白在电泳上仅显示为18.0 kD和19.5 kD两个条带,表明其他扁桃仁蛋白质已被去除,已经得到纯度较高的扁桃仁2S-清蛋白样品。
2.3 扁桃仁2S-清蛋白分子质量
采用高分辨的质谱对扁桃仁2S-清蛋白的分子质量进行分析。纯化的扁桃仁2S-清蛋白样品,经HPLC分离后进行MS分析,通过在质谱中的离子峰测定扁桃仁清蛋白的分子质量,结果如图4所示。
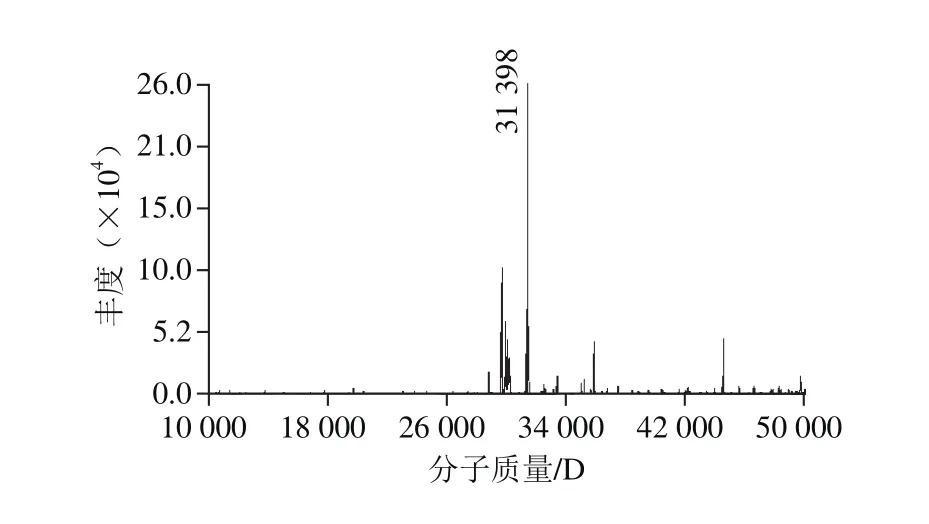
图 4 扁桃仁2S-清蛋白的HPLC-MS图谱Fig. 4 HPLC-MS profi le of 2S-albumin
由图4可知,扁桃仁2S-清蛋白在质谱中表现为多个离子峰,分布范围主要在20~50 kD之间,其中,信号强度最高的质谱峰在31 398 D处,表明扁桃仁2S-清蛋白的分子质量为31.40 kD。质谱分析测定的准确分子质量与图3中的结果有些差异。这可能是由于扁桃仁2S-清蛋白为多亚基蛋白,在SDS-PAGE分析中,由于还原剂、变性剂和加热处理等,使其亚基分离,因此显示为两个分子质量较小的条带;而质谱分析中,处理条件较为温和,亚基未分离,测定的为整个分子的总体分子质量,因此,两种测定方法的结果并不一致。
2.4 扁桃仁2S-清蛋白氨基酸组成分析
采用HPLC测定纯化得到的扁桃仁清蛋白氨基酸组成,共计测定16 种氨基酸,结果如表1所示。
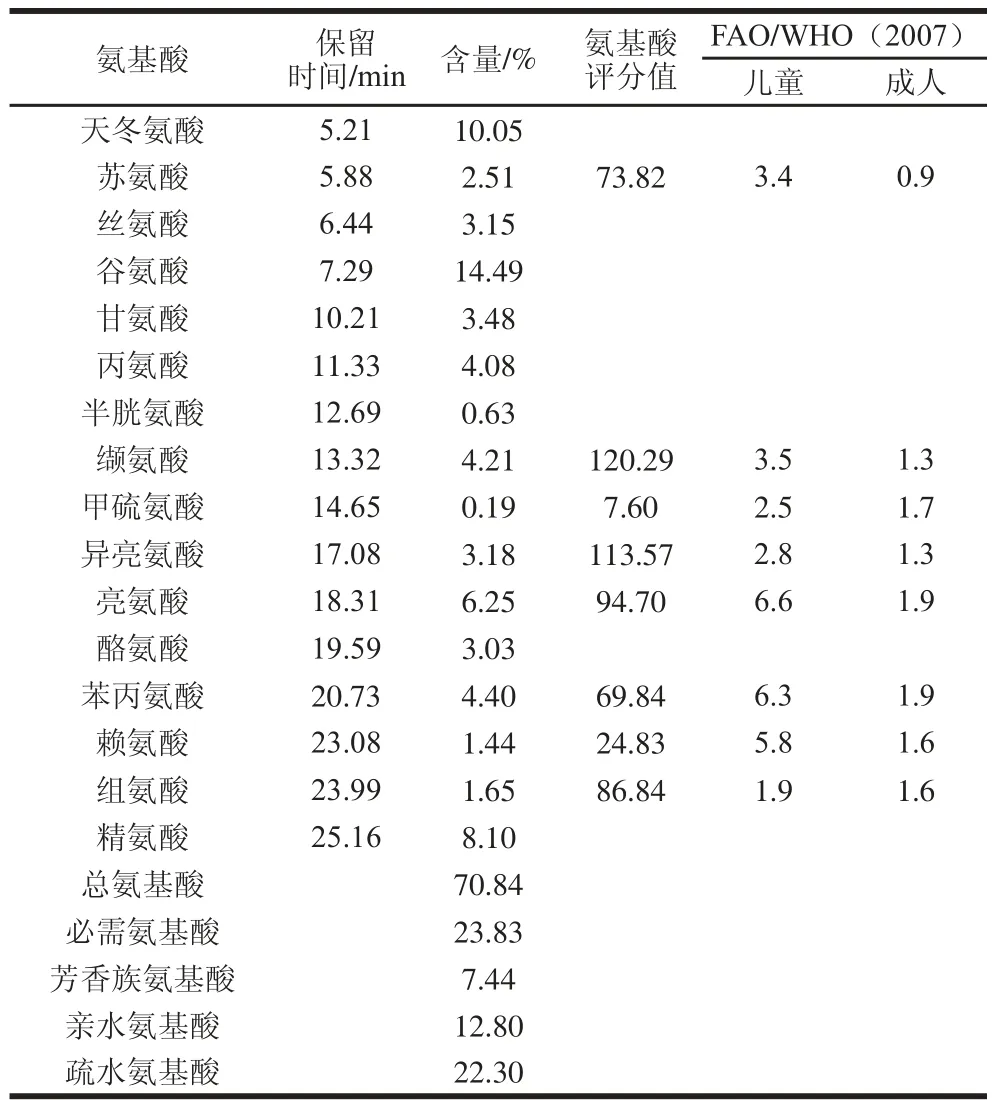
表 1 扁桃仁2S-清蛋白的氨基酸组成Table 1 Amino acid composition of 2S-albumin
由表1可知,扁桃仁2S-清蛋白含所测定全部16 种氨基酸。扁桃仁清蛋白酸性氨基酸含量相对较多,其谷氨酸(Glu)和天冬氨酸(Asp)含量分别达14.49%和10.05%,该结果表明扁桃仁2S-清蛋白等电点较低;此外,这些酸性氨基酸使扁桃仁2S-清蛋白含有较强的离子键等非共价作用力,在该蛋白提取时采用一定离子强度的弱碱性缓冲液可以更好地促进该蛋白的溶出。扁桃仁2S-清蛋白中含有较多的亲水性氨基酸,这些亲水性氨基酸赋予该蛋白良好的水溶性[19]。从氨基酸评分角度分析,扁桃仁2S-清蛋白第一限制性氨基酸为甲硫氨酸,第二限制性氨基酸为赖氨酸,除该两种氨基酸外,其余必需氨基酸含量均能满足联合国粮农组织/世界卫生组织(Food and Agriculture Organization of the United/ World Health Organization,FAO/WHO)成人推荐标准;扁桃仁2S-清蛋白中精氨酸含量高且氨基酸组成全面,可能具有很高的生物学价值,可作为特殊食品中氨基酸膳食补充剂。
2.5 扁桃仁2S-清蛋白CD分析
对扁桃仁2S-清蛋白进行CD分析,结果如图5所示,扁桃仁清蛋白在195~198 nm波长处有一强的正吸收峰,在205~240 nm范围内为一个较宽的负吸收峰,α-螺旋结构的“双负”吸收峰不明显,说明扁桃仁蛋白二级结构中α-螺旋比例较少,以β-折叠结构为主。采用Protein SSE软件对图谱和标准对照品的二级结构进行拟合计算,参考标准曲线采用软件自带的标准α-螺旋、β-折叠、β-转角和无规卷曲曲线[20]。计算结果显示,扁桃仁2S-清蛋白的二级结构相对含量为:α-螺旋9.7%、β-折叠65.9%、β-转角4.5%、无规卷曲19.9%。在蛋白质的二级结构中β-折叠和α-螺旋是较为有序的结构[21],通常而言含量越高,结构越稳定,变性温度就越高。而扁桃仁2S-清蛋白虽然含有大量的β-折叠,但是变性温度仍较低,其可能原因是β-折叠和α-螺旋不是影响扁桃2S-清蛋白变性温度的主要因素,而二硫键较少等其他原因可能是主要因素。
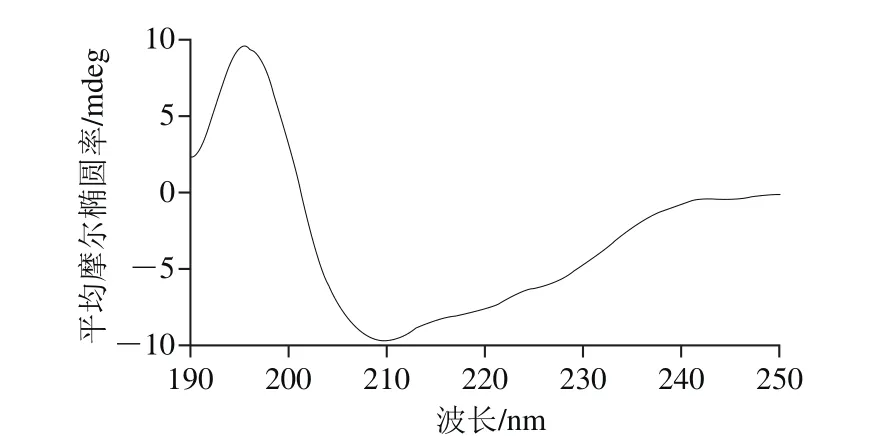
图 5 扁桃仁2S-清蛋白的CD图Fig. 5 Circular dichroism spectrum of 2S-albumin
2.6 扁桃仁2S-清蛋白的表面活性基团
蛋白质表面活性基团对蛋白质的理化性质具有重要影响,其中最重要的为巯基、羰基以及表面的疏水性基团。对扁桃仁2S-清蛋白的表面活性基团进行了测定,结果如表2所示。

表 2 扁桃仁2S-清蛋白的表面活性基团Table 2 Functional group contents of 2S-albumin
蛋白质羰基含量表征了蛋白质氧化的程度,吴伟等[22]研究丙二醛氧化对大米蛋白功能性质的影响时发现,丙二醛浓度为0 nmol/L时大米蛋白羰基含量为3.91 nmol/mg,而扁桃仁2S-清蛋白的羰基含量为4.45 nmol/mg,表明扁桃仁2S-清蛋白氧化程度较小。巯基和二硫键是维系蛋白质空间结构的重要化学键[23],这些化学键的断裂或者重新键合,将导致蛋白质高级结构发生变化,最终会对蛋白的活性和功能造成影响。扁桃仁2S-清蛋白的总巯基含量为57.11 μmol/g,活性巯基含量为39.95 μmol/g,二硫键含量为8.58 μmol/g,与扁桃仁清蛋白[24]相比,扁桃仁2S-清蛋白的总巯基和活性巯基含量都较低,二硫键亦较前者低,这可能是扁桃仁2S-清蛋白较扁桃仁清蛋白变性温度低的原因。表面疏水性对蛋白质的乳化性和起泡性具有重要影响,扁桃仁2S-清蛋白的表面疏水性为23.45 μg,表明该蛋白表面存在一定的疏水性氨基酸,这些疏水性氨基酸的暴露,可以使扁桃仁2S-清蛋白蛋白具有更好的两亲特性,造成蛋白质乳化性的增加[25]。
2.7 扁桃仁2S-清蛋白热性质分析
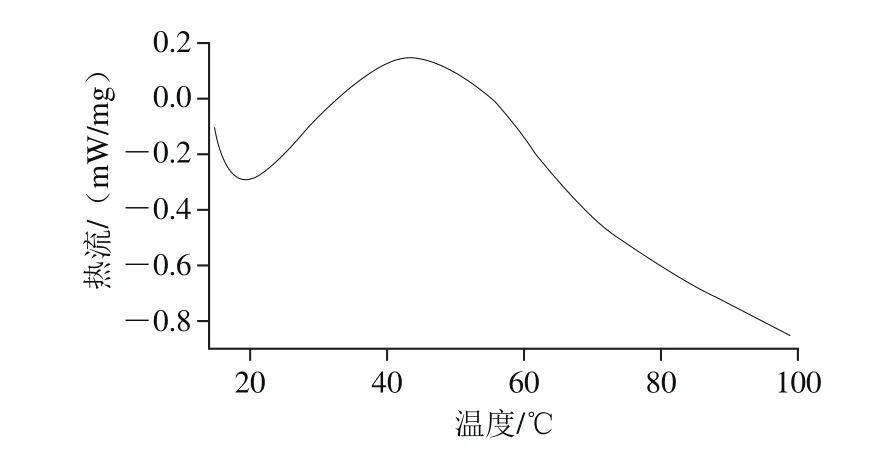
图 6 扁桃仁2S-清蛋白DSC曲线Fig. 6 DSC curve of 2S-albumin
扁桃仁2S-清蛋白的DSC曲线如图6所示。根据测定结果,扁桃仁2S-清蛋白的变性起始温度为28.4 ℃,变性终止温度为57.6 ℃,峰值为43.3 ℃。与扁桃仁分离蛋白相比[26],扁桃仁2S-清蛋白的变性温度较低,变性温度范围较窄,表明扁桃仁2S-清蛋白纯度较高,分子一致性较高。扁桃仁2S-清蛋白变性温度较花生2S蛋白变性温度低,其可能的原因是扁桃仁2S-清蛋白中可形成二硫键的Met和Cys等硫氨基酸较少的缘故[27]。
3 结 论
本实验以有机溶剂多次沉淀法制备扁桃仁清蛋白粗提物,经SDS-PAGE分析,该粗提物分子质量介于8~75 kD之间,其中9、18.5 kD和20 kD 3 个条带的组分含量高;经Q Sepharose FF分离纯化得到扁桃仁2S-清蛋白,经HPLC-MS分析该蛋白准确分子质量为31.40 kD,在SDS-PAGE凝胶上呈现出18.0 kD和19.5 kD两个条带;扁桃仁2S-清蛋白含所测定全部16 种氨基酸,其第一限制性氨基酸为甲硫氨酸,除该甲硫氨酸和赖氨酸外,其余必需氨基酸含量均能满足FAO/WHO成人推荐标准;在CD图上,扁桃仁2S-清蛋白在195~198 nm波长处有一强的正吸收峰,在205~240 nm范围内为一个较宽的负吸收峰,α-螺旋结构的“双负”吸收峰不明显,表明其二级结构以β-折叠结构为主,含量为65.9%;扁桃仁2S-清蛋白干粉DSC曲线出现一个峰,对应的变性峰值温度为43.3 ℃;扁桃仁2S-清蛋白羰基含量为4.45 nmol/mg、总巯基含量为57.11 μmol/g,活性巯基含量为39.95 μmol/g、二硫键含量为8.58 μmol/g、表面疏水性为23.45 μg。这些数据可为深入研究新疆扁桃仁蛋白质的组成、结构特性及应用提供科学依据。
[1] MARTÍ A F I, FORCADA C F I, KAMALI K, et al. Molecular analyses of evolution and population structure in a worldwide almond [Prunus dulcis(Mill.) D.A. Webb syn. P. amygdalus Batsch] pool assessed by microsatellite markers[J]. Genetic Resources and Crop Evolution, 2015, 62(2): 205-219. DOI:10.1007/s10722-014-0146-x.
[2] 韩宏伟, 王建友, 李勇, 等. 引种国外巴旦木品种筛选研究[J]. 新疆农业科学, 2014, 51(10): 1830-1839. DOI:10.6048/j.issn.1001-4330.2014.10.012.
[3] SACK M, HOFBAUER A, FISCHER R, et al. The increasing value of plant-made proteins[J]. Current Opinion in Biotechnology, 2015, 32: 163-170. DOI:10.1016/j.copbio.2014.12.008.
[4] 陈贵堂, 赵霖. 植物蛋白的营养生理功能及开发利用[J]. 食品工业科技, 2004(9): 137-140. DOI:10.13386/j.issn1002-0306.2004.09.041.
[5] GARINO C, DE PAOLIS A, COÏSSON J D, et al. Pru du 2S albumin or Pru du vicilin?[J]. Computational Biology and Chemistry, 2015, 56: 30-32. DOI:10.1016/j.compbiolchem.2015.03.004.
[6] POLTRONIERI P, CAPPELLO M S, DOHMAE N, et al. Identifi cation and characterisation of the IgE-binding proteins 2S albumin and conglutin γ in almond (Prunus dulcis) seeds[J]. International Archives of Allergy and Immunology, 2002, 128(2): 97-104.
[7] GENG F, HUANG X, YAN N, et al. Purification of hen egg white ovomacroglobulin using one-step chromatography[J]. Journal of Separation Science, 2013, 36(23): 3717-3722. DOI:10.1002/ jssc.201300425.
[8] FANG G, HUANG Q, WU X F, et al. Co-purifi cation of chicken egg white proteins using polyethylene glycol precipitation and anionexchange chromatography[J]. Separation and Purifi cation Technology, 2012, 96(33): 75-80. DOI:10.1016/j.seppur.2012.05.021.
[9] 齐建双, 铁双贵, 韩小花, 等. 氨基酸分析仪法快速测定玉米籽粒中赖氨酸含量[J]. 中国农学通报, 2014, 30(30): 199-202.
[10] GENG F, HUANG X, MAJUMDER K, et al. Mass spectrometry and two-dimensional electrophoresis to characterize the glycosylation of hen egg white ovomacroglobulin[J]. Journal of Agricultural and Food Chemistry, 2015, 63(37): 8209-8215. DOI:10.1021/acs.jafc.5b02618.
[11] ANDREWS G L, SIMONS B L, YOUNG J B, et al. Performance characteristics of a new hybrid quadrupole time-of-flight tandem mass spectrometer (Triple TOF 5600)[J]. Analytical Chemistry, 2011, 83(13): 5442-5446. DOI:10.1021/ac200812d.
[12] 王晶. 鸡蛋贮藏期间三种蛋白质结构与功能性质的变化研究[D].武汉: 华中农业大学, 2014: 20.
[13] 吴大伟, 陈星, 洑琴, 等. 常温储存和干热处理对豆粕蛋白质氧化的影响[J]. 中国粮油学报, 2014, 29(5): 90-94.
[14] ALIZADEHPASDAR N, LICHAN E C Y. Comparison of protein surface hydrophobicity measured at various pH values using three different fluorescent probes[J]. Journal of Agricultural and Food Chemistry, 2000, 48(2): 328-334. DOI:10.1021/jf990393p.
[15] 许晶, 齐宝坤, 赵青山, 等. 大豆分离蛋白结构特性与表面疏水性的关系[J]. 中国粮油学报, 2015, 30(8): 32-36; 41.
[16] 吴海波, 齐宝坤, 江连洲, 等. 大豆分离蛋白热性质及其空间构象对表面疏水性的影响[J]. 中国粮油学报, 2014, 29(10): 42-46.
[17] YUSUF A A. Physico-chemical properties of almond seed protein concentrate[J]. Italian Journal of Food Science, 2003, 15(4): 531-539.
[18] LIANG J, FIEG G, JAKOBTORWEIHEN S. Ion-exchange adsorption of proteins: experiments and molecular dynamics simulations[J]. Chemie Ingenieur Technik, 2015, 87(7): 903-909. DOI:10.1002/ cite.201400095.
[19] 蔡联辉, 曾虹燕, 王亚举, 等. 莲子蛋白质的氨基酸组成及其营养评价[J]. 营养学报, 2010, 32(5): 503-506. DOI:10.13325/j.cnki.acta.nutr. sin.2010.05.013.
[20] 沈星灿, 梁宏, 何锡文, 等. 圆二色光谱分析蛋白质构象的方法及研究进展[J]. 分析化学, 2004, 32(3): 388-394.
[21] 黎卫. 芡实蛋白组分的结构表征及其理化性质研究[D]. 无锡: 江南大学, 2015: 29.
[22] 吴伟, 蔡勇建, 吴晓娟, 等. 丙二醛氧化对大米蛋白功能性质的影响[J]. 食品工业科技, 2015, 36(18): 113-116; 122. DOI:10.13386/ j.issn1002-0306.2015.18.014.
[23] HOGG P J. Disulfi de bonds as switches for protein function[J]. Trends in Biochemical Sciences, 2003, 28(4): 210-214. DOI:10.1016/S0968-0004(03)00057-4.
[24] 王东爽, 陆健康, 李述刚. 新疆莎车1号扁桃仁4种蛋白组分功能特性研究[J]. 食品科技, 2016, 41(2): 74-79. DOI:10.13684/j.cnki. spkj.2016.02.014.
[25] GANG Y, ZHENG L, JIN Z, et al. Impacts of the surface charge property on protein adsorption on hydroxyapatite[J]. Chemical Engineering Journal, 2002, 87(2): 181-186.
[26] 李述刚, 陆健康, 王萍, 等. 不同脱脂处理对新疆莎车1号扁桃仁蛋白功能特性的影响[J]. 中国油脂, 2015, 40(6): 24-28. DOI:1003-7969( 2015) 06-0024-05.
[27] 杨晓泉, 张水华, 黎茵, 等. 花生2S蛋白的提取分离及部分性质研究[J].华南理工大学学报(自然科学版), 1998(4): 1-5.
Purifi cation and Characteristics of 2S-Albumin in Shache No. 1 Almond from Xinjiang
LI Shugang1, LU Jiankang2,*, WANG Ping2, MA Meihu3,*
(1. Glyn O. Phillips Hydrocolloid Research Center, Hubei Collaborative Innovation Center for Industrial Fermentation, School of Biological Engineering and Food, Hubei University of Technology, Wuhan 430068, China; 2. Production & Construction Group Key Laboratory of Special Agricultural Products Further Processing in Southern Xinjiang, College of Life Sciences, Tarim University, Alar 843300, China;3. College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
Albumin is the major protein in almond. In this experiment, we purifi ed and structurally characterized 2S-albumin from Shache No.1 almond (SC-1) from Xinjiang. Crude albumin extract was obtained from almond by repeated precipitation with organic solvents and then fractionated chromatographically on Q Sepharose FF to obtain 2S-albumin. By HPLC-MS analysis, the accurate molecular mass of 2S-albumin was determined to be 31.40 kD, which was separated into two bands (18.0 and 19.5 kD) in sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE), indicating that it was composed of two distinct subunits connected through disulfide bonds. In 2S-albumin, the contents of glutamic acid, aspartic acid and arginine residues were relatively high, and its dominant secondary structure was β-sheet (65.9%). The carbonyl group content of 2S-albumin was 4.45 nmol/mg, the active thiol group content was 39.95 μmol/g, the total thiol group content was 57.11 μmol/g, the surface hydrophobicity was 23.45 μg, and the denaturation temperature was 43.3 ℃. These results can provide a theoretical support for the development and utilization of Xinjiang grown almond.
almond; 2S-albumin; purifi cation; structure characteristics
10.7506/spkx1002-6630-201717007
TS255.1
A
1002-6630(2017)17-0036-06引文格式:
2017-02-14
国家自然科学基金青年科学基金项目(31401644);兵团中青年创新领军人才项目(2016BC001)
李述刚(1979—),男,教授,硕士,研究方向为食品蛋白质化学与应用。E-mail:lishugang2010@163.com *通信作者:陆健康(1983—),男,副教授,硕士,研究方向为农产品加工。E-mail:lujiankang301@163.com马美湖(1957—),男,教授,博士,研究方向为食品蛋白质化学。E-mail:mameihuhn@163.com
