体外模拟消化对车前子来源毛蕊花苷抑制黄嘌呤氧化酶活性的影响
2017-09-09张阿惜陈雪洋余迎利夏冬华付桂明
万 茵,张阿惜,陈雪洋,陈 明,余迎利,夏冬华,付桂明,4,*
(1.南昌大学食品学院,食品科学与技术国家重点实验室,江西 南昌 330 047;2.南阳农业职业学院农业科学系,河南 南阳 473000;3.南昌大学第一附属医院,江西 南昌 330006;4.南昌大学中德食品工程中心,江西 南昌 330047)
体外模拟消化对车前子来源毛蕊花苷抑制黄嘌呤氧化酶活性的影响
万 茵1,张阿惜1,陈雪洋2,陈 明3,余迎利1,夏冬华1,付桂明1,4,*
(1.南昌大学食品学院,食品科学与技术国家重点实验室,江西 南昌 330 047;2.南阳农业职业学院农业科学系,河南 南阳 473000;3.南昌大学第一附属医院,江西 南昌 330006;4.南昌大学中德食品工程中心,江西 南昌 330047)
研究体外模拟消化各阶段的条件对车前子来源毛蕊花苷抑制黄嘌呤氧化酶活性的影响。结果发现毛蕊花苷含量在模拟消化作用4 h后降低,降低程度最高的是肠菌孵育样液,毛蕊花苷含量减少率为(71.26±0.96)%,其次是累加消化样液,达(28.46±0.50)%。模拟消化后各样液的黄嘌呤氧化酶抑制作用均有所增加,增加程度最大的为肠菌孵育样液(P<0.05),其次为累加消化样液。经高效液相色谱-质谱联用分析发现,各消化样液中均能检出毛蕊花苷的代谢苷元咖啡酸和羟基酪醇,活性实验表明后两者对黄嘌呤氧化酶的体外抑制活性高于前体毛蕊花苷。毛蕊花苷降解成具有黄嘌呤氧化酶体外抑制活性的产物可能是其在体内表现生理活性的途径之一。
毛蕊花苷;模拟消化;黄嘌呤氧化酶;体外抑制作用;苷元
万茵, 张阿惜, 陈雪洋, 等. 体外模拟消化对车前子来源毛蕊花苷抑制黄嘌呤氧化酶活性的影响[J]. 食品科学, 2017, 38(17): 8-13. DOI:10.7506 /spkx1002-6630-201717002. http://www.spkx.net.cn
WAN Yin, ZHANG Axi, CHEN Xueyang, et al. Effects of in vitro simulated degradation on the xanthine oxidase inhibitory activity of verbascoside from Plantago asiatica L.[J]. Food Science, 2017, 3 8(17): 8-13. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201717002. http://www.spkx.net.cn
大粒车前子是一种保健食品资源,被报道具有降高尿酸血症模型大鼠血尿酸水平的作用,其主要有效成分之一为毛蕊花苷[1]。毛蕊花苷(verbascoside)又名类叶升麻苷、洋丁香苷,为最早发现的苯乙醇苷类物质之一,在药食两用或可用于保健食品资源等双子叶植物中广泛存在,被报道具有许多生理活性,但其作用机理仍不完全清楚。国内外可见关于毛蕊花苷的分布和体内代谢的研究,如甘萍等[2]研究了类叶升麻苷在大鼠体内的药代动力学、组织分布特征;吴培培等[3]建立了类叶升麻苷血药浓度方法,可用于其体内定量分析;Qi Meng等[4]使用超高效液相色谱-飞行时间电喷雾离子化-四极杆串联质谱法研究了毛蕊花苷在大鼠体内代谢产物及代谢途径。但是关于毛蕊花苷在体外水解的报道较少,基本没有涉及到主要水解产物种类及功能。Vertuani等[5]研究发现毛蕊花苷在中性环境(pH 7)中2~3 周后完全降解,而在弱酸性环境(pH 5)能保持最高比例的原型(73%),pH 6时稳定性居中。D’Imperio等[6]亦报道毛蕊花苷在pH 3环境下稳定性大于pH 7,24 h后回收率几乎100%,而中性环境下毛蕊花苷回收率为62.4%。Cardinali等[7]报道在体外人工胃液和小肠液消化条件下毛蕊花苷原型很不稳定,在实验条件下回收率为53%,推断毛蕊花苷的低生物利用度很大程度上是受其在机体胃肠道中的低回收率影响之故。
近年来研究表明,大多数糖苷类化合物的脂溶性小,难以直接进入体内,生物利用度相对较低,需要通过消化分解为苷元来发挥其生理活性[8-11],如黄酮苷类物质在生物机体内是以其配糖基形式表现活性[12]。生物体消化道中除了各种消化酶外,还存在大量的肠道菌群,在肠道环境中厌氧发酵可产生多种水解酶促进消化[13],尤其是肠道细菌的苷键水解酶对苷类天然物质进行的水解[14]。人体尿液和粪便中既含有人体自身代谢产生的物质,也包含肠道菌群代谢产生的物质[15-16]。大肠末端的微生物种类最多、数量最大,约占肠道微生物总量的35%~50%[17],常被用于模拟肠道菌群。
本实验通过人工唾液、人工胃液、人工小肠液、模拟生物体消化顺序体外累加消化、肠菌培养液孵育进行毛蕊花苷的体外水解,检测毛蕊花苷的含量变化,分析水解产物,同时研究它们对黄嘌呤氧化酶(xanthione oxidase,XOD)活性的抑制作用,以期为毛蕊花苷的体内代谢及大粒车前子的生理活性物质基础研究提供参考。
1 材料与方法
1.1 材料与试剂
毛蕊花苷为本实验室从江西产大粒车前子(车前科车前属大粒车前Plantigo asiatica L.的种子,2015年 11月产自江西泰和地区)原料中制得,经质谱(mass spectrometry,MS)、核磁共振波谱确定结构,高效液相色谱(high performance liquid chromatography,HPLC)检测纯度为98.6%。
甲醇(色谱纯) 美国Honeywell公司;咖啡酸(caffeic acid)标准品、氯化硝基四氮唑蓝(nitrotetrazolium blue chloride,NBT) 上海Aladdin试剂公司;羟基酪醇(hydroxytyrosol,纯度≥98%)北京恒元启天化工技术研究院与北京世纪奥科生物技术有限公司联合研制;甲酸(色谱纯)、浓盐酸(37%)、NaOH、K2HPO4、KH2PO4、NaCl、(NH4)2SO4、CaCl2、MgSO4·H2O、L-半胱氨酸·H2O、L-抗坏血酸、Na2CO3、牛肉膏、蛋白胨、Na2HPO4、NaH2PO4(均为分析纯) 天津永大化学试剂公司;别嘌呤醇 上海晶纯试剂有限公司;黄嘌呤(纯度98%,生化试剂)、XOD(酶活力≥0.4 U/mg pro)、胃蛋白酶(来源于猪胃黏膜,酶活力400~800 U/mg pro)、胰蛋白酶(来源于猪胰腺,酶活力1 500 U/mg) 美国Sigma公司;α-淀粉酶(酶活力2×104U/mL) 无锡市协达生物制品有限公司;蒸馏水 屈臣氏公司。
1.2 实验动物
SD雄性健康大鼠,体质量200~220 g,购于湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2013-0004。
1.3 仪器与设备
FA1604电子天平、PHS-3C pH计、UV-7504紫外分光光度仪 上海精密科学仪器有限公司;E2695 HPLC仪 美国Waters公司;1200 HPLC-G6430 MS联用仪 美国Agilent公司;C-1厌氧产气袋、C-43圆底立式培养袋 日本三菱公司;5810R冷冻型台式大容量高速离心机 德国Eppendorf公司;H.S.G电热恒温水浴锅 上海讯大机电仪器仪表有限公司;Finnpipette移液枪 美国Thermo Fisher Scientifi c公司。
1.4 方法
1.4.1 毛蕊花苷体外模拟消化样品的制备
1.4.1.1 消化液的配制
0.1 mol/L盐酸溶液:用移液管吸取0.84 mL的浓盐酸加入已经含有少许蒸馏水的100 mL容量瓶中,加水定容,摇匀配制成0.1 mol/L盐酸溶液。
0.1 mol/L NaOH溶液:用电子天平精密称取0.40 g NaOH,用蒸馏水溶解后定容于100 mL的容量瓶中。
人工唾液[18]:分别称取2.38 g Na2HPO4、0.19 g KH2PO4和8.00 g NaCl溶于1 L蒸馏水中,将溶液的pH值调至6.75后加入α-淀粉酶,至溶液的酶活力调至200 U/mL。
人工胃液:将0.1 mol/L稀盐酸,用蒸馏水稀释至pH 1.2。每100 mL的pH 1.2的盐酸溶液中加入0.20 g胃蛋白酶,混匀。
人工小肠液[19]:取KH2PO46.80 g加500 mL蒸馏水溶解,用0.1 mol/L NaOH溶液回调pH值至6.8。每100 mL缓冲液中加入0.20 g胰蛋白酶,混匀。
1.4.1.2 毛蕊花苷体外模拟单独消化样品的制备
精密吸取10.0 mg/mL的毛蕊花苷溶液50 μL于安瓿管中,分别用以上3 种人工消化液稀释至1 mL,涡旋混匀,每组3 个平行样。消化液样品37 ℃水浴孵育4 h,用甲醇稀释1 倍,4 000 r/min离心5 min后取上清液,即得各样品。水解0 h的样品作为对照组,空白组用等量蒸馏水代替毛蕊花苷。
1.4.1.3 按照生物体消化顺序的累加消化样品的制备
精密吸取50 μL 10.0 mg/mL毛蕊花苷溶液于安瓿管中,先用人工唾液稀释至1 mL,涡旋混匀,每组3 个平行样。将样品37 ℃水浴孵育4 h,用甲醇稀释1 倍,4 000 r/min离心5 min后取上清 液1 mL,用N2吹干后加入1 mL人工胃液,涡旋混匀,37 ℃水浴孵育4 h,用甲醇稀释1 倍后4 000 r/min离心5 min,取上清液1 mL,经N2吹干后加入1 mL人工小肠液,涡旋混匀,37 ℃水浴,孵育4 h,用甲醇稀释1 倍后4 000 r/min离心5 min,取上清液1 mL经N2吹干,再用1 mL甲醇复溶,即得模拟体内消化顺序的水解样品。水解0 h的样品作为对照组,空白组用等量蒸馏水代替毛蕊花苷。
1.4.2 毛蕊花苷大鼠肠菌培养消化样品的制备
厌氧培养液的制备[20]:37.5 mL 0.78% K2HPO4、37.5 mL混合液(0.47% KH2PO4、1.18% NaCl、1.2% (NH4)2SO4、0.12% CaCl2、0.25% MgSO4·H2O)、2 mL 25% L-抗坏血酸、0.5 g L-半胱氨酸·H2O、50 mL 8% Na2CO3、1 g蛋白胨、1 g牛肉膏,加蒸馏水至1 L,将pH值调至7.5~8.0范围内。
肠菌培养液的制备[21]:取SD大鼠的新鲜粪便和生理盐水按1∶4(m/V)的比例混合制成混悬液,2 000 r/min离心15 min后取上清液即为大鼠肠道菌液。将肠道菌液与厌氧培养液按1∶9(V/V)混匀后得到大鼠肠菌培养液。取一定体积肠菌培养液于121 ℃灭菌15 min,制得空白肠菌培养液。
毛蕊花苷与SD大鼠肠道菌群的共培养:分别取上述大鼠肠菌培养液1 mL,加入10.0 mg/mL的毛蕊花苷溶液0.05 mL,混匀后,37 ℃厌氧培养4 h,加入1 mL甲醇使反应终止,漩涡振荡2 min后,10 000 r/min离心10 min,上清液用0.22 μm滤膜过滤,同时做空白实验。
1.4.3 XOD体外抑制作用
[22]的方法,取单独消化、累加消化和肠菌培养消化样品各1 mL,加入XOD 0.2 mL(0.1 U/mL)、2 mL pH 7.8磷酸盐缓冲液(phosphate buffered saline, PBS),37 ℃水浴中孵育15 min,再加入2.0 mmol/L黄嘌呤溶液1.6mL、1.8 mg/mL NBT溶液0.2 mL,37 ℃水浴30 min,测定560 nm波长处的吸光度A1。将毛蕊花苷水解溶液换成PBS溶液,测定空白对照组的吸光度A0。根据以下公式计算各组样品对XOD的抑制率。
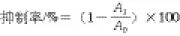
1.4.4 HPLC-MS定性分析
水解液过0.22 μm滤膜,取10 μL用HPLC-MS检测组分出峰情况,与对照品比较,分析毛蕊花苷的水解情况及其水解产物结构。
色谱条件[23]:Symmetry C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇(A)和0.1%甲酸水溶液(B),比例为40∶60(V/V);流速0.7 mL/min;2998PDA二极管阵列检测器,检测波长280 nm,柱温35 ℃;进样量10 μL。
质谱条件:扫描范围m/z 100~1 000;干燥气温度350 ℃;干燥气流速10.0 L/min;雾化气压力50 psi;离子化方式:电喷雾(electron spray ionization,ESI);ESI电压:3 000 V。
1.5 数据统计分析
所有样品平行测定3 次,数据结果均用±s表示,采用SPSS 19.0统计软件进行数据处理和统计分析。
2 结果与分析
2.1 不同条件对毛蕊花苷的水解作用
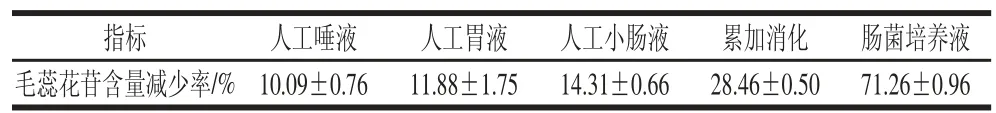
表 1 毛蕊花苷在不同消化液中的含量变化情况Table 1 Reduction of verbascoside content under different digestion conditions
HPLC检测水浴4 h后各消化样液中残留毛蕊花苷含量,计算毛蕊花苷含量的减少比率(表1)。结果表明毛蕊花苷含量均有下降,减少率大小顺序为:肠菌培养液消化>累加消化>人工小肠液消化>人工胃液消化≈人工唾液消化。结果表明毛蕊花苷在胃液比小肠液中稳定,与Vertuani[5]和D’Imperio[6]等分别报道的毛蕊花苷在酸性环境(pH 5、3)比中性环境(pH 7)中稳定一致。模拟累加消化导致毛蕊花苷含量下降程度高于单一消化液,但小于三者减少率之和。毛蕊花苷与肠道菌群液孵育4 h时其含量下降了70%以上,说明肠道菌群分解毛蕊花苷是其降解的主要因素。
2.2 毛蕊花苷不同水解溶液对XOD活性的抑制作用
由图1可知,毛蕊花苷的各水解样液对XOD活性的抑制率均强于水解前;水解前后抑制率相差最大的是肠菌培养液(P<0.05),其次是模拟生物体累加消化样液,而经人工唾液、人工胃液和人工小肠液水解后的样液抑制率略有增加。
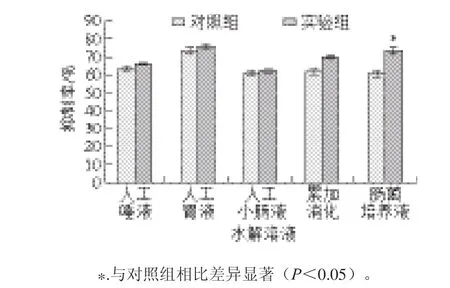
图 1 毛蕊花苷经不同消化条件作用前后对XOD活性的抑制作用对比Fig. 1 XOD inhibitory effect of verbascoside after different digestion treatments

图 2 消化后毛蕊花苷含量减少率与酶活性抑制率增加值的比较Fig. 2 Comparison of percentage reduction in verbascoside content and increase in XOD activity after different degradation treatments
如图2所示,经消化后,毛蕊花苷含量减少率曲线与酶活性抑制率增加程度的曲线趋势基本相同,即毛蕊花苷含量降低越多,酶活性抑制率增加越明显,结合文献[4]推测可能是毛蕊花苷降解成活性更高的产物所致。
2.3 不同消化条件下毛蕊花苷体外消化产物的HPLC-MS分析
文献报道天然小分子苷类物质进入机体后,首先会被降解为苷元再被机体吸收[24]。毛蕊花苷化学结构中有2 个糖基,分别为1 个鼠李糖和1 个葡萄糖基,其苷元为咖啡酸和羟基酪醇,后二者是典型的天然活性单元[25]。本研究将各消化样品进行HPLC-MS分析,检测毛蕊花苷在不同消化条件下降解产生苷元情况。
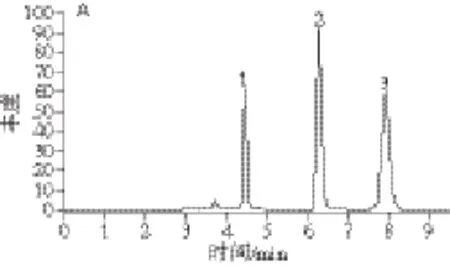
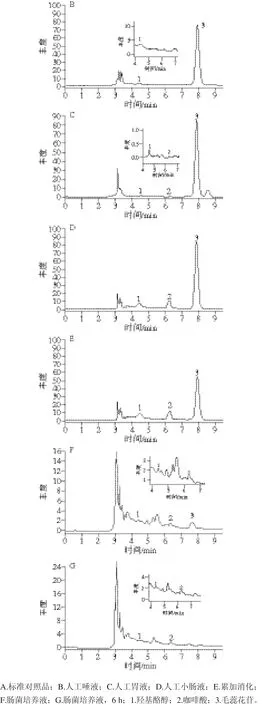
图 3 毛蕊花苷在不同消化环境下的HPLC图Fig. 3 HPLC profi les of degradation products of verbascoside in different digestion environments

表 2 羟基酪醇和咖啡酸在各消化样品中的质量浓度Table 2 The concentrations of hydroxytyrosol and caffeic acid in different digestion samples
图3A为毛蕊花苷及其苷元羟基酪醇、咖啡酸对照品的谱图,峰1为羟基酪醇,保留时间4.43 min;峰2为咖啡酸,保留时间6.25 min;峰3为毛蕊花苷,保留时间7.87 min。结合图3和表2数据可知,人工唾液和毛蕊花苷消化液中检测到微量羟基酪醇(图3B),人工胃液+毛蕊花苷消化液中检测到微量羟基酪醇和咖啡酸(图3C),此两图显示毛蕊花苷在人工唾液或人工胃液作用下的降解程度小;人工小肠液及毛蕊花苷作用液中能检测到羟基酪醇和咖啡酸(图3D);毛蕊花苷、人工唾液4 h、人工胃液4 h及人工小肠液4 h的累加消化液中检出羟基酪醇和咖啡酸,且毛蕊花苷峰降低(图3E);肠菌液孵育4 h的样液的谱图中毛蕊花苷峰显著降低,羟基酪醇峰和咖啡酸峰较高(图3F),表明毛蕊花苷降解程度较大;延长孵育时间至6 h,则毛蕊花苷峰消失(图3G),说明已全部被肠道菌群降解,生产羟基酪醇、咖啡酸和其他降解产物。
综上所述,毛蕊花苷在模拟人体唾液、胃液消化条件下,少部分可能降解,发生酯键及糖苷键的断裂生成咖啡酸和羟基酪醇,大部分保持原型形式。而在小肠液和累加消化后毛蕊花苷含量下降较大的原因可能是,在模拟肠道消化环境下毛蕊花苷发生了氧化分解之故,包括毛蕊花苷在内的多酚类物质发生自氧化产生各种氧化产物[26]。而肠道菌群对毛蕊花苷的降解能力最强,作用4 h可使大部分毛蕊花苷降解,生成羟基酪醇和咖啡酸等产物,6 h后可使毛蕊花苷完全降解。
2.4 毛蕊花苷及其苷元对XOD的体外抑制作用

表 3 毛蕊花苷及其苷元对XOD的体外抑制结果Table 3 XOD inhibitory activity of verbascoside and its aglycone metabolites
以别嘌呤醇作为阳性对照,不同质量浓度毛蕊花苷、咖啡酸及羟基酪醇对XOD的体外抑制结果如表3所示。6.250 μg/mL别嘌呤醇对XOD活性的体外抑制率达(87.13±1.13)%。6.250 μg/mL毛蕊花苷、咖啡酸、羟基酪醇对XOD的体外抑制率分别为(18.81±1.41)%、(36.58±1.26)%、(31.07±1.96)%。且随着质量浓度的升高,毛蕊花苷、咖啡酸、羟基酪醇在体外对XOD的抑制率呈上升趋势。当质量浓度为156.250 μg/mL时,三者对体外XOD的抑制率分别达到(55.46±1.03)%、(67.33±1.20)%和(70.90±1.35)%。
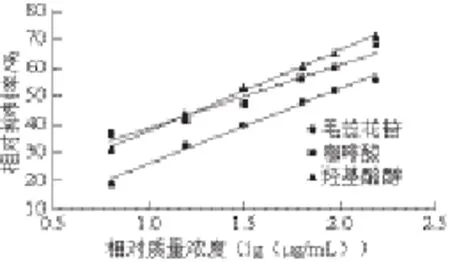
图 4 不同质量浓度的毛蕊花苷、咖啡酸、羟基酪醇对XOD的抑制曲线Fig. 4 XOD inhibitory effects of verbascoside, caffeic acid and hydroxytyrosol at different concentrations
由图4可知,毛蕊花苷、咖啡酸、羟基酪醇对XOD的半数抑制浓度(half maximal inhibitory concentration,IC50)分别为81.15、32.06、27.04 μg/mL,咖啡酸和羟基酪醇均具有较强的抑酶活性,与文献[27-28]报道结果相符,且IC50明显低于毛蕊花苷,表明它们对XOD的体外抑制作用强于毛蕊花苷。
3 结 论
本实验室前期药代动力学研究表明,毛蕊花苷的脂水分配系数小[29],故不易被机体直接吸收,文献亦报道其生物利用度不高[30]、活性较低。在体内消化过程中,毛蕊花苷易被肠道菌群降解生成咖啡酸和/或羟基酪醇等代谢产物,被机体吸收、发挥生理作用,可能是毛蕊花苷具有抑制XOD活性的途径之一。
毛蕊花苷在分别经人工唾液、人工胃液、人工小肠液、模拟生物体消化顺序体外累加消化,以及与肠菌培养液于37 ℃孵育4 h后,得到的各消化液样品对XOD的体外抑制作用均强于消化前,且酶活性抑制率的增加幅度基本随毛蕊花苷降解程度的增加而加大,其中肠菌培养消化样品对XOD的抑制作用增强最显著(P<0.05),毛蕊花苷的降解程度也最大。HPLC-MS分析表明在消化液中检出了毛蕊花苷的代谢苷元咖啡酸和羟基酪醇。咖啡酸、羟基酪醇(IC50分别是32.06、27.04 μg/mL)对XOD的体外抑制作用强于毛蕊花苷(IC50为81.15 μg/mL)。因此,水溶性高、吸收率低导致生物利用度低的毛蕊花苷极有可能是通过在模拟机体各消化环境中发生酯键及糖苷键的断裂,生成苷元咖啡酸和羟基酪醇,导致了酶活性抑制率的增强。研究结果对揭示毛蕊花苷在人体中的抑制血尿酸升高作用机理具有重要意义,也可以为毛蕊花苷抗痛风产品的开发提供理论依据。
参考文献:
[1] 皮璟渔, 苏昱, 李娅, 等. 大粒车前子苯乙醇苷提取物的精制及其降血尿酸作用[J]. 食品工业科技, 2016, 37(12): 339-344. DOI:10.13386/j.issn1002-0306.2016.12.056.
[2] 甘萍, 霍仕霞, 白鹏, 等. 类叶升麻苷在大鼠体内的药代动力学及组织分布研究[J]. 中国药理学通报, 2014, 30(3): 417-420. DOI:10.3969/j.issn.1001-1978.2014.03.026.
[3] 吴培培, 霍仕霞, 高莉, 等. 类叶升麻苷在大鼠体内的药代动力学研究[J]. 中国中药杂志, 2012, 37(21): 3312-3315. DOI:10.4268/ cjcmm20122132.
[4] QI Meng, XIONG Aizhen, LI Pengfei, et al. Identification of acteoside and its major metabolites in rat urine by ultra-performance liquid chromatography combined with electrospray ionization quadrupole time-of-flight tandem mass spectrometry[J]. Journal of Chromatography B, 2013, 940: 77-85. DOI:10.1016/ j.jchromb.2013.09.023.
[5] VERTUANI S, BEGHELLI E, SCALAMBRA E, et al. Activity and stability studies of verbascoside, a novel antioxidant, in dermocosmetic and pharmaceutical topical formulations[J]. Molecules, 2011, 16(8): 7068-7080. DOI:10.3390/molecules16087068.
[6] D’IMPERIO M, CARDINALI A, D’ANTUONO I, et al. Stabilityactivity of verbascoside, a known antioxidant compound, at different pH conditions[J]. Food Research International, 2014, 66: 373-378. DOI:10.1016/j.foodres.2014.09.037.
[7] CARDINALI A, LINSALATA V, LATTANZIO V, et al. Verbascoside from olive mill waste water: assessment of their bioaccessibility and intestinal uptake using an in vitro digestion/Caco-2 model system[J]. Journal of Food Science, 2011, 76(2): 48-54. DOI:10.1016/j.foodres.2014.09.037.
[8] HASEGAWA H, UCHIYAMA M. Antimetastatic efficacy of orally administered gensenoside Rb1 in dependence on intestinal bacterial hydrolyzing potential and signifance of treatment with an active bacterial metabolism[J]. Plant Medica, 1998, 64(8): 696-700. DOI:10.1055/s-2006-957560.
[9] 徐皓. 积雪草的生物学特性及利用价值[J]. 特种经济动植物, 2005, 8(8): 24-25. DOI:10.3969/j.issn.1001-4713.2005.08.024.
[10] 沈岚, 徐德生, 冯怡, 等. 大鼠肠内细菌对麦冬皂苷D 代谢的研究[J]. 中国中药杂志, 2005, 30(8): 618-620. DOI:10.3321/ j.issn:1001-5302.2005.08.017.
[11] BAE E A, HAN M J, LEE K T, et al. Metabolism of 6 -O-xylosyltectoridin by human intestinal bacteria and their hypolycemic and in vitro cytotoxic activites[J]. Biological & Pharmaceutical Bulletin, 2000, 22(12): 1314-1318. DOI:10.1248/ bpb.22.1314.
[12] WALLE T. Absorption and metabolism of flavonoids[J]. Free Radical Biology and Medicine, 2004, 36(7): 829-837. DOI:10.1016/ j.freeradbiomed.2004.01.002.
[13] 徐婷, 刘璐, 张东军. 肠道菌群与人体代谢[J]. 中国微生态学杂志, 2014, 26(7): 858-862. DOI:10.13381/j.cnki.cjm.201407033.
[14] HE J X, GOTO E, AKAO T, et al. Interaction between Shaoyao-Gancao-Tang and a laxative with respect to alteration of paeonifi orin metabolism by intestinal bacteria in rats[J]. Phytomedicine, 2007, 14(7/8): 452-459. DOI:10.1016/j.phymed.2006.09.014.
[15] ZHAO L P, SHEN J. Whole-body systems approaches for gut microbiota-targeted, preventive healthcare[J]. Journal of Biotechnology, 2010, 149(3): 183-1190. DOI:10.1016/ j.jbiotec.2010.02.008.
[16] MCFALL-NGAI M. Are biologists in ‘future shock’? symbiosis integrates biology across domains[J]. Nature Reviews Microbiology, 2008, 6(10): 789-792. DOI:10.1038/nrmicro1982.
[17] SALMINEN S, ISOLAURI E, SALMINEN E. Clinical uses of probiotics for stabilizing the gut mucosal barrier: successful strains and future challenges[J]. Antonie van Leeuwenhoek, 1996, 70(2): 347-358. DOI:10.1016/j.foodres.2014.09.037.
[18] 杨红叶. 甜荞和苦荞多酚构成对比研究与其蒸制品的模拟消化分析[D]. 杨凌: 西北农林科技大学, 2011: 69.
[19] 王瑞国, 苏晓鸥, 樊霞, 等. 液相色谱-串联质谱法测定人工模拟猪消化液中3 种霉菌毒素[J]. 分析化学, 2015, 43(1): 1-6. DOI:10.11895/ j.issn.0253_3820.140672.
[20] 张怡红. 离体培养的肠道菌群对黄山药总皂苷的代谢研究[D].广州: 广东药学院, 2008: 68. DOI:10.7666/d.d044176.
[21] 刘树民, 杨补科, 卢芳, 等. 刺五加苷B、苷E在体外大鼠肠道菌群中的代谢[J]. 中国药师, 2011, 14(8): 1075-1077. DOI:10.3969/ j.issn.1008-049X.2011.08.001.
[22] 李思慧, 万茵, 付桂明, 等. 常见蔬菜醇提物对黄嘌呤氧化酶的抑制作用[J]. 南昌大学学报(理科版), 2015, 39(2): 163-167. DOI:10.13764/j.cnki.ncdl.2015.02.012.
[23] 万茵, 黄婧嫣, 苏昱, 等. HPLC同时测定毛蕊花糖苷、咖啡酸和羟基酪醇[J]. 分析试验室, 2016, 35(1): 30-33. DOI:10.13595/j.cnki. issn1000-0720.2016.0007.
[24] 陈志祥, 陆伟根. 苷类天然药物的生物药剂学研究进展[J]. 中成药, 2011, 33(1): 121-125. DOI:10.3969/j.issn.1001-1528.2011.01.031.
[25] KORKINA L G. Phenylpropanoids as naturally occurring antioxidants: from plant defense to human health[J]. Cellular and Molecular Biology, 2007, 53(1): 15-25. DOI:10.1170/T772.
[26] NEILSON A P, SONG B J, SAPPER T N, et al. Tea catechin autooxidation dimers are accumulated and retained by Caco-2 human intestinal cells[J]. Nutrition Research, 2010, 30(5): 327-340. DOI:10.1016/j.nutres.2010.05.006.
[27] NILE S H, KO E Y, KIM D H, et al. Screening of ferulic acid related compounds as inhibitors of xanthine oxidase and cyclooxygenase-2 with anti-inflammatory activity[J]. Revista Brasileira de Farmacognosia, 2015, 26(1): 50-55. DOI:10.1016/j.bjp.2015.08.013.
[28] WANG S H, CHEN C S, HUANG S H, et al. Hydrophilic ester-bearing chlorogenic acid binds to a novel domain to inhibit xanthine oxidase[J]. Planta Medica, 2009, 75(11): 1237-1240. DOI:10.1055/s-0029-1185521.
[29] 张伦宁, 付桂明, 万茵. 紫外分光光度法测定毛蕊花糖苷浓度及其油水分配系数[J]. 食品安全质量检测学报, 2014, 5(2): 528-532. DOI:10.3969/j.issn.1008-049X.2011.08.001.
[30] WU Y T, LIN L C, SUNG J S, et al. Determination of acteoside in Cistanche deserticola and Boschniakia rossica and its pharmacokinetics in freely-moving rats using LC-MS/MS[J]. Journal of Chromatography B, 2006, 844(1): 89-95. DOI:10.1016/ j.jchromb.2006.07.011.
Effects of in Vitro Simulated Degradation on the Xanthine Oxidase Inhibitory Activity of Verbascoside from Plantago asiatica L.
In this study, the effects of different stages of in vitro simulated digestion on the stability of Plantago asiatica L. seed verbascoside (PSV) we re explored. It was found that the concentration of PSV in all simulated digestion systems was reduced after digestion for 4 h, and the highest reduction of (71.26 ± 0.96)% was observed in the gut bacterial culture, followed by the simulated gastrointestinal digestion system ((28.46 ± 0.50)%). After simulated digestion, xanthine oxidase inhibitory activity in va rious simulated digestion systems increased, in particular in the gut bacterial culture (P < 0.05), followed by the simulated gastrointesti nal digestion system. The aglycone metabolites of verbascoside, caffeic acid and hydroxytyrosol, were detected from all simulated digestion systems by LC-MS. The in vitro xanthine oxidase inhibitory activity of caffeic acid and hydroxytyrosol was higher than that of verbascoside. The degradation of verbascoside into xanthine oxidase inhibitory metabolites is likely to be one of the effective ways to exert its physiological activity in vivo.
verbascoside; simulated digestion; xanthine oxidase; in vitro inhibition activity; aglycone
10.7506/spkx1002-6630-201717002
TS20 1.2
A
1002-6630(2017)17-0008-06引文格式:
2016-07-28
国家自然科学基金地区科学基金项目(31160316)
万茵(1976—),女,副教授,博士,研究方向为食品功能成分。E-mail:yinwan@ncu.edu.cn
*通信作者:付桂明(1972—),男,教授,博士,研究方向为食品科学与工程。E-mail:fuguiming@ncu.edu.cn
WAN Yin1, ZHANG Axi1, CHEN Xueyang2, CHEN Ming3, YU Yingli1, XIA Donghua1, FU Guiming1,4,*
(1. State Key Laboratory of Food Science and Technology, College of Food Science, Nanchang University, Nanchang 330047, China; 2. Department of Agricultural Sciences, Nanyang Vocational College of Agriculture, Nanyang 473000, China; 3. The First Affi liated Hospital of Nanchang University, Nanchang 330006, China; 4. Sino-German Food Engineering Center, Nanchang University, Nanchang 330047, China)
