不完全睡眠剥夺对青春期SD大鼠生长发育的影响
2017-09-08朱寅秋汪雅荻严国锋袁聪俐马政文
朱寅秋, 汪雅荻, 严国锋, 周 晶, 汪 静, 袁聪俐, 马政文
(1. 上海交通大学农业与生物学院, 上海200240; 2. 上海卢湾中学, 上海200025;3. 上海交通大学医学院实验动物科学部, 上海200025)
不完全睡眠剥夺对青春期SD大鼠生长发育的影响
朱寅秋1,3, 汪雅荻2, 严国锋3, 周 晶3, 汪 静3, 袁聪俐1, 马政文3
(1. 上海交通大学农业与生物学院, 上海200240; 2. 上海卢湾中学, 上海200025;3. 上海交通大学医学院实验动物科学部, 上海200025)
目的 观察不完全睡眠剥夺对青春期大鼠生长发育的影响,从而为充足睡眠对青少年生长发育的重要性提供实验参考依据。方法 4周龄SD大鼠(雌雄各半)随机分为正常对照组和三个睡眠剥夺实验组(睡眠9 h、睡眠6 h、睡眠3 h)。采用“小平台水环境”方法建立睡眠剥夺模型,观察SD大鼠在整个青春发育期(4~8周龄),实验组与对照组大鼠间体质量、体长、行为习惯及大脑海马发育情况等方面的变化。结果 实验组大鼠体质量、体长增长减缓(P<0.01); 行为躁狂易激惹、精神状态差甚至出现死亡; 性腺周围脂肪明显减少,性激素分泌减少。结论 长期不完全睡眠剥夺可能造成青春期SD大鼠发育迟缓。
睡眠剥夺; 青春期; 大鼠; 生长发育; 性激素
睡眠剥夺(睡眠缺失/不足, sleep deprivation)即睡眠时间至正常生理需要量以下。研究表明, 睡眠不足的人常伴有情绪异常、感知和学习记忆能力降低, 而青少年睡眠不足会影响身体和智力发育[1-5]。
有关睡眠对儿童生长发育影响的研究[6],缺乏实验动物的实验数据支持。长期不完全睡眠剥夺,接近于现实生活中的睡眠缺失情况。本课题模拟青少年长期不完全睡眠不足, 对4周龄青春期SD大鼠按组别每日给予不同时间的睡眠剥夺,连续4周。采用“小平台水环境”方法建立长期不完全睡眠剥夺模型,观测睡眠剥夺对大鼠在整个青春发育期(4~8周龄)的体质量、体长、行为习惯、性激素水平、性腺周围脂肪重量、性腺发育及大脑海马的影响,以期为青少年充足睡眠对生长发育的重要性提供实验参考依据。
1 材料与方法
1.1 实验动物
4周龄清洁级SD大鼠40只, 雌雄各半, 购自上海斯莱克实验动物有限公司(SCXK(沪)2012-0002)饲养于上海交通大学医学院[SYXK(沪)2013-0050]
1.2 实验器材
1.2.1 自制睡眠剥夺水台装置 用透明有机玻璃粘合,搭建60 cm×60 cm×30 cm的全包围有机玻璃盒子,盒子内用有机玻璃搭建9个高度5 cm顶部直径5 cm的圆柱形水台,该水台大小以只允许一只大鼠站立其上为准。通常装置内水面高度离水台1 cm左右。有机玻璃盒子上配有多个通气孔、透明有机玻璃上盖,以保持空气畅通,同时防止大鼠逃逸。
1.2.2 仪器、设备与试剂 称量天平(YB601N 上海海康电子仪器厂)、Thermo离心机(Legend micr 017)化学发光免疫测定仪(雅培, 美国Architect i2000)石蜡切片机(德国、Leica2235)。氯胺酮(福建古田药业,批号: 1507294)。
1.3 研究方法
1.3.1 实验动物分组 40只大鼠随机分为4组: 睡眠3 h(睡眠剥夺8 h)组、睡眠6 h(睡眠剥夺5 h)、睡眠9 h(睡眠剥夺2 h)组和正常对照组。自然状态下,4周龄大鼠的睡眠时间约为11 h/24 h。
1.3.2 大鼠睡眠剥夺模型建立 采用“小平台水环境法”, 4周龄大鼠实验组按组别每日分别在特殊水台上放置21 h(睡眠3 h组)、18 h(睡眠6 h组)和15 h(睡眠9 h组), 大鼠限制于水台上, 一旦瞌睡就会跌入水中, 强迫其清醒复位, 从而建立睡眠剥夺模型。睡眠剥夺实验实施至大鼠8周龄(性成熟), 为期4周。1.3.3 大鼠行为学观察 每日观察大鼠进食、被毛光泽、行为、习惯、精神状态变化。
1.3.4 大鼠生长发育相关指标观察 每2周检测一次,用称量天平称量大鼠的体质量; 用标准皮尺测量仰卧位大鼠从鼻尖到尾尖的距离为体长; 大鼠经麻醉(100 mg/kg 体质量)后, 心脏采血, 3 000 r/min离心15 min, 分离血清,用化学发光免疫测定仪检测孕酮、睾酮、雌二醇、催乳素水平。心脏采血后自由休息24 h,停止睡眠剥夺实验,使大鼠恢复。
1.3.5 大鼠性成熟后卵巢观察 至大鼠8周龄,取性腺周围脂肪称重,比较正常对照组与实验组之间的区别。取雌性大鼠卵巢,直接浸入质量分数4%多聚甲醛固定,4~5 d后梯度乙醇脱水、石蜡包埋,切片后苏木素-伊红染色(HE染色), 观察卵巢结构。
1.4 统计方法
所有数据用x-± s表示,采用Prism(4.5版本)软件,用One-way ANOVA进行统计学处理,在每个时间点上进行组间方差分析(Two-way ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 成功建立青春期SD大鼠睡眠剥夺模型
实验开始前(4周龄)心脏采血时有4只大鼠未能从麻醉中复苏。进入正式实验大鼠,对照组8只(雄性 =4, 雌性 =4), 9 h 组 9 只(雄性 =5, 雌性 =4)都经历4周睡眠剥夺, 没有死亡; 6 h组、3 h组于实验开始后1周内分别有1只和2只雄性大鼠死亡, 而在6周龄心脏采血后, 3 h组有一只雌性大鼠未能从麻醉中复苏。因此, 6 h组有8只大鼠(雄性=4, 雌性=4)、3 h组有6只大鼠(雄性=3, 雌性=3)完成整个实验。
2.2 发育期大鼠行为学观察
对照组与各实验组每日饲料消耗量, 雌性大鼠基本相同, 雄性大鼠中对照组略高于各实验组,尤其是6~8周龄, 而各实验组间同性别大鼠没有差别。
对照组大鼠被毛光滑、性格温顺、状态良好;9 h组与正常组差别不大; 6 h组大鼠毛发光泽度不够,开盖时偶有大鼠往外跳、试图逃跑,实验开始一周内1只雄性大鼠溺水; 3 h组大鼠毛发无光泽、个别被毛粗糙,眼球突出、状态较差,开盖时经常有大鼠往外跳、试图逃跑, 暴躁易激惹、狂躁尖叫、出现攻击行为、捕捉不易,实验开始一周内2只雄性大鼠溺水、1只雌鼠采血后死亡。
2.3 发育期大鼠生长发育相关指标变化
2.3.1 体质量变化 如表1所示, 实验初始各组大鼠体质量相似。6周龄时,各实验组大鼠体质量增长均低于对照组(P<0.01),雌性大鼠9 h组明显高于3 h组(P<0.01); 雄性大鼠9 h组与6 h、3 h组相比有统计学差异(P<0.05或P<0.01)。8周龄时, 各实验组大鼠体质量增长明显低于对照组(P<0.01)。雌、雄性大鼠3 h组均明显低于9 h、6 h组(P<0.01);9 h组与6 h组间也有统计学差异(P<0.01)。
2.3.2 体长变化 与体质量变化趋势基本一致,详见表1。
2.3.3 发育期大鼠性激素变化 由表2可知,6周龄时, 相同性别中对照组孕酮分泌明显高于各实验组(P<0.001); 8周龄时, 各组内雄性与雌性大鼠的孕酮含量有显著性差异(P<0.001)。雌性大鼠9 h、6 h组及对照组的组内8周龄与4周龄孕酮有显著差异(P<0.01);雄性对照组大鼠8周龄孕酮含量明显低于6周龄(P<0.05)。雌性大鼠睾酮8周龄时对照组与3 h组有统计学差异(P<0.05); 8周龄时雄性大鼠睾酮对照组与6 h、3 h组之间有统计学差异(P<0.05和P<0.001),9 h组与3 h组之间有统计学差异(P<0.01)。对照组雌雄大鼠在8周龄与4周龄的睾酮有统计学差异(P<0.05, P<0.01)。6周龄时, 实验组与对照组无统计学差异。8周龄时, 雌性大鼠雌二醇对照组与6 h组之间有统计学差异(P<0.05); 相同周龄雌雄大鼠之间无统计学差异, 相同性别各实验组间有显著差异(P<0.01)。各组雌雄大鼠血清中的催乳素含量在4到8周内维持在相似水平, 且各组之间无统计学差异。
2.4 SD大鼠性成熟后的性腺周围脂肪、卵巢组织的观察
2.4.1 性腺周围脂肪变化 SD大鼠在8周龄时解
剖、分离性腺周围包裹的脂肪,并称重。正常组雌性大鼠卵巢周围的脂肪重量几乎是各实验组脂肪重量的10倍(P<0.001), 而各实验组间没有统计学差异。正常组雄性大鼠睾丸周围的脂肪重量是各实验组脂肪重量的3.36~6.85倍(P<0.001), 9 h、6 h、3 h实验组性腺周围脂肪的重量依次降低, 但组间没有统计学差异。
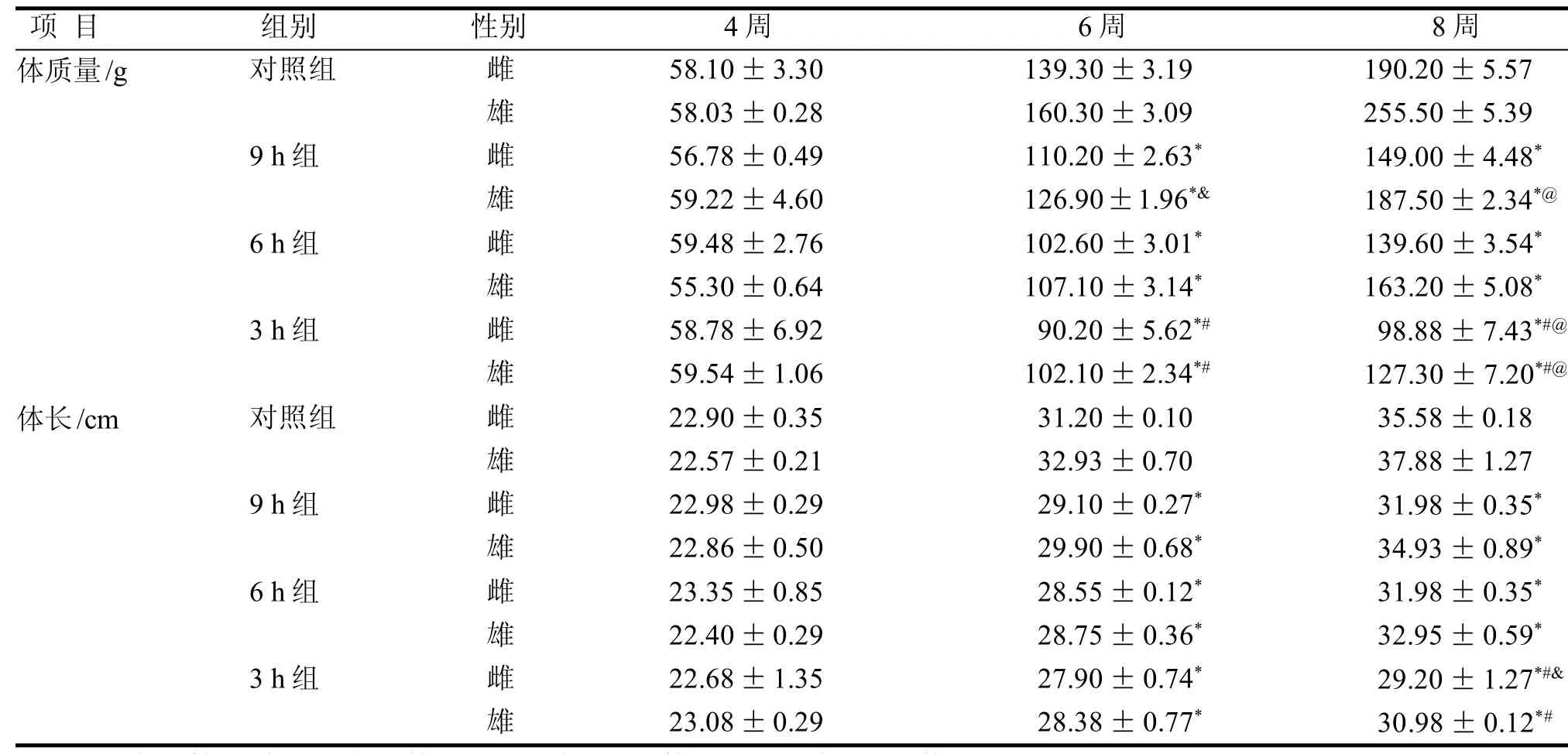
表 1 大鼠各阶段体质量及体长
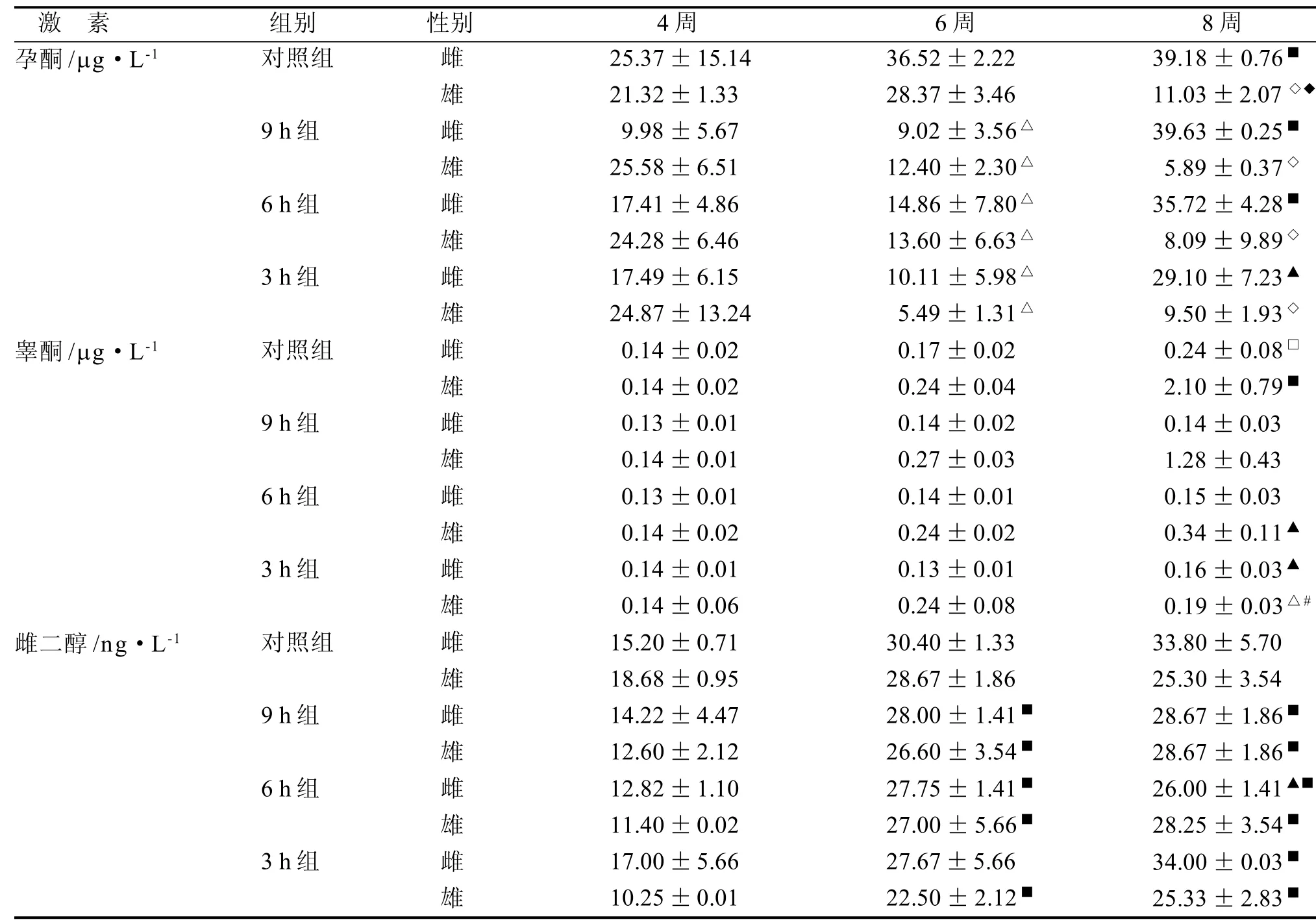
表 2 大鼠各阶段激素水平
2.4.2 卵巢发育 SD雌性大鼠8周龄时, 正常对照组和各实验组的卵巢已基本发育成熟。卵巢外覆结缔组织白膜。卵巢外周部的皮质较厚, 含有发育不同阶段、大小不一的卵泡(图1,对照组: A-B; 6 h组: G-I),可见卵泡腔较大的次级卵泡(*),以及很大的黄体(图1,A, D, G, J中标记“L”)。中央部为髓质(图1,A中“#”标记处),结缔组织较疏松,无卵泡, 含血管较多。初级卵泡发育成为次级卵泡,后者有一个更大的卵泡腔(图1, C和I),初级卵母细胞(图1,C和I中“△”所指)位居卵泡一侧并与周围的卵泡细胞凸向卵泡腔,形成卵丘(图1,C和I中“↑”所指),卵泡腔周围密集的卵泡细胞(又称颗粒细胞)形成颗粒层(图1, C和I中“▲”所指), 其外侧为卵泡膜。卵泡膜内层细胞较多、胞质染色浅, 称膜细胞。卵泡发育中分泌的雌激素是由颗粒细胞和膜细胞协同作用生成的。
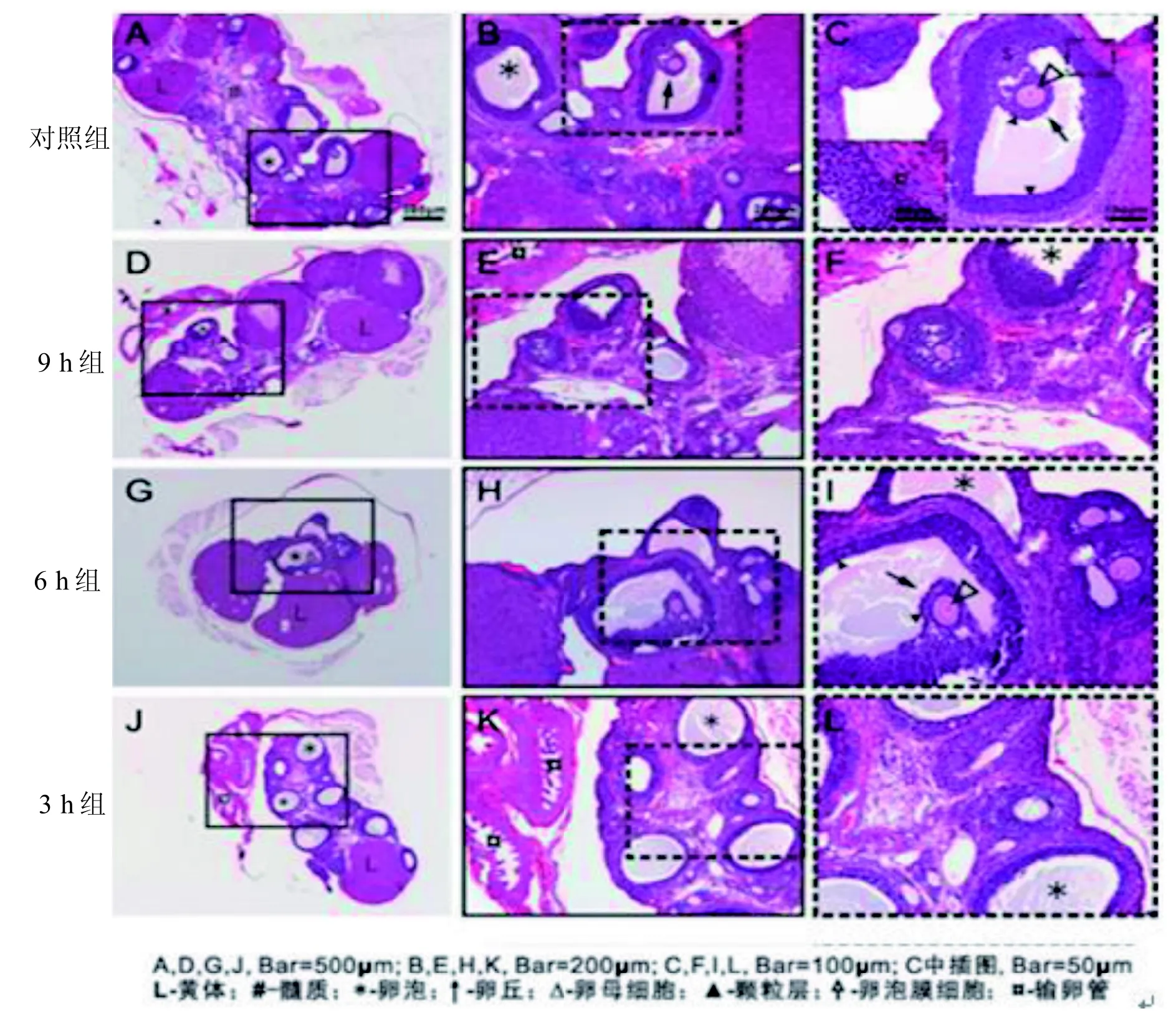
图1 8周龄雌性SD大鼠卵巢结构
图1中E和K显示输卵管(¤)结构。黏膜皱襞发达, 皱襞高而分支多; 肌层薄, 外膜为疏松结缔组织。
3 讨论
了解睡眠剥夺对机体生长、发育造成的影响,并采取相应措施减少睡眠剥夺将具有实际意义。
睡眠剥夺是一种经典的内源性应激[7],可激活人体下丘脑-垂体-肾上腺皮质轴(HPA轴),致机体内分泌、免疫、泌尿生殖、神经精神系统等功能紊乱,甚至导致死亡。本实验中4周龄SD大鼠开始睡眠剥夺后一周内,6 h组和3 h组分别有1只雄性和2只雄性大鼠死亡,并随着周龄增长,各实验组大鼠虽然状态不好(睡眠越少,状态越差),但是再没有出现死亡现象。提示年龄越小,睡眠剥夺后造成的影响越严重; 而雄性相对雌性更易受应激,严重时或产生猝死现象。这与流行病学调查一致,睡眠时间的持续减少与人群猝死率的上升有关[7]。
各实验组大鼠在4周龄到8周龄发育过程中, 体质量与体长的增长都较正常对照组滞缓, 随着发育进程, 这种差异越明显; 而各实验组间也呈现差异, 睡眠时间越少, 增长越慢。青春期大鼠的体质量、体长增长可能直接与睡眠时间有关, 睡眠越少, 体质量体长增长越慢。Cohen等[8]应用平台法剥夺大鼠睡眠实验中,也表明睡眠剥夺可引起动物的体质量减轻及胸腺重量减轻, 机体免疫反应抑制等, 与本文实验结果相符。
正常组雌性大鼠孕酮分泌从4周龄开始持续上升,而各实验组则在6周龄时下降,然后再上升; 正常组及各实验组雌二醇分泌在6周龄时都较4周龄升高一倍,正常组与9 h组雌二醇分泌持续升高至8周龄,而6 h和3 h组雌二醇分泌则下降。提示剥夺青春期雌性大鼠睡眠可能使其发育延迟。正常组雄性大鼠睾酮分泌略有升高,8周龄时升高明显,而各实验组有升高也有降低,9 h组与6 h组不如正常组睾酮含量高, 其中6 h组与正常组比较有统计学差异,而3 h组睾酮分泌则下降。提示剥夺青春期雄性大鼠睡眠可能使其发育滞后。孙清梅等[9]曾报道,对青春期Wistar大鼠(4~5周龄)进行72 h睡眠剥夺,雌性大鼠雌二醇含量、雄性大鼠睾酮含量都较对照组明显降低,差异有统计学意义。这一结果显示短期、完全性睡眠剥夺会导致青春期大鼠性激素分泌减少。本文所用的不完全睡眠剥夺模型也显示了长期反复睡眠剥夺可能会使大鼠性激素分泌减少、发育滞后。有报道[5]睡眠剥夺后, HPA轴过度激活, 负反馈作用减弱,从而导致睡眠剥夺后性激素分泌减少,发育滞后。
性腺周围脂肪属于内脏脂肪的一种,雌激素通过结合脂肪细胞上的雌激素受体而作用于脂肪细胞,因此,脂肪含量与雌激素水平有关。脂肪越多,雌激素水平越高,而脂肪中的芳香酶也会将雄激素(睾酮)转化成雌激素。当脂肪含量少时,雌激素水平也会降低。典型的雌性和雄性脂肪分布方式出现在青春期,与血液循环中性激素水平的升高相关[10]。而在本文实验中睡眠剥夺的发育期大鼠,其性腺周围脂肪含量少,与对照组比较有明显的统计学差异。一方面反应了其体内脂肪少,另一方面青春期睡眠剥夺影响了性腺周围脂肪的分布和含量,可能是导致实验组雌激素含量减少的原因之一。尽管雌激素含量降低性腺周围脂肪减少,但是各组8周龄时卵巢发育基本正常。提示睡眠剥夺对雄性生殖系统的不良影响比对雌性生殖系统的影响可能更大些。
综上所述, 长期不完全睡眠剥夺(部分睡眠剥夺)会影响青春期大鼠生长、发育, 表现在体质量、体长增长缓慢, 性激素分泌减少, 性腺周围脂肪含量减少。因此, 睡眠剥夺对青春期身体影响是多方面的, 探究睡眠剥夺对身体影响机理, 对于寻求有效预防措施和干预手段、并指导青少年正确学习、睡眠具有重要意义
[1] 王晓宁. 儿童矮小262例病因分析[J]. 中国基层医药, 2005 12(12):1720-1721.
[2] Alatzoglou KS, Webb EA, Le Tissier P, et al. Isolated growt hormone deficiency (GHD) in childhood and adolescence recent advances [ J]. Endocr Rev, 2014, 35(3):376-432.
[3] 魏虹, 梁雁, 王燕逊. 矮小儿童的生长激素、胰岛素样生长因子轴功能的检查 [J]. 中华儿科杂志, 2005, 45(2):99 103.
[4] Ranke MB, Feldt Rasmussen U, Bang P, et al. How shoul insulin-like growth factor I be measured A consensus statemen[J]. Horm Res, 2001, 55 (Suppl 2):106-109.
[5] Sahin U, Ozturk O, Ozturk M. Habitual snoring in primar school children: prevalence and association with sleep related disorders and school performance [J]. Med Prin Pract, 2009, l8(6):458-465.
[6] 沈晓明, 江帆, 李生慧, 等. 睡眠对儿童生长发育影响的研究及其应用[J]. 上海交通大学学报: 医学版, 2012, 32(9)1209-1213.
[7] 杨佳琳, 宋红涛, 张理义, 等. 睡眠剥夺对青年人神经内分泌激素的影响[J]. 中华保健医学杂志, 2014, 16(6):439 441.
[8] Cohen HB, Dement WC. Sleep: changes in threshold t electroconvulsive shock in rats after deprivation o“paradoxical”phase[J]. Science, 1965, 150(3701):1318 1319.
[9] 孙清梅, 李冬艳, 冯铁娟, 等. 睡眠剥夺对青春期大鼠性激素水平的影响[J]. 中国校医, 2009, 3:269-270.
[10] 赵文燕, 董耀, 仇树林. 脂肪细胞雌激素受体的表达及其与人体脂肪分布的相关性[J]. 中国美容医学, 2005, 14(5)534-536.
Q95-33
B
1674-5817(2017)04-0295-05
10.3969/j.issn.1674-5817.2017.04.008
2016-05-06
2017-03-31
国家自然基金青年基金81200940和2013闵行区产学研合作基金
朱寅秋(1986-), 男, 硕士研究生, 从事动物实验与兽医研究。E-mail: zhuyq@shsmu.edu.cn
马政文(1972-), 女, 博士, 副研究员, 从事动物实验与神经生物学。E-mail: mazhengwen@shsmu.edu.cn袁聪俐(1981-), 男, 副研究员, 从事感染与免疫方面的研究。E-mail: yec@sjtu.edu.cn
