香烟烟雾对慢性阻塞性肺疾病大鼠肺功能及血清细胞因子水平影响
2017-09-08张金娟吴艳俊黄惠妍
熊 英, 张金娟, 李 玲, 陈 燕, 吴艳俊, 黄惠妍
(贵州医科大学1. 机能实验室(花溪区大学城), 贵阳550025; 2. 附属医院内科, 贵阳550004)
香烟烟雾对慢性阻塞性肺疾病大鼠肺功能及血清细胞因子水平影响
熊 英1, 张金娟1, 李 玲1, 陈 燕2, 吴艳俊1, 黄惠妍2
(贵州医科大学1. 机能实验室(花溪区大学城), 贵阳550025; 2. 附属医院内科, 贵阳550004)
目的 探讨被动吸烟联合气道内注入脂多糖(LPS)法制备大鼠慢性阻塞性肺疾病(COPD)模型过程中, 大鼠肺功能及血清中细胞因子水平的变化。方法 72只雄性SD大鼠随机均分为4周、6周、8周模型组,自然愈合3周、6周组和对照组。采用气管内两次注入LPS联合持续熏烟的方法建立COPD大鼠模型,动态监测被动吸烟过程中及停止熏烟后,动物肺功能指标0.3 s用力呼气容积(FEV0.3)及其与用力肺活量(FVC)比值(FEV0.3/FVC)的变化; 同时用酶联免疫吸附方法检测血清中白细胞介素8(IL-8)、白细胞介素10(IL-10)、肿瘤坏死因子α(TNF-α)含量,并进行相关分析。结果 与对照组比较, 各模型组 FEV0.3、FEV0.3/FVC、IL-10水平降低, IL-8、TNF-α水平升高(P均<0.05); 且随着熏烟时间延长细胞因子及肺功能指标变化更为显著。模型组IL-8、TNF-α水平与FEV0.3/FVC呈负相关(P<0.001, r=-0.579; P=0.034, r=-0.354)。与对照组比较, 自然愈合6周组IL-8、TNF-α水平下降(P均<0.05), IL-10升高(P<0.05),各自然愈合组FEV0.3、FEV0.3/FVC均低于对照组(P均<0.05)。结论 香烟烟雾刺激能显著影响COPD大鼠体内细胞因子水平。
慢性阻塞性肺疾病(COPD); 细胞因子; 动物模型; 香烟烟雾
随着人口老龄化和环境污染加重,世界卫生组织预计慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)导致的社会经济负担将进一步增加[1]。吸烟和反复感染是人类COPD的重要发病因素[2],被动吸烟复合气道内注入脂多糖(lipopolysaccharide, LPS)法建立的COPD大鼠模型具有发病机制与人类相似、造模方法容易掌握的优点, 是目前国内研究者常用的动物模型。该模型具有造模时间短,4周即可建立COPD大鼠模型[3,4]的优点,但亦存在实验动物短时间内需经受多种刺激(烟熏、LPS、麻醉、气管滴注机械损伤等),以及熏烟的剂量较大的缺点。香烟烟雾对动物气道的直接损害,以及机体对刺激的应激反应都会引起动物体内细胞因子水平的改变。本实验就香烟烟雾对COPD模型大鼠体内细胞因子水平的影响进行了探讨,以进一步明确该动物模型体内细胞因子水平变化的意义。
1 材料与方法
1.1 实验动物及饲养条件
72只清洁级雄性SD大鼠, 体质量(200±20) g第三军医大学大坪医院实验动物中心提供[SCXK(军)2012-0011]。于贵州医科大学实验动物中心[SYXK(黔)2012-0001]适应性饲养1周后用于实验环境温度18~25℃,通风良好。
1.2 主要仪器与试剂
HX200插管式呼吸传感器、BL-420S生物机能实验系统, 成都泰盟软件有限公司; 酶标仪, 美国BioTek公司; 黄果树(10 mg)过滤嘴香烟, 贵州中烟公司; 脂多糖(lipopolysaccharide, LPS)(L2880-10 mg),索莱宝生物技术有限公司; 白细胞介素8(interleukin-8,IL-8)、IL-10、肿瘤坏死因子α(tumour necrosis factor-alpha, TNF-α)试剂盒, 上海沪鼎生物技术有限公司; 有机玻璃熏烟箱(50 cm×40 cm×20 cm)自制。
1.3 实验方法
1.3.1 动物分组和造模方法 (1)动物分组: 计算机随机分组法将72只SD大鼠分成对照组、4周、6周和8周模型组、自然愈合3周和6周组,每组12只。(2)造模方法: 采用气管内滴注脂多糖联合持续熏烟的方法造模,于造模第1日和第14日,参照陈燕等[5]的方法将动物麻醉(质量分数8%水合氯醛4.5 mL/kg,腹腔注射)后行直视下气管插管术,除对照组注入等量生理盐水外,其余各组大鼠气道内均注入质量分数0.1%LPS溶液200 μL。从造模第2日起,除对照组外各组大鼠均予以被动吸烟,1 次 /日(参照前期的实验方法[6]: 将 6 只大鼠放入有机玻璃熏烟箱内, 同时点燃2支香烟并置于箱内两对角的位置,待自行燃尽后立即更换, 每次熏烟共需燃尽8支香烟, 约45 min)。4周、6周和8周模型组分别连续熏烟28 d、42 d和 56 d; 自然愈合3周和6周组则连续熏烟56 d后停止熏烟,于造模前相同条件下分别饲养21 d和42 d。气管内滴注LPS当日不予熏烟,对照组术后不予熏烟。
1.3.2 病理学观察 取大鼠左肺行病理学检查。用7#留置针行颈动脉穿刺抽尽全血, 待动物死亡后迅速开胸取出双侧肺组织,生理盐水冲洗表面, 取左肺用体积分数10%中性甲醛固定, 脱水, 石蜡包埋,切片, 苏木素-伊红(HE)染色, 光学显微镜下观察。
1.4 指标检测
各模型组于熏烟结束后次日将动物麻醉后先测定呼吸功能0.3 s用力呼气容积(FEV0.3)及其与用力肺活量(FVC)比值(FEV0.3/FVC),再行颈总动脉插管术收集全血、分离血清, 测定IL-8、IL-10和TNF-α的含量。对照组与4周模型组在同日进行检测。自然愈合组分别于停止熏烟3周和6周后,用同样方法检测上述各项指标。
设小正方形的边长为x(即为原题设条件中所折无盖长方体形盒子的高h),则盒底的边长为a-2x,所折无盖长方体形盒子的高也为x,因此,无盖方盒的容积为:
1.4.1 肺功能测定 麻醉后行气管切开插管术,将Y型插管的一端与呼吸传感器连接, 并通过BL-4 20 s生物机能实验系统监测呼吸曲线,另一端接三通阀。在呼气末打开三通阀并快速向气管内推入空气6 mL(相当于被动深吸气[7]),通过记录到的呼吸曲线计算FEV0.3和FEV0.3/FVC。
1.4.2 细胞因子含量测定 用7#留置针行颈总动脉穿刺, 并用真空采血管(普通血清管)收集全血, 室温下静置20 min后离心(3 000 r/min, 20 min), 分离血清。用酶联免疫吸附(ELISA)法测定细胞因子含量。
1.5 统计分析
用SPSS 17.0软件进行统计分析,实验数据以表示,多组间比较采用单因素方差分析(one-way ANOVA),相关分析采用Pearson法,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠一般情况
造模过程中逐渐出现毛发微黄、体质量减轻、精神萎靡、反应迟钝以及呼吸伴喘鸣音等症状。停止熏烟后上述症状均有所好转、体质量增加。
2.2 病理观察结果
对照组大鼠支气管周围及间质无明显炎症细胞浸润,支气管、终末细支气管、肺泡无明显破坏,肺泡壁完整(图1A)。各模型组均出现肺泡壁变薄、肺泡腔扩大或肺泡壁破裂、融合形成肺大疱;支气管黏膜坏死、脱落,伴淋巴细胞、浆细胞为主的炎症细胞浸润等(图1B、C、D),肺气肿和支气管炎症的病理学改变,结合肺功能指标(FEV0.3,FEV0.3/FVC)下降说明造模成功。与模型组比较,自然愈合组炎症细胞浸润、肺泡扩张融合等现象均有不同程度的减轻(图1E、F),其中以6周组更为明显。
2.3 肺功能测定
与对照组比较, 各模型组和自然愈合组FEV0.3、FEV0.3/FVC均显著下降(P<0.05),各模型组之间比较,6周、8周模型组与4周模型组有统计学差异(P均<0.05); 与8周模型组比较,各自然愈合组FEV0.3、FEV0.3/FVC升高(P均<0.05),且自然愈合6 周组较3 周组升高(P<0.05),(表1)。
2.4 细胞因子检测
与对照组比较, 各模型组血清IL-8、TNF-α水平升高(P均<0.05), IL-10水平下降(P<0.05)。模型组间比较IL-8水平有统计学差异(P均<0.05)。各自然愈合组与8周模型组比较, IL-8、TNF-α水平显著下降(P均<0.05), 而IL-10水平显著升高(P<0.05);自然愈合组组间比较上述细胞因子水平均有统计学差异(P<0.05)。与对照组比较, 自然愈合6周组IL-8、TNF-α水平下降, IL-10 升高(P<0.05)(表 1)。
2.5 相关性分析
将全部模型组血清IL-8、TNF-α、IL-10水平与FEV0.3/FVC作直线相关分析, 模型组IL-8、TNF-α水平与FEV0.3/FVC呈负相关(P<0.000, r=-0.579 P=0.034相关系数r=-0.354); 而IL-10与FEV0.3FVC无线性相关(P=0.304)。同样对全部自然愈合组的上述指标进行相关分析,IL-8与FEV0.3/FVC呈负相关(P=0.041, r=-0.420)。
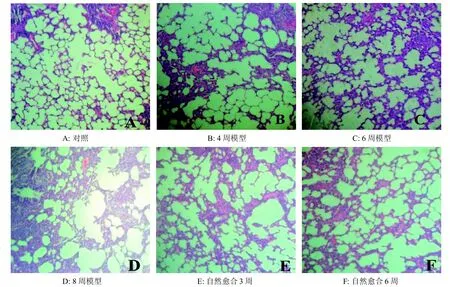
图1 各组大鼠肺组织HE染色(×100)Figure 1 HE staining of lung tissue in rats of each group

表 1 各组大鼠肺功能和细胞因子水平比较Table 1 The concentration of IL-8, IL-10, TNF-α and lung function in rats of each groups
3 讨论
COPD是呼吸系统常见疾病,反复发作的肺部感染是导致疾病加重的重要因素。肺部炎症会导致机体的全身炎症反应和炎症细胞的异常活化,并释放大量炎性相关细胞因子,细胞因子和炎症细胞相互作用进一步放大炎症效应,并导致肺组织结构的破坏。因此细胞因子水平变化和炎症细胞活化是全身炎症反应的标志。动物模型是研究疾病发病机制和治疗方法的基础,但是由于COPD病因复杂且动物和人存在种属差异,目前尚无公认的标准COPD动物模型制备方法。熏烟复合气道内注入LPS法最早由宋一平等[3]报道,该方法模拟了人类COPD的发病诱因,动物病理生理状况与人类相似,被许多国内学者采用。但是除了疾病导致的机体炎症反应外,大剂量烟雾刺激能够通过氧化应激直接损伤气道上皮细胞,引起细胞因子水平的变化。因此,熏烟法建立的COPD动物模型用于细胞因子相关的实验研究时,应该充分考虑香烟烟雾对动物体内细胞因子水平的直接影响。
本研究分别监测了持续熏烟不同时间及停止熏烟后大鼠的肺功能和血清IL-8、IL-10和TNF-α的水平, 结果显示, 造模4周后动物肺功能指标显著下降,IL-8、TNF-α升高、IL-10下降(P均<0.05),结合病理检查结果说明该动物模型成立,并且细胞因子在早期就有显著改变。模型组之间比较显示,随着造模时间延长上述细胞因子水平变化更为显著,且模型组IL-8、TNF-α水平与FEV0.3/FVC呈负相关,与国外文献报道一致[8]。IL-8主要由肺泡巨噬细胞产生,是中性粒细胞重要的趋化因子。TNF-α是炎症反应的启动因子,主要由活化的单核细胞和巨噬细胞分泌,其通过气道慢性炎症网络,参与了COPD气道重塑和阻塞进程[9]。IL-10是重要的抗炎因子, 研究认为IL-10的减少与COPD气道炎症的持续存在关系密切[10]。临床研究认为,IL-8和TNF-α相互影响,共同参与了气道炎症反应和气道重塑过程, 导致患者肺功能下降[11,12],本实验的研究结果提示,模型组大鼠血清IL-8、TNF-α水平与FEV0.3/FEV0.3/FVC有负相关关系,且自然愈合组IL-8与FEV0.3/FEV0.3/FVC也呈负相关,提示这两个因子一定程度上反映了该动物模型COPD的严重程度。
为了进一步探讨该动物模型体内细胞因子水平变化与烟雾刺激的关系, 监测了停止熏烟3周和6周后大鼠肺功能和血清中上述因子的水平,结果显示: 自然愈合组大鼠肺功能指标较8周模型组改善(P均<0.05), 但与对照组比较, FEV0.3、FEV0.3/FVC降低(P均<0.05); 与8周模型比较, 自然愈合组上述细胞因子水平呈显著恢复趋势; 自然愈合3周组细胞因子水平与对照组接近。提示香烟烟雾是引起细胞因子水平变化的因素之一,停止熏烟后因子水平的变化能在短时间内恢复,但肺功能损伤不可逆。
被动吸烟复合气道内注入LPS法建立的COPD大鼠模型虽然具有发病机制与人类相似、建模所需时间短的优点,且大鼠血清IL-8和TNF-α水平与肺功能下降有相关关系,但是短时间内大剂量香烟烟雾刺激导致的呼吸道损伤,也是导致体内部分细胞因子水平变化的重要因素,停止熏烟后血清细胞因子水平变化会在短时间内恢复,与人类COPD的慢性呼吸道和全身炎症反应导致的细胞因子变化不完全相同,因此在采用这一动物模型进行细胞因子相关的实验研究时应充分考虑该因素的影响。
[1] Lopez AD, Shibuya K, Rao C, et al. Chronic obstructive pulmonary disease: current burden and future projections[J]. Eur Respir J, 2006, 27(2):397-412.
[2] 刘君波, 黄梦珊, 余晨曦, 等. 慢性阻塞性肺疾病模型[J]. 中国实验动物学报, 2011, 19(2):129-133.
[3] 宋一平, 崔德健, 茅培英, 等. 慢性阻塞性肺疾病大鼠模型气道重塑及生长因子的研究[J]. 中华结核和呼吸杂志,2001, 24(5):283-285.
[4] 杨金星, 袁嘉丽, 管翰粟, 等. 活血化瘀药对COPD 模型大鼠气道重塑的干预作用[J]. 现代中西医结合杂志, 2013,22(23):2524-2526.
[5] 陈燕, 熊英, 李玲, 等. 慢性阻塞性肺疾病模型大鼠细胞因子水平变化的研究[J]. 中华疾病控制杂志, 2015, 19(8):839-842.
[6] 熊英, 张金娟, 黄惠妍, 等. 异丙托溴铵雾化吸入治疗对COPD大鼠肺功能的保护作用及机制[J]. 山东医药, 2016,56(21): 27-29.
[7] 王翠茹, 李玲, 韩云霞, 等. 补肺胶囊对慢性阻塞性肺疾病模型大鼠肺功及血气分析的影响[J]. 时珍国医国药杂志,2012, 23(1):104-106.
[8] Paone G, Conti V, Leone A, et al. Analysis of sputum markers in the evaluation of lung inflammation and functionalimpairment in symptomatic smokers and COPD patients[J].Dis Markers, 2011, 31(2):91-100.
[9] Mukhopadhyay S, Hoidal JR, Mukherjee TK. Role of TNF-alpha in pulmonary pathophysiology[J]. Respir Res, 2006,7(1):125-133.
[10] Takanashi SY, Hasegawa Y, Kanehira Y, et al. Interleukin-10 level in sputum is reduced in bronchial asthma, COPD and in smokers[J]. Eur Respir J, 1999, 14(2):309-314.
[11] 牛颖梅. 慢性阻塞性肺疾病急性加重期细菌感染和细胞因子变化的临床研究[J]. 中国现代医学杂志, 2010, 20(9)1354-1357.
[12] 王晓青. 慢性阻塞性肺疾病患者血清IL-8、IL-10、α HBDH、CRP及NO水平的变化[J]. 细胞与分子免疫学杂志, 2010, 26(12):1262-1263.
Effects of Cigarette Smoke on Lung Function and Serum Cytokine Levels in Chronic Obstructive Pulmonary Disease Rat
XIONG Ying1, ZHANG Jin-juan1, LI Lin1, CHEN Yan2, WU Yan-jun1, HUANG Hui-yan2
(1. Department of Medical Funtcion of the Laboratory, Guizhou Medical University, Guiyang 550025, China;2. Department of Medicine,the Affiliated Hospital of Guizhou Medical University, Guiyang 550025, China)
Objective To investigate the influence of cigarette smoke on lung function and serum cytokine levels in chronic obstructive pulmonary disease (COPD) rats which were established by the complex stimulation of lipopolysaccharide (LPS) and smoked cigarettes. Methods Seventy-two male SD rats were randomly divided into six groups, 4 weeks, 6 weeks and 8 weeks model group, 3 weeks and 6 weeks natural healing group, and control group. A COPD rat model was established by the complex stimulation of two times LPS injection and smoked cigarettes. The lung function of the rats was measured during passive smoking and quit smoking. At the same time serum interleukin-8(IL-8), IL-10 and tumour necrosis factor-alpha (TNF-α) levels were monitored by Enzyme-linked immunosorbent assay. Correlation analysis concerning cytokine levels and pulmonary function index were conducted. Results Compared with control group, forced expiratory volume in 0.3 second (FEV0.3), forced expiratory volume in 0.3 second as a percentage of forced vital capacity (FEV0.3/FVC) and IL-10 were decreased (P<0.05), IL-8 and TNF-α levels were increased in the model groups (P<0.05). And as the building time prolonged, the changes of those cytokines and lung function indexes were more obvious than before. IL-8 and TNF-α levels were inversely associated with FEV0.3/FVC(P<0.001, r=-0.579; P=0.034, r=-0.354). Compared with control group, IL-8 and TNF-α levels were decreased in the 6 weeks healing group, at the same time IL-10 levels was increased(P<0.05), the FEV0.3and FEV0.3/FVC were decreased in the healing groups (P<0.05). Conclusions Cigarette smoke is the primary cause of changes on cytokine levels in this animal model.
Chronic obstructive pulmonary disease (COPD); Cytokines; Animal model; Cigarette smoke
R332; R563; Q95-33
A
1674-5817(2017)04-0315-05
10.3969/j.issn.1674-5817.2017.04.012
2017-05-30
贵州省科学技术基金(黔科合LG字[2012]014号)
熊 英(1977-), 女, 讲师, 硕士。主要研究方向: 机能实验、药理学。E-mail: xiongying1116@163.com
黄惠妍(1980-), 女, 临床医学硕士,E-mail: huanghuiyan8039@163.com
