肝假性动脉瘤破裂引起消化道出血1例及文献回顾
2017-09-08吕沐翰李昌平
扈 星,吕沐翰,李昌平
(西南医科大学附属医院1.全科医学科;2.消化内科,四川泸州 646000)
·短篇及病例报道·
肝假性动脉瘤破裂引起消化道出血1例及文献回顾
扈 星1,吕沐翰2△,李昌平2▲
(西南医科大学附属医院1.全科医学科;2.消化内科,四川泸州 646000)
肝假性动脉瘤(hepatic artery pseudoaneurysm,HAP)以往被认为是一种罕见的肝脏疾病,但近年来由于检查方法的不断进步,报道日趋增多。HAP破裂可引起胆道出血、腹腔大出血,病情危重,需急诊处理。本院收治1例HAP破裂出血患者,现将其临床资料分析报道如下,同时结合文献,对HAP破裂出血的发病机制、临床表现、诊断及治疗进行分析。
1 临床资料
1.1 初诊 患者男性,80岁,以“黑便2-d”为主诉入院。2-d前不明原因出现腹胀,伴剑突下烧灼感,解成型柏油样大便5~6 次/天,每次量约50 g左右,不含黏液、脓血,不含鲜红色血液,不伴呕血。
既往史:1+月前患者无明显诱因出现右上腹疼痛伴腰背部放射,并服用消炎止痛类药物。否认其他特殊病史。
入院查体:体温36.5℃,脉搏78次/分,呼吸19次/分,血压85/42 mm Hg,发育正常,神志清楚,结膜稍显苍白,巩膜稍显黄染。胸廓呼吸运动正常,无肋间隙增宽或变窄,语颤正常,无胸膜摩擦音、皮下捻发感,叩诊音清,双肺呼吸音清晰,右下肺可闻及湿性啰音,语音共振正常。心前区无隆起,心浊音界无扩大,心率78次/分,心律齐,心脉率一致,各瓣膜听诊区未闻及杂音。腹膨隆,未见腹壁静脉曲张,腹部无压痛、反跳痛,腹软、无包块,肝脾肋缘下未触及,Murphy征阴性,肾区无叩击痛,移动性浊音阳性,肠鸣音正常,双下肢不肿。
辅助检查:血常规示白细胞13.82×109/L,中性粒细胞8.81×109/L,中性粒细胞率63.74%,红细胞数2.41×1012/L,血红蛋白72 g/L,红细胞压积22.7%,红细胞平均体积94.2 fL。凝血酶原时间(PT) 15.3 s,PT% 74%,活化部分凝血活酶时间(APTT) 42.5 s。肝功能:丙氨酸氨基转移酶(ALT)35.4 U/L,天门冬氨酸氨基转移酶(AST)49.7 U/L,总蛋白42.1 g/L,清蛋白19.1 g/L,A/G 0.83,总胆红素27.7μmol/L,直接胆红素21.9μmol/L,总胆汁酸36.1 μmol/L,碱性磷酸酶112.8 U/L,前清蛋白60.7 mg/L。肾功能:尿素18.37 mmol/L,肌酐151.1 μmol/L,肾小球滤过率40 mL/min。入院初步考虑:急性胃黏膜病变(NSAID相关性溃疡)引起出血可能性大。行急诊胃镜检查示:食管下段可见静脉显露,未见糜烂及异常增生。胃底、胃体、胃窦多处黏膜充血水肿、点片状糜烂,十二指肠球部及降段可见咖啡色血迹附着。见图1、2。
1.2 复诊 入院第3天,患者突然出现便血,呈暗红色,含血凝块,量大,约1 500 g/d左右,几乎不含粪渣,不伴呕血。立即予以生长抑素、去甲肾上腺素等治疗,便血较前稍缓解。
完善相关辅助检查:腹部CT平扫提示,肝硬化,脾大,大量腹水,网膜、系膜广泛肿胀,多发肠管壁肿胀增厚;胆囊多发结石伴胆囊炎;腹主动脉及双侧髂血管壁多发钙化斑。自身肝血清学检测示,抗线粒体抗体(+),抗线粒体M2抗体(+++)。见图3。

图1 食管下段静脉显露图2 十二指肠降段咖啡色血迹附着

A:肝硬化显影;B:胆囊结石显影。
图3 CT检查结果
考虑诊断为:原发性胆汁性肝硬化导致患者出现门静脉高压性胃肠病引起便血可能性大。治疗经过:予以生长抑素、抑酸、抗感染等治疗患者仍间断、多次便血。输注红细胞悬液600 mL,新鲜冰冻血浆800 mL后复查血常规提示,白细胞17.43×109/L,中性粒细胞12.45×109/L,中性粒细胞率71.44%,红细胞数1.59×1012/L,血红蛋白48 g/L,红细胞压积15.6%,红细胞平均体积98.2 fL。
1.3 进展 予以生长抑素、抑酸等止血措施效果不佳,便血持续未能缓解。欲行结肠镜检查以明确病因,但患者行肠道准备过程中,仍持续便血,故未能行此项检查。
结合病史特点,暂不能排除动脉出血,故急诊行介入治疗,采用Seldinger技术穿刺右侧股动脉置导管鞘,泥鳅导丝引导下引入5F RH导管至腹腔干造影示:肝左动脉假性动脉瘤形成,肝右动脉、胃左动脉、十二指肠动脉、肠系膜上动脉、肠系膜下动脉造影均未见明显异常,进一步插管至肝左动脉假性动脉瘤处,用MWCE-18S-3.0-3-HILAL微弹簧圈3个、MWCE-18S-8/4-TORNADO微弹簧圈1个栓塞假性动脉瘤,再造影未见假性动脉瘤显影。见图4、5。
介入治疗后患者便血基本停止。输注红细胞悬液200 mL,血浆200 mL,于术后第3天复查血常规示,白细胞4.63×109/L,中性粒细胞2.90×109/L,中性粒细胞率62.64%,红细胞数2.23×1012/L,血红蛋白68 g/L,红细胞压积22.4%,红细胞平均体积100.4 fL。故考虑诊断为:肝左动脉假性动脉瘤破裂引起消化道出血可能性大。
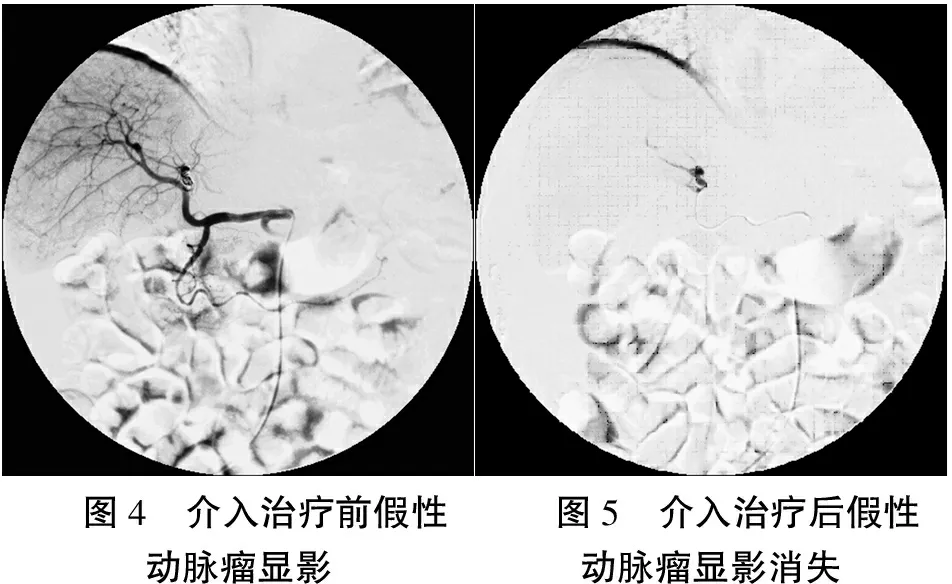
图4 介入治疗前假性动脉瘤显影图5 介入治疗后假性动脉瘤显影消失
2 讨 论
2.1 发病机制 HAP是由于血液通过一个中断的动脉壁外渗进入周围组织而形成的搏动性血肿[1],具有潜在致命性,其病死率高达40%~100%[2]。HAP主要是由围绕肝脏的创伤性事件而发生,如肝脏活检、经皮肝穿刺胆道造影、腹部闭合性损伤、胆囊切除、胆囊或胆管系统与肝动脉之间形成瘘管等[3]。其他重要的病因包括胆结石,非结石性胆囊炎,血管异常和肿瘤等[4]。近年来,随着有创诊断和微创治疗等技术在肝胆疾病中的广泛应用,医源性肝动脉出血的发病率逐年升高,需要引起临床医生对该病高度重视[5]。
肝内胆管由左右肝动脉分支形成的非轴性动脉网供血,在汇管区内与门静脉分支伴行[6]。肝内胆管系统与肝脏血管系统(肝动脉、门静脉)关系密切,在肝内三者被包绕在一个纤维鞘内,肝动脉大部分分支包绕胆管,组成胆管周围血管丛。在胆道手术、胆道阻塞、胆道急慢性炎症、胆管引流、胆囊切除、肝穿刺、肝切除时,肝动脉主干及相关分支增粗、扩张、血流量增加,随着血流搏动瘤体不断增大,临近瘤体的胆管壁受压破溃形成动脉-胆管瘘,当假性动脉瘤瘤壁破裂时就出现胆道出血[7]。通常胆道出血是由肝内假性动脉瘤破裂引起,同时可伴有肝内血肿,部分感染时形成肝内脓肿。而肝外的假性动脉瘤破裂常表现为胆道出血或腹腔内出血[8-9]。
原发性胆汁性肝硬化是一种原因不明的慢性自身免疫性疾病,其病理改变主要以肝内细小胆管的慢性非化脓性破坏、汇管区炎症、慢性胆汁淤积和肝纤维化为特征,可引起胆管的炎症、增生性变化和胆汁淤积,导致毗邻的肝动脉管壁的破坏,进而形成肝动脉-胆道瘘,推测是此病例中引起胆道出血的重要机制。
2.2 临床表现 HAP无特殊临床表现,常因突然破裂出现休克或发生严重的胃肠道出血被发现。在创伤或活动等因素使得血压持续或暂时过度升高时,假性动脉瘤破裂进入上消化道、结肠、腹腔或腹膜后,临床表现多种多样,缺乏特征性,包括出血(呕血,便血或胃管、腹腔管、胆道引流管引流出血性液体)、腹痛、腹胀及休克症状。若进入胆道则可表现为典型的胆道出血“三联征”,胆道出血“三联征”由Gorich等[10]提出,主要有黑便(90%)和呕血(60%)、胆绞痛(70%)、阻塞性黄疸(60%),但以“三联征”为临床表现的患者所占比例低于40%。HAP破裂也可有并发症,如感染性栓子相关的感染或炎症发生。Yu等[11]报道1例HAP引起急性特发性胰腺炎的病例,推测其HAP的形成机理是由于胰酶的自身消化,急性胰腺炎由于不明原因可能侵蚀血管壁,导致形成假性动脉瘤,然后HAP破裂造成胆道出血。胆道出血最常出现在损伤因素发生后几天至数周内(平均间隔约1个月),越早期出现胆道出血的患者预后越差[12]。Okuno等[13]提出对于没有明显“三联征”表现的患者,若具有以下一些前驱症状,也要高度怀疑假性动脉瘤破裂引起胆道出血的可能。(1)破裂前症状:周期性右上腹胀痛及压迫感;(2)破裂时症状:突发的腰背部疼痛,上腹部绞痛;(3)临床症状:间断呕血、黑便、便血、发热;(4)实验室检查:支持阻塞性黄疸、白细胞升高,高胆红素血症;(5)体格检查:黄疸、腹部脓肿。
2.3 诊断 HAP破裂造成的出血常呈间歇性,早期诊断困难,且一旦破裂,致死率很高,因此及时、准确诊断尤为重要[14]。常用的诊断方法有:(1)B超及彩色多普勒血流显影(CDFI)[15]。可清楚地显示假性动脉瘤的部位、破口、大小、瘤体内有无血栓形成,能显示动脉内的血流信号,可观察随访瘤体的大小、形态的变化以及治疗效果,是临床工作中筛查的首选检查,但其准确性高度与操作者的水平相关,而且有时会受到某些解剖位置的限制。(2)增强CT。由于扫描层问题,对于直径小于8 mm的假性动脉瘤可能漏诊。(3)十二指肠镜检查。上消化道侧视内镜可对胆道出血做出明确诊断,内镜下见血液直接从十二指肠乳头部流出为出血的直接征象,或新鲜血液存在于没有活动性出血部位的十二指肠为间接征象。也可排除其他常见出血原因如糜烂性胃炎,消化性溃疡,食管胃底静脉曲张[16]。(4)肝动脉造影检查[17]。目前的研究表明,选择性肝动脉造影是诊断原因不明胆道出血的首选方法,对胆道出血的诊断具有很高的敏感性。当出血量大于0.5 mL/min,即可显示造影剂外溢,且造影剂外溢是诊断出血最可靠征象;当出血量小于0.5 mL/min及出血间歇期,肝动脉分支上的瘤样扩张或假性动脉瘤,柱状扩张等改变亦视为出血动脉。
2.4 治疗 国外相关报道表明,目前所采用的微创技术用于假性动脉瘤的治疗主要包括:超声引导下压迫,血栓形成剂注入假性动脉瘤,栓塞术和支架术[18],前两种方式更适用于下肢,而不是内脏假性动脉瘤。HAP破裂常引起严重消化道出血和失血性休克,保守治疗往往效果不佳,需行介入或手术治疗才能解决问题[19]。目前多主张采用经导管血管栓塞术(transhepatic arterial emboliza-tion,TAE),被认为是诊断和治疗的金标准,其具有创伤小,止血迅速,效果持久可靠,不成功可再次栓塞治疗并可避开感染部位等优点[20]。目前国外多数学者认为,实施与病变动脉相关的某一肝动脉分支或肝内血管分支的栓塞治疗,可使这种具有生命威胁的疾病通过安全非手术方法来治愈,在胆道出血间歇期手术较为安全,但会增加术中定位的困难。TAE被认为是一种安全,并发症小于2%的治疗手段,但是仍存在并发症,如胆囊坏死,线圈迁移至非栓塞血管,远端移位,血栓形成,穿孔,形成瘘管进入内脏和通过微线圈持续灌流等[21-24]。但是,由于既往的介入或手术治疗、动脉粥样硬化疾病、炎症、甚至解剖变异可使假性动脉瘤无法进入到导管。Cope等[25]曾用病例说明,此时可选用直接经皮假性动脉瘤栓塞穿刺术,以替代经导管栓塞术,尤其适用于常规方法未能有效的治疗而患者血流动力学不稳定的状态。直接经皮假性动脉瘤栓塞穿刺术的材料一般选用线圈、凝血酶等。Yoshida等[26]报道1例使用N-氰基丙烯酸正丁酯(NBCA)经皮假性动脉瘤栓塞,治疗HAP的成功病例,该报道中提出NBCA和碘盐的最佳比率为1∶2。
外科手术只限于肝外或胆囊出血,以及TAE失败。常采取的手术方式主要有部分肝脏切除,结扎膨胀的出血部位,动脉瘤切除,解除胆管梗阻解除等。手术风险高,损伤大,术后并发症多,老年、同时罹患多种疾病及肝功能不全的患者往往不适合接受急诊外科手术治疗。随着介入栓塞治疗在动脉性出血疾病治疗中的广泛应用,急诊外科手术的临床使用率已有明显降低。
综上所述,对于消化道出血的临床诊治一定要从多个角度进行综合性考虑,找准引起出血的病因才能从根本上解决问题。此病例告诫临床工作者,消化道出血的鉴别诊断不可忽视胆道出血的可能,从目前文献报道统计看来,胆道出血的发病率在上消化道出血中仅次于溃疡出血及食管静脉曲张破裂出血。因此,对于消化道出血患者,在排除肝硬化门静脉高压性胃病或胃十二指肠溃疡出血等常见病因,尤其是当临床表现与检查不符的情况下,更要多考虑其他能引起消化道出血的原因。若出血量大,呈间歇性(有文献提出“前哨出血”的概念,指少量出血后出血停止,12 h后再次或者多次出血),特别是有胆囊肿大时,不论是否存在典型的胆道出血三联征(右上腹绞痛、呕血或黑便、黄疸),尤其患者有过肝脏创伤、有创性检查或手术史的,要想到胆道出血或HAP形成的可能。
[1]Unalp OV,Karaca CA,Sezer TO,et al.Hepatic artery pseudoaneurysm as a cause of gastrointestinal system bleeding:a case report with a brief review of the literature[J].Turk J Gastroenterol,2012,23(6):784-787.
[2]Green MH,Duell RM,Johnson CD,et al.Haemobilia[J].Br J Surg,2001,88(6):773-786.
[3]Priya H,Anshul G,Alok T,et al.Emergency cholecystectomy and hepatic arterial repair in a patient presenting with haemobilia and massive gastrointestinal haemorrhage due to a spontaneous cystic artery gallbladder fistula masquerading as a pseudoaneurysm[J].BMC Gastroenterol,2013,13(1):43.
[4]Heo TY,An YY,Lee JH,et al.A case of spontaneous hemorrhagic cholecystitis without gallstone[J].Korean J Gastroenterol,2010,56(4):260-263.
[5]Potter C,Hogan MJ,Henry-Kendjorsky K,et al.Safety of pediatric percutaneous liver biopsy performed by interventional radiologists[J].J Pediatr Gastroenterol Nutr,2011,53(2):202-206.
[6]刘冰,单鹏.血管损伤后假性动脉瘤形成机制及诊疗原则[J].中国实用外科杂志,2014,34(12):1200-1202.
[7]Finley DS,Hinojosa MW,Paya M,et al.Hepatic artery pseudoaneurysm:a report of seven cases and a review of the literature[J].Surg Today,2005,35(7):543-547.
[8]汪雷,万圣云,周连帮,等.假性动脉瘤破裂导致胃癌术后上消化道大出血[J].世界华人消化杂志,2014(2):244-248.
[9]樊艳华.胆囊壁假性动脉瘤致胆道出血的鉴别与治疗--腹痛、肝功能异常、便血1例病案分析[J].中国临床医生杂志,2012,40(6):78-79.
[10]Gorich J,Rilinger N,Brado M,et al.Non-operative management of arterial liver hemorrhages[J].European radiol,1999,9(1):85-88.
[11]Yu YH,Sohn JH,Kim TY,et al.Hepatic artery pseudoaneurysm caused by acute idiopathic pancreatitis[J].World J Gastroenterol,2012,18(18):2291.
[12]Perez RG,Ruizde Angulo D,Poveda MJ,et al.Hemorrhagic cholecystitis and hemobilia:two infrequent complications of systemic lupus erythematosus[J].Rev Esp Enferm Dig,2011,103(8):431-433.
[13]Okuno A,Miyazaki M,Ito H,et al.Nonsurgical management of ruptured pseudo-aneurysm in patients with hepatobiliary pancreatic diseases[J].Am J Gastroenterol,2001,96(4):1067-1071.
[14]Kamani L,Mosharraf SM,Tanveer-ul-Haq,et al.Haemobilia:a rare cause of gastrointestinal bleeding[J].J Coll Physicians Surg Pak,2011,21(12):766-768.
[15]徐丹凤,王志利.彩色多普勒超声诊断肝假性动脉瘤伴出血一例[J/CD].中华医学超声杂志(电子版),2014,11(8):72-72.
[16]Murugesan S D,Sathyanesan J,Lakshmanan A,et al.Massive hemobilia:a diagnostic and therapeutic challenge[J].World J Surg,2014,38(7):1755-1762.
[17]芮兴无,王文辉.肝动脉假性动脉瘤破裂出血的介入栓塞治疗[J].当代医学,2010,16(17):273-276.
[18]Saad NE,Saad WE,Davies MG,et al.Pseudoaneurysms and the role of minimally invasive techniques in their management[J].Radiographics,2005,25(Suppl 1):S173-189.
[19]申景,刘玉娥,唐文恒,等.瘤内及载瘤动脉栓塞治疗假性动脉瘤的体会[J].介入放射学杂志,2013,22(9):761-764.
[20]Marynissen T,Maleux G,Heye S,et al.Transcatheter arterial embolization for iatrogenic hemobilia is a safe and effective procedure:case series and review of the literature[J].Euro J Gastroenterol Hepatol,2012,24(8):905-909.
[21]Walker TG,Salazar GM,Waltman AC.Angiographic evaluation and management of acute gastrointestinal hemorrhage[J].World J Gastroenterol,2012,18(11):1191-1201.
[22]Moribata K,Kato J,Ichinose M.Microcoil slipping out of the gastric varices[J].Clin Gastroenterol Hepatol,2012,10(6):e53.
[23]Pua U.Hepatobiliary and Pancreatic:Migration of hepatic coils into the biliary system[J].J Gastroenterol Hepatol,2012,27(7):1256-1256.
[24]Miyayama S,Yamashiro M,Hattori Y,et al.Microcoil embolization during abdominal vascular interventions through microcatheters with a tip of 2 French or less[J].Japan J Rad,2011,29(4):286-290.
[25]Cope C,Zeit R.Coagulation of aneurysms by direct percutaneous thrombin injection[J].Am J Roentgenol,1986,147(2):383-387.
[26]Yoshida RY,Kariya S,Nakatani M,et al.Direct puncture embolization using N-butyl cyanoacrylate for a hepatic artery pseudoaneurysm[J].Minim Invasive Ther Allied Technol,2014,23(2):110-114.
扈星(1989-),住院医师,硕士,主要从事肝脏病学的研究。△
,E-mail:52721759@qq.com。▲共同通信作者,E-mail:506854209@qq.com。
10.3969/j.issn.1671-8348.2017.24.050
R543.5
C
1671-8348(2017)24-3454-03
2017-03-10
2017-04-24)
