血管紧张素I转换酶基因插入/缺失遗传变异与中国人群2型糖尿病肾病发病风险的Meta分析
2017-09-08贝春华秦林原段洁莹余红平于祥远
贝春华,张 瑛,秦林原,杨 琳,段洁莹,刘 念,余红平,于祥远
(桂林医学院公共卫生学院流行病与卫生统计学教研室,广西桂林 541004)
·循证医学·
血管紧张素I转换酶基因插入/缺失遗传变异与中国人群2型糖尿病肾病发病风险的Meta分析
贝春华,张 瑛,秦林原,杨 琳,段洁莹,刘 念,余红平,于祥远△
(桂林医学院公共卫生学院流行病与卫生统计学教研室,广西桂林 541004)
目的 综合评估血管紧张素I转换酶(ACE)插入/缺失(I/D)遗传变异与中国人群2型糖尿病肾病(T2DN)发病风险的关系。方法 应用中国知网(CNKI)及万方数据知识服务平台检索相关文献,截止日期2016年6月1日。运用Review Manager 5.0研究数据进行统计分析,以合并OR值及相应95%置信区间(95%CI)评估ACE基因I/D多态与T2DN的发病风险。结果 依据纳入、排除标准,共29篇文献4 357例研究对象,包括2 208例T2DN患者和2 149例2型糖尿病且无DN者纳入本研究。Meta分析显示,与ACE基因I/D多态I等位基因相比,D等位基因可显著增加T2DM患者发生DN的风险,OR值及相应95%CI为1.44(1.25,1.66);基因型分析显示,在显性和隐性遗传模型下,ACE基因I/D多态位点与中国人群DN发病风险显著相关,相对发病风险的OR及相应95%CI为1.42(1.15,1.76)和1.75(1.46,2.10)。Begg′s检验显示,所纳入研究数据不存在明显发表偏倚。结论 ACE基因I/D多态性与T2DN发病风险密切相关,D等位基因可能是2型糖尿病患者发生DN的危险遗传因素。
血管紧张素Ⅰ;变异(遗传学);诱变,插入;基因缺失;糖尿病肾病
糖尿病微血管病变引起的糖尿病肾病(diabetics nephropathy,DN),导致肾小球硬化,是糖尿病患者严重慢性并发症之一。DN发病机制复杂,目前认为主要与肾血流动力学异常、高血糖症、促生长因子增加等有关[1]。有研究显示,血管紧张素Ⅰ转换酶(angiotensin-Ⅰ converting enzyme,ACE) 基因第16内含子一段287 bp的Alu重复序列插入/缺失(I/D)多态位点可影响2型糖尿病患者血浆ACE水平,可能与2型糖尿病肾病(T2DN)发病风险关系密切[2]。迄今,国内学者采用分子流行病学病例-对照研究,探讨ACE基因I/D多态变异与T2DN发病风险的关系。但各研究间结论存在矛盾。本研究运用Meta分析的基本原理和方法,综合评价ACE基因I/D遗传变异与T2DN发病风险的关联,明确ACE基因I/D多态性与DN易感性的关系。
1 资料与方法
1.1 文献检索 联合应用中国知网(CNKI)及万方数据知识服务平台检索相关文献,以“血管紧张素Ⅰ转换酶”“遗传变异”或者“单核苷酸多态性”或“糖尿病肾病”作为关键词,检索2016年6月1日前有关ACE基因I/D多态变异与中国人群T2DN发病风险的关联研究。由两名专业研究人员同时对检索文献进行筛选,研究数据进行整理,若出现不确定数据,则由第三人仔细阅读全文进行裁定。
1.2 检索文献纳入与排除
1.2.1 纳入标准 (1) 研究对象为中国人群,试验组为确诊的T2DN患者,对照组为无DN的2型糖尿病患者;(2)研究ACE基因I/D与T2DN发病风险的关系;(3) 具有该位点相关基因型和(或)等位基因频率等分型资料。
1.2.2 排除标准 (1) 研究对象为非2型糖尿病或不全为2型糖尿病者;(2)分型资料不完整;(3)综述、文摘等非病例-对照研究;(4) 不符合哈迪-温伯格(Hardy-Weinberg,HWE)遗传平衡定律。
1.3 资料提取 统一制订研究资料收集表,由两位研究者独立提取研究数据,主要包括:第一作者、发表时间、基因分型结果、对照组HWE遗传平衡状态。
1.4 统计学处理 Meta分析应用Review Manager 5.0统计软件评价ACE基因I/D多态变异与DN发病风险,以相对危险度(Odd ratio,OR)及相应95%置信区间(95%CI)进行描述;采用χ2检验评价对照组基因型分布的HWE遗传平衡状态。采用Cochran Q检验各研究间异质性,P<0.05提示发表文献数据间存在明显异质性;I2值定量评价异质性大小,值越大提示异质性愈明显。设定异质性检验结果P<0.05或I2>50%,则提示各研究存在明显异质性,分析时采用随机效应模型;反之则采用固定效应模型。以Begg′s漏斗图评估纳入研究数据的发表偏倚情况[3]。采用Leave-one-out方法,逐一剔除单个研究进行敏感性分析,用以评价单一研究对总体效应的影响。
2 结 果
2.1 纳入文献基本资料特征 截止2016年6月1日,依据制定的检索策略,共检索ACE基因I/D多态性与T2DN发病风险相关报道58篇,阅读题目和摘要后排除文献21篇,初筛纳入37篇相关研究;通过阅读全文,按照文献纳入及排除标准,再次排除8篇文献,包括综述2篇、不符合HWE遗传平衡2篇,研究对象为非2型糖尿病或不全为2型糖尿病者4篇,最终纳入合格文献29篇[4-32]。所纳入研究共包含研究对象4 357例,其中2 208例T2DN患者和2 149例2型糖尿病且无DN者。文献筛选流程,见图1。
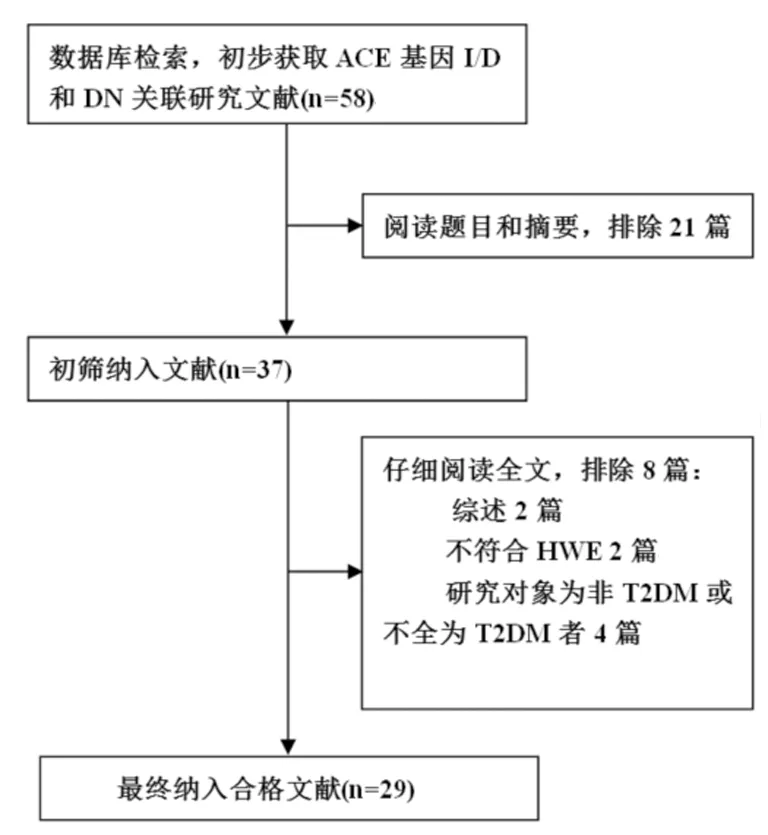
图1 纳入文献筛选流程
2.2 Meta分析结果
2.2.1 ACE I/D多态位点等位基因与T2DN的发病风险 本研究应用Review Manager 5.0软件,采用随机效应模型对所纳入文献等位基因在试验组和对照组中的分布情况进行分析。结果显示,与ACE基因I等位基因相比,D等位基因可明显增加T2DN的发病风险,其整体合并效应的OR值及相应95%CI分别为1.44(1.25,1.66)。Cochran Q检验结果显示,所纳入各研究分型结果等位基因数据存在明显异质性(I2=62%,P<0.01),见图2。
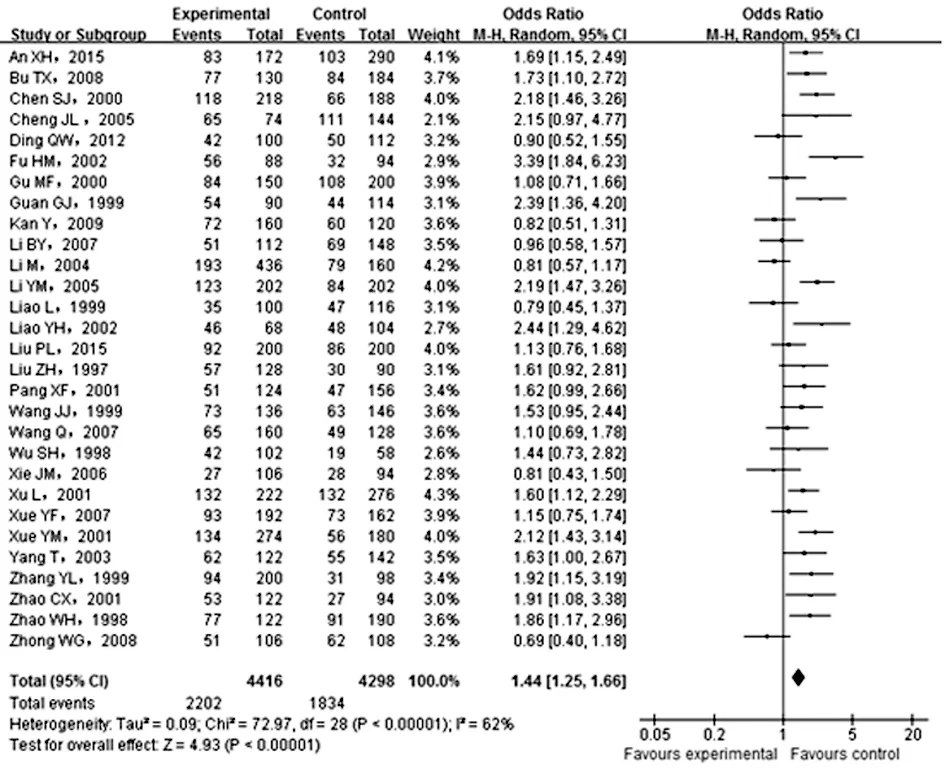
图2 ACE基因I/D多态位点等位基因(D vs. I) 与T2DN的发病风险分析
2.2.2 ACE基因I/D位点不同遗传模型与T2DN的发病风险 本研究综合评估了显性遗传模型(ID+DDvs. Ⅱ)和隐性遗传模型(DDvs. Ⅱ+ID)下ACE基因I/D多态性与中国人群T2DN遗传易感性的关系。结果发现,在显性和隐性遗传模型下,ACE基因I/D多态性均与T2DN发病风险存在显著关联,其总体相对发病风险的OR及相应95%CI分别为1.42(1.15,1.76)和1.75(1.46,2.10)。Cochran Q异质性检验显示,在两种遗传模型下,所纳入各研究基因型数据间均存在显著异质性,I2和相应P值分别为显性模型:I2=57%,P<0.01;隐性模型:I2=33%,P=0.04。见图3、4。
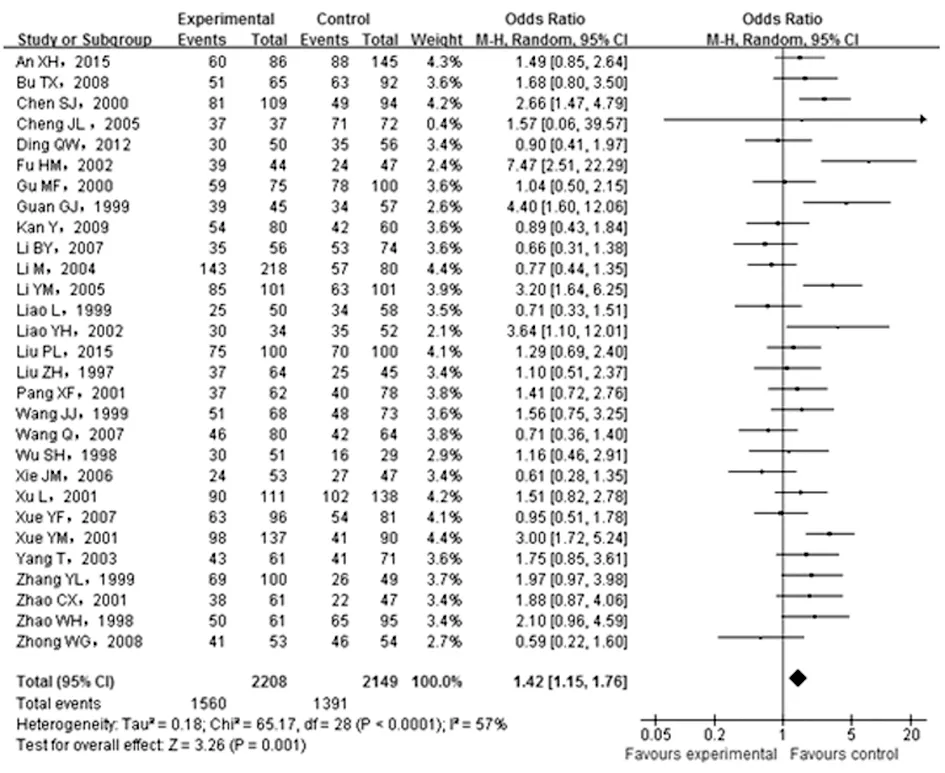
图3 ACE基因I/D位点显性遗传模型 (ID+DD vs. Ⅱ)与T2DN发病风险分析
2.2.3 文献发表偏倚情况 应用Review Manager 5.0软件评估所纳入研究数据的发表偏倚情况,Begg′s漏斗图显示,显性和隐性遗传模型下,所纳入研究发表情况的散点图基本呈对称分布,表明本研究所纳入相关文献在显性(A)和隐性(B)遗传模型下,不存在明显的发表偏倚,见图5。

图4 ACE基因I/D位点隐性遗传模型 (DD vs. Ⅱ+ID)与T2DN发病风险分析

图5 Begg′s方法检验显性(A)和隐性(B) 遗传模型所纳入研究发表偏倚
2.2.4 敏感度和异质性来源分析 采用Leave-one-out方法,将本研究所纳入文献逐一剔除,评估单个研究对显性和隐性遗传模型下总体效应的影响,结果并未发现总体效应的OR及95%CI因单篇文献发生明显波动,说明本研究结果稳健性较好。同时,逐一剔除单个研究后,所纳入发表数据间的异质性检验结果未发生显著性变化。
3 讨 论
T2DN 的发病机制仍较复杂,至今尚未阐明,研究认为其发病是环境和遗传因素共同作用所致[33],其中,遗传易感因素的作用在T2DN病因学机制研究中愈发受到关注。研究表明,ACE、内皮细胞性一氧化氮合酶(eNOS)、葡萄糖转运蛋白-1(Glut-1)等基因单核苷酸多态性与T2DN的发病风险有关[34]。近年来,ACE基因第16内含子插入/缺失多态性与T2DN发病风险的关联研究成为探讨2型糖尿病患者对DN易感性研究的热点。ACE是肾素-血管紧张素系统(RAS)的关键酶,通过ACE可将血管紧张素Ⅰ转化成具有强烈收缩活性的血管紧张素Ⅱ,以及灭活舒血管作用的物质缓激肽而在血管的生理调节中发挥关键作用。截至目前,国内外大量有关ACE基因I/D多态性与DN遗传易感性的关联研究,试图揭示ACE I/D多态性同DN发病风险之间的关系,但各研究结果和结论存在分歧。由于在群体遗传学研究中,HWE遗传平衡定律是反映所研究样本具有来源群体代表性的基本定律。结合各研究HWE情况,本研究把对照组是否符合HWE遗传平衡定律作为文献纳入的一项标准,对不符合HWE的两项研究进行剔除。本研究运用Meta分析的方法,纳入符合要求的文献报道29篇,共4 357例研究对象,包括2 208例T2DN患者和2 149例2型糖尿病且无DN者,综合评价ACE基因I/D多态变异与T2DN发病风险之间的关联。
通过文献调研,彭少华等[35]的Meta分析探讨了2010年以前有关ACE基因I/D多态性与T2DN发病有关研究,发现ACE基因I/D多态性D等位基因携带与中国汉族人群T2DN发病风险增加有关。但其研究纳入4篇未经正式发表数据,另外纳入2篇研究数据经检验偏离HWE遗传平衡定律。因此,对于该研究结论仍应保持谨慎态度。相比,本研究增加2010年至2016年6月1日正式发表的有关ACE基因I/D多态性与中国人群T2DN发病相关研究数据,扩大样本量,并剔除不符合HWE遗传平衡的研究,通过本研究有望更为清晰地揭示ACE基因I/D多态性与T2DN发病之间的关系。
本研究发现,与I等位基因相比,ACE基因I/D多态位点D等位基因与T2DM患者继发DN风险的显著增加有关,其整体合并效应的OR值及相应95%CI为1.44(1.25,1.66)。基因型比较显示,在显性和隐性遗传模型下,相对发病风险的OR及相应95%CI为1.42(1.15,1.76)和1.75(1.46,2.10)。据此推测,该ACE基因插入/缺失多态性可能通过某种未明机制导致机体对T2DN的遗传易感性改变而与2型糖尿病患者发生DN风险有关。但因各研究人群的区域性和性别比例等可能存在差异,以及T2DN发病的多因素性,目前还不能确定ACE基因I/D多态位点D等位基因及DD基因型是导致中国人群2型糖尿病患者发生DN的致病遗传因素。
另外,本研究仅纳入已公开发表的有关ACE基因插入/缺失多态性与T2DN易感性关系的研究报道,因样本量大小、病例/对照的配对比例等,可能存在固有的发表偏倚,但应用Review Manager 5.0软件评估所纳入研究数据的发表偏倚情况,未检测到明显的发表偏倚。针对等位基因分析和显性遗传模型的异质性来源方面,应用单研究剔除方法进行了探讨,结果未发现单一研究明显导致了纳入各研究数据之间的异质性。
综上所述,ACE基因I/D遗传变异与T2DN发病风险显著相关,但不同区域或不同人群可能表现出不同程度的易感性;D等位基因与T2DM患者发生DN风险的显著增加有关,推测其可能是T2DM患者发生DN的危险遗传因素。鉴于固有发表偏倚及纳入文献数据之间的异质性等局限,本研究结论仍需经过优化设计及大样本量的研究进行验证。
[1]Park HC,Choi SR,Kim BS,et al.Polymorphism of the ACE gene in dialysis patients:overexpression of DD genotype in type 2 diabetic end-stage renal failure patients[J].Yonsei Med J,2005,46(6):779-787.
[2]Marre M,Bernadet P,Gallois Y,et al.Relationships between angiotensin I converting enzyme gene polymorphism,plasma levels,and diabetic retinal and renal complications[J].Diabetes,1994,43(3):384-388.
[3]Peters JL,Sutton AJ,Jones DR,et al.Comparison of two methods to detect publication bias in meta-analysis[J].JAMA,2006,295(6):676-680.
[4]安新焕,崔文龙,宋滇平,等.ACE和eNOS2个基因多态性并存与糖尿病肾病的相关性[J].昆明医科大学学报,2015,36(11):12-16.
[5]步天栩,周建新,李昕,等.血管紧张素转化酶基因多态性与Ⅱ型糖尿病肾病的关系[J].天津医科大学学报,2008,14(3):293-296.
[6]陈素杰,周哲,陈孟芝,等.血管紧张素转换酶基因缺失纯合型与糖尿病肾病相关联[J].基础医学与临床,2000,20(5):411-413.
[7]成金罗,沈默宇,王劲松,等.ACE基因多态性与2型糖尿病肾病的相关性研究[J].中国现代医药杂志,2005,7(1):14-16.
[8]丁蔷薇,马亚楠,江新泉.2型糖尿病肾病与ACE基因多态性的相关性研究[J].泰山医学院学报,2012,33(5):358-359.
[9]符辉明,伍汉文,杨建平,等.湘西地区苗族人群糖尿病肾病遗传流行病学调查及血管紧张素转换酶基因多态性研究[J].中华肾脏病杂志,2002,18(3):228-229.
[10]顾敏峰,邓振霞,唐建英.血管紧张素Ⅰ转换酶基因多态性与2型糖尿病肾病的关系[J].江苏医药,2000,26(3):169-171.
[11]关广聚,吴涛,文蓉珠.血管紧张素-Ⅰ转换酶基因多态性与糖尿病及糖尿病肾病的关系[J].中华肾脏病杂志,1999,15(6):365-367.
[12]阚瑛,赵焱,阚殉,等.血管紧张素Ⅰ转换酶基因多态性与2型糖尿病肾病的关联性[J].吉林大学学报(医学版),2009,35(2):352-355.
[13]李博一,罗平,文磊.昆明地区汉族2型糖尿病肾病与血管紧张素Ⅰ转换酶基因多态性的相关性研究[J].实用糖尿病杂志,2007,3(1):41-42.
[14]李鸣,刘丽梅,郑泰山.血管紧张素Ⅰ转换酶基因多态性与2型糖尿病肾病相关性研究[J].上海医学,2004,27(7):457-459.
[15]李咏梅,齐秀英.血管紧张素转换酶基因多态性与2型糖尿病肾病的关系[J].中国慢性病预防与控制,2005,13(1):12-13.
[16]廖岚,雷闽湘,韩秀云,等.2型糖尿病肾病与血管紧张素转换酶基因多态性的研究[J].中国糖尿病杂志,1999,7(6):337-340.
[17]廖蕴华,孙安远,冼苏,等.广西汉族人血管紧张素转换酶I基因多态性与2型糖尿病肾病相关性研究[J].临床荟萃,2002,17(7):378-379.
[18]刘品力,陈燕玲.ACE及AGT基因多态性与糖尿病肾病发病风险的关系[J].中国老年学杂志,2015,35(15):4177-4179.
[19]刘志红,陈朝红,关天俊,等.血管紧张素转换酶基因多态性与糖尿病和糖尿病肾病的关系[J].肾脏病与透析肾移植杂志,1997,6(5):407-410.
[20]庞小芬,巩云霞,朱理敏,等.血管紧张素-Ⅰ转换酶基因多态性与老年人糖尿病及糖尿病肾病的关系[J].老年医学与保健,2001,7(2):94-96.
[21]王健军,潘颖,孙林.血管紧张素Ⅰ转化酶基因多态性与老年人2型糖尿病肾病的关系[J].中华老年医学杂志,1999,18(2):80-83.
[22]王群,马增霞,邱书娟.血管紧张素转换酶基因多态性与2型糖尿病肾病的相关性[J].山东医药,2007,47(26):71-72.
[23]吴松华,项坤三,翁青,等.糖尿病肾病与血管紧张素I转换酶基因多态性的关系[J].中华医学杂志,1997,77(3):183-186.
[24]谢基明,王玉珍,岳秀兰,等.内蒙古包头地区汉族人血管紧张素转换酶基因与糖尿病肾病的相关性研究[J].内蒙古医学院学报,2006,28(1):14-18.
[25]许玲,张秀英,马玉燕,等.血管紧张素Ⅱ型受体基因,血管紧张素Ⅰ转化酶基因多态与2型糖尿病肾病的关系[J].山东医科大学学报,2001,39(6):514-516.
[26]薛迎风,李昌臣,林洪丽,等.ACE基因多态性与2型糖尿病肾病关系的研究[J].医师进修杂志,2000,23(12):26-28.
[27]薛耀明,周琳,关美萍,等.血管紧张素I转换酶基因多态性与2型糖尿病肾病的易感性及病情发展的相关研究[J].第一军医大学学报,2001,21(2):85-87.
[28]杨涛,陈家伟,周红文.血管紧张素转换酶基因多态性与早发性糖尿病肾病[J].齐齐哈尔医学院学报,2003,24(10):1086-1088.
[29]李英,张艳玲,丁小颖,等.河北地区汉族人血管紧张素转换酶基因与糖尿病肾病的相关性研究[J].中国急救医学,2000,20(4):222-223.
[30]赵长霞,胡东南,谢翠鹏,等.血管紧张素转化酶基因多态性与Ⅱ型糖尿病肾病[J].中国航天医药杂志,2001,3(2):35-37.
[31]赵卫红,王笑云,丁国宪.血管紧张素转换酶基因多态性与2型糖尿病肾病的关系[J].南京医科大学学报,1998,18(06):477-479.
[32]钟卫干.2型糖尿病肾病患者ACE基因I/D、AGT基因T174M多态性分析[J].广西医科大学学报,2008,25(6):908-910.
[33]Odubanjo MO,Okolo CA,Oluwasola AO,et al.End-stage renal disease in Nigeria:an overview of the epidemiology and the pathogenetic mechanisms[J].Saudi J Kidney Dis Transpl,2011,22(5):1064-1071.
[34]Carpena MP,Rados DV,Sortica DA,et al.Genetics of diabetic nephropathy[J].Arq Bras Endocrinol Metabol,2010,54(3):253-261.
[35]彭少华,陈婷,李彩蓉,等.血管紧张素Ⅰ转换酶基因插入/缺失多态性与中国汉族2型糖尿病人群肾病发病风险相关性的Meta分析[J].中国全科医学,2012,15(12B):4092-4096.
Meta-analysis of insertion/deletion genetic variation of ACE gene and onset risk of type 2 diabetic nephropathy in Chinese population*
BeiChunhua,ZhangYing,QinLinyuan,YangLin,DuanJieying,LiuNian,YuHongping,YuXiangyuan△
(DepartmentofEpidemiologyandHealthStatistics,SchoolofPublicHealth,GuilinMedicalUniversity,Guilin,Guangxi541004,China)
Objective To systematically assess the relation between angiotensin-I converting enzyme(ACE) gene insertion/deletion (I/D) variation and type 2 diabetic nephropathy (T2DN) onset risk among Chinese population.Methods The related literatures were retrieved from the China National Knowledge Infrastructure (CNKI) and Wanfang Data until June 1st,2016.The RevMan 5.0 was used to conduct the statistical analysis.The merge OR value and corresponding 95% confidence interval(95%CI) were used to assess ACE gene I/D polymorphism and T2DN onset risk.Results Totally 29 papers with 4 357 subjects were included according to the inclusion and exclusion standard,including 2 208 cases of DN and 2 149 cases of T2DM without DN.Meta analysis showed that compared with ACE gene I/D polymorphism I allele,D allele could significantly increase the risk of T2DM patients suffering from DN,theORvalue and corresponding 95%CIwere 1.44(1.25,1.66);the gene analysis showed that ACE gene I/D polymorphism loci were significantly correlated with DN onset risk in the Asian population.The corresponding relative onset riskORand 95%CIwere 1.42(1.15,1.76) and 1.75(1.46,2.10) in the dominant and recessive genetic model.The Begg′s test showed that the included data had no obvious publication bias existence.Conclusion ACE gene I/D polymorphism is closely correlated with the onset risk of T2DN,and D allele might be a risk genetic factor for DN occurrence in the patients with T2DM.
angiotensin Ⅰ;variation (genetics);mutagenesis,insertional;gene deletion;diabetic nephropathy
2016年度重庆市出版专项资金资助项目
广西科技开发项目(桂科攻14124004-1-15)。
贝春华(1983-),讲师,博士,主要从事分子流行病学研究。
△通信作者,E-mail:guilinxiangyuan123@163.com。
10.3969/j.issn.1671-8348.2017.24.015
R181.3+2
A
1671-8348(2017)24-3362-04
2017-01-21
2017-03-02)
