异甘草素诱导人宫颈癌细胞增殖的影响及作用机制的研究*
2017-09-08哈尼克孜吐尔逊古再丽努尔麦麦提图尔荪木合布力阿布力孜马依努尔艾肯祖菲娅艾力
哈尼克孜·吐尔逊,古再丽努尔·麦麦提图尔荪,木合布力·阿布力孜,马依努尔·艾肯,祖菲娅·艾力△
(1.新疆医科大学第一附属医院妇科,乌鲁木齐 830054;2.新疆维吾尔自治区喀什地区第二人民 医院妇产科 844000;3.新疆医科大学药学院,乌鲁木齐 830011; 4.新疆维吾尔自治区第二人民医院妇科,乌鲁木齐 830054)
论著·基础研究
异甘草素诱导人宫颈癌细胞增殖的影响及作用机制的研究*
哈尼克孜·吐尔逊1,古再丽努尔·麦麦提图尔荪2,木合布力·阿布力孜3,马依努尔·艾肯4,祖菲娅·艾力2△
(1.新疆医科大学第一附属医院妇科,乌鲁木齐 830054;2.新疆维吾尔自治区喀什地区第二人民 医院妇产科 844000;3.新疆医科大学药学院,乌鲁木齐 830011; 4.新疆维吾尔自治区第二人民医院妇科,乌鲁木齐 830054)
目的 研究异甘草素(ISL)抑制宫颈癌Hela细胞增殖作用及促进细胞凋亡的作用机制。方法 采用0.025、0.050、0.100、0.200、0.300、0.400 mg/mL浓度ISL处理HeLa细胞,采用四甲基偶氮唑盐(MTT)比色法检测HeLa细胞增殖;采用流式细胞仪检测HeLa细胞凋亡情况;应用罗丹明123染色法检测HeLa细胞线粒体跨膜电位的变化;采用RT-PCR检测6种不同浓度ISL对Bcl-2、P53、P21、E6 mRNA基因表达的影响。结果 (1)MTT检测结果显示:随着ISL浓度增加,对不同时间段HeLa细胞的抑制作用明显增加(P<0.05);(2)流式细胞仪检测:相比于空白对照组,随着ISL浓度逐渐增加,Hela细胞凋亡率明显升高(P<0.01),且凋亡率呈剂量依赖性;(3)罗丹明123荧光染色检测结果:随着ISL浓度逐渐增加,细胞线粒体膜电位下降(P<0.01);(4)RT-PCR结果显示:随着ISL浓度逐渐增加,E6、Bcl-2 mRNA表达水平明显降低(P<0.05),而P53、p21 mRNA表达水平越升高(P<0.05)。结论 ISL通过下调E6、Bcl-2的表达和上调P21、P53基因的表达来抑制宫颈癌细胞的增殖。
宫颈肿瘤;Hela细胞;细胞凋亡;异甘草素
子宫颈癌(简称宫颈癌)为常见妇科恶性肿瘤,是威胁女性生殖系统健康的主要疾病之一,主要发病年龄为50岁左右[1]。研究数据显示,全世界每年新发宫颈癌患者人数为46.5万,而我国宫颈癌每年新发病例数超过13万,且每年死于宫颈癌的患者占据女性癌症死亡人数第2位[2]。异甘草素(2,2,4-三羟基查耳酮,isoliquiritigenin,ISL)是甘草黄酮的一种查耳酮类化合物,是甘草黄酮中主要活性成分之一。近年来研究报道显示,ISL对肺癌、前列腺癌、结直肠癌等肿瘤具有明显的抑制作用,其主要通过抑制细胞周期诱导细胞凋亡来发挥作用[3]。而少见国内关于ISL对宫颈癌的研究报道,通过本次实验探讨ISL对宫颈癌Hela细胞的增殖抑制作用及凋亡机制,为肿瘤化疗及生物治疗提供新的思路及策略。
1 材料与方法
1.1 细胞株 体外培养宫颈癌细胞株HeLa 细胞(HPV18+,野生型p53)均购于中国典型培养物保藏中心(CCTCC)。
1.2 方法
1.2.1 相关药品与试剂 ISL由新疆医科大学实验室合成并提供;高糖DMEM培养基(美国HyClone公司);胎牛血清(FBS,美国Gibco公司);胰蛋白酶(T-EDTA,美国HyClone公司);磷酸盐缓冲液(PBS,美国HyClone公司);双抗(美国HyClone公司);四甲基偶氮唑盐 (MTT,美国Sigma公司);二甲基亚砜 (DMSO,美国Sigma公司);逆转录试剂盒(美国Thermo公司);PCR 引物(上海生工生物技术有限公司);罗丹明123(美国Sigma公司);AnnexinⅤ 细胞凋亡检测试剂盒Ⅰ试剂盒(美国BD公司)。
1.2.2 Hela细胞培养 将细胞用完全培养液(44.5 mL高糖DMEM+5 mL FBS+0.5 mL 双抗)培养在37 ℃,5% CO2恒温培养箱中,倒置显微镜下观察细胞形态、贴壁及融合等状态,一般在2~3 d进行传代。
1.2.3 MTT实验 取对数生长期的Hela细胞,进行消化、离心操作,重悬细胞并调整细胞数目为1×105个/毫升,然后接种于96孔培养板,每孔200 μL,培养箱中培养24 h后将配置好的不同浓度ISL(0.025、0.050、0.100、0.200、0.300、0.400 mg/mL)加入培养板中,设立空白组(仅细胞培养液)及阳性组(0.025 mg/mL顺铂),每组设5个复孔,分别培养24、48、72 h。每孔中加入5 mg/mL 20 μL MTT溶液,37 ℃ 避光孵育4 h,去除溶液后,加入150 μL DMSO,室温下振荡,在酶标仪上选用490 nm测定吸光度值。实验重复3次,取3次实验的平均值作为实验结果,以不同浓度ISL为X轴,细胞数量为Y轴绘制细胞生长抑制曲线。利用计算公式计算不同浓度各个时间段药物对Hela细胞增殖的抑制率,得出最佳时间段最佳药物浓度。其中抑制率(%)=(空白组-不同浓度ISL处理组)/空白组×100%。
1.2.4 按AnnexinⅤ 细胞凋亡检测试剂盒Ⅰ试剂盒说明书进行操作,用流式细胞仪上机检测。
1.2.5 ISL诱导Hela细胞凋亡的线粒体跨膜电位的变化 取对数生长期的Hela细胞2×106个接种于6孔板中药物干预后,进行以下操作:(1)换液;(2)收集细胞;(3)加1 mL罗丹明123染色液(终浓度0.01 mg/mL)染色,避光孵育30 min;(4)离心后洗涤细胞2次;(5)再加入0.5 mL PBS悬浮细胞后,直接用流式细胞仪上机检测。
1.2.6 RT-PCR检测药物对Hela细胞相关凋亡基因表达水平影响 取对数生长期的Hela细胞,进行消化、离心操作,重悬细胞并调整细胞数目为1×106个/毫升,然后接种于培养皿中,培养24 h贴壁后各个组加药提取总RNA进行RT-PCR。(1)提取总RNA。(2)定量总RNA。(3)逆转录反应:按照Postscript Ⅱ First-strand cDNA Synthesis Mix试剂盒操作说明进行逆转录。(4)RT-PCR检测HPV16 E6、Bcl-2、P21、P53及内参β-actin基因,每份样品设3个复孔,反应条件:①E6反应条件,逆转录产物95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火60 s,72 ℃延伸10 s,共40个循环,72 ℃延伸10 min;②Bcl-2反应条件,逆转录产物95 ℃预变性3min,95 ℃变性30s,54 ℃退火30 s,72 ℃延伸10 s共40个循环,72 ℃延伸10 min;③P53反应条件,逆转录产物95 ℃预变性3 min,95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸10 s,共40个循环,72 ℃延伸10 min;④β-actin反应条件,逆转录产物95 ℃预变性3 min,95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸10 s,共40个循环,72 ℃延伸10 min;⑤P21反应条件,逆转录产物95 ℃预变性3 min,95 ℃变性30 s,54 ℃退火30 s,72 ℃延伸10 s,共40个循环,72 ℃延伸10 min。利用系统自带软件分析各基因溶解曲线、起峰曲线及Ct值,根据结果分析药物对细胞基因表达的影响。
1.2.7 Western blot检测药物对Hela细胞相关蛋白表达水平影响 取对数生长期细胞进行消化、离心,细胞重悬后以1×106个/毫升细胞培养密度种植于培养瓶中,温箱中培养24 h,待贴壁后加入0.025、0.050、0.100 mg/mL ISL和0.025 mg/mL顺铂干预24 h,蛋白裂解液裂解细胞后提取总蛋白,采用BSA法进行蛋白质定量,简单步骤如下:(1)提取总蛋白;(2)BAS法蛋白质定量;(3)蛋白质变性;(4)凝胶配制及电泳;(5)十二烷基硫酸钠-聚丙烯酰胺凝胶电流(SDS-PAGE)凝胶配制;(6)转膜;(7)封闭;(8)一抗孵育;(9)二抗孵育;(10)显色。

2 结 果
2.1 ISL对HeLa细胞生长抑制作用 采用0.025、0.050、0.100、0.200、0.300、0.400 mg/mL ISL对Hela细胞进行24 h、48 h、72 h处理后,结果显示,随着药物浓度的升高及时间的延长,抑制率越高。且作为阳性对照的顺铂对细胞也具有明显的增殖抑制作用(表1)。

表1 不同浓度ISL对Hela细胞不同时间的抑制率
a:P<0.05,与空白组比较;b:P<0.05,与阳性组比较。
2.2 Hela细胞凋亡率检测结果 从凋亡结果可知:空白组早期凋亡率只有5.4%,0.025、0.050、0.100 mg/mL ISL药物与顺铂0.025 mg/mL作用细胞后早期凋亡率分别为19.13%、25.43%、56.63%、51.27%,与空白组相比凋亡率明显增加,差异有统计学意义(P<0.01)。见图1。
2.3 ISL诱导Hela细胞凋亡的线粒体跨膜电位的变化结果 不同浓度的药物干预Hela细胞后空白组线粒体膜电位荧光强度为6 255.3%,而药物组0.025、0.050、0.100 mg/mL分别为4 180.0%、3 328.3%、346.0%,阳性组为1 238.7%,与空白组相比差异有统计学意义(P<0.01)。见图2。
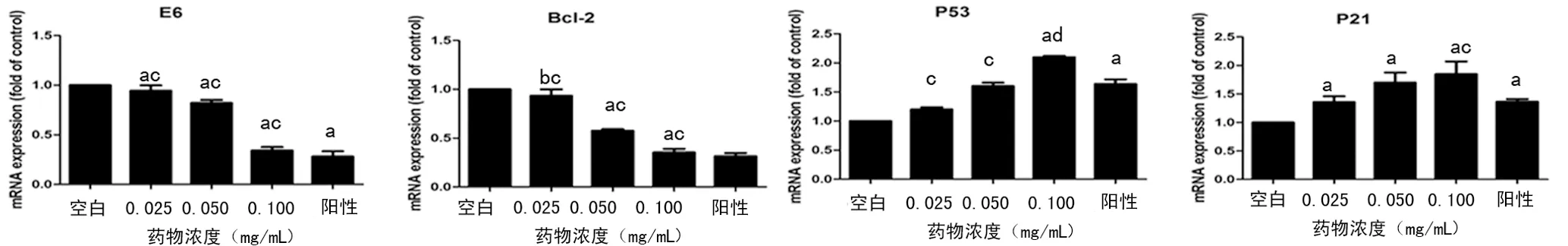
2.4 RT-PCR检测药物对Hela细胞相关凋亡基因表达的影响 药物干预Hela细胞24 h后相关基因中E6和Bcl-2基因随着剂量的增加,基因表达下调;P53和P21基因随着药物剂量的增加,基因表达反而上调。见图3。
2.5 Western blot检测药物对宫颈癌细胞P53、P21 及Bcl-2蛋白表达影响结果 Bcl-2蛋白药物表达与空白组相比较,随着ISL药物浓度增加,蛋白表达水平逐渐降低,P53与P21蛋白的药物组表达与空白组相比较,随着ISL药物浓度增加,蛋白表达逐渐升高。见图4、5。
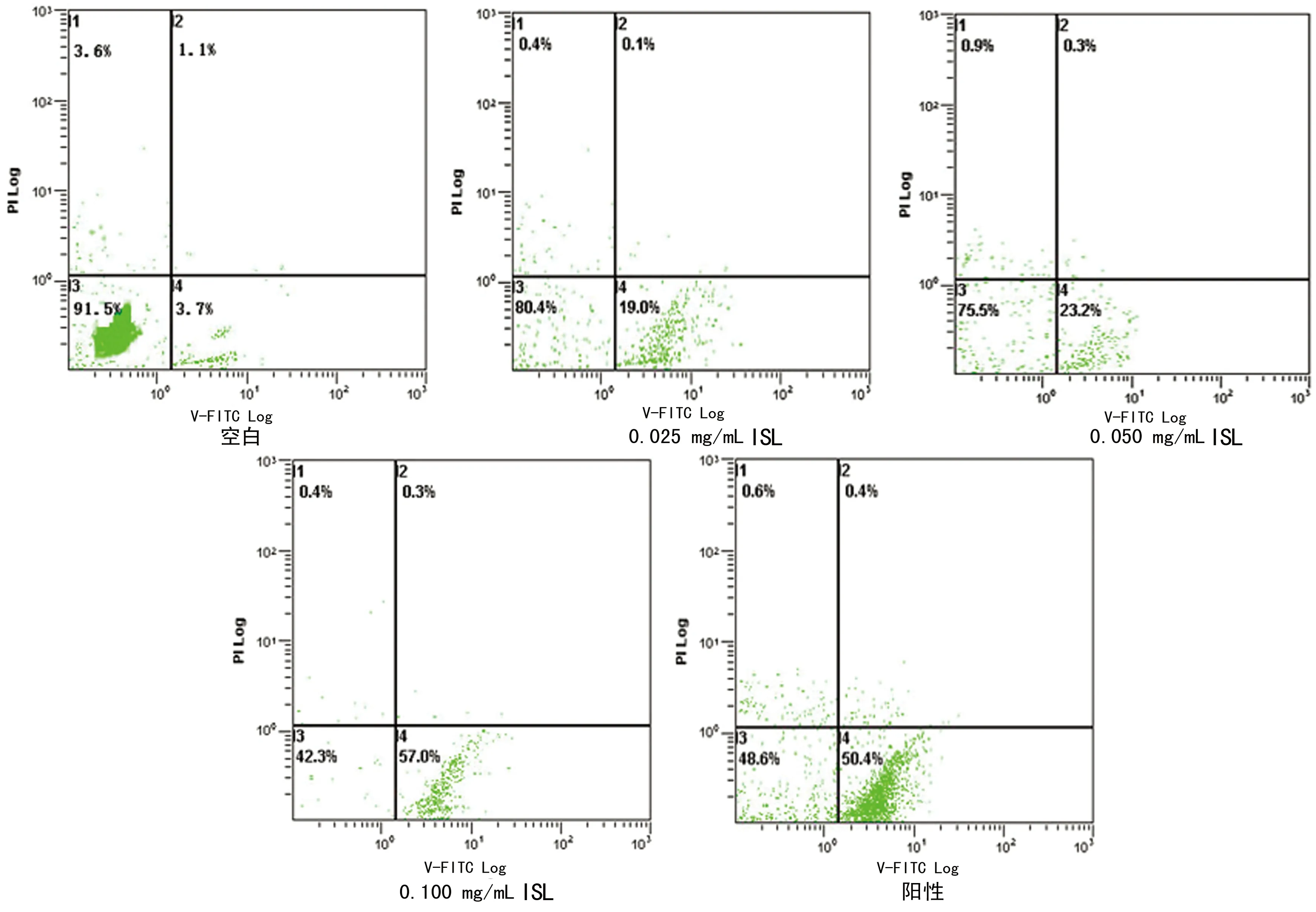
图1 各个浓度药物干预Hela细胞后凋亡率

图2 ILG对Hela细胞线粒体膜电位的影响(罗丹明123标记)
a:P<0.01,b:P<0.05,与空白组比较;c:P<0.01,d:P<0.05,与阳性组比较
图3 各个浓度药物对Hela细胞凋亡基因的影响(n=3)

图4 SL对相关蛋白表达的影响

a:P<0.01,b:P<0.05,与空白组比较;c:P<0.01,d:P<0.05,与阳性组比较
图5 ISL对相关蛋白表达影响的灰度值(n=3)
3 讨 论
MTT为黄色化合物,是一种接受氢离子的荧光染料,能够被活细胞体内琥珀酸脱氢酶还原为不溶于水的蓝紫色结晶甲瓒(Formazan)并沉积在细胞中,而凋亡细胞丧失细胞中琥珀酸脱氢酶消失,不能将MTT还原成蓝紫色结晶,而采用DMSO溶解细胞中的甲瓒,用酶联免疫检测仪在490 nm波长处测定其吸光度值,可间接反映活细胞数量[4]。且活细胞数量越多,生成蓝紫色结晶越多,检测的吸光度值就越大,活细胞数量少,生成紫色结晶少,吸光度值越小,MTT结晶形成的量与细胞数成正比。因此,MTT法能够间接反映活细胞数及细胞生长活性,具有灵敏度高、操作简便、经济、快速等优点,被广泛用于生物活性因子、细胞毒性的检测[5]。本研究结果显示,随着ISL浓度增加对Hela细胞增殖抑制作用逐渐增强,且呈现出时间和剂量依赖性效应。
细胞凋亡是生物界广泛存在的一种基本生命现象,是指细胞在一定生理或病理条件下,受内在遗传机制控制自动结束生命的过程,细胞凋亡受凋亡相关基因调控,又称为细胞程序性死亡。近年来,有学者发现,机体内细胞凋亡机制的发生和进行受到精确调控,各种凋亡信号通过相应的信号传导通路传递到相关细胞核内的相关靶基因,靶基因通过表达相关蛋白引起细胞凋亡,细胞凋亡对肿瘤起着负调作用,而细胞凋亡的调控过程发生紊乱会导致细胞代谢紊乱,从而导致肿瘤恶性增殖的发生[6]。本研究结果显示,将通过AnnexinⅤ-FITC和PI双标记法用流式细胞仪检测细胞凋亡可得到。因此得知,药物浓度与凋亡的发生呈正相关,随着药物浓度增加,Hela细胞出现致密浓染的凋亡细胞增多,早期凋亡率明显升高,说明ISL诱导宫颈癌Hela细胞凋亡。
细胞膜电位和细胞凋亡有着密不可分的关系,细胞凋亡的过程中往往伴随着线粒体跨膜电位的破坏,这被广泛认为是细胞凋亡过程中最早发生的事件之一。有研究报道,在ISL诱导细胞凋亡的可能机制为,线粒体膜电位的耗散触发细胞色素C的释放和半胱天冬酶的活化[7-9]。Yuan等[10]研究报道显示,ISL主要是通过改变细胞线粒体跨膜电位的变化来诱导细胞凋亡。本研究结果显示,ISL能够降低Hela细胞线粒体跨膜电位稳定性,从而诱导线粒体介导的细胞凋亡,且随着ISL浓度增加,凋亡程度显著增加。ISL药物浓度越增加,罗丹明123荧光强度越明显下降,膜电位下降百分比也下降,表明ISL以浓度依赖方式降低HeLa细胞线粒体跨膜电位。
宫颈癌细胞中肿瘤抑制因子P53表达以野生型为主,P53在不同的刺激下分别调节细胞周期或者细胞凋亡,通过转录活化相关靶基因,如P21、Bax、P53DINP1等,其作为一种重要抑癌基因与细胞生长、分化及死亡的生物调控具有密切联系[11-12]。HPV早期编码区E6、E7基因表达E6、E7蛋白是致癌的关键,其中E6蛋白能够与E6相关蛋白介导与抑癌蛋白P53结合,经过泛素途径使其降解,阻止细胞凋亡,导致细胞向恶性增殖发展;而E7蛋白能够结合细胞周期相关负向调节因子P21和P16,导致其失活抑制细胞生长,造成细胞周期紊乱,引起细胞无限增殖并向恶性转化,最终导致子宫颈癌的发生[13]。本研究结果显示:随着ISL药物浓度的增加,p53、p21表达增加或者恢复功能,抑制E6、Bcl-2的表达,并呈现剂量依赖性效应。
综上所述,ISL药物能够通过引起线粒体膜电位变化来诱导宫颈癌细胞凋亡,同时ISL还可以降低Hela细胞中E6癌基因、Bcl-2基因表达,增加P53、P21基因表达来促进肿瘤细胞凋亡,为进一步明确ISL的抗肿瘤活性和抗癌候选药物的筛选提供理论基础。
[1]高淑平.宫颈癌诊断与治疗的新进展[J].医学理论与实战,2012,25(12):1446-1448.
[2]程大丽.β-谷甾醇对宫颈癌细胞株的抑制作用及其机制研究[D].沈阳:中国医科大学,2012:1-52.
[3]钱庆庆,金辉,孙光春,等.异甘草素抗肿瘤作用研究进展[J].中国药理学与毒理学杂志,2013,16(6):908-910.
[4]Karthikeyan S,Kanimozhi G,Prasad NR,et al.Radiosensitizing effect of ferulicacid on human cervical carcinomacells in vitro[J].Toxicol In Vitro,2011,25(1):66-75.
[5]高洋.茶多酚对人宫颈癌Hela细胞增殖及凋亡的影响和机制[D].天津:天津医科大学,2010:1-73.
[6]杨俊.蛋白酶体抑制剂MG132对宫颈癌Hela细胞凋亡及caspase-3表达的影响[D].长沙:中南大学,2007:1-40.
[7]刘韦成.低表达蛋白HAX1对肿瘤细胞线粒体膜电位及细胞凋亡的影响[D].武汉:华中科技大学,2009:1-39.
[8]JungJI,LimSS,ChoHJ,etal.Isoliquiritigenininduceapoptosisbydepolarizingmitochondrialmembrances in prostate cancer cells[J].Nutr Biochem,2006,17(5):689-696.
[9]Hsu YL,Chia CC,Chen PJ,et al.Shallot and licorice constituent isoliquiritigenim arrests cell cycle progression and induces apoptosis through the induction of ATM/p53 and initiation of the mitochondrial system in human cervical carcinoma Hela cells[J].Mol Nutr Food Res,2009,53(6):826-835.
[10]Yuan X,Zhang B,Gan L,et al.Involvement of the mitochondrion-dependent and the endoplasmic reticulum stress-signaling pathways in isoliquiritigenin-induced apoptosis of hela cell[J].Biomed Environ Sci,2013,26(4):268-276.
[11]Hollstein M,Hainaut P.Massively regulated genes:the example of TP53[J].Pathol,2010,220(2):164-73.
[12]Kim E,Giese A,Deppert W.Wild-type p53 in cancer cells:when a guardian turnsinto a blackguard[J].Biochem Pharmacol,2009,77(1):11-20.
[13]卫莹.GRIM-19诱导子宫颈癌细胞中p53蛋白积聚的机制研究[D].合肥:安徽医科大学,2010:1-60.
Effect and mechanism of isoquiritigenin on proliferation of human cervical cancer cells*
Hanikezi·Tuerxun1,Guzainuer·Maimaitituersun2,Mourboul·Ablise3,Mayinuer·Aiken4,Zufeiya·Aili2△
(1.DepartmentofGynecology,FirstAffiliatedHospital,XinjiangMedicalUniversity,Urumqi,Xinjiang830054,China;2.KashiAreaSecondPeople′sHospital,Kashi,Xinjiang844000,China; 3.CollegeofPharmacy,XinjiangMedicalUniversityUrumqi,Xinjiang830011,China; 4.DepartmentofGynecology,SecondPeople′sHospitalofXinjiangAutonomousRegion,Urumqi,Xinjiang830054,China)
Objective To study the effects and mechanism of isoquiritigenin (ISL) in inhibiting the proliferation and promoting the apoptosis of cervical cancer HeLa cells.Methods HeLa cells were treated with ISL of 0.025,0.050,0.100,0.200,0.300 and 0.400 mg/mL.The proliferation of HeLa cells was detected by MTT colorimetric assay,and the apoptosis of HeLa cells was detected by flow cytometry.Changes of mitochondrial transmembrane potential in HeLa cells were detected by rhodamine 123 staining method.RT-PCR was used to detect the effect of 6 different concentrations of ISL on the expression of Bcl-2,P53,P21 and E6mRNA genes.Results (1) MTT test showed that with the increase of ISL concentration,the inhibitory effect on HeLa cells in different time periods increased significantly (P<0.05).(2) Flow cytometry showed that compared with the blank control group,with the increase of ISL concentration,the apoptosis rate of Hela cells increased significantly (P<0.01),and the apoptosis rate was dose-dependent.(3) Rhodamine 123 fluorescence staining showed that with the increase of ISL concentration,the mitochondrial membrane potential decreased (P<0.01).(4) RT-PCR showed that the expression levels of E6 and Bcl-2 mRNA decreased significantly (P<0.05),and the expression levels of P53 and p21mRNA increased (P<0.05) with the increase of ISL concentration.Conclusion ISL can inhibit the proliferation of cervical cancer cells by down regulating the expression of E6 and Bcl-2 and up regulating the expression of P21 and P53 genes.
Cervical neoplasms;HeLa cells;apoptosis;isoquiritigenin
新疆维吾尔自治区自然科学基金资助项目(2014211C064)。
哈尼克孜·吐尔逊(1975-),副主任医师,硕士,主要从事妇科肿瘤方面的研究。
△通信作者,E-mail:2428157641@qq.com。
10.3969/j.issn.1671-8348.2017.24.004
R711.74
A
1671-8348(2017)24-3324-04
2017-01-11
2017-03-21)
