CDH17调节TGF-β自分泌影响胃癌细胞侵袭作用的研究*
2017-09-08孟庆斌邵永胜
卢 昕,孟庆斌,邵永胜
(武汉市第一医院胃肠外科 430022)
论著·基础研究
CDH17调节TGF-β自分泌影响胃癌细胞侵袭作用的研究*
卢 昕,孟庆斌,邵永胜△
(武汉市第一医院胃肠外科 430022)
目的 探讨转化生长因子(TGF)-β自分泌在钙黏蛋白17(CDH17)调节胃癌细胞侵袭性中的作用及可能机制。方法 构建siRNA-CDH17并转染入胃癌细胞系MKN-45,沉默其表达。通过免疫荧光染色、Western blot、ELISA检测CDH17沉默前后细胞TGF-β表达及培养上清液中TGF-β水平变化,观察TGF-β的自分泌情况。同时采用Western blot检测TGF-β/Smad3信号通路活化情况,并通过Transwell侵袭实验观察在给予信号通路抑制剂后,胃癌细胞侵袭力的变化,评价TGF-β自分泌及相关信号通路活化在CDH17调节胃癌细胞侵袭性中的作用。结果 转染siRNA-CDH17沉默MKN-45细胞CDH17表达后,细胞TGF-β表达较未转染组明显下降,其培养上清液中TGF-β水平也显著减少[(510±55.0)pg/mLvs.(115±20)pg/mL,P<0.05]。Western blot显示CDH17沉默后Smad3磷酸化水平也明显降低,而给予TGF-β/Smad3信号通路抑制剂SIS3(10 μmol/L)也可抑制CDH17高表达时的Smad3磷酸化水平。同时,沉默CDH17及抑制Smad3磷酸化均可明显降低MKN-45细胞侵袭性(P<0.05)。结论 CDH17可能通过促进自分泌TGF-β活化TGF-β/Smad3信号通路参与调节胃癌细胞侵袭性。
胃肿瘤;肿瘤浸润;转化生长因子-β;CDH17;信号通路
目前研究发现钙黏蛋白17(CDH17)是参与调节胃癌细胞侵袭及淋巴转移的重要分子[1],然而目前其确切调控机制仍不明确,笔者前期研究发现CDH17 可通过诱导胃癌细胞向间质表型转换促进胃癌细胞侵袭,提示上皮间质转化可能是CDH17调控胃癌细胞侵袭性的可能机制之一。转化生长因子(TGF)-β及相关信号通路是参与调节上皮间质转化的重要分子信号[2]。目前报道多种肿瘤可通过自分泌TGF参与调节自身的增殖、侵袭、转移等生物学行为[3-4]。因此推测TGF-β自分泌也可能在CDH17诱导的胃癌细胞侵袭中发挥作用。本实验通过比较胃癌细胞CDH17沉默前后,TGF-β的表达及分泌变化和相关信号通路活化情况,观察其对胃癌细胞侵袭性的影响,探讨TGF-β自分泌在CDH17调节胃癌细胞侵袭力中的作用及其可能机制。
1 材料与方法
1.1 主要材料和试剂 蛋白裂解液M-PER购自美国Thermo Pierce公司。CDH17和TGF-β一抗购自美国Abcam公司,磷酸化p-Smad3、总t-Smad3和SIS3一抗购自美国Cell Signaling Technology公司。β-actin一抗及相应的二抗和链霉亲和素-生物复合物(SABC)免疫荧光试剂盒购自武汉博士德生物工程有限公司。超敏电化学发光(ECL)试剂盒购自碧云天生物技术研究所。胎牛血清和高糖DMEM培养基购自美国Hyclone公司。TGF-β ELISA试剂盒购自美国R&D公司。去细胞因子基质胶购自美国Sigma-Aldrich公司。24孔嵌套Transwell(聚碳酯膜孔径8μm)购自美国Corning公司。
1.2 方法
1.2.1 细胞培养及实验分组 胃癌细胞系MKN-45由华中科技大学同济医学院附属协和医院普通外科实验室保存提供。细胞培养于含10%胎牛血清的高糖DMEM完全培养基中,置于37℃,5%CO2培养箱,2~3 d传代一次。实验共分为3组:转染siRNA-CDH17组;转染CDH17空白质粒(vector)组和非转染组。
1.2.2 siRNA-CDH17的构建与转染 CDH17基因的cDNA序列由 GenBank(NM_001144663.1) 获得,针对该序列的3种不同siRNA 由在线RNAi设计算法设计(http://www.ambion.com/techlib/misc/siRNA_finder.html)。所有设计的siRNAs由上海吉玛生物制药有限公司合成纯化。合成纯化的siRNAs 用全式金脂质体转染试剂盒(北京全式金生物技术有限公司)根据说明书转染入MKN-45细胞。经实时定量PCR 鉴定,siRNA-CDH17 序列正义链:5′-TGC AUT TCC UAA GGC TGA-3′,反义链5′- GAU CCT GGT TCA AUA ACA T-3′,具有最佳干扰效率。再将siRNA-CDH17用上述方法和试剂盒分别转染入MKN-45细胞。细胞转染48 h后用于实验,细胞活性由台盼蓝染色鉴定。
1.2.3 细胞免疫荧光染色 分别将转染与非转染MKN-45细胞接种于盖玻片上,以SABC法进行免疫荧光染色。4%多聚甲醛固定后,以0.1%Triton-x-100对细胞膜打孔15 min,30%过氧化氢与甲醇混合浸泡60 min以灭活内源性过氧化物酶,洗涤后以5%牛血清清蛋白封闭60 min,分别加入CDH17和TGF-β一抗(1∶100),4℃湿盒内孵育过夜。再滴加生物素化二抗室温孵育20 min后加入异硫氰酸荧光素(FITC)标记的SABC荧光反应液室温孵育20 min,脱水,透明,封片,荧光显微镜观察。
1.2.4 ELISA 收集上述各组细胞培养上清液,按TGF-β ELISA试剂盒说明测定标准曲线后加样,每孔终体积50 μL。用封板膜封板后置37 ℃温育30 min后甩干、洗涤,重复5次,拍干。每孔加入酶标试剂50 μL,空白孔除外,重复上述步骤5次,拍干。每孔加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻振荡混匀,37 ℃避光显色15 min。每孔加终止液50 μL,终止反应,最后以空白孔凋零,450 nm波长依序测量各孔的吸光度。
1.2.5 Western blot 将转染siRNA-空载体组细胞预先用SIS3(10 μmol/L)孵育24 h,然后同上述转染和未转染细胞洗涤加入蛋白裂解液提取总蛋白。蛋白定量后,煮沸变性后按每孔30 μg上样,经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(DS-PAGE)凝胶电泳后转移至PVDF膜,以5%脱脂奶粉封闭60 min,分别加入TGF-β(1∶1 000)、p-Smad3(1∶1 000)和t-Smad3(1∶1 000)及β-actin(1∶1 000)一抗4 ℃孵育过夜,二抗室温孵育1 h后,采用ECL,以Bio-Rad荧光成像系统显影。目的蛋白表达以β-actin作为参照相对定量。
1.2.6 Transwell侵袭实验 将上述经SIS3孵育的细胞及转染和未转染细胞按1×105/孔接种于铺有去细胞因子基质胶的24孔Transwell嵌套(滤膜孔径为8 μm)中,上室加入不含血清的高糖DMEM培养基,下室均加入含10%胎牛血清的完全培养基,孵育8 h后,苏木素染色,显微镜下计数穿膜细胞。

2 结 果
2.1 siRNA-CDH17转染对TGF-β表达的影响 细胞免疫荧光显示转染siRNA-CDH17后,MKN-45细胞CDH17及TGF-β表达明显下降,Western blot也显示沉默CDH17表达后,TGF-β表达也明显减少。转染siRNA-vector(空载体)组与未转染对照组TGF-β呈现相对高表达,二者间表达水平比较差异无统计学意义(图1)。
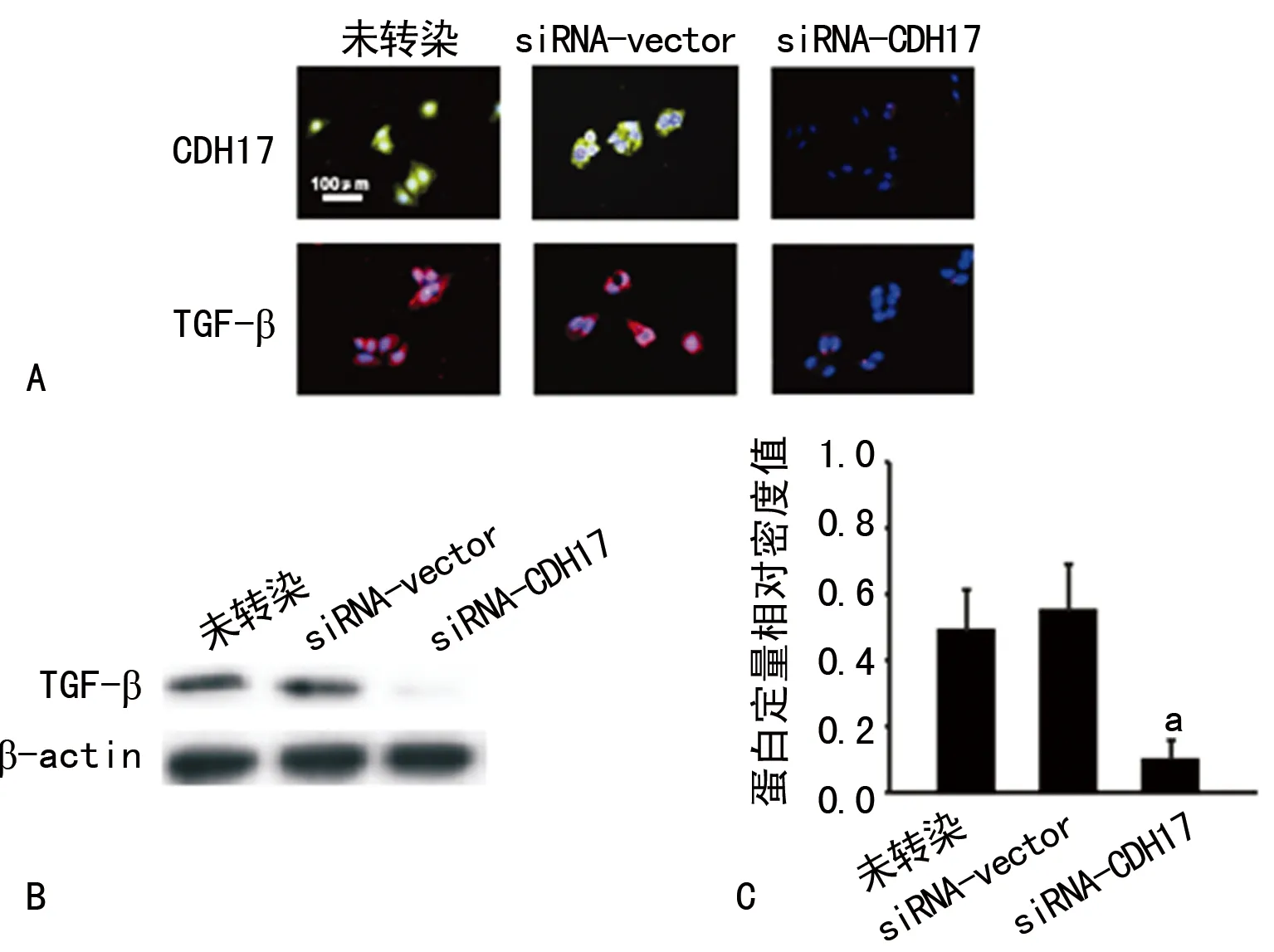
A:免疫荧光染色;B:Western blot;C:Western blot相对定量。a:P<0.05
图1 siRNA-CDH17转染对TGF-β表达的影响
2.2 siRNA-CDH17转染对TGF-β分泌的影响 ELISA检测显示,转染siRNA-CDH17,沉默MKN-45细胞CDH17表达后,其培养上清液中TGF-β水平明显降低[(510±55)pg/mLvs.(115±20) pg/mL,P<0.05],而转染siRNA-vector组与未转染组上清液中TGF-β水平相对较高,两组比较差异无统计学意义[(510±55)pg/mLvs.(485±38) pg/mL,P>0.05]。
2.3 siRNA-CDH17转染对TGF-β/Smad3信号通路活化的影响 转染siRNA-CDH17,沉默CDH17表达后,胃癌MKN-45细胞Smad3磷酸化水平较未转染组明显下降(P<0.05),而转染siRNA-vector组与未转染组细胞Smad3磷酸化水平较高,两组比较差异无统计学意义(P>0.05)。而TGF-β/Smad3信号通路抑制剂SIS3可明显减少siRNA-vector组的Smad3磷酸化水平(P<0.05),见图2。
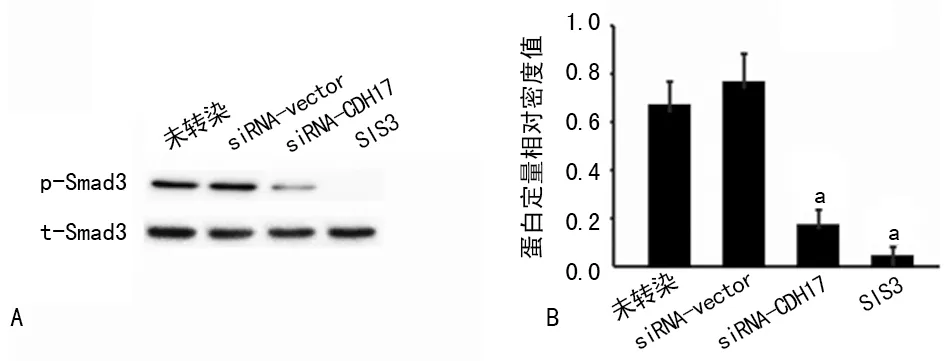
A:Western blot;B:Western blot相对定量。a:P<0.05
图2 siRNA-CDH17转染对TGF-β/Smad3信号通路活化的影响
2.4 TGF-β/Smad3信号通路对MKN-45细胞侵袭性的影响 Transwell侵袭实验检测显示,较未转染组(9 525±1 000)及siRNA-vector组(9 525±1 000),siRNA-CDH17转染(2 650±410)及应用SIS3处理(3 800±525)均可明显减少胃癌MKN-45细胞的侵袭数,差异有统计学意义(P<0.05)。
3 讨 论
前期研究发现CDH17表达可诱导胃癌细胞向间质细胞表型转化,提示上皮间质转化可能在CDH17调控胃癌细胞转移、侵袭中发挥作用。因此探讨上皮间质转化相关信号机制与CDH17侵袭调控间的关系,有助于进一步阐明胃癌侵袭调控的信号生物学机制。本实验通过检测CDH17对胃癌细胞TGF-β产生和TGF-β/Smad3信号通路活化的影响,以及TGF-β/Smad3信号活化在胃癌细胞侵袭中的作用,探讨TGF-β及其相关信号通路在CDH17调控胃癌细胞侵袭性中的可能作用及机制。
本研究发现在胃癌细胞高表达CDH17时,细胞TGF-β的表达及分泌均较高,而抑制CDH17表达后,TGF-β的表达及分泌均明显减少,提示CDH17可能对胃癌细胞TGF-β的自分泌发挥作用。尽管CDH17是钙黏蛋白家族成员,通常被作为下游蛋白受上游分子信号调节。但近来研究表明,采用siRNA干扰技术,抑制CDH17的基因表达,可抑制上游β-catenin/Wnt和Ras/MEK信号通路活化,进而影响胃癌细胞的侵袭[5-6]。本研究则发现,CDH17高表达伴随的TGF-β高表达可增加Smad3磷酸化水平,而沉默CDH17表达后,在TGF-β产生减少的同时,Smad3磷酸化水平也显著下降,表明CDH17也可介导上游TGF-β/Smad3信号通路活化,进而促进胃癌细胞侵袭。
TGF-β/Smad3信号通路在介导上皮间质转化(epithelial-mesenchymal transition,EMT)中发挥最重要功能[7]。而EMT通过细胞表型向间质转化,使细胞高表达基质金属蛋白酶,从而易于分解细胞外基质,利于细胞迁移;同时通过间质转化本身,细胞内骨架重排,迁移能力增强也有利于细胞迁移力及侵袭性增强[8]。前期研究证实,CDH17可通过诱导胃癌细胞EMT促进其侵袭。本研究也发现,Smad3磷酸化水平与胃癌细胞侵袭性相关,无论抑制CDH17表达或直接抑制Smad3活化均可显著减少胃癌细胞侵袭。进一步证实TGF-β/Smad3信号通路可能通过诱导EMT在介导胃癌细胞侵袭性中发挥重要作用。
本研究发现为CDH17在调节胃癌细胞侵袭性中的作用提供了又一新的分子细胞生物学机制,较以往的研究不仅关注分子信号机制本身,结合前期研究更进一步揭示分子信号与侵袭终效应间的细胞生物学行为联系。但由于β-catenin/Wnt和Ras/MEK等信号通路也在CDH17介导的胃癌细胞侵袭中发挥重要作用,且细胞信号本身存在多种信号交联机制。因此进一步深入探寻信号交联分子在其中的作用,更有助于进一步阐明胃癌细胞侵袭转移机制。同时CDH17介导上游信号通路的活化调节是直接作用还是需要中间分子机制参与是下一个研究目标。
[1]Park SS,Kang SH,Park JM,et al.Expression of liver-intestine cadherin and its correlation with lymph node metastasis in gastric cancer:can it predict N stage preoperatively? [J].Ann Surg Oncol,2007,14(1):94-99.
[2]Zavadil J,Bottinger EP.TGF-beta and epithelial-to-mesenchymal transitions [J].Oncogene,2005,24(37):5764-5774.
[3]蔡洪培,高勇,张翼翔.人肝癌细胞系SMMC-7721细胞TGF-α 的自分泌[J].第二军医大学学报,2001,22(4):393-394.
[4]洪祖蓓,狄文,丁传伟.TGF-α/EGFR自分泌环调控卵巢癌细胞增殖转移的分子机制[J].中国癌症杂志,2006,16(11):899-902.
[5]Qiu HB,Zhang LY,Ren C,et al.Targeting CDH17 suppresses tumor progression in gastric cancer by downregulating Wnt/β-catenin signaling[J].PLoS One,2013,8(3):e56959.
[6]Wang J,Kang WM,Yu JC,et al.Cadherin-17 induces tumorigenesis and lymphatic metastasis in gastric cancer through activation of NFκB signaling pathway [J].Cancer Biol Ther,2013,14(3):262-270.
[7]Micalizzi DS,Farabaugh SM,Ford HL.Epithelial-mesenchymal transition in cancer:parallels between normal development and tumor progression[J].J Mammary Gland Biol Neoplasia,2010,15(2):117-134.
[8]Yang J,Weinberg RA.Epithelial-mesenchymal transition:at the crossroads of development and tumor metastasis[J].Dev Cell,2008,14(6):818-829.
Study on role of CDH17 regulating TGF-β autocrine for affecting invasion of gastric cancer cells*
LuXin,MengQingbin,ShaoYongsheng△
(DepartmentofGastrointestinalSurgery,WuhanMunicipalNo.1Hospital,Wuhan,Hubei430022,China)
Objective To explore the role and possible mechanism of transforming growth factor (TGF)-β autocrine in CDH17 regulating invasion of gastric cancer cells.Methods Construction and transfection of siRNA-CDH17 into MKN-45 gastric cancer cell line to silence the expression of CDH17.Expression of TGF-β and concentrations of TGF-β in supernatants were detected before and after CDH17 silence by immunofluorescence,immunoblotting and ELISA.The autocrine situation of TGF-β was observed.Meanwhile,the activation of TGF-β/Smad3 signaling pathway was also detected by immunoblot.After giving signaling pathway inhibitor,the changes of invasion ability of MKN-45 cells were observed by Transwell invasion experiment.The role of TGF-β autocrine and related signaling pathway activation in CDH17-regulated invasion of gastric cancer cells was evaluated.Results After transfecting siRNA-CDH17 for silencing CDH17 expression in MKN-45 cells,the expression of TGF-β was significantly decreased compared with non-transfection group,its concentration in supernatants was also significantly reduced[(510±55)pg/mLvs. (115±20) pg/mL,P<0.01].The immunoblots revealed that phosphorylation level of Smad3 after CDH17 silence was also significantly diminished.However,giving the TGF-β/Smad3 signaling inhibitor SIS3 (10 μmol/L) could also suppress the phosphorylation level of Smad3 when CDH17 was highly expressed,meanwhile silencing CDH17 and inhibiting Smad3 phosphorylation could significantly decrease the invasion of MKN-45 gastric cancer cells (P<0.05).Conclusion CDH17 could participate in the invasion of gastric cancer cells by promoting TGF-β autocrine to activate TGF-β/Smad3 signaling pathway.
stomach neoplasms;neoplasm invasiveness;transforming growth factor -β;CDH17;signaling pathway
2015年武汉市卫生和计划生育委员会科研项目(WX15C31).
卢昕(1971-),副主任医师,博士,主要从事胃肠肿瘤分子生物学研究。
△通信作者,E-mail:shaoyongsheng1211@medmail.com.cn。
10.3969/j.issn.1671-8348.2017.24.003
R735.2
A
1671-8348(2017)24-3321-03
2016-12-19
2017-03-07)
