老年直肠癌患者外周血与癌组织miR-141的表达及其临床相关性
2017-09-08吕雅蕾徐志宏王贵英
冯 莉,吕雅蕾,常 靓,刘 妍,王 龙,徐志宏,王贵英
(河北医科大学第四医院:1.肿瘤内科,2.外二科,石家庄 050011)
论著·临床研究
老年直肠癌患者外周血与癌组织miR-141的表达及其临床相关性
冯 莉1,吕雅蕾1,常 靓1,刘 妍1,王 龙1,徐志宏1,王贵英2△
(河北医科大学第四医院:1.肿瘤内科,2.外二科,石家庄 050011)
目的 研究老年直肠癌患者外周血与癌组织微小RNA(miR)-141的表达及临床相关性。方法 75例直肠癌患者取直肠癌组织及癌旁正常组织并抽取肘静脉血,应用实时聚合酶联法检测直肠癌、癌旁正常组织标本和外周血中miR-141的表达水平,分析直肠癌组织和外周血miR-141的相关性,外周血miR-141与临床病理特征和临床预后的关系。结果 (1)与健康体检者外周血或者与正常癌旁组织相比,miR-141的表达水平在直肠癌患者外周血和直肠癌组织中均明显下调(P<0.01);(2)有淋巴结转移的患者中直肠癌组织miR-141水平与外周血miR-141水平呈正相关(r=0.694,P<0.01),无淋巴结转移的患者中直肠癌组织miR-141水平与外周血miR-141水平呈正相关(r=0.725,P<0.01);(3)直肠癌患者外周血miR-141表达与肿瘤分期、肿瘤分化程度和有无淋巴结转移相关;(4)术后6个月随访显示,75例患者中有13例(17.33%)患者出现复发/转移,复发/转移患者外周血miR-141水平为(2.64±0.34),显著低于未复发/转移患者(P<0.01)。结论 miR-141在直肠癌患者外周血中表达与在癌组织中表达变化趋势一致,可反映直肠癌的临床病理特征。
直肠肿瘤;老年人;微RNAs;预后;miRNA-141
直肠癌是常见的消化道恶性肿瘤之一,目前随着社会发展和人民生活水平的提高,其发病率也呈上升趋势,居消化道肿瘤第2位[1],并且以4.2%的平均速度逐年递增[2-3]。结直肠癌的早期筛查与诊断越来越受到人们的关注。近年来新发现的微小RNA(microRNA,miR) 是一类非编码小RNA分子,由20~24个核苷酸组成。miR可抑制miR的翻译,并诱导miR的切割降解[4]。近年来大量研究证实,miR可发挥抑癌基因或癌基因的作用,通过负调控基因表达,参与恶性肿瘤的发生、发展过程,miR有望成为肿瘤的早期诊断、特异性治疗及评估预后的标志物。目前对miR在肿瘤患者中表达的研究主要集中于肿瘤组织样品中,而以血清作为样品的研究较少。已有研究显示,miR-21在结直肠癌、食管鳞状细胞癌等患者血清中表达上调,提示其有望应用于多种恶性肿瘤的早期诊断和预后评估[5-6]。有报道发现,miR-141在结直肠癌患者血清中的表达水平显著高于健康人,结肠癌血清miR-141水平与临床分级和预后密切相关[7]。由于miR-141在不同肿瘤中作用不同,如在头颈部鳞状细胞癌、非小细胞肺癌、女性生殖系统肿瘤和肾细胞癌中具有抑制肿瘤迁移、侵袭、增殖和耐药的作用[8-10],但在卵巢癌中miR-141会促进肿瘤细胞增殖和耐药性[11-12]。本研究探讨直肠癌组织与血清miR-141的相关性,分析其与直肠癌的发展和预后的相互关系,为结直肠癌预后的推测及治疗寻求一种简便、可靠的检测方法。
1 资料与方法
1.1 一般资料 本研究的直肠癌患者为 2014年1~12月在本院收治的患者,最后共纳入75例。患者的纳入标准:(1)年龄大于或等于60岁;(2)经过组织病理学确诊为直肠癌;(3)为避免治疗的影响,所有纳入对象均未经过放疗或化疗。对象纳入的直肠癌患者中男43例(57.33%),女32例(42.67%);年龄60~72岁,平均(65.26±6.52)岁;肿瘤直径2.4~7.3 cm,平均(4.63±1.58)cm;肿瘤TNM分期Ⅰ期13例(17.33%)、Ⅱ期31例(41.33%)、Ⅲ期24例(32.00%)、Ⅳ期7例(9.34%);黏膜下层浸润46例(61.33%)、黏膜层浸润29例(38.67%);距肛缘距离大于或等于5 cm 40例(53.33%),距肛缘距离小于5 cm 35例(46.67%);高度分化16例(21.33%)、中度分化23例(30.67%)和低度分化36例(48.00%);无淋巴结转移31例(41.33%)、有淋巴结转移44例(58.67%)。同时按照年龄和性别配比选取同期在本院体检中心健康体检者40例作为对照,年龄60~75岁,平均(66.45±5.96)岁;男22例(55.00%)、女18例(45.00%)。两组受试者年龄和性别差异均无统计学意义(P>0.05)。所有对象均签署知情同意书,研究经本院伦理委员会审核通过。
1.2 主要试剂 mirVanaTMPARISTMmiRNA试剂盒,由美国Applied Biosystems提供;FAST1000试剂盒,由北京先锋生物公司提供;Affymetrix 逆转录试剂盒,由美国Qiagen 公司提供;Micrornas实时聚合酶联反应(real time-polymerase chain reaction,RT-PCR)检测试剂盒,由北京艾德莱生物科技公司;miR-141及内参U6引物设计与合成由北京艾德莱生物科技公司提供,miR-141的引物序列为5′-CCG GTA ACA CTG TCT GGT AA-3′,内参U6的引物序列为5′-GCT TCG GCA GCA CAT ATA CTA AAA T-3′。
1.3 主要仪器 紫外可见分光光度仪,由德国Eppendorf公司提供;ABI step one荧光定量PCR仪,由美国ABI公司提供;GeneGenius全自动凝胶成像系统,由美国Syngene公司提供。
1.4 试验方法 提取受试者外周血和直肠标本的RNA,采用Real-time PCR法测定直肠病理组织。
1.4.1 RNA提取 抽取受试者空腹肘静脉血5 mL,室温下静置30 min,待血液完全凝固后离心分离血清。取血清采用mirVanaTMPARISTMmiRNA试剂盒提取总RNA。直肠组织RNA提取采用FAST1000试剂盒进行。称取100 mg直肠癌组织或癌旁正常组织并加入裂解液,研磨,吸取裂解液后加入氯仿进行混匀,离心,加入聚合液并转移至内套管,洗脱液洗脱2次,高速离心,将内套管移入EP内,膜中央加洗脱液RNase-free H2O,静置,离心,即得。所得RNA 经紫外分光光度法测定浓度,吸光度A260/A280为1.8~2.1的RNA样品于-80 ℃保存。
1.4.2 RT-PCR 采用Affymetrix one-cycle cDNA Synthesis Kit,以总RNA为模板,miR-141 特异性逆转录引物进行逆转录反应得cDNA。逆转录条件如下:16 ℃ 30 min;42 ℃ 30 min;85 ℃ 5 min。将逆转录所得cDNA纯化后应用Micrornas RT-PCR检测试剂盒在ABI step one荧光定量PCR仪进行PCR扩增。反应总体积为20 μL:1.5 μL cDNA 模板,1 μL miR-141或U6引物,10 μL miRNA qPCR Mix,7.5 μL H2O。PCR反应条件为:94 ℃预变性3 min,然后以94 ℃ 20 s、60 ℃ 20 s和72 ℃ 40 s,循环40次。以U6 为参照,采用2-△△Ct计算目标基因的相对表达量。
1.5 临床治疗和疗效评价 所有Ⅰ期患者根治术后观察随访,Ⅱ~Ⅲ期患者根治术后接受辅助放化疗,Ⅳ期患者姑息术后接受一线化疗。化疗方案均采用mFOLFOX6方案(奥沙利铂85 mg/m2,静脉滴注大于2 h,第1天;四氢叶酸钙400 mg/m2,静脉滴注2 h,第1天;氟尿嘧啶0.4 g/m2,静脉推注,2.4 g/m2,持续静脉输注46~48 h;每2周为1个周期)或XELOX方案(奥沙利铂130 mg/m2,静脉滴注大于2 h,第1天;卡培他滨 850~1000 mg/m2,每天两次口服,第1~14天;每3周为1个周期)。术后辅助放疗于术后2个月内在本院放疗科实施。术后6个月观察肿瘤复发/转移情况。

2 结 果
2.1 组织及外周血miR-141的表达 直肠癌患者直肠癌组织miR-141表达水平(5.13±0.62)较癌旁正常组织(8.67±0.95)明显下调(t=27.025,P<0.01);直肠癌患者外周血miR-141水平(3.54±0.44)较健康体检者(6.24±0.76)明显下调(t=20.409,P<0.01)。见图1、2。

A、B、C:直肠癌组织,D、E、F:癌旁正常组织。
图1 直肠癌组织和癌旁正常组织miR-141的表达
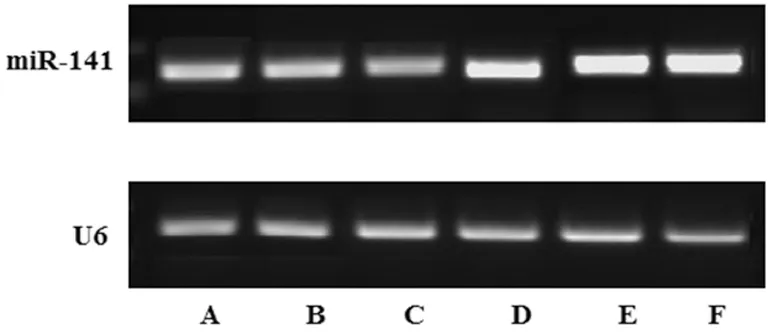
A、B、C:直肠癌患者,D、E、F:正常体检者。
图2 直肠癌患者和健康体检者外周血miR-141的表达
2.2 直肠癌组织与外周血miR-141水平的相关性分析 有淋巴结转移的患者中直肠癌组织miR-141水平与外周血miR-141水平呈正相关(r=0.694,P<0.01),无淋巴结转移的患者中直肠癌组织miR-141水平与外周血miR-141水平亦呈正相关(r=0.725,P<0.01)。
2.3 外周血miR-141表达与直肠癌临床病理特征的单因素分析 对外周血miR-141的表达水平与直肠癌临床病理特征进行单因素分析后,发现miR-141表达水平与研究对象的年龄、性别、肿瘤直径、浸润程度、距肛缘距离不存在明显的关联(P>0.05),但是随着患者肿瘤分期的增大血液miR-141表达下调(P<0.01),随着患者肿瘤分化程度降低而血液miR-141表达下调(P<0.01),有淋巴结转移的患者较无淋巴结转移的患者其血液miR-141表达下调(P<0.01)。见表1。
2.4 外周血miR-141水平与临床疗效的相关性分析 术后6个月随访时共有13例(17.33%)患者出现肿瘤复发/转移。出现肿瘤复发/转移的患者和未出现肿瘤复发/转移的患者其术前外周血miR-141水平分别为(2.64±0.34)和(5.65±0.56),差异有统计学意义(t=18.613,P<0.01)。

表1 外周血miR-141表达与直肠癌临床病理特征的关系
3 讨 论
近年来由于生活方式加快、饮食习惯等改变,直肠癌发病率、病死率呈不断上升趋势[13]。伴随老龄化现象,直肠癌老年患者的数量增长更为显著[14]。miRs 是一类内生、小分子非编码的调控RNAs,由20~24 个核苷酸短序列组成,3′端有1~2个碱基长度变化。在人类基因组中约有900多种特定的miR,其中1/3由miRs调控[15]。miRs 在机体各种生理及病理过程中发挥重要作用,并且有可能成为肿瘤的早期诊断、特异性治疗及评估预后的标志物。miRs在肿瘤中具有特定的表达模式,在肿瘤患者的循环核酸中存在源自肿瘤的miRs 分子,并且较高的稳定性和特异性,因此血清miRs有望成为肿瘤无创诊断的新型分子标志物。由于外周血样品检测具有非创伤性、可重复测试、多指标及同时检测等优点,适合于所有癌症患者尤其适用于年老体弱患者的随访,故血清miRs的检测更适于临床应用。miR-200家族是近年来研究比较集中的热点,miR-141作为miR-200家族成员,具有上皮组织细胞特异性的miRs,在维持上皮细胞表型稳定方面发挥重要作用,但当其表达失调时可促进细胞表型上皮-间质转换并导致上皮来源肿瘤的增殖、侵袭、转移。众多研究显示,miR-141 与结直肠癌、子宫癌、前列腺癌、肝细胞肝癌、肾透明细胞癌及子宫内膜癌等恶性肿瘤的发生和发展密切相关,与胆管癌细胞的增殖和肾透明细胞癌的侵袭活动有关,提示miR-141与多种肿瘤的发病机制及转移等有关[16-19]。
血清miRs在诊断方面的作用是近年来研究的热点。血清miRs 表达稳定、取材方便、损伤性小,并且可以耐受RNase 消化、反复冻融、强酸强碱、高温煮沸等条件而不被破坏[20],提示循环miR可以作为一种无创性生物标志物,用于诊断、预后等判断[21]。本研究结果显示,直肠癌组织miR-141表达水平较癌旁正常组织明显下调(P<0.01),并且外周血miR-141水平较健康体检者明显下调(P<0.01),提示在直肠癌的发生、发展中miR-141可能作为抑癌基因发挥重要作用,这点与其在结肠癌发生和发展中的作用不同。有淋巴结转移的患者中直肠癌组织miR-141水平与外周血miR-141水平呈正相关(r=0.694,P<0.01),无淋巴结转移的患者中直肠癌组织miR-141水平与外周血miR-141水平亦呈正相关(r=0.725,P<0.01)。因此,无论直肠癌患者是否发生淋巴结转移,癌组织miR-141水平与外周血miR-141水平均呈正相关。分析外周血miR-141与直肠癌临床病理参数相关性结果显示,血液miR-141表达与年龄、性别、肿瘤直径、浸润程度、距肛缘距离无明显相关性(P>0.05),提示患者的年龄、性别并不影响外周血miR-141的表达,同时miR-141的表达水平也不能指示肿瘤大小、浸润程度或者直肠癌的位置。患者肿瘤分期越晚及肿瘤分化程度越低血液miR-141表达下调(P<0.01),并且有淋巴结转移的患者较无淋巴结转移的患者血液miR-141表达下调(P<0.01),提示血液miR-141与直肠癌分化、转移相关,而肿瘤的分化、转移等与患者预后有直接相关性。已有研究表明,血浆miR-141水平是检测Ⅳ期结肠癌的敏感标志,并且血浆中miR-141水平与患者短期生存情况密切相关,推测其可独立作为结肠癌预后的指标[22]。另有研究显示,结肠癌组织中miR-141的表达量和癌旁正常组织显著不同,并且结肠癌组织的分化程度不同则miR-141的表达不同,并且结肠癌转移患者和非转移患者结肠癌组织中miR-141的表达量不同,提示miR-141的表达可能与结肠癌的分化程度和淋巴结有无转移相关[23]。在本研究中,术后6个月出现肿瘤复发/转移的直肠癌患者和未出现肿瘤复发/转移的患者其术前外周血miR-141水平分别为(2.64±0.34)和(5.65±0.56),差异有统计学意义(t=18.613,P<0.01),说明外周血miR-141水平与直肠癌患者的临床预后密切相关。虽然对于血清中miR-141的来源尚不确定,目前有观点认为其来自于凋亡或坏死的细胞,细胞的主动释放,以及循环细胞的裂解,但是由于考虑其具有稳定、取材方便、损伤性小的优点,并且与肿瘤组织中miR-141表达水平呈正相关,并且与患者临床预后密切相关,因此可考虑作为直肠癌患者临床预后的判断指标。
总之,miR-141在直肠癌患者外周血中的表达与在癌组织中表达变化趋势一致,可反映直肠癌的病理特征,可考虑作为直肠癌临床预后的备选生物学标记物。
[1]文莎丽,张静平.直肠癌结肠造口患者家属焦虑、抑郁状况及其影响因素研究[J].中国全科医学,2013,16(7A):2291-2293.
[2]Agüero F,Murta-Nascimento C,Gallén M,et al.Colorectal cancer survival:results from a hospital-based cancer registry[J].Rev Esp Enferm Dig,2012,104(11):572-577.
[3]Arredondo J,Baixauli J,Beorlegui C,et al.Prognosis factors for recurrence in patients with locally advanced rectal cancer preoperatively treated with chemoradiotherapy and adjuvant chemotherapy[J].Dis Colon Rectum,2013,56(4):416-421.
[4]Lam TK,Shao S,Zhao Y,et al.Influence of quercetinrich The food intake on mirna expression in lung cancer tissues [J].Cancer Epidemiol Biomarkers Prev,2012,21(12):2176 -2184.
[5]Toiyama Y,Takahashi M,Hur K,et al.Serum miR-21 as a diagnostic and prognostic biomarker in colorectal cancer[J].J Natl Cancer Inst,2013,105(12):849-859.
[6]Kurashige J,Kamohara H,Watanabe M,et al.Serum microRNA-21 is a novel biomarker in patients with esophageal squamous cell carcinoma[J].J Surg Oncol,2012,106(2):188-192.
[7]马一楠,金迎迎,王亚利,等.miR-141表达抑制增强结肠癌细胞对5-Fu药物敏感性的研究[J].山西医科大学学报,2016,47(6):510-517.
[8]Chen X,Wang X,Ruan A,et al.miR-141 is a key regulator of renal cell carcinoma proliferation and metastasis by controlling EphA2 expression[J].Clin Cancer Res,2014,20(10):2617-2630.
[9]Marchini S,Cavalieri D,Fruscio R,et al.Association between miR-200c and the survival of patients withstage Ⅰ epithelial ovarian cancer:a retrospective study of two independent tumour tissue collections[J].Lancet Oncol,2011,12(3):273-285.
[10]Ceppi P,Mudduluru G,Kumarswamy R,et al.Loss of miR-200c expression induces an aggressive,invasive,and chemoresistant phenotype in non-small cell lung cancer[J].Mol Cancer Res,2010,8(9):1207-1216.
[11]van Jaarsveld MT,Helleman J,Boersma AW,et al.miR-141 regulates KEAP1 and modulates cisplatin sensitivity in ovarian cancer cells[J].Oncogene,2013,32(36):4284-4293.
[12]Hur K,Toiyama Y,Takahashi M,et al.MicroRNA-200c modulates epithelial-to-mesenchymal transition(EMT) in human colorectal cancer metastasis[J].Gut,2013,62(9):1315-1326.
[13]Taylor FG,Quirke P,Heald RJ,et al.Preoperative high- resolution magnetic resonance imaging can identify good prognosis stage Ⅰ,Ⅱ,and Ⅲ rectal cancer best managed by surgery alone:a prospective,multicenter,European study[J].Ann Surg,2011,253(4):711-719.
[14]Ozden SA,Ozyurt H,Ozgen Z,et al.Prognostic role of sensitive-to-apoptosis gene expression in rectal cancer[J].World J Gastroenterol,2011,17(44):4905-4910.
[15]Kim VH,Han J,Siomi MC.The Biogenesis of small RNAs in animals[J].Nat Rev Mol Cell Biol,2009,10(2):126-139.
[16]Gonzales JC,Fink LM,Goodman Jr OB,et al.Comparison of circulating microRNA 141 to circulating tumor cells,lactate dehydrogenase,and prostate-specific antigen for determining treatment.The response in patients with metastatic prostate cancer [J].J Clin Genitourin Cancer,2011,9(1):39-45.
[17]Lee TS,Jeon HW,Kim YB,et al.The Aberrant mirna expression in Endometrial carcinoma using formalin - fixed paraffin - embedded(FFPE) tissues [J].PLoS One,2013,8(12):e81421.
[18]Liu Y,Ding Y,Huang J,et al.MiR-141 suppresses the migration and night of HCC cells by targeting Tiam1 [J].PLoS One,2014,9(2):e88393.
[19]Yu XY,Zhang Z,Liu J,et al.MicroRNA- 141 is downregulated in human renal cell carcinoma and regulates cell survival by targeting CDC25B [J].Onco Targets Ther,2013,10(6):349-354.
[20]Davalos V,Moutinho C,Villanueva A,et al.Dynamic epigenetic regulation of the microRNA - 200 family mediates epithelial and mesenchymal transitions in human tumorigenesis[J].Oncogene,2012,31(16):2062-2074.
[21]Vrba L,Jensen TJ,Garbe JC,et al.Role for DNA methylation in the regulation of miR -200c and miR -141 expression in normal and cancer cell[J].PLoS One,2010,5(1):e8697.
[22]Cheng H,Zhang L,Cogdell DE,et al.The Circulating plasma MiR-141 is will be a biomarker for metastatic colon cancer and predicts poorprognosis[J].PLoS One,2011,6(3):e17745.
[23]王亚南,陈昭华,陈卫昌,等.microRNA-141在结肠癌中的表达分析研究[J].重庆医学,2015,44(16):2250-2252.
Expression and clinical correlation of miR-141 in peripheral blood and tumor tissue in elderly patients with rectal cancer*
FengLi1,LvYalei1,ChangLiang1,LiuYan1,WangLong1,XuZhihong1,WangGuiying2△
(1.DepartmentofOncology;2.SecondDepartmentofSurgery,FourthHospitalofHebeiMedicalUniversity,Shijiazhuang,Hebei050011,China)
Objective To study the expression and clinical correlation of miR-141 in peripheral blood and tumor tissue in elderly patients with rectal cancer.Methods Rectal tumor tissue and tumor-adjacent normal tissues were taken in 75 cases of rectal cancer.The expression levels of miR-141 in peripheral blood and tumor tissue as well as tumor-adjacent normal tissues were determined by real-time polymerase chain reaction method.The correlation of miR-141 expression between peripheral blood and tumor tissue,and the correlation of peripheral blood miR-141 with clinicopathologic features and clinical prognosis were analyzed.Results (1) Compared with peripheral blood in the subjects undergoing normal physical examination or tumor-adjacent normal tissue in the patients with rectal cancer,the miR-141 expression level in peripheral blood and tumor tissue in the patients with rectal cancer was decreased significantly (P<0.01).(2) The cancer tissue miR-141 level in the patients with lymph node metastasis was positively correlated with peripheral blood miR-141 level (r=0.694,P<0.01),and cancer tissue miR-141 level in the patients without lymph node metastasis was positively correlated with peripheral blood miR-141 level (r=0.725,P<0.01).(3) The differences between peripheral blood miR-141 level with tumor stage,tumor differentiation degree and lymphatic metastasis had statistical significance (P<0.01).(4)The postoperative 6-month follow up displayed that among 75 cases,13 cases(17.33%) appeared replase/ metastasis,and peripheral blood miR-141 level was (2.64±0.34),which was significantly lower than that in the patents without replase/metastasis (P<0.01).Conclusion Expression variation trend of miR-141 in peripheral blood is similar to that in tumor tissue,which can reflect the clinicopathologic feature in the patients with rectal patients.
rectal neoplasms;aged;microRNAs;prognosis;miRNA-14
河北省卫生厅医学科学研究重点课题(20150769)。
冯莉(1982-),主治医师,博士,主要从事消化道恶性肿瘤的临床与基础研究。
△通信作者,E-mail:wgy777@yeah.net。
10.3969/j.issn.1671-8348.2017.24.008
R735.2
A
1671-8348(2017)24-3339-04
2016-12-22
2017-03-10)
