IL-18激活NF-κB细胞信号通路对人脐静脉内皮细胞损伤作用的体外研究*
2017-09-08李光第赵学凌周如丹
李光第,赵学凌,周如丹△
(1.贵州医科大学附属医院骨科,贵阳 550004;2.昆明医科大学第一附属医院骨科,昆明 650032)
·论 著·
IL-18激活NF-κB细胞信号通路对人脐静脉内皮细胞损伤作用的体外研究*
李光第1,赵学凌2,周如丹2△
(1.贵州医科大学附属医院骨科,贵阳 550004;2.昆明医科大学第一附属医院骨科,昆明 650032)
目的 探讨促炎因子白细胞介素-18(IL-18)通过激活核因子-κB(NF-κB)介导的细胞信号通路,对静脉内皮细胞功能的影响及其与深静脉血栓形成(DVT)的联系。方法 利用重组人IL-18作用体外培养的人脐静脉内皮细胞(HUVECs),并以NF-κB激活抑制剂进行干预,通过实时荧光定量PCR、Western blot、免疫荧光、流式细胞仪等检测手段,验证IL-18是否通过激活NF-κB介导的细胞信号转导通路,影响HUVECs正常状态及血管性血友病因子(vWF)、P-选择素(P-selectin)、组织型纤溶酶原激活物(t-PA)等内皮细胞功能标记物的表达,结合既往研究对IL-18参与DVT的机制进行综合分析。结果 IL-18可激活内皮细胞内NF-κB,使细胞核内p65表达增高、细胞内IκBα表达降低,并使HUVECs早期凋亡细胞明显增多;添加QNZ(EVP4593)可使IL-18对NF-κB的激活作用明显抑制,细胞损伤、凋亡的发生显著减少;IL-18可促使vWF、P-selectin和t-PA等DVT相关的内皮细胞标志物发生表达异常(P<0.05),而各标志物可在NF-κB激活抑制后恢复常规表达。结论 IL-18及NF-κB间的相互作用导致HUVECs生长状态和功能异常,可能是与DVT发病相关的疾病机制。
白细胞介素18;NF-κB;内皮细胞;静脉血栓形成
深静脉血栓形成(DVT)的病理生理变化、预诊指标及疾病机制的研究,均是相关研究中探讨较为集中的问题。DVT在大量研究中被发现与炎性反应关系密切,脉管内膜组织可因炎性因素引发损伤而导致血栓性疾病。Tsai等[1]学者发现多种炎性标志物的血浆含量变化可视为发生静脉血栓的危险因素,而体内某些炎性标记物的变化可影响炎症的发生与发展;曾有研究认为深静脉血栓可导致炎性反应的发生和炎性因子上调[2];但是临床实际工作中可见下肢创伤患者双侧发病者并非少见,这些均反映了炎性反应与血栓形成间相辅相成的密切联系[3]。组织因子(TF)、血管性假血友病因子(vWF)、P-选择素(P-selectin)、组织型纤溶酶原激活物(t-PA)和纤维连接蛋白(FN)等标志物发生表达变化,可在静脉内皮细胞受损时被发现,这些标志物的变化使静脉内皮具备了一定的促凝性。同时,研究证实白细胞介素(IL)-18与DVT动物模型血栓形成的发生、发展有关[4],其介导的促炎反应在静脉血栓发生中可能起重要作用。IL-18与临床患者下肢DVT的发生密切相关[5],将其构建的过表达及干扰病毒载体感染人脐静脉内皮细胞,基因表达芯片谱测定显示可诱发多条细胞转导通路的异常改变。因此,为探讨IL-18通过对内皮细胞信号通路的影响与DVT的联系,本实验对IL-18影响核因子-κB(NF-κB)介导的细胞信号通路所致的人脐静脉内皮细胞(HUVECs)功能改变,进行了更具针对性的研究。
1 材料与方法
1.1 材料与仪器 重组人IL-18(CYT-269)购自ProSpec公司;NF-κB抑制剂QNZ (EVP4593)购自Selleck公司;P65、NF-κB抑制(IκB)因子抗体购自美国Proteintech公司;磷酸化p65抗体购自美国CST公司;IF二抗羊抗兔IgG购自Thermo公司;t-PA抗体、vWF、P-selectin抗体购自Santa Cruz Biotechnology公司;HUVECs购自江阴齐氏生物科技有限公司;细胞培养耗材购自Corning公司;细胞核蛋白与浆蛋白抽提试剂盒(P0028)、线粒体膜电位检测试剂盒(C2006)、异硫氰酸荧光素标记的膜联蛋白V(Annexin V);FITC细胞凋亡检测试剂盒(C1062)购自Beyotime Biotechnology公司;Western blot试剂购自鼎国生物技术有限公司;荧光定量试剂盒购自Fermentas公司;荧光定量ABI-7300PCR仪购自ABI公司;流式细胞仪(CyFlow®Space)购自PARTEC公司。
1.2 方法
1.2.1 HUVECs细胞培养 获取HUVECs新鲜细胞株后37 ℃、5% CO2、饱和湿度细胞培养箱静置2~3 h;弃去原瓶培养液,0.25%乙二胺四乙酸(EDTA)胰酶37 ℃消化2 min,大部分细胞收缩抱团后终止消化,所获得细胞接种于2~4个培养瓶,补充新鲜培养基至每瓶4 mL,静置培养。此后,倒置显微镜动态观测生长情况,HUVECs贴壁生长;72 h首次换液,以后根据细胞生长情况及实验安排1~2 d换液。
1.2.2 IL-18对细胞表达NF-κB的影响 实验添加重组人IL-18至HUVECs,检测NF-κB-p65表达。预实验选定IL-18最佳浓度和时间:HUVECs传代培养48 h,倒置显微镜观察生长良好;向培养瓶加入IL-18,浓度梯度0、5、10、50、100、500 ng/mL,继续培养24 h;提取总蛋白:加200 μL添加PMSF的RIPA,冰浴裂解30 min;4 ℃、12 000×g离心5 min。Western blot检测IL-18各浓度作用下NF-κB-p65的表达,选择IL-18理想浓度。NF-κB表达活性检测显示:50 ng/mL时为显著高表达,直至100 ng/mL活性仍明显增强,此后表达情况不符合实验要求。添加50 ng/mL浓度IL-18,分别培养6、12、24、48、72 h;提取细胞总蛋白,Western blot检测NF-κB-p65表达,IL-18作用24 h后 NF-κB-p65表达活性明显增强,高表达状态可持续至72 h。
1.2.3 IL-18激活NF-κB细胞信号通路相关测定 HUVECs分3组进行预处理,A组:正常培养24 h;B组:IL-18预作用24 h,50 ng/mL,培养24 h;C组:IL-18预作用12 h,添加QNZ(EVP4593)、50 μmol/mL,继续培养至24 h。
1.2.3.1 HUVECs核蛋白与浆蛋白分离提取 室温融解细胞核蛋白与浆蛋白抽提试剂、混匀置冰,取适量胞浆蛋白抽提试剂A加入PMSF(终浓度1 mmol/L)。EDTA处理后移液器吹打细胞,离心后吸尽上清液;每20 μL细胞沉淀加200 μL添加PMSF的试剂A;涡旋振荡10 s,悬浮分散沉淀;冰浴10~15 min,加胞浆蛋白抽提试剂B 10 μL,涡旋振荡5 s、冰浴1 min;涡旋振荡5 s,(12 000~16 000)×g、4 ℃离心5 min;吸取上清液至预冷EP管,即为胞浆蛋白。吸尽沉淀残余上清液,加50 μL细胞核蛋白抽提试剂高速涡旋振荡30 s悬浮分散,置冰浴、每隔1~2 min高速涡旋振荡30秒/次,共30 min;(12 000~16 000)×g、4 ℃离心10 min;吸取上清液至预冷EP管中,即为细胞核蛋白;蛋白浓度检测(BCA)法检测胞浆、核蛋白浓度。
1.2.3.2 Western blot NF-κB-p65和IκBα分别在胞浆和胞核中的表达情况检测:吸取各组蛋白上清液,按20%体积加入5×十二烷基硫酸钠(SDS)、置沸水10 min,80 V浓缩胶电压和140 V分离胶电压行SDS-聚丙烯酰胺凝胶电泳。裁剪滤纸及聚偏氟乙烯(PVDF)经甲醇处理,滤纸、胶和膜浸泡于转膜缓冲液5 min;按顺序叠放,对齐后玻璃棒滚除气泡,20 V电压转膜60 min;转膜后清水浸润PVDF膜,温箱37 ℃干燥后100%甲醇浸润,双蒸水浸洗,5%脱脂奶粉三羟甲基氨基甲烷缓冲盐水(TBS-T)溶液20~25 ℃封闭过夜;封闭后膜TBS-T漂洗3次、10分钟/次;含1%脱脂奶粉TBS-T稀释一抗(1∶500~1∶1 000),4 ℃孵育过夜,TBS-T漂洗3次、10分钟/次;含1%脱脂奶粉TBS-T稀释二抗(1∶5 000),20~25 ℃孵育60 min,再次将膜浸TBS-T漂洗3次,10分钟/次;增强化学发光法(ECL Plus)显色、Bio-Rad膜成像系统检测。
1.2.3.3 免疫荧光检测 3组HUVECs分别制成细胞悬液(2×104个/毫升),高压灭菌盖玻片置于24孔板,滴加50 μL上述细胞悬液;培养过夜,细胞贴壁生长后,每孔添加1 mL培养基,相同条件再次培养过夜;吸出培养基,磷酸盐缓冲液(PBS)轻洗2次; 4%多聚甲醛室温固定30 min;PBS轻洗2次,3% H2O2室温封闭15 min;PBS洗2次;每孔滴加一抗100 μL,湿盒孵育2 h;PBS轻洗2次,每次5 min;滴加二抗室温避光孵育1 h;PBS洗3次,4′,6-二脒基-2-苯基吲哚(DAPI)核染;荧光显微镜观察。
1.2.4 IL-18激活NF-κB对细胞状态、功能的影响
1.2.4.1 线粒体膜电位检测 线粒体膜电位检测试剂盒(JC-1),HUVECs分组培养于六孔板,吸除培养液,PBS洗涤1次,加1 mL新鲜培养液;JC-1工作液:每50 μL JC-1(200×)加8 mL超纯水稀释后剧烈涡旋振荡,再加2 mL JC-1染色缓冲液(5×),混匀为JC-1染色工作液;培养板每孔加JC-1工作液1 mL,培养箱孵育20 min;孵育期间,以每毫升 JC-1染色缓冲液(5×)加4 mL蒸馏水,配制JC-1染色缓冲液(1×),冰浴;孵育结束吸除上清液,JC-1染色缓冲液(1×)洗涤2次;加2 mL培养液;Nikon Eclipse 90i荧光显微镜观察。
1.2.4.2 Annexin Ⅴ-FITC/碘化丙啶(PI)流式细胞仪检测 Annexin Ⅴ-FITC细胞凋亡检测试剂盒,细胞分组培养及预处理,将培养液分别吸出留存,PBS洗涤1次,胰酶消化、室温孵育至轻吹可使贴壁细胞脱落时,弃胰酶;分别加入各组收集的原培养液,稍混匀,移至离心管内,1 000×g离心5 min,弃上清液收集细胞,PBS重悬计数;取各组HUVECs[(5~10)×104],1 000×g离心5 min,弃上清液、加195 μL Annexin Ⅴ-FITC结合液,重悬;加5 μL Annexin V-FITC混匀,铝箔包裹25 ℃避光孵育10 min;1 000×g离心5 min,弃上清液,加190 μL Annexin V-FITC结合液重悬;加10 μL PI染色液混匀,冰浴避光放置;流式细胞仪检测。
1.2.4.3 内皮细胞相关标志物检测 依照前序研究分为3组进行预处理,检测细胞与DVT形成相关的标志物表达,观察IL-18激活NF-κB介导细胞信号转导通路发生改变后,引起下游功能标志物的表达情况。(1)蛋白水平差异测定:Western blot检测各组vWF、p-selectin、t-PA的蛋白表达,获得蛋白相对表达水平后,分析IL-18在激活NF-κB后,HUVECs功能相关蛋白的表达变化。(2)mRNA水平测定:抽提各组HUVECs总RNA, RevertAid First Strand cDNA合成试剂盒进行cDNA合成;GenBank搜索待测基因完整mRNA序列,BLAST和primer 5.0分析设计特异性real-time PCR引物(Human vWF 正向引物5′- TCC TCC TAC TCT GCC CCC C-3′,反向引物5′- TCC ATC CGC TGA ATC ACC TC-3′;Human p-selectin 正向引物5′- CCG TGC GTA ATT ACT CCC CC-3′,反向引物5′- AGG CTT TCT CGG CTT CAT CTG-3′;Human t-PA 正向引物5′- CCC AGA TCG AGA CTC AAA GCC-3′,反向引物5′- TGA CCC ATT CCC AAA GTA GCA G-3′;Human β-actin正向引物5′- ACG GCA AGT TCA ACG GCA CAG-3′,反向引物5′- GAC GCC AGT AGA CTC CAC GAC A-3′)。依据Maxima®SYBR Green/ROX qPCR Master Mix (2×) 试剂盒,以ABI Prism 7300HT real-time PCR扩增仪行荧光定量PCR检测,2-ΔΔCt法(DataAssistTMv3.0 Software,ABI)进行实验分析。

2 结 果
2.1 IL-18介导NF-κB激活情况的测定结果
2.1.1 NF-κB-p65和IκBα表达 实验成功分离提取HUVECs各组蛋白,Western blot检测各组IκBα、胞浆和细胞核蛋白中p65。依据结果换算IκBα、p65的各组 Ratio值,A、B、C 3组IκBα分别为:0.744、0.487、0.615;胞核内p65分别为:0.777、1.177、0.749;胞浆内p65分别为:0.978、0.579、1.153。胞浆中NF-κB-p65的表达,B组明显减少,而C组相对表达量较B组增多(图1)。
2.1.2 免疫荧光检测结果 p-p65通常在正常脐静脉内皮细胞中呈现低表达状态;NF-κB受到IL-18的作用后明显激活,染色结果可见p65-p50二聚体向细胞核内发生明显转移活动;在IL-18处理后的细胞中加入QNZ后,NF-κB受抑制的细胞中p-p65表达水平明显出现下降。
2.2.2 IL-18激活NF-κB对细胞的影响
2.2.2.1 线粒体膜电位检测 实验结果可观察到正常培养的HUVECs细胞线粒体基质中,存在明显的JC-1聚合物,线粒体膜电位较高(显示为明显的红色荧光);HUVECs中添加IL-18后JC-1单体明显增多,细胞线粒体膜电位较低(显示为绿色荧光);然而,添加NF-κB抑制剂QNZ后,IL-18的NF-κB激活作用受到抑制,线粒体膜电位正常的红色荧光细胞数量明显增多,而显示绿色荧光的凋亡细胞减少。
2.2.2.2 Annexin V-FITC/PI细胞凋亡检测 Q1表示检测许可范围内误差,无实际意义;Q2象限表示凋亡晚期和坏死细胞量;Q3象限表示正常活细胞量;Q4象限为早期凋亡细胞量。其中,正常体外培养的A组细胞Q3象限检测量为3组最多(98.71%),Q2、Q4象限均为3组最少(0.14%、0.02%);NF-κB受到激活的B组细胞Q2、Q4象限均为3组最多(1.51%、27.76%),而正常活细胞最少(68.70%);NF-κB激活受抑制后的C组细胞,各象限细胞检测量均接近正常细胞。见图2。

图1 IκBα及NF-κB-p65相对表达水平

A:正常培养细胞;B:NF-κB受到激活;C:NF-κB激活受抑制。
图2 流式细胞仪检测结果

图3 Western blot检测vWF、P-selectin、t-PA的蛋白表达
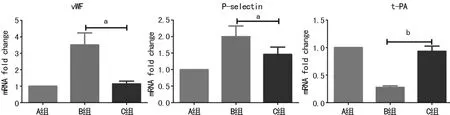
a:P<0.05;b:P<0.01
图4 real-time PCR检测基因的表达水平
2.3 内皮细胞相关标志物检测
2.3.1 Western blot结果 实验结果可见IL-18激活NF-κB后可影响各功能标志物的表达水平(图3)。测得A、B、C组Ratio值(蛋白相对表达水平)为, vWF:0.593、1.301、0.825;P-selectin:1.029、1.476、1.315;t-PA:1.281、0.650、0.832。相对以A组为1计算的各组Ratio值可见:B组细胞受IL-18作用后vWF(2.19)、P-selectin(1.43)均明显增高,t-PA(0.51)表达明显降低;C组细胞中添加QNZ后vWF(1.39)、P-selectin(1.28)表达回降,t-PA(0.64)表达有所增加。
2.3.2 荧光定量PCR检测结果 获取检测结果后以2-ΔΔCt法进行数据分析(表1)。B组vWF、P-selectin表达明显增加(P<0.05),t-PA较A组明显下调(P<0.01)。

表1 real-time PCR检测基因的表达水平
a:P<0.05;b:P<0.01,与A组相比
C组中添加QNZ后IL-18对HUVECs的损伤及功能影响受到有效抑制(图4):C组vWF、P-selectin明显较B组表达下调并接近A组表达水平,且与B组相比差异有统计学意义(P<0.05)。C组t-PA表达恢复接近正常,与B组比较差异有统计学意义(P<0.01)。
3 讨 论
炎性因素导致的血管内皮受损是DVT形成的常见原因,血栓形成过程中静脉内膜致凝作用产生优势效应,这与静脉内皮组织中FN、TF和vWF等异常表达密不可分,并促使了血栓的形成和发展。内皮细胞具备生理性抗凝血及病理性血栓形成的调控功能,其损伤在血栓疾病发展过程中发挥了重要作用。相关研究也证实了,除溶性凝血因子的激活和血小板黏附聚集释放外,内皮细胞损伤可视为血栓形成的3个独立要素之一[4]。
内皮细胞是循环中免疫和炎性介质的主要靶点。Chandrasekar等[5]研究证实,L-18作用于血管内皮细胞,促使细胞凋亡信号活化、导致细胞生长及功能异常,并且IL-18直接激活了血管内皮细胞中的NF-κB而诱导HCMECs发生死亡。本课题组既往研究证实,IL-18在DVT患者及动物模型血液中均存在异常表达,其变化与DVT的发生与发展存在密切联系[6-7];同时,通过构建IL-18过表达和抑制的病毒载体感染人脐静脉内皮细胞,可对细胞的生理活性产生显著影响[5]。Baker等[8]研究结果可见,NF-κB的持续激活可促进多种炎性因子表达发生改变,通过促发炎症进展过程而引发细胞损伤,从而导致了疾病的发生。静息状态下的NF-κB在胞质以二聚体(p65-p50)形式存在,其与抑制物/IκB结合为无活性状态[9];受激活物作用后结合物可解离,NF-κB二聚体转移入细胞核中激活其介导的细胞信号通路,从而发挥靶基因转录等重要作用[10]。
本研究中IL-18作用HUVECs后发现细胞内NF-κB表达出现明显变化,分别对HUVECs胞浆、胞核蛋白进行检测,发现受IL-18作用时胞核中p65表达量明显上调,而胞浆中表达量较正常减少,证实了IL-18可有效激活细胞内NF-κB;研究中加入NF-κB激活抑制剂QNZ后可有效阻碍IL-18的上述作用效应,使细胞核中p65的表达明显下调接近正常。研究中免疫荧光检测结果亦证实,IL-18作用后NF-κB明显激活,发生磷酸化的p65-p50二聚体向核内转移,可见荧光信号闪亮、呈亮绿色;而该效应在QNZ干预后发生显著改变。相关研究也证实,QNZ可使细胞内NF-κB介导的信号转导通路激活受影响,并有效干扰了细胞和动物模型体内相关靶基因的转录过程[11-12]。
本研究对IL-18作用后的HUVECs进行线粒体膜电位检测,发现大量细胞发生了线粒体膜电位的下降,证明细胞受到明显影响处于非正常生长状态,并使大多数细胞发生凋亡早期改变。正常机体细胞群体稳态的维持主要通过细胞凋亡来进行动态调整,该过程发生异常会引发细胞组群功能改变,甚至导致疾病的发生和发展。Choy等[13]研究证实,血管内壁受损可因炎性因子所诱发的内皮细胞凋亡异常所致,而该过程最终可致血管内壁损伤、诱发血凝块形成,并进一步引发炎性反应过程而导致血管内血栓或粥样硬化斑块等。然而,实验中使用NF-κB抑制剂阻断IL-18作用后,正常活细胞量明显增加,而细胞凋亡和坏死量几乎均接近正常对照。研究可见,IL-18引起HUVECs生长状态异常,尤其是早期凋亡状态细胞增多;然而,NF-κB介导的细胞内信号转导通路受阻后,细胞状态得以明确改善。同时,检测IL-18作用HUVECs后细胞功能障碍标志物的表达水平,发现与正常细胞比较vWF表达水平明显升高,而NF-кB的激活抑制则可影响这一变化。vWF在体内同时存在于血浆及内皮组织,为内皮细胞合成的大分子糖蛋白,内皮受损或受刺激时合成、分泌增加。既往研究显示,动脉粥样硬化(AS)高危因素者和AS确诊患者vWF有表达上调的改变,vWF在内皮细胞损伤处和血小板一起参与栓子的形成,可作为内皮损伤的标志物[14]。内皮细胞功能标志物中P-selectin亦呈现了与vWF相同的表达变化趋势,P-selectin常作为内皮细胞功能障碍的标志物和静脉血栓的临床危险因素[15]。内皮细胞受异常刺激或功能异常时,Weibel-Palade小体与细胞膜融合,P-selectin则演化为细胞表面的膜糖蛋白,介导了内皮细胞、血小板、白细胞间的相互作用,其活化可诱导促凝物激活和纤维蛋白形成而致静脉易栓性。内皮细胞可合成t-PA和尿激酶型纤溶酶原激活物(u-PA),参与构成机体内复杂的纤溶系统,从而在血管内皮受损时参与维持正常止凝血过程的动态平衡。t-PA对纤维蛋白有较高的亲和力,其可在纤维蛋白表面活化纤溶酶原发挥纤溶作用[16]。本课题实验发现,IL-18作用后HUVECs产生的t-PA明显低于正常细胞,而NF-κB激活抑制剂作用后,IL-18对HUVECs的影响明显得到改善,t-PA水平回升至接近正常表达状态。
本研究发现IL-18可能通过激活NF-кB介导的信号转导通路,使内皮细胞生长状态、凋亡形式等发生改变,继而引发静脉细胞的生理功能障碍,并导致血栓相关的内皮细胞功能标志物vWF、P-selectin、t-PA等产生异常变化,这些因素可能共同参与了血栓疾病的发生与发展。DVT形成的机制极其复杂,IL-18通过参与炎性反应和免疫反应调节等过程,发挥其对内皮细胞正常生长状态和功能的影响,可能是其中较为重要的机制之一。
[1]Tsai AW,Cushman M,Rosamond WD,et al.Coagulation factors,inflammation markers,and venous thromboembolism:the longitudinal investigation of thromboembolism etiology (LITE)[J].Am J Med,2002,113(8):636-642.
[2]Roumen-Klappe EM,Den Heijer M,Van Uum SH,et al.Inflammatory response in the acute phase of deep vein thrombosis[J].J Vasc Surg,2002,35(4):701-706.
[3]Strukova S.Blood coagulation-dependent inflammation.Coagulation-dependent inflammation and inflammation-dependent thrombosis[J].Front Biosci,2006,11(1):59-80.
[4]Blann AD,Lip GY.Virchow's triad revisited:the importance of soluble coagulation factors,the endothelium,and platelets[J].Thromb Res,2001,101(4):321-327.
[5]Chandrasekar B,Vemula K,Surabhi RM,et al.Activation of intrinsic and extrinsic proapoptotic signaling pathways in interleukin-18-mediated human cardiac endothelial cell death[J].J Biol Chem,2004,279(19):20221-20233.
[6]李光第,白云城,宋恩,等.过表达或抑制IL-18对大鼠深静脉血栓形成的影响[J].南京医科大学学报(自然科学版),2015,32(3):367-372.
[7]李光第,宋恩,赵学凌,等.白细胞介素-18与深静脉血栓疾病的相关性研究[J].重庆医学,2015,44(5):600-604.
[8]Baker RG,Hayden MS,Ghosh S.NF-κB,inflammation,and metabolic disease[J].Cell Metab,2011,13(1):11-22.
[9]Oeckinghaus A,Hayden MS,Ghosh S.Crosstalk in NF-κB signaling pathways[J].Nat Immunol,2011,12(8):695-708.
[10]Hayden MS,Ghosh S.Shared principles in NF-kappa B signaling[J].Cell,2008,132(3):344-362.
[11]Armstrong SJ,Wiberg M,Terenghi G,et al.Laminin activates NF-kappaB in Schwann cells to enhance neurite outgrowth[J].Neurosci Lett,2008,439(1):42-46.
[12]Yang RH,Strong JA,Zhang JM.NF-kappaB mediated enhancement of Potassium currents by the chemokine CXCL1/growth related oncogene in small diameter rat sensory neurons[Z],2009:26.
[13]Choy JC,Granville DJ,Hunt DW,et al.Endothelial cell apoptosis:biochemical characteristics and potential implications for atherosclerosis[J].J Mol Cell Cardiol,2001,33(9):1673-1690.
[14]Blann AD.Plasma von willebrand factor,thrombosis,and the endothelium:the first 30 years[J].Thromb Haemost,2006,95(1):49-55.
[15]Blann AD,Noteboom WM,Rosendaal FR.Increased soluble P-selectin levels following deep venous thrombosis:cause or effect?[J].Br J Haematol,2000,108(1):191-193.
[16]Kruithof EK,Dunoyer-Geindre S.Human tissue-type plasminogen activator[J].Thromb Haemost,2014,112(2):243-254.
In vitro study on injury effect of IL-18 activating NF-κB cell signal pathway on human umbilical vein endothelial cells*
LiGuangdi1,ZhaoXueling2,ZhouRudan2△
(1.DepartmentofOrthopedics,AffiliatedHospital,GuizhouMedicalUniversity,Guiyang,Guizhou550004,China; 2.DepartmentofOrthopedics,FirstAffiliatedHospital,KunmingMedicalUniversity,Kunming,Yunnan650032,China)
Objective To investigate the influence of proinflammatory factor interleukin-18(IL-18) on vein endothelial cell function by activating NF-κB mediated cell signal pathway and its association with deep vein thrombosis(DVT).Methods Recombinant human IL-18 was used to act on in vitro cultured human umbilical vein endothelial cell(HUVECs).The NF-κB activation inhibitor was used to conduct interference.The detection measures of real time fluorescence quantitative PCR,Western blot,immunofluorescence and flow cytometry were used to verify whether IL-18 affect the expression of endothelial cellular function markers such as HUVECs normal statusand vWF,P-selectin and tissue plasminogen activator(t-PA) by activating NF-κB mediated cell signal pathway.Moreover the mechanism of IL-18 participating in the DVT was performed the comprehensive analysis by combining with previous study.Results IL-18 could activate NF-κB in endothelial cell,increased the p65 expression in nucleus,decreased the intracellular IκBα expression and significantly increased early apoptosis cells in HUVECs; adding QNZ(EVP4593) could significantly inhibit the activation effect of IL-18 on NF-κB,the occurrence of cellular injury and apoptosis was significantly reduced; IL-18 could promote the abnormal expression of DVT related endothelial cell markers vWF,P-selectin and t-PA(P<0.05).But various markers could recover conventional expression after inhibiting NF-κB activation.Conclusion The interaction between Il-18 and NF-κB causes the abnormality of HUVECs growth status and function,which may be the DVT onset related pathogenic mechanism.
interleukin-18;NF-kappa B;endothelial cells;venous thrombosis
10.3969/j.issn.1671-8348.2017.24.001
国家自然科学基金面上项目(30960389);云南省卫生科技计划项目(2014NS141);云南省重点新产品开发计划项目(2010BC010);云南省卫计委内设机构项目(2016NS021);贵州医科大学博士基金(院博合J字[2015]019号);贵州省科技厅合作计划项目(黔科合LH字[2016]7228号)。
李光第(1981-),副主任医师,博士,主要从事骨科常见疾病、深静脉血栓疾病基础与临床的研究。
△通信作者,E-mail:kittypku@qq.com。
R619
A
1671-8348(2017)24-3313-05
2017-02-18
2017-04-06)
