小白蒿总黄酮抗炎作用及其HPLC分离与NMR鉴定
2017-09-08图布兴王青虎白音木其尔代那音台
图布兴 王青虎 白音木其尔 代那音台
1.内蒙古自治区阿拉善盟药品器械采购服务中心,内蒙古 巴彦浩特镇 750306;2.内蒙古民族大学蒙医药学院,内蒙古 通辽 028000
实验研究
小白蒿总黄酮抗炎作用及其HPLC分离与NMR鉴定
图布兴1王青虎2*白音木其尔2代那音台2
1.内蒙古自治区阿拉善盟药品器械采购服务中心,内蒙古 巴彦浩特镇 750306;2.内蒙古民族大学蒙医药学院,内蒙古 通辽 028000
目的:研究小白蒿总黄酮对甲醛致大鼠足肿胀模型的抗炎作用,并明确其主要化学成分。方法:采用甲醛致大鼠足肿胀模型观察小白蒿总黄酮的抗炎作用,然后运用HPLC法对其进行分离并利用NMR法鉴定其分离物。同时,观察小白蒿总黄酮的急性毒性。结果:小白蒿总黄酮在低剂量(50mg/kg)、中剂量(100mg/kg)和高剂量(200mg/kg)下表现出明显的抗炎作用及剂量依赖性关系;根据小白蒿总黄酮的HPLC分离及NMR鉴定结果可知,其中主要含有5个黄酮类化合物,即5,3′-二羟基-3,6,7,4′-四甲氧基黄酮(S1);5,7,3′-三羟基-6,4′-四甲氧基黄酮 (S2),;5,3′-二羟基-6,7,4′-三甲氧基黄酮 (S3),;5-羟基-3′,4′-二甲氧基黄酮-7-O- β-D- 葡萄糖醛酸苷 (S4);5-羟基-3′,4″,5′-三甲氧基黄酮-7-O-β-D-葡萄糖醛酸苷(S5)。小白蒿总黄酮的LD50大于4.06 g/kg。结论:小白蒿总黄酮具有明显的抗炎作用, 是小白蒿的主要抗炎有效部位之一。
小白蒿;总黄酮;抗炎作用;HPLC分析;NMR鉴定
小白蒿系菊科蒿属植物冷蒿ArtemisiafrigidaWilld.的地上部分,是历代民间常用的燥“希日乌苏” 特色蒙药[1]。《四部医典》中小白蒿能调理血液,兼燥“沙日乌苏”而治疗关节肿胀。现代蒙医临床证明小白蒿为主剂的五味甘露汤对“希日乌苏”病人治疗关节肿胀和疼痛有明显效果,尤其对热性“希日乌苏”病人,疗效可达到90%以上[2-4]。
“希日乌苏”(蒙医体质分类类型)[5]汉译为黄水,它存在于全身各处,尤其在肌肤及关节较多。希日乌苏出现偏盛偏衰和功能紊乱等反常状态而导致病变称之为“希日乌苏”病。现代蒙药药理学[6]认为,“希日乌苏”蒙药的主要药理共性为抗炎作用,但目前对蒙药燥“希日乌苏”功效与抗炎作用的相关性方面的实验研究未见报道。然而,国内外专家学者从炎症的不同途径和环节对中药抗炎作用进行了研究,实验结果[7-12]证实,我国的传统中药具有良好的抗炎功效,并且毒副作用小。所以,探索出具有民族特色的抗炎药物的研究方向,寻找和发现适合于地区患者的抗炎新蒙药是具有重要的现实意义。
前期研究结果[13-16]表明,小白蒿主要化学成分为黄酮类化合物,相对含量约为10%,主要包括羟基化多甲氧基黄酮。近期研究[17-19]表明,羟基化多甲氧基黄酮比其全甲氧基化黄酮具有更强的生物活性,如抗炎活性和抗癌。故本研究在小白蒿中分离得到总黄酮的基础上,首先采用甲醛致大鼠足肿胀模型观察小白蒿总黄酮的抗炎作用,然后运用HPLC法对其进行分离并利用NMR法鉴定其分离物。
1 仪器与材料
1.1 仪器 AUW220D型电子天平(日本岛津);HH-S26S 型水浴锅(金坛市大地自动化仪器厂);RE52-2型旋转蒸发器(上海泸西分析仪器厂);Bruker AVAIVCEⅢ-300型核磁共振谱仪(布鲁克公司);日本岛津液相色谱仪(LC-20Ap输液泵,SPD-20A检测器, CBM-20A工作站);色谱柱为EZ0566。
1.2 试药 醋酸地塞米松片(浙江仙据制药有限公司);羧甲基纤维素钠(中国医药上海化学试剂公司);D101大孔树脂(天津市光复精细化工研究所);氘代试剂为Cambridge Isotope Laboratories, InC;Sephadex LH-20 (Pharmacia 公司),其它试剂均为分析纯。小白蒿采集于内蒙古通辽市,由内蒙古民族大学蒙医药学院布和巴特尔教授鉴定为菊科蒿属植物冷蒿ArtemisiafrigidaWilld.的地上部分。标本(No.20130720)保存于内蒙古民族大学蒙医药学院蒙药化学教研室。
1.3 动物 昆明种健康小鼠,雄雌各半,体重(20±2)g;Wistar 大鼠, 雄性, 体重200~300 g,由长春市亿斯实验动物技术有限责任公司提供,动物许可证号:SCXK(吉林)-2011-0004。实验时的饲养环境条件为温度(22±2)℃,湿度(50±10)%。
2 方法与结果
2.1 提取 小白蒿粉末2.0kg,用75%乙醇50L回流提取两次,每次3h,滤过,合并滤液。合并液减压浓缩至干, 得到其提取物860g。提取物加水500mL,搅拌成混悬液。将处理好的D101树脂500g,装柱, 吸取混悬液,上柱,以3mL/min的流速进行吸附,先用水5L洗脱,然后用20%乙醇溶液5L洗脱后再用85%乙醇溶液10L洗脱。85%乙醇洗脱液减压回收至干,即得小白蒿总黄酮 (580.0g)。
2.2 HPLC分离与NMR鉴定 小白蒿总黄酮1.5g,精密称定,加30%的乙腈水溶液50mL,超声处理30min,过滤。滤液再用0.45μm的滤膜,过滤后备用。
色谱条件:流动相为30%乙腈水溶液,检测波长为254nm,流速为5mL/min和进样量为200μL。在上述色谱条件下,进样,扫描,结果见图1。HPLC分离得到化合物S1、S2、S3、S4和S5各15 mg溶解于5mL氘代二甲亚砜(DMSO-d6)中,测定其1H-NMR(500MHz, DMSO-d6)和13C-NMR (125MHz, DMSO-d6)数据,经分析其NMR数据,确定了化合物的结构式。结果见图2。
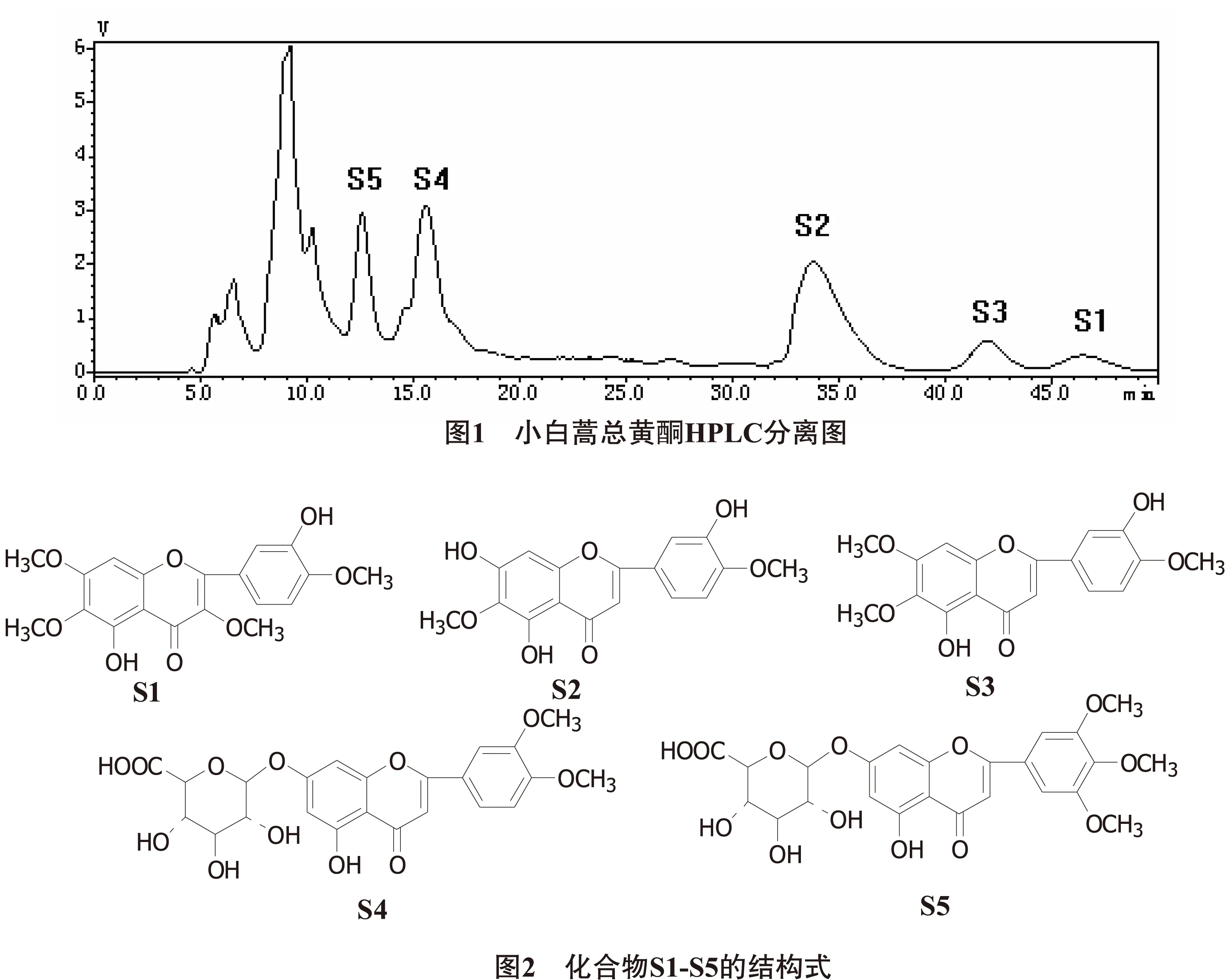
化合物S1 淡黄色结晶(氯仿),盐酸-镁粉反应阳性,易溶于氯仿、乙酸乙酯、甲醇和乙醇。1H-NMR(DMSO-d6)δ:12.9 (1H, s, 5-OH), 3.93 (3H, s, 7-OCH3), 3.91 (3H, s, 4′-OCH3), 3.89 (3H, s, 3-OCH3), 3.78 (3H, s, 6-OCH3), 6.91 (1H, s, H-8), 7.64 (1H, d,J= 2.0 Hz, H-2′), 6.97 (1H, d,J= 8.0 Hz, H-5′), 7.60 (1H, dd,J= 8.0, 2.0 Hz, H-6′)。13C-NMR(DMSO-d6)δ: 151.3 (C-2), 137.0 (C-3), 178.2 (C-4), 151.8 (C-5), 131.1 (C-6), 158.5 (C-7), 91.7 (C-8), 155.7 (C-9), 105.5 (C-10), 122.3 (C-1′), 115.5 (C-2′), 147.9 (C-3′), 150.1 (C-4′), 112.3 (C-5′), 120.4 (C-6′), 56.3 (7-OCH3), 56.2 (4′-OCH3), 55.8 (3-OCH3), 55.2 (6-OCH3)。
化合物S2 淡黄色结晶(氯仿),盐酸-镁粉反应阳性,易溶于氯仿、乙酸乙酯、甲醇和乙醇。1H-NMR(DMSO-d6)δ:12.7 (1H, s, 5-OH), 3.88 (3H, s, 4′-OCH3), 3.76 (3H, s, 6-OCH3), 6.56 (1H, s, H-3), 6.93 (1H, s, H-8), 7.52 (1H, d,J=2.0 Hz, H-2′), 6.95 (1H, d,J=8.0 Hz, H-5′), 7.56 (1H, dd,J=8.0, 2.0 Hz, H-6′)。13C-NMR(DMSO-d6)δ: 164.4 (C-2), 103.2 (C-3), 181.6 (C-4), 152.5 (C-5), 130.7 (C-6), 156.0 (C-7), 90.9 (C-8), 153.4 (C-9), 101.5 (C-10), 121.0 (C-1′), 112.6 (C-2′), 145.8 (C-3′), 149.6 (C-4′), 115.6 (C-5′), 120.5 (C-6′), 56.1 (4′-OCH3), 55.0 (6-OCH3)。
化合物S3 淡黄色结晶(氯仿),盐酸-镁粉反应阳性,易溶于氯仿、乙酸乙酯、甲醇和乙醇。1H-NMR(DMSO-d6)δ:12.9 (1H, s, 5-OH), 3.94 (3H, s, 7-OCH3), 3.90 (3H, s, 4′-OCH3), 3.74 (3H, s, 6-OCH3), 6.60 (1H, s, H-3), 6.93 (1H, s, H-8), 7.60 (1H, d,J=2.0 Hz, H-2′), 6.94 (1H, d,J=8.0 Hz, H-5′), 7.61 (1H, dd,J=8.0, 2.0 Hz, H-6′)。13C-NMR(DMSO-d6)δ: 164.0 (C-2), 103.2 (C-3), 182.1 (C-4), 152.7 (C-5), 131.7 (C-6), 152.3 (C-7), 91.9 (C-8), 158.6 (C-9), 105.2 (C-10), 121.4 (C-1′), 115.7 (C-2′), 148.0 (C-3′), 150.8 (C-4′), 110.2 (C-5′), 120.5 (C-6′), 56.4 (7-OCH3), 56.1 (4′-OCH3), 55.1 (6-OCH3)。
化合物S4 黄色粉末(甲醇),盐酸-镁粉反应阳性,易溶于氯仿、乙酸乙酯、甲醇和乙醇。1H-NMR(DMSO-d6)δ:12.5 (1H, s, 5-OH), 3.93 (3H, s, 4′-OCH3), 3.90 (3H, s, 3′-OCH3), 6.93 (1H, s, H-3), 6.47 (1H, d,J=2.0 Hz, H-6), 6.95 (1H, d,J=2.0 Hz, H-8), 7.63 (1H, d,J=2.0 Hz, H-2′), 6.98 (1H, d,J=8.0 Hz, H-5′), 7.60 (1H, dd,J=8.0, 2.0 Hz, H-6′), 5.09 (1H, d,J=7.0 Hz, H-1″)。13C-NMR(DMSO-d6)δ: 164.3 (C-2), 103.4 (C-3), 182.3 (C-4), 161.0 (C-5), 99.0 (C-6), 163.1 (C-7), 96.3 (C-8), 157.2 (C-9), 105.1 (C-10), 121.3 (C-1′), 115.7 (C-2′), 148.6 (C-3′), 149.7 (C-4′), 111.0 (C-5′), 119.8 (C-6′), 56.3 (4′-OCH3), 56.1 (3′-OCH3), 102.2 (C-1″), 73.1 (C-2″), 73.9 (C-3″),71.8 (C-4″), 76.5 (C-5″), 171.5 (C-6″)。
化合物S5 黄色粉末(甲醇),盐酸-镁粉反应阳性,易溶于氯仿、乙酸乙酯、甲醇和乙醇。1H-NMR(DMSO-d6)δ:12.9 (1H, s, 5-OH), 3.91 (3H, s, 4′-OCH3), 3.89 (3H, s, 3′-OCH3), 3.89 (3H, s, 5′-OCH3), 7.03 (1H, s, H-3), 6.44 (1H, d,J=2.0 Hz, H-6), 6.92 (1H, d,J=2.0 Hz, H-8), 7.35 (1H, s, H-2′), 7.35 (1H, s, H-6′), 5.11 (1H, d,J=7.0 Hz, H-1″)。13C-NMR(DMSO-d6)δ: 164.1 (C-2), 103.9 (C-3), 182.0 (C-4), 161.2 (C-5), 99.4 (C-6), 163.1 (C-7), 95.3 (C-8), 156.7 (C-9), 105.1 (C-10), 120.3 (C-1′), 104.5 (C-2′), 148.2 (C-3′), 140.7 (C-4′), 148.2 (C-5′), 104.5 (C-6′′), 56.2 (3′,5′-OCH3), 59.6 (4′-OCH3), 103.1 (C-1″), 73.5 (C-2″), 74.1 (C-3″), 72.0 (C-4″), 76.6 (C-5″), 172.1 (C-6″)。
2.3 急性毒性研究 昆明种健康小鼠,雄雌各半,50只,按体重随机分为5个组。剂量设置如下:第1组0.52 g/kg、第2组1.02 g/kg、第3组2.10 g/kg、第4组3.12 g/kg、第5组4.06 g/kg。动物禁食不禁水16h后,一次性灌胃给药0.2 mL/10 g体重,样品用0.5%CMC-Na溶解。观察14d,记录动物毒性反应、死亡情况及死亡动物解剖脏器病变。结果给药后14d内,各剂量组无小鼠死亡,无明显毒性反应,14d后解剖无可见脏器病变。小白蒿总黄酮的LD50大于4.06 g/kg。
2.4 对甲醛致大鼠足肿胀的影响 按每组大鼠重量计算给药量,然后加适量的0.5%CMC-Na溶解,即得。按文献[20]方法,雄性Wistar 大鼠50只,随机分为5个组。空白对照组(0.5%CMC-Na,10 mL/kg)、阳性对照组(地塞米松,2.5 mg/kg)、给药组低剂量(小白蒿总黄酮,50 mg/kg)、中剂量(小白蒿总黄酮,100 mg/kg))和高剂量(小白蒿总黄酮,200 mg/kg)。测量致炎前大鼠正常足体积2次,取其平均值。各组每天1次灌胃给药1mL/100 g,连续7d。最后一次给药1h后,右后足跖腱膜下注射2%甲醛0.1mL致炎,左后足相同部位注射0.1mL生理盐水(NS)作对照。同时,每只大鼠灌胃给药5mL NS行水负荷。致炎后1h、2h、6h、12h、24h分别测定大鼠足体积。以左右足容积之差表示足肿胀度,由表1可知,在200mg/kg剂量下,小白蒿总黄酮能抑制甲醛致炎后1h、2h、6h、12h、24h的足肿胀,其抑制率为21.34%~35.41%,且具有明显的量效关系。


组别剂量肿胀度/mL(抑制率/%)1h3h6h12h24h空白组-0.492±0.0970.566±0.1470.633±0.1920.669±0.2390.658±0.224阳性组2.5mg/kg0.330±0.139*(32.93)0.369±0.136**(34.81)0.365±0.177**(42.34)0.371±0.214***(44.54)0.355±0.280*(46.05)低剂量组50mg/kg0.452±0.068(8.13)0.515±0.102(9.01)0.557±0.114(12.01)0.563±0.166(15.84)0.532±0.166(19.15)中剂量组100mg/kg0.424±0.115(13.82)0.484±0.13(14.49)0.534±0.209*(15.17)0.548±0.218*(18.09)0.491±0.204(25.38)高剂量组200mg/kg0.387±0.115*(21.34)0.433±0.197*(23.50)0.464±0.234**(26.70)0.463±0.195**(30.79)0.425±0.293*(35.41)
注:与空白对照组比较,*P<0.05,**P<0.01,***P<0.001。
3 讨论
根据小白蒿总黄酮的HPLC分离与NMR鉴定结果可知,其主要含有5个黄酮类化合物,分别是5,3′-二羟基-3,6,7,4′-四甲氧基黄酮(S1), 5,7,3′-三羟基-6,4′-四甲氧基黄酮(S2), 5,3′-二羟基-6,7,4′-三甲氧基黄酮(S3), 5-羟基-3′,4′-二甲氧基黄酮-7-O- β-D-葡萄糖醛酸苷(S4), 5-羟基-3′,4′,5′-三甲氧基黄酮-7-O-β-D-葡萄糖醛酸苷(S5)。以上均为羟基化多甲氧基黄酮,这类黄酮比其全甲氧基化黄酮具有更强的抗炎作用[17-19],故可能是小白蒿总黄酮的主要抗炎活性成分。
实验明确了小白蒿总黄酮的主要化学成分及抗炎作用,但对其化学成分的抗炎作用及机制尚未清楚,有待于下一步的研究。然而,从蒙医临床上来看,该药多年用来治疗关节肿胀和疼痛等热性“希日乌苏”病人的经验也验证了小白蒿具有一定的抗炎作用。
[1]王青虎,乌仁苏布德,布和巴特尔,等.蒙药小白蒿的历史沿革与现代研究概述[J]. 中国现代应用药学, 2010,27(10): 897-900.
[2]乌兰, 特木其乐, 玉兰,等.蒙药治疗膝关节骨性关节炎疗效分析[J].内蒙古医学杂志, 2011, 43(9): 654-655.
[3]特木其乐,戴雪梅,萨茄拉,等. 蒙医药治疗骨性关节炎132 例疗效评价研究[J].中国民族医药杂志,2011, 4(1): 10-11.
[4]策·苏荣扎布. 蒙医临床学[M]. 呼和浩特:内蒙古人民出版社,1999:7.
[5]白清云.中国医学百科全书[M].赤峰:内蒙古科学技术出版社, 1986:322-323.
[6]王秀兰,白玉霞,王欢.蒙药药理学[M]. 呼和浩特:内蒙古人民出版社, 2006: 136-137.
[7]Tao JY, Zheng GH, Zhao L, et al. Anti-inflammatory effects of ethyl acetate fraction fromMelilotussuaveolensLedeb on LPS-stimulated RAW264.7 cells [J]. Journal of Ethnopharmacology,2009(123): 97-105.
[8]Shi EM, Zhou HY, Guo LY, et al. Anti-inflammatory effects of glycyrol isolated fromGlycyrrhizauralensisin LPS-stimulated RAW264.7 macrophages [J]. International Immunopharmacology, 2008(8): 1524-1532.
[9]Kwona OK, Leeb MY, Yuka JE, et al. Anti-inflammatory effects of methanol extracts of the root ofLiliumlancifoliumon LPS-stimulated Raw264.7 cells [J]. Journal of Ethnopharmacology, 2010(92): 67-73.
[10]Wang LY, Unehara T, Kitanaka S. Anti-inflammatory activity of new guaiane type sesquiterpene fromWikstroemiaindica[J]. Chem Pharm Bull, 2005(53): 137-139.
[11]Escandll JM, Recio MC, Manez S, et al. Cucurbitacin R reduces the inflammation and bone damage associated with adjuvant arthritis in lewis rats by suppression of tumor necrosis factor-alpha in Tlymphocytes and macrophages [J]. J Pharmacol Exp Ther, 2007(320): 581-590.
[12]Marsik P, Kokoka L, Malnoe A, et al. n vitro inhibitory effects of thymol and quinones ofNigellasativaseeds on cyclooxygenase-1-and-2-catalyzed prostaglandin E2 biosyntheses [J]. Planta Med, 2005(71): 739-742.
[13]王青虎,王金辉,额尔顿巴根那,等. 小白蒿化学成研究 [J]. 中草药, 2009, 40 (10): 1540-1543.
[14]王青虎,武小兰,王军辉. 小白蒿化学成研究(Ⅱ)[J]. 中草药, 2011, 42 (6): 1540-1543.
[15]Wang QH, Ao WLJ, Wang XL, et al. Two new flavonoid glycosides glycosides fromArtemisiafrigidaWilld. Journal of Asian Natural Products Research, 2010, 12 (11): 950-954.
[16]Wang QH, Ao WLJ, Dai NYT. The structural elucidation and HPLC analysis of six flavone glycosides fromArtemisiafrigida Willd[J]. Chem.Res.Chin.Univ, 2013, 29 (3): 439-444.
[17]Li S, Sang S, Pan S, et al. Anti-inflammatory property of the urinary metabolites of nobiletin in mouse [J]. Bioorg Med Chem Lett, 2007(17): 5177-5181.
[18]Pan MH, Lai YS, Lai YJ, et al. 5-hydroxy-3,6,7,8,3′,4′-hexamethoxy flavone induces apoptosis through reactive oxypen species production, growth arrest and DNA damge-inducible gene 153 expression, and caspase activation in human leukemia ceels [J]. J Agric Food Chem, 2007(55): 5081-5091.
[19]Lai CS, Li S, Chai CY, et al. Inhibitory effect of citrus 5-hydroxy-3,6,7,8,3′,4′-hexamethoxy flavone on 12-O-tetradecanoylphorbol 13-acetate-induced skin inflammation and tumor promation in mice [J]. Carcinogenesis, 2007(28): 1581-1588.
[20]You KM, Jing HG, Kin HP. Inhibition of cyclooxygenase/lipoxygenase from human platelets by polyhydroxylated/methoxylated flavonoids isolated from medicinal plants [J]. Arch Pharm Res, 1999(22): 18-24.
Anti-inflammatory Effects, HPLC Isolation and NRM Identification of the Total Flavonoids fromArtemisiafrigida
Tubuxing1WANG Qinghu2*Bai Yinmuqier2Dai Nayintai2
1. Alashan pharmaceutical equipment procurement service center, Bayanhaotezhen750306, China;2.College of Traditional Mongolian Medicine,Inner Mongolia University for Nationalities,Tongliao 028000,China
Objective To study the anti-inflammatory effects of total flavonoids fromArtemisiafrigidaWilld on inflammation in rats, and determine the main chemical components. Methods The anti-inflammatory effects of total flavonoids fromArtemisiafrigidaWilld on the model of paw edema in rats induced by formaldehyde and then the HPLC and NMR were used to carry on the isolation and identification of 1it’s chemical components. At the same time, the acute toxicity of total flavonoids fromArtemisiafrigidaWilld was observed. Results At the doses used total flavonoids fromArtemisiafrigidaWilld (50, 100, and 200 mg/kg) showed significant and dose-dependent anti-inflammatory effects. According to the HPLC isolation and NMR identification of the total flavonoids fromA.FrigidaWilld, there are five major compounds, namely 5,3′-dihydroxy-3,6,7,4′-tetramethoxy flavone (S1), 5,7,3′-trihydroxy-6,4′-dimethoxyflavone (S2), 5,3′-dihydroxy-6,7,4′-trimethoxyflavone (S3), 5-hydroxy-3′,4′-dimethoxy-7-O- β-D- glucuronide (S4), 5-hydroxy-3′,4′,5′-trimethoxy-7-O-β-D-glucuronide (S5). The LD50of total flavonoids fromArtemisiafrigidaWilld was more than 4.06 g/kg. Conclusions The total flavonoids fromArtemisiafrigidaWilld has significant anti-inflammatory effects, which is one of the main active parts ofArtemisiafrigidaWilld.
ArtemisiaFrigidaWilld; Total Flavonoids; Anti-inflammatory; HPLC Isolation; NMR Identification
国家自然科学基金项目(8146054)。
图布兴(1975-),男,蒙古族,学士,副主任蒙药师,研究方向为蒙药质量标准。E-mail:myycdx@163.com
王青虎(1968-),男,蒙古族,博士研究生,教授,研究方向为蒙药有效物质基础。E-mail: wqh693@163.com
R285.5
A
1007-8517(2017)16-0040-04
2017-06-20 编辑:程鹏飞)
