禽肉中铜绿假单胞菌的分离及其耐药性
2017-09-07魏超代晓航郭灵安雷欣宇刘月悦
魏超+代晓航+郭灵安+雷欣宇+刘月悦

摘 要:采用GB 4789.4—2010《食品安全国家标准 食品微生物学检验 沙门氏菌检验》中的选择性前增菌方法从鲜鹅肉、鸭肉样本中检测到2 株疑似沙门氏菌的菌株,但经ATB生化鉴定和基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization-time of flight-mass spectrometry,MALDI-TOF-MS)鉴定为铜绿假单胞菌。比对2 株铜绿假单胞菌和沙门氏菌的生化图谱,其中鸟氨酸脱羧酶、精氨酸双水解酶和L-阿拉伯糖的实验结果同为阳性,其余生化反应结果差异较大;2 株铜绿假单胞菌的质谱标识峰足迹与肠炎沙门氏菌CICC21482有明显不同。微生物耐药实验结果表明:大部分抗生素对铜绿假单胞菌无抑制作用,只有喹诺酮类抗生素环丙沙星、氨基糖苷类抗生素庆大霉素和链霉素对其有一定的抑制作用。
关键词:禽肉;铜绿假单胞菌;沙门氏菌;生化鉴定;基质辅助激光解吸电离飞行时间质谱
Isolation and Drug Resistance of Pseudomonas aeruginosa from Poultry Meat
WEI Chao1,2, DAI Xiaohang1,2, GUO Lingan1,2, LEI Xinyu1, LIU Yueyue1,*
(1.Analysis and Testing Center of Sichuan Academy of Agricultural Sciences, Chengdu 610066, China;
2.Agricultural Products Quality and Safety Risk Assessment Laboratory of Ministry of Agriculture (Chengdu), Chengdu 610066, China)
Abstract: Two strains of suspected Salmonella spp were detected from fresh goose and duck samples by the selective
pre-enrichment method according to the GB 4789.4?2010. However, the microorganism was identified as Pseudomonas aeruginosa by ATB biochemical identification and matrix-assisted laser desorption-ionization time of flight mass spectrometry (MALDI-TOF-MS). By analyzing the biochemical profiles of the two Pseudomonas aeruginosa strains and Salmonella spp, we found that the results of ornithine decarboxylase, arginine dihydrolase and L-arabinose tests were identically positive while the other biochemical results varied widely. Besides, the footprints of mass spectrometric peak of Pseudomonas aeruginosa and Salmonella enteritidis were significantly different. Drug resistance results showed that most of the antibiotics examined except ciprofloxacin, gentamicin and streptomycin could not inhibit Pseudomonas aeruginosa.
Key words: poultry meat; Pseudomonas aeruginosa; Salmonella; biochemical identification; matrix-assisted laser desorption-ionization time of flight mass spectrometry (MALDI-TOF-MS)
DOI:10.7506/rlyj1001-8123-201707002
中图分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2017)07-0007-04
引文格式:
魏超, 代晓航, 郭灵安, 等. 禽肉中铜绿假单胞菌的分离及其耐药性[J]. 肉类研究, 2017, 31(7): 7-10. DOI:10.7506/rlyj1001-8123-201707002. http://www.rlyj.pub
WEI Chao, DAI Xiaohang, GUO Lingan, et al. Isolation and drug resistance of Pseudomonas aeruginosa from poultry meat[J]. Meat Research, 2017, 31(7): 7-10. DOI:10.7506/rlyj1001-8123-201707002. http://www.rlyj.pub
銅绿假单胞菌(Pseudomonas aeruginosa)是革兰氏阴性菌,专性需氧,菌体长短不一,成对或呈短链状排列,单鞭毛、无芽胞、无荚膜,在普通培养基上可以产生水溶性色素,如绿脓素(pyocynin)等,是一种常见的条件致病菌[1]。铜绿假单胞菌的生长温度范围为25~42 ℃,该菌具有4 ℃不生长而在42 ℃可以生长的特点[2]。铜绿假单胞菌是医院的主要污染菌,感染可发生于很多解剖部位,包括皮肤、骨、耳、眼、尿路和心脏瓣膜等,感染部位与细菌的感染程度及病人的易感性endprint
有关[3-6]。铜绿假单胞菌极易产生耐药性,广谱抗生素、激素以及免疫抑制剂的广泛使用簇生铜绿假单胞菌进化出多种耐药菌株[7-14]。沙门氏菌(Salmonella)是公共卫生学上具有重要意义的引发人畜共患病的致病菌之一,易引起食物中毒,导致胃肠炎、伤寒和副伤寒,是常见的肠道致病菌[15-16]。禽肉易受致病菌感染,其中沙门氏菌为检出率较高的肠道致病菌[17-22]。基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization-time of flight-mass spectrometry,MALDI-TOF-MS)是基于微生物外周蛋白和核糖體蛋白的特异性获得蛋白质指纹图谱,并与数据库中的特征峰比对从而进行微生物鉴定的方法,可以用于研究微生物蛋白质水平的差异性[23-24]。本研究采用
GB 4789.4—2010《食品安全国家标准 食品微生物学检验 沙门氏菌检验》[25]中的选择性前增菌方法,在鸭肉、鹅肉中分别检测出2 株疑似沙门氏菌但经鉴定为铜绿假单胞菌的菌株,并对此2 株铜绿假单胞菌进行生化鉴定和质谱分析,为铜绿假单胞菌检测方法的开发提供理论支持。
1 材料与方法
1.1 材料与试剂
新鲜鹅肉、鸭肉,均为市售。
血平板培养基 广州博赛生物科技有限公司;沙门氏菌显色培养基(chromogenic Salmonella agar,CHR) 上海中欣生物科技有限公司;缓冲蛋白胨水(buffered peptone water,BPW)、氯化镁-孔雀绿增菌液(tetrathionate broth base,TTB)、营养琼脂 广州环凯生物技术有限公司;ATB试剂条ID32E 法国梅里埃公司;乙腈、乙醇(色谱纯) 美国Fisher Scientific公司;甲酸(色谱纯) 美国Tedia公司;α-氰-4-羟基肉桂酸(α-cyano-4-hydroxycinnamic acid,α-CHCA)(色谱纯) 美国Sigma公司;氯霉素、罗红霉素、复方新诺明、链霉素、庆大霉素、环丙沙星、土霉素、卡那霉素、青霉素、氯霉素 英国Oxoid公司。
1.2 仪器与设备
ATB细菌鉴定仪 法国生物梅里埃公司;基质辅助激光解吸电离飞行时间质谱仪 日本岛津公司;YM75Z高压灭菌锅 上海三申仪器设备有限公司;
HF-safe-1200生物安全柜 上海立申仪器设备有限公司。
1.3 方法
1.3.1 菌株分离与生化鉴定
参考GB 4789.4—2010《食品安全国家标准 食品微生物学检验 沙门氏菌检验》[25]中的沙门氏菌检测方法,称取25 g禽肉肌肉纤维中间部分样品于无菌均质袋中,加入225 g BPW浸泡2 min后均质,(36±1) ℃培养18 h;取增菌液1 mL接种至9 mL TTB中,(42±1) ℃增菌培养24 h,取1 μL TTB增菌液接种到CHR培养基中,(36±1) ℃增菌培养24 h。
选取CHR培养基上光滑、湿润、呈紫红色的阳性菌落,采用血平板进行2 次经典纯化,挑取血平板上的单菌落至生理盐水比浊管中,调至0.5 麦氏浊度,用移液器移取55 μL至ID32E试剂条样杯中,36 ℃培养24 h后由ATB系统读出鉴定结果。
1.3.2 菌株的质谱鉴定及比对
选取血平板上的菌落,挑取适量,加入75%的乙醇水溶液,振荡1 min,4 000 r/min条件下离心1 min,去上清液,加入0.75 mL 75%的乙酸水溶液,振荡1 min,加入0.75 mL乙腈,振荡混匀,4 000 r/min条件下离心1 min,取1 μL点至靶板,加入1 μL基质α-CHCA,晾干。
质谱条件:正离子模式;能量:75 Hz;质荷比(m/z)范围:2 000~20 000;将每个样品的200 个收集峰叠加。
1.3.3 抗生素抑菌实验
移取1.3.1节中的0.5 麦氏浊度菌液50 μL于空白培养皿中,倾注45~50 ℃的营养琼脂,振荡混匀,待带菌培养基凝固,将药敏纸片贴于培养基表面,每皿4 片,36 ℃培养24 h,观察并计算结果。
1.4 数据处理
将获得的微生物蛋白图谱在Myla数据库中进行比对,获得鉴定结果,采用SARAMIS Premium软件的Maches in graphical view程序进行标记峰足迹图绘制。
2 结果与分析
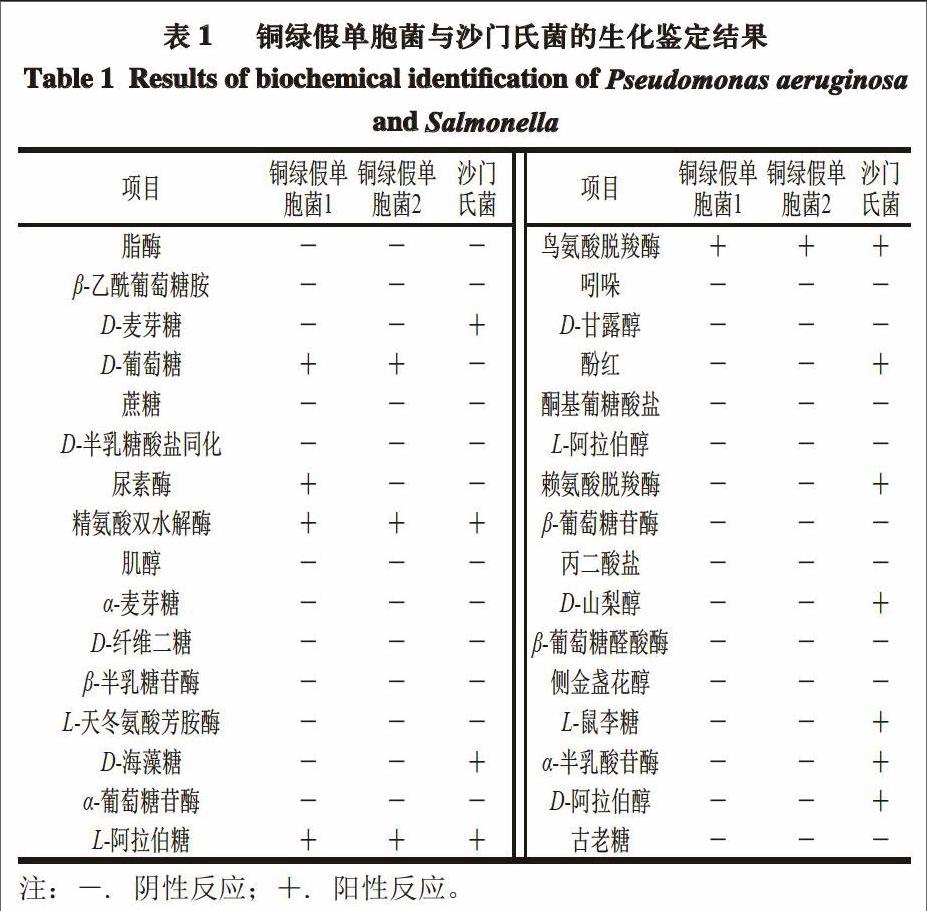
2.1 菌株的生化鉴定
鉴定百分率(ID)是根据被鉴定菌株的生化反应模式得出的菌株属于数据库中哪一分类单位的鉴定结果的可信度,其值越大,结果的可信度越高;T值表示菌株的生化反应结果与该菌最典型生化图谱的接近程度,二者能够给予微生物鉴定结果可信性评价。用1.3.1节的分离与纯化方法在鹅肉和鸭肉样品中分别分离、纯化得到2 株在沙门氏菌选择性培养基上表现为阳性的菌株,但经生化鉴定,2 株菌均为铜绿假单胞菌,分别为铜绿假单胞菌1
(ID=99.7%,T=0.43)和铜绿假单胞菌2(ID=95.3%,T=0.36)。由表1可知,沙门氏菌的生化反应结果与分离得到的2 株铜绿假单胞菌有很大差异,只有鸟氨酸脱羧酶、精氨酸双水解酶和L-阿拉伯糖同时表现为阳性,沙门氏菌在赖氨酸脱羧酶、酚红等实验反应中更多表现为阳性。
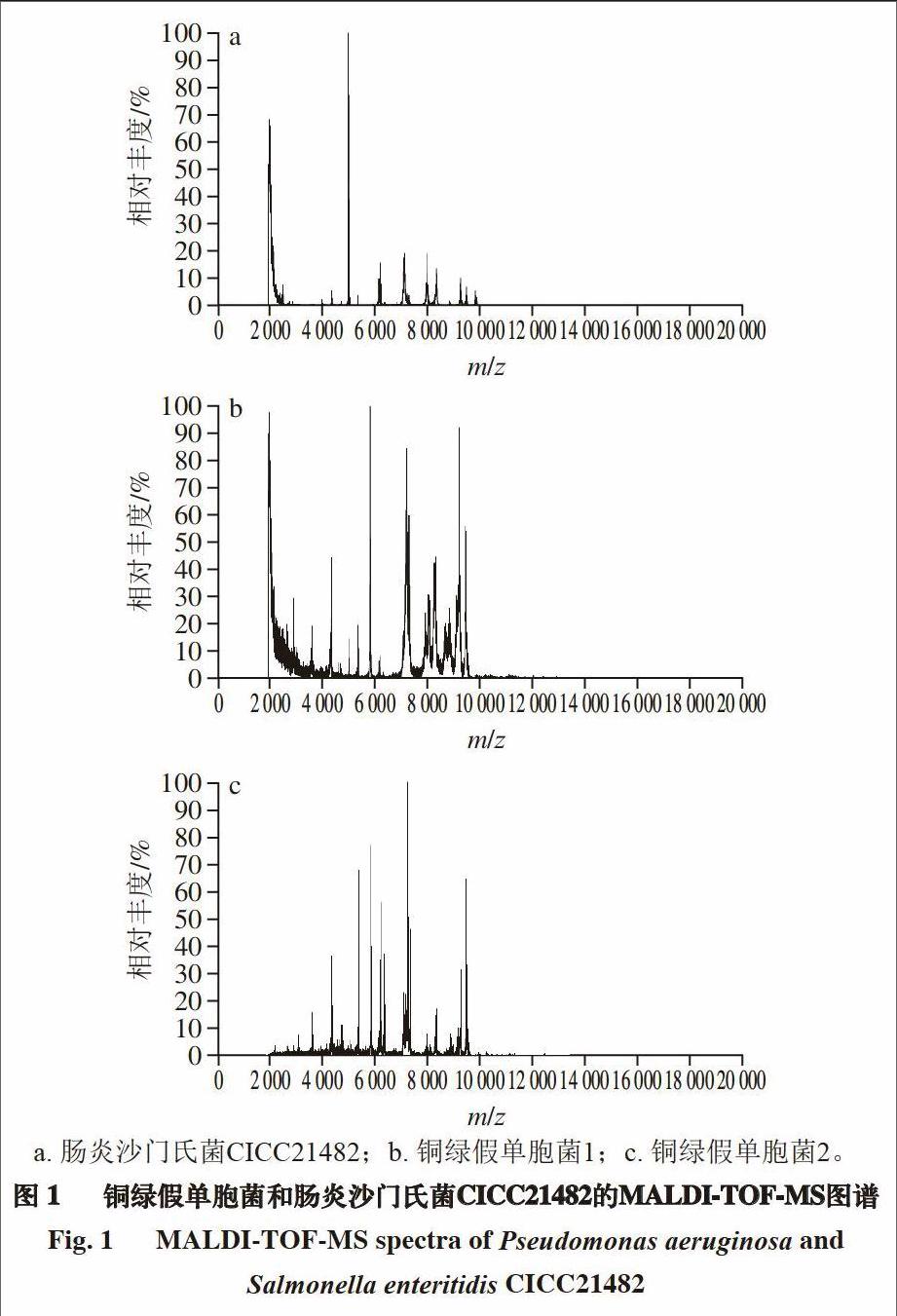
2.2 质谱鉴定与比对
由图1可知,MALDI-TOF-MS可有效鉴定2 株铜绿假单胞菌,但由图2的蛋白标志峰足迹图(图2中的足迹点均对应图1中的蛋白质标识峰(包含小于0.08的相对偏差))可知,分离得到的铜绿假单胞菌与沙门氏菌在质荷比10 000内相交的共同标识峰足迹较多,但在质荷比10 000以后共同标识峰的足迹差异较明显,表明铜绿假单胞菌和沙门氏菌虽然有一定的相似性,但总体差异明显。endprint
2.3 菌株耐药性分析
本研究采用9 種抗生素进行耐药性实验,其中包括7 种不同类型的抗生素,分别为大环内酯类、磺胺类、氯霉素类、四环素类、β-内酰胺类、喹诺酮类、氨基糖苷类,其中卡那霉素、链霉素、庆大霉素均为氨基糖苷类抗生素,7 类抗生素均为畜禽养殖中的常见抗生素[26-31]。由表3可知,大部分抗生素对2 种铜绿假单胞菌均无抑制作用,仅有2 种类型的3 种抗生素具有一定的抑制作用,分别为喹诺酮类抗生素环丙沙星以及氨基糖苷类抗生素庆大霉素和链霉素。
3 讨 论
3.1 检测方法分析
本研究用标准沙门氏菌的前增菌方法对鸭肉和鹅肉样本进行检测,在显色培养基中分离的疑似沙门氏菌菌株经鉴定均为铜绿假单胞菌,综合分析沙门氏菌的前增菌部分,其中BPW为弱营养广泛增菌液,对营养要求不高的铜绿假单胞菌可以在其中实现扩增,氯化镁-孔雀绿培养基能够增加渗透压,孔雀绿有一定的抑制非沙门氏菌菌株的效果[32],在42 ℃条件下可以抑制大多数细菌的生长,但铜绿假单胞菌也具有42 ℃可生长的特性;在沙门氏菌显色培养基上,铜绿假单胞菌也表现为阳性菌落,可能其代谢产物与沙门氏菌有一定的相似性,但其后的32 个生化反应中,铜绿假单胞菌与沙门氏菌的反应结果表现出明显的不同,对其蛋白质的质谱图进行分析也可以看到明显的差异,因此对铜绿假单胞菌的快速特异性检测可以参考沙门氏菌增菌的部分方法,并添加针对铜绿假单胞菌特异性生化特点设计的选择培养基。
3.2 禽肉中微生物的控制
铜绿假单胞菌虽然为条件致病微生物,但其耐抗生素特性使得在肉制品中很难被去除,其对生长环境的营养要求不高且很容易在肉制品中占据主要生态位。本研究采用沙门氏菌选择性增菌方法检测出疑似沙门氏菌、但经鉴定为铜绿假单胞菌的菌株,表明即使样品中有致病微生物存在也可能因其弱生态位而不能被检测出,因此存在风险和隐患。应建立更加精细、准确的实验方法,在肉制品中针对性地检测、鉴定致病微生物,保证食品安全。
参考文献:
[1] 房海, 陈翠珍, 张晓军. 肠杆菌科病源细菌[M]. 北京: 中国农业科学技术出版社, 2011: 282-284.
[2] 董庆利, 王忻, 丁甜. 铜绿假单胞菌单细胞与群体细胞生长规律模拟与验证[J]. 农业机械学报, 2017, 45(9): 204-207.
[3] 朱星成, 夏鹏. 铜绿假单胞菌的临床分布及耐药分析[J]. 中华医院感染杂志, 2009, 19(1): 111-113.
[4] 周莹, 陈杏春, 梁亮, 等. 医院获得性铜绿假单胞菌感染的临床分布与耐药性分析[J]. 中华医院感染学杂志, 2015, 25(12): 2681-2687. DOI:10.1186/cn.ni.2015-135416.
[5] 张春平, 喻华, 刘华, 等. 铜绿假单胞菌感染分布及耐药性动态变迁[J]. 中华医院感染学杂志, 2008, 18(1): 121-123.
[6] 梁勇, 陈裔. 临床分离铜绿假单胞菌体外耐药的动态观察[J]. 中华医院感染学杂志, 2005(5): 594-595.
[7] 张祎博, 孙景勇, 倪语星, 等. 2005—2014年CHINET铜绿假单胞菌耐药性监测[J]. 中国感染与化疗杂志, 2016, 16(2): 141-145. DOI:10.16718/j.1009-7708.2016.02.005.
[8] FALAGAS M E, KOPTERIDES P. Risk factors for the isolation of multi-drug-resistant Acinetobacter baumannii and Pseudomonas aeruginosa: a systematic review of the literature[J]. Journal of Hospital Infection, 2006, 64(3): 7-15. DOI:10.1016/J.HIN.2016.04.015.
[9] 冬兰, 尹秋生, 施冰, 等. 铜绿假单胞菌与鲍曼不动杆菌的多重耐药性分析[J]. 中国临床保健杂志, 2013(6): 582-584. DOI:10.3969/J.issn.1672-6790.2013.06.006.
[10] 钟兴美, 代树均, 李方, 等. 434 株铜绿假单胞菌的耐药性分析[J]. 中华医院感染学杂志, 2003(5): 476-478.
[11] 陈键. 老年住院患者产金属酶耐亚胺培南铜绿假单胞菌的耐药监测[J]. 中华医院感染学杂志, 2012(11): 2434-2436.
[12] 胥琳琳, 陈宗宁. 耐亚胺培南铜绿假单胞菌的耐药性分析及金属β-内酰胺酶的检测[J]. 检验医学与临床, 2012, 9(5): 558-559. DOI:10.3969/J.issn.1672-6455.2012.05.023.
[13] 刘萍, 张志伦, 倪丹妮, 等. 铜绿假单胞菌产金属β-内酰胺酶因素分析[J]. 中华医院感染学杂志, 2011, 21(23): 5058-5060.
[14] 王春新, 赵琪, 周丽珍, 等. 中国部分地区铜绿假单胞菌氨基糖苷类修饰酶基因型研究[J]. 中华医院感染学杂志, 2010, 20(5): 601-604.
[15] ZHOU D G, GAL?N J. Salmonella entry into host cells: the work in concert of type III secreted efector proteins[J]. Microbes and Infection, 2001, 3(14/15): 1293-1298. DOI:10.1016/S1286-4579(01)01489-7.endprint
[16] BESS?DE E, ANGLA-GRE M, DELAGARDE Y, et al.
Matrix-assisted laster-desorption/ionization BIOTYPER: experience in the routine of a university hospital[J]. Clinical Microbiology and Infection, 2011, 17(4): 533-538. DOI:10.1111/j.1469-0691.2010.03274.x.
[17] 卢旭红, 李鑫, 阳宇恒, 等. 北京市大型超市中冰鲜鸡肉微生物污染状况调查[J]. 中国食物与营养, 2014, 20(12): 10-13.
[18] 孙彦雨, 周光宏, 徐幸莲. 冰鲜鸡肉贮藏过程中微生物菌相变化分析[J]. 食品科学, 2011, 32(11): 146-151.
[19] 章薇, 吴娟, 熊国远. 鸡肉加工过程中微生物控制的探讨[J]. 畜牧与饲料科学, 2010, 31(5): 93-94.
[20] 王佳媚, 章建浩. 纳米TiO2对鸡肉源微生物的光催化抑菌效果研究[J]. 安徽农业科学, 2016, 44(23): 37-40; 68.
[21] 吴云凤, 袁宝君. 零售鸡肉中沙门氏菌的半定量风险评估研究[J]. 食品安全质量检测学报, 2014, 5(12): 4157-4162.
[22] 朱江辉, 任鹏程, 徐海滨. 中国鸡肉沙门菌厨房内交叉污染模型初探[J]. 食品安全质量检测学报, 2016(3): 2221-2223.
[23] DUBOIS D, GRARE M, PRERE M F, et al. Performances of the Vitek MS matrix-assisted laser desorption ionization-time of flight mass spectrometry system for rapid identification of bacteria in routine clinical microbiology[J]. Journal of Clinical Microblology, 2012, 50(8): 2568-2576. DOI:10.1128/JCM.0033-12.
[24] MARTINY D, BUSSON L, WYBO I, et al. Comparison of the Microflex LT and Vitek MS systems for routine identigication of bacteria by matrix-assisted laser desorption lionization-time of flight mass spectrometry[J]. Journal of Clinical Microblology, 2012, 50(4): 1313-1325. DOI:10.1128/JCM.0597-11.
[25] 中華人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 4789.4—2016 食品安全国家标准 食品微生物学检验 沙门氏菌检验[S]. 北京: 中国标准出版社, 2016.
[26] 朱永官, 欧阳纬莹, 吴楠, 等. 抗生素耐药性的来源与控制对策[J]. 中国科学院院刊, 2015(4): 104-106.
[27] 刘芳, 颜智勇, 李刚, 等. 2 种四环素类抗生素对厌氧消化的最低抑制浓度和联合抑制类型[J]. 江西农业学报, 2013, 25(4): 120-123.
[28] 陈燕凌, 王志强. 畜禽专用抗生素饲料添加剂[J]. 兽药与饲料添加剂, 2001(3): 175-178.
[29] 洪学. 大环内脂类兽药的合理应用[J]. 当代畜禽养殖业, 2007(7): 152-153.
[30] 裴立忠, 张鹏. 兽用抗生素应用情况及发展前景[J]. 价值工程, 2014(26): 501-504.
[31] 章明奎, 徐秋彤. 农田系统中兽用抗生素的污染及行为研究进展[J]. 浙江农业学报, 2013, 25(2): 416-424. DOI:10.3969/j.issn.1004-1524.2013.02.39.
[32] 杜兆丰, 李惠萍. 氯化镁-孔雀绿培养基增菌效果与改良[J]. 实用预防医学, 1995(3): 78-79.endprint
