不同减菌方式对滩羊肉制品货架期的影响
2017-09-07牛佳陈辉罗瑞明
牛佳+陈辉+罗瑞明

摘 要:以白切羊肉、凉手抓羊肉、椒盐羊肝、酱羊肉和酱羊头肉5 种宁夏特色滩羊肉制品为研究对象,经切割、分块、煮制等过程得到羊肉系列制品,用保鲜盒包装。实验组的切割、包装间采用无菌处理,包括紫外照射和空气过滤装置,并采用紫外照射对羊肉制品的加工包装过程进行层层减菌处理;对照组1、2分别在正常环境下加工后进行微波杀菌和高压灭菌,包装好后置于0~5 ℃贮藏。在贮藏第0、7、14、21、28、35天时检测各组样品的菌落总数、pH值、总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量、硫代巴比妥酸反应物(thiobarbituric acid reactive substance,TBARs)值及水分分布的变化。结果表明:在贮藏过程中,减菌处理的羊肉制品的各项理化指标均优于微波杀菌和高压灭菌,说明采用栅栏技术的减菌处理方法是适用于低温羊肉制品的最佳杀菌方式。经减菌处理的白切羊肉和凉手抓羊肉的货架期为30 d,椒盐羊肝的货架期为28 d,酱羊肉和酱羊头肉的货架期为35 d。
关键词:滩羊肉;栅栏技术;货架期;菌落总数;总挥发性盐基氮
Effect of Different Sterilization Methods on the Shelf Life of Mutton Products from Tan Sheep
NIU Jia, CHEN Hui, LUO Ruiming*
(College of Agriculture, Ningxia University, Yinchuan 750021, China)
Abstract: Boiled mutton, hand-grasped mutton, mutton liver with spiced salt, sauced mutton and sauced sheep head meat were made by segmentation, cutting and cooking and then stored in sealed polypropylene boxes. The experiment included two groups: the experimental group was subjected to aseptic segmentation and cutting through UV light exposure and by using an air filtration system, and sterilized by UV light to reduce bacterial populations during processing and packaging, while the control groups 1 and 2 were processed in normal environment and sterilized by microwave irradiation and autoclaving, respectively, and both were stored at 0–5 ℃ after packaging. After 0, 7, 14, 21, 28 and 35 days of storage, the total colony number, pH value, total volatile basic nitrogen (TVB-N) content, thiobarbituric acid reactive substance (TBARs) content and water distribution were measured on all samples. The physicochemical properties of the experimental group were better than those of the control groups. Thus, this study illustrated that sterilization using hurdle technology was the most suitable for low-temperature mutton products. The shelf life of boiled mutton and hand-grasped mutton in the experimental group was 30 days, that of mutton liver with spiced salt was 28 days, and that of sauced mutton and sauced sheep head meat was 35 days.
Key words: Tan sheep; hurdle technology; shelf life; total colony number; total volatile basic nitrogen (TVB-N)
DOI:10.7506/rlyj1001-8123-201707007
中圖分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2017)07-0034-10
引文格式:
牛佳, 陈辉, 罗瑞明. 不同减菌方式对滩羊肉制品货架期的影响[J]. 肉类研究, 2017, 31(7): 34-43. DOI:10.7506/rlyj1001-8123-201707007. http://www.rlyj.pub
NIU Jia, CHEN Hui, LUO Ruiming. Effect of different sterilization methods on the shelf life of mutton products from Tan sheep[J]. Meat Research, 2017, 31(7): 34-43. DOI:10.7506/rlyj1001-8123-201707007. http://www.rlyj.pubendprint
宁夏盐池滩羊肉味道鲜美,最主要的原因是本地滩羊常吃野草,而这些野草中掺杂着许多种中草药,最具代表性的有黄芪、苦豆子、甘草、苜蓿和盐蒿等29 种,因此滩羊羊肉肉质细嫩、口感滑爽、不干不柴、脂肪分布均匀,吃起来不腥、不膻[1]。滩羊肉是一种高蛋白、低脂肪食品,含有大量维生素,且钙、磷、铁含量高于其他肉类,胆固醇含量低,能有效防止神经系统老化,具有促消化、明目、解毒、滋补等功效,是传统的养生佳品。但盐池滩羊肉目前主要以生鲜肉为主,市场上加工好的、开口即食的滩羊肉制品种类很少,其主要原因是传统滩羊肉制品主要以堂食为主,货架期较短。
肉类制品货架期的长短主要与3 个因素有关,即微生物生长、脂肪氧化酸败和肌红蛋白变性。而低温肉制品货架期较短的主要原因是低温肉制品熱加工温度较低,不能杀灭所有微生物,且产品本身的水分活度和pH值均较高,贮存、销售等环节的温度较高时就会引起细菌的生长和繁殖,导致产品腐败变质[2]。本研究在前期危害分析与关键控制点(hazard analysis and critical control point,HACCP)体系的基础上,引入栅栏技术来针对性地控制产品从原料到成品整个生产过程中的关键控制点,不仅可以达到不使用防腐剂即可使产品获得理想货架期的目的,还能够提高产品品质和食用安全性[3]。通过对比经不同方式杀菌(减菌处理、微波杀菌和高压灭菌)的滩羊肉制品在低温贮藏期间菌落总数、pH值、总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量、硫代巴比妥酸反应物(thiobarbituric acid reactive substance,TBARs)值及水分分布的变化,判断减菌处理低温滩羊肉制品的货架期。旨在将味道鲜美、营养价值高的盐池滩羊肉制成食用方便、货架期长的宁夏特色滩羊肉制品,让更多的人品尝到地道的宁夏传统特色美味。
1 材料与方法
1.1 材料与试剂
新鲜盐池滩羊(整只) 宁夏回族自治区盐池县大夏牧场清真食品有限公司;食盐、味精、花椒、八角、香叶、干辣椒、大葱、生姜、蒜、食品级PP密封保鲜盒宁夏新华百货超市宁阳店。
平板计数琼脂(plate count agar,PCA)培养基、卵黄琼脂(egg yolk agar,EYA)培养基、金黄色葡萄球菌显色培养基、MAC培养基、木糖赖氨酸脱氧胆盐琼脂(xylose lysine deoxycholate salt agar,XLD)显色培养基、氯化镁、硼酸、盐酸、甲基红、次甲基蓝、溴甲酚绿、三氯乙酸、TBA溶液、氯仿(试剂均为分析纯) 银川伟博鑫生物科技有限公司。
1.2 仪器与设备
pH-280手持pH计 杭州陆恒生物科技有限公司;AL240电子天平 上海精科仪器有限公司;DZ-2SD型真空包装机 东莞市益健包装机械有限公司;SF-100CZ
型超净工作台 深圳市云峰净化技术有限公司;
HHS-11-4恒温水浴锅 杭州康纳科技有限公司;
YX-280D型压力蒸汽灭菌器 深圳市良谊实验室仪器有限公司;LRH-142B生化培养箱 深圳岳鑫仪器有限公司;UDK127自动凯氏定氮仪 意大利Velp公司;
TDL-5B台式低速大容量离心机 江苏省金坛市友联仪器研究所;721G-100分光光度计 深圳精科仪器设备有限公司;NMI20型低场核磁脉冲成像分析仪 上海纽曼电子科技有限公司。
1.3 方法
1.3.1 滩羊肉产品的制备
白切羊肉、凉手抓羊肉的制作工艺(作料相同):分割、切块→清洗→预煮→煮制→冷却→无菌包装→减菌处理→贮藏;椒盐羊肝的制作工艺:分割→清洗→预煮→清洗→煮制→冷却→切片→无菌包装→减菌处理→贮藏;酱羊肉、酱羊头肉的制作工艺(作料相同):分割、切块(去毛皮)→清洗→预煮→煮制→冷却→无菌包装→减菌处理→贮藏
1.3.2 样品处理
1.3.2.1 减菌处理(实验组)
活羊在屠宰和之后的排酸过程中严格按照良好生产规范(good manufacturing practice,GMP)操作,经冷链运输至实验室的无菌室内进行分割、切块,无菌室内所有设备以及分割所用的案板、刀具和容器等提前用75%的酒精擦拭后紫外线照射45 min[3]。煮制过程所用的八角、花椒等先进行121 ℃、15 min的高压灭菌,保证辅料中不携带致病菌。分割结束即可进行正常的煮制过程。
减菌包装前对保鲜盒进行高压灭菌(121 ℃、15 min),同时开启无菌真空包装仓的空气过滤装置,然后开启紫外杀菌装置照射45 min,无菌包装仓内的空气含菌量控制在10~20 个/m3。杀菌结束后,将保鲜盒置于无菌包装仓中,对冷却后的滩羊肉制品进行称量和包装,并在无菌包装仓中对密封后的保鲜盒进行覆膜塑封包装。最后,开启无菌包装仓内的杀菌装置对塑封后的保鲜盒进行常温紫外照射30 min,结束后置于0~5 ℃贮藏[4]。
1.3.2.2 微波杀菌处理(对照组1)
原料肉选自经普通方式宰杀的羊胴体,在正常环境中进行切割和分块煮制,包装前对保鲜盒进行121 ℃、15 min的高压灭菌,待肉制品冷却至常温,在正常环境下称量和包装后放入微波炉进行杀菌处理(频率2 450 MHz,功率800 W,时间130s[5]),冷却后覆膜塑封包装,置于0~5 ℃贮藏。
1.3.2.3 高压灭菌处理(对照组2)
原料肉选自经普通方式宰杀的羊胴体,在正常环境中进行切割和分块煮制,包装前对保鲜盒进行121 ℃、15 min的高压灭菌[6],待肉制品冷却至常温,在正常环境下称量后放入保鲜盒内,进行高压灭菌(121℃、15min),冷却后覆膜塑封包装,置于0~5 ℃贮藏[7]。endprint
1.3.3 指标测定
1.3.3.1 pH值
按照GB/T 9695.5—2008《肉与肉制品pH测定》[8]中的方法进行测定:称取不同贮藏时间的样品30 g,分成3 组,每组10 g,将每组样品绞碎,并加入90 mL蒸馏水,测定滩羊肉制品的pH值。
1.3.3.2 菌落总数
按照GB 4789.2—2010《食品安全国家标准 食品微生物学检验 菌落总数测定》[9]中的方法进行测定。
1.3.3.3 TVB-N值
按照GB/T 5009.44—2003《肉与肉制品卫生标准的分析方法》[10]中的半微量定氮法进行测定。
1.3.3.4 TBARs值
采用白艳红[11]的方法进行测定。样品在组织捣碎机中进行均质,取捣碎的肉样10 g,加入50 mL 7.5%的三氯乙酸(含0.1 mol/L的EDTA),振摇30 min,用双层滤纸过滤2 次;取5 mL上清液,加入5 mL 0.02 mol/L的硫代巴比妥酸(thiobarbituric acid,TBA)溶液,90 ℃水浴保温40 min,取出冷却1 h,1 600 r/min条件下离心5 min;在上清液中加入5 mL氯仿,振摇,静置分层后取上清液,分别在532 nm和600 nm波长处测定吸光度,按以下公式计算TBARs值[12]。
式中:TBARs为样品的硫代巴比妥酸反应物值/(mg/100 g);A532 nm和A600 nm分别为溶液在532 nm和600 nm波长处的吸光度。
1.3.3.5 水分分布
核磁共振(nuclear magnetic resonance,NMR)弛豫特性的测定在NMI20低场脉冲核磁共振分析仪上进行。在温度为32 ℃、质子共振频率为22.4 MHz的條件下,采用CPMG脉冲序列(90°脉冲和180°脉冲之间的时间τ=200 μs),采样点数TD=241 000,重复采样次数NS=8,谱宽(spectral width,SW)100 kHz,重复间隔时间(repetition time,TR)1 200 ms,得到以指数形式衰减的核磁信号[13]。将2 g左右样品放入直径15 mm的核磁管中,用保鲜膜封口后放入分析仪中。每个样品至少重复测定3 次。
1.3.3.6 致病菌
肉毒梭状芽孢杆菌按照GB 4789.12—2003《食品卫生微生物学检验 肉毒梭菌及肉毒毒素检验》[14]进行检测;金黄色葡萄球菌按照GB 4789.10—2010《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验》[15]进行检测;志贺氏菌按照GB 4789.5—2012《食品安全国家标准 食品微生物学检验 志贺氏菌检验》[16]进行检测;沙门氏菌按照GB 4789.4—2010《食品安全国家标准 食品微生物学检验 沙门氏菌检验》[17]进行检测。每隔5 d对产品进行抽样检测,做到实时监测,若发现产生肉毒梭状芽孢杆菌的样品,应及时进行高压灭菌处理。
1.4 数据处理
所有实验数据用Excel和Origin 8.6软件进行绘图。实验均重复测定3 次,结果用平均值±标准差表示。
2 结果与分析
2.1 滩羊肉制品贮藏过程中菌落总数的变化
由图1~2可知,减菌处理的白切羊肉和凉手抓羊肉贮藏30 d时的菌落总数达4.3~4.4 (lg(CFU/g)),
而此时对照组1(微波杀菌)和对照组2(高压灭菌)的2 种样品的菌落总数明显大于4.5(lg(CFU/g))。
GB 2726—2005《熟肉制品卫生标准》[18]规定肉制品菌落总数不得大于30 000 CFU/g,即对数值不得大于
4.48(lg(CFU/g)),因此减菌处理的白切羊肉和凉手抓羊肉样品在30 d内可以食用,微波杀菌和高压灭菌的2 种样品贮藏30 d时的菌落总数已超标。
由图3可知,减菌处理的椒盐羊肝在贮藏28 d时的菌落总数就已达到4.3~4.4 (lg(CFU/g)),2 组对照组已超过4.5(lg(CFU/g)),同样按GB 2726—2005《熟肉制品卫生标准》[18]的要求,减菌处理的椒盐羊肝在贮藏28 d内的菌落总数在正常范围内,而微波杀菌和高压灭菌样品的菌落总数已超标。
由图4~5可知,减菌处理的酱羊肉和酱羊头肉的菌落总数在贮藏第35天时达4.8~4.9(lg(CFU/g)),
而微波杀菌和高压灭菌样品的菌落总数已大于
5 (lg(CFU/g)),国标规定酱卤类肉制品菌落总数不得大于80 000 CFU/g[15],即菌落总数不得大于
4.9(lg(CFU/g)),因此,减菌处理的酱羊肉和酱羊头肉在贮藏35 d内的菌落总数未超标,对照组样品超标。
综合分析样品的菌落总数可知,5 种羊肉制品的菌落总数在贮藏初期缓慢上升,中期快速上升,后期趋于稳定,变化较显著(P<0.05),菌落总数的变化趋势呈S形曲线,形成这一变化趋势的原因是在贮藏初期初始菌落较少,增长速度较慢,贮藏中期微生物开始生长繁殖,后期由于营养物质减少,微生物生长缓慢。此外,样品菌落总数实验组<对照组1<对照组2,原因是实验组样品在包装时使用了无菌真空包装仓,该设备运行时先将空气进行过滤,使空气中菌数降低,再进行紫外照射杀菌,称量、入盒以及塑封过程均在无菌真空包装仓内进行,之后在这个密闭环境内对包装好的样品进行常温紫外照射30 min,即减菌处理,这一过程不仅杀死了肉制品中的致病菌,还保证了保鲜盒内空气中菌的较低浓度,微生物的生长受限。因此,减菌处理组样品在贮藏期间的菌落总数整体较低。而对照组1采用微波杀菌方式,对保鲜盒内的空气灭菌不够彻底,对照组2在高压灭菌后会形成大量水蒸气,降温后会凝成水滴,使保鲜盒内湿度增大,细菌大量滋生,因此样品菌落总数普遍较高。白切羊肉和凉手抓羊肉的保鲜期为30 d,椒盐羊肝为28 d,而酱羊肉和酱羊头肉为35 d,这是由于羊肝中含血液较多,而血液中富含微生物生长所需的营养物质,因此椒盐羊肝的保鲜期相对较短,而酱羊肉和酱羊头肉在煮制过程中使用了花椒、八角、酱油及食盐等大量调味料,它们能在一定程度上抑制微生物的生长,因此保鲜期较长。endprint
2.2 滩羊肉制品贮藏过程中pH值的变化
由图6~7可知,白切羊肉和凉手抓羊肉贮藏过程中的pH值均呈先下降后平稳的变化趋势,这是由于用保鲜盒包装的肉制品不是处于完全无氧状态,随着初始菌落的生长,糖类被分解产生有机酸,使得肉制品pH值下降,贮藏后期pH值趋于稳定可能是由于密封的保鲜盒中氧气被耗尽,需氧菌停止生长,厌氧菌产生的少量有机酸与蛋白质分解形成的低分子量含氮碱性物质发生中和反应造成的[19]。
由图8可知,椒盐羊肝贮藏过程中的pH值先上升后下降,这是由于肝脏中富含蛋白质,而脂肪含量较低,在低温贮藏条件下,微生物可利用的营养物质较少,而大量蛋白质分解产生的含氮碱性物质使样品pH值上升,随着初始菌落的生长,微生物开始大量生长产酸,故pH值降低。
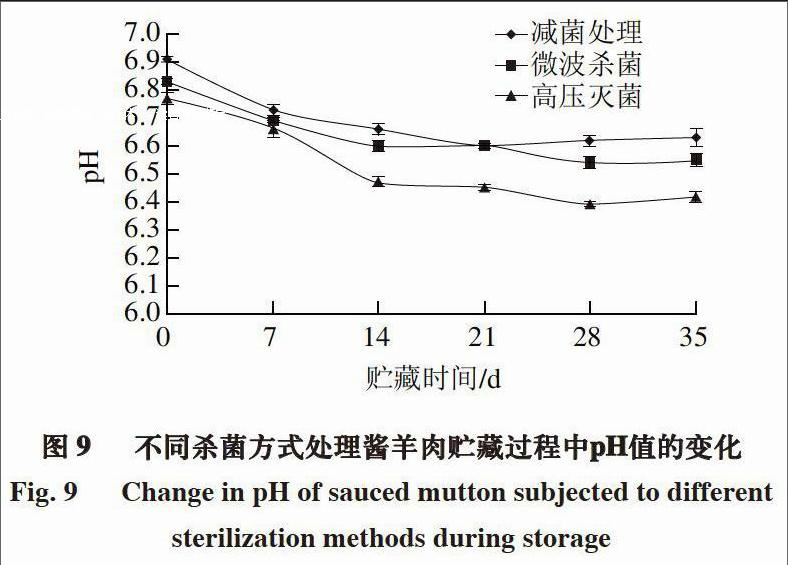
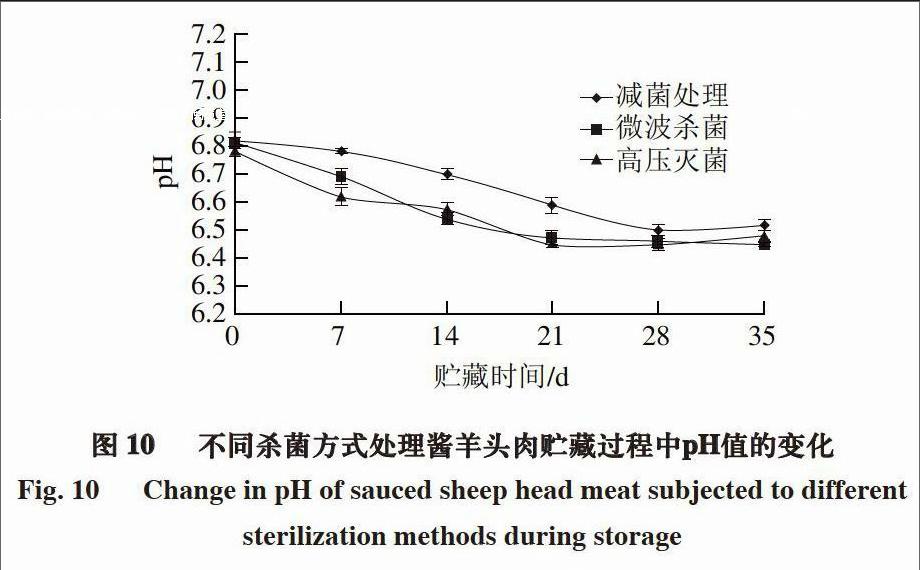
由图9~10可知,2 种酱羊肉制品贮藏期间的pH值均呈现先下降后略有上升的趋势,贮藏前期pH值下降的原因与白切羊肉相同,后期由于酱羊肉和酱羊头肉制作过程中放入的花椒、八角等具有刺激性,对乳酸菌的生长有一定的抑制作用,同时,肉中蛋白质的分解使pH值有所升高。
综合分析5 种羊肉制品pH值的变化可知,实验组>对照组1 >对照组2,原因主要与杀菌方式有关,减菌处理的杀菌效果明显优于微波杀菌和高压灭菌。此外,白切羊肉和凉手抓羊肉的pH值小于酱羊肉和酱羊头肉,这主要是由于酱肉制品中的香辛料及酱油等的使用量较大,能够抑制微生物的生长,故其pH值相对较大。
2.3 滩羊肉制品贮藏过程中TVB-N值的变化
由图11~15可知,5 种羊肉制品贮藏期间的TVB-N值均呈现先上升后略有下降的趋势,肉品中所含TVB-N的量随着腐败进程逐渐增加,与肉品的腐败程度成正比,因此TVB-N值可与菌落总数结合来鉴定肉制品的新鲜度[20]。在肉制品贮藏过程中,由于酶和细菌的作用,蛋白质、肌酸、次黄嘌呤核苷酸、肌肽等含氮大分子分解形成氨及胺类等碱性含氮物质,此类物质可以与腐败过程中同时分解产生的有机酸结合,形成一种称为盐基态氮(NH4+·R-)的物质,积聚在肉品中,使产品TVB-N值增大。贮藏后期,这些含氮大分子被分解利用完,不再产生碱性化合物,同时部分与酸性物质中和,导致产品TVB-N值轻微下降。
综合分析5 种羊肉制品TVB-N值的变化可知,减菌处理组<微波灭菌组<高压杀菌组,其原因同上述分析。另外,白切羊肉和凉手抓羊肉的TVB-N值整体上小于酱羊肉和酱羊头肉,而椒盐羊肝的TVB-N值最大,原因可能是相对于白切羊肉和凉手抓羊肉来说,酱羊肉和酱羊头肉含有的氨类及胺类物质在贮藏过程中由于酶和微生物的作用分解产生了更多的碱性含氮物质,使它们的TVB-N值偏高,而羊肝中大量蛋白质的分解使其TVB-N值较大。
2.4 滩羊肉制品贮藏过程中TBARs值的变化
由图16~20可知,5 种滩羊肉制品贮藏过程中TBARs值的变化显著(P<0.05)。脂类氧化是肉类及肉制品品质降低的重要原因之一,由于细胞膜上脂质双分子层中的磷脂部分含有不饱和脂肪酸,使得肉类特别容易发生脂类氧化反应[21],肉类食品的脂质氧化程度通常用硫代巴比妥酸法(TBA法)进行评价[22]。5 种产品的TBARs值随着贮藏时间的延长均呈先上升后下降,随后趋于稳定的趋势。这是由于保鲜盒包装的产品中有空气,这使得脂肪被氧化,导致产品TBARs值上升,而后生成的次级代谢产物与肉制品中的氨基成分发生化学反应生成聚合物,使得产品TBARs值下降[22]。在贮藏后期,样品的TBARs值趋于稳定,这可能是由于产品包装内的氧气耗尽使TBARs值不再增加,最后趋于稳定。
減菌处理组<微波杀菌组<高压灭菌组,这与杀菌方式有关。另外,酱羊肉和酱羊头肉的TBARs值明显低于其他3 种肉制品,相关研究表明,香辛料不仅具有抑菌作用,同时抗氧化能力较强,因此酱羊肉和酱羊头肉样品的TBARs值较低。
2.5 滩羊肉制品贮藏过程中水分分布的变化
水分作为肉与肉制品的主要成分,以一定数量定位、定向存在于其中,并以结合水(与大分子相互作用的水)、不易流动水(肌原纤维和网状组织中的水)和自由水(细胞外的水)3 种形式存在,而结合水又分为强结合水和弱结合水[23]。水分子的存在形式和活性分布状态不但决定了蛋白质的保水能力,也会对肉制品的货架期产生一定影响。运用低场核磁共振技术(low-field nuclear magnetic resonance,LF-NMR)测定肉制品中的水分分布状态、水分含量及其流动性,能够科学准确地反映肉制品贮藏过程中的水分变化。在LF-NMR测定中得到的2 个主要参数是自旋-晶格弛豫时间(用T1表示,又称为纵向弛豫时间)和自旋-自旋弛豫时间(用T2表示,又称为横向弛豫时间)。在肉与肉制品研究中,由于T2变化范围较大,并且表示水分分布状态比T1更加敏感,因此常用T2弛豫时间作为衡量肉品持水性的指标,T2弛豫时间的不同能够较容易地区分自由水和结合水[24-26]。
由图21~22可知,白切羊肉和凉手抓羊肉中均检测出了4 种峰:T21在0.1~1 ms之间,代表与蛋白质等氨基、羰基以氢键相结合的单层水,这种结合十分紧密,流动性很差,称为弱结合水;T22在0.5~8 ms之间,被认为是与蛋白质中的酰胺基、淀粉纤维素中的羟基形成键能较小的氢键的水,其结合强度比单分子层水略差些,称为强结合水,T21和T22统称为T2b;T23在10~100 ms之间,弛豫时间较长,为不易流动水;T24在80~350 ms之间,流动性最强,是可以自由移动的水分,称为自由水[27-28]。
比较白切羊肉和凉手抓羊肉对应峰的面积发现,3 种不同杀菌方式下2 种肉制品的T21和T22峰面积随着贮藏时间的延长几乎未发生改变,而T23峰面积均逐渐减小,T24峰面积在减菌处理和微波杀菌样品中逐渐增大,高压灭菌样品中逐渐减小,这表明2 种肉制品中的结合水由于强烈的束缚作用几乎不发生转移,不易流动水向自由水转移。由于减菌处理和微波杀菌对肉制品组织及细胞膜的破坏性不是很大,因此自由水流失并不严重,而经过高压灭菌,肉制品的细胞组织由于被高温高压破坏而变得松散,细胞壁和生物膜受到损伤,膜内水分流出,经不易流动水转移过来的自由水大量散失[29-30]。endprint
由图23可知,3 种不同杀菌方式处理的椒盐羊肝样品均出现了3 种峰,T2b在0.1~8 ms之间,为结合水,结合水因与颗粒表面的距离不同,受电场作用力的大小也不同,因此结合水分为强结合水和弱结合水,单峰和双峰的出现并无本质区别[31]。T23在7~100 ms之间,为不易流动水,T24在80~350 ms之间,为自由水。3 种不同杀菌方式处理下,结合水的峰面积随着贮藏时间的延长几乎不发生改变,不易流动水和自由水峰面积均减小,且高压灭菌样品的自由水峰面积比减菌处理和微波杀菌的样品更小,原因可能是肝脏作为机体主要的代谢器官,在物质合成、转化和分解过程中比较活跃,分子进出细胞比较频繁,加之与肌细胞相比,肝细胞膜厚度较小,且肝细胞组织较松散,在煮制过程中,肝细胞通透性增大,因此在低温贮藏期间,肝细胞内的不易流动水向自由水转移,自由水快速流失,而高压灭菌加剧了肝细胞膜的破损,使得自由水流失的速率更快。
由图24~25可知,3 种不同杀菌方式处理的酱羊肉和酱羊头肉样品的结合水、不易流动水及自由水的出峰时间均与椒盐羊肝相似,峰面积随贮藏时间延长的变化趋势均与白切羊肉相似,原因同上述分析。
对比5 种滩羊肉冷拼菜肴分别在减菌处理、微波杀菌以及高压灭菌后的贮藏期内水分分布的变化发现:1)椒盐羊肝整体的水分含量明显大于其他4 种冷拼菜肴,这是由于肝脏细胞的水分含量为86%左右,而肌细胞的水分含量为70%左右,且肝脏细胞小于肌肉细胞,相同质量的肝脏与肌肉相比,肝脏中的水分明显高于肌肉,由于肝脏中水分基数较大,虽然贮藏过程中有所流失,但其水分活度仍有利于微生物的生长,因此肝脏制品的货架期小于其他4 种肉制品;2)减菌处理的5 种肉制品的水分含量均大于微波杀菌及高压灭菌,说明经减菌处理的肉制品水分流失相对较小,而经层层减菌处理的包装盒内气体与肉制品的初始菌落含量较低,因此肉制品同样可以达到较长的货架期。
2.6 样品中致病菌的检测
本研究对不同贮藏时期滩羊肉制品的致病菌进行检测,主要检测对象为肉毒梭状芽胞杆菌、金黄色葡萄球菌、志贺氏菌和沙门氏菌。GB 2726—2005《熟肉卫生标准》[18]规定,以上所列出的几种微生物均不得检出。结果表明,5 种产品中均未检出上述致病菌,表明产品在整个生产过程中的卫生安全控制得当。
2.7 利用栅栏技术减菌处理滩羊肉制品的货架期
白切羊肉和凉手抓羊肉的菌落总数在贮藏30 d时接近国标中规定的30 000 CFU/g,貯藏超过30 d时的菌落总数超标,pH值的变化范围在6.3~6.6之间,适口性较好,TVB-N值和TBARs值反应的腐败与脂肪氧化情况均在可接受范围内,因此可初步判断白切羊肉和凉手抓羊肉的货架期均为30 d。
椒盐羊肝的菌落总数在贮藏28 d时接近30 000 CFU/g,贮藏超过28 d时的菌落总数超标,pH值先上升后下降,变化范围在6.6~7.0之间,TVB-N值<15 mg/100 g(新鲜肉制品指标),脂肪氧化情况在可接受范围内,水分流失相对较少,因此可初步判断椒盐羊肝的货架期为28 d。
酱羊肉和酱羊头肉的菌落总数在贮藏35 d时接近80 000 CFU/g,贮藏超过35 d时的菌落总数超标,pH值整体呈下降趋势,TVB-N值<15 mg/100 g,脂肪氧化情况在可接受范围内,水分流失相对较少,因此可初步判断酱羊肉和酱羊头肉的货架期均为35 d。
3 结 论
通过对3 种不同杀菌方式处理的5 种肉制品的菌落总数、pH值、TVB-N值、TBARs值以及水分分布进行综合分析,发现肉制品采用减菌处理后,低温贮藏期间的各项理化指标及持水性均优于微波杀菌和高压灭菌肉制品,在3 种不同的杀菌方式中,减菌处理作为一种新颖的二次灭菌方式,相对于微波灭菌和高压灭菌这2 种技术相对成熟的灭菌方式来说,是一种操作简单、安全性高、灭菌效果好的最佳灭菌方式。
参考文献:
[1] 宣苏哲. 宁夏盐池: 美味滩羊何以香飘四方[N]. 中国畜牧兽医报, 2016-09-11(001).
[2] 李威娜, 徐松滨, 张玲, 等. 低温肉制品保鲜技术综述[J]. 食品工程, 2013(3): 13-15; 40.
[3] 张伟威, 罗瑞明, 胡聪. 栅栏技术在传统清蒸羊羔肉低温制品加工中的应用[J]. 食品工业科技, 2014(19): 220-224. DOI:10.13386/j.issn1002-0306.2014.19.038.
[4] EISEL W G, LINTION R H, MURIANA P M. A survey of microbial levels for incoming raw beef, environmental sources, and ground beef in a red meat processing plant[J]. Food Microbiology, 1997, 14(3): 273-282. DOI:10.1006/fmic.1996.0094.
[5] 郭辽朴, 李洪军, 杜杰, 等. 微波杀菌技术在肉制品中的应用[J]. 肉类研究, 2008, 22(5): 76-79.
[6] WU Chongman, LIU Suer. Volatile components of water-boiled duck meat and cantonese style roasted duck[J]. Journal of Agricultural and Food Chemistry, 1992, 40(5): 838-841. DOI:10.1021/jf00017a026.
[7] SAMELIS J, KAKOURI A, REMENTZIS J. Selective effect of the product type and the packaging condition on the species of lactic acid bacteria dominating the spoilage microbial association of cooked meats at 4 ℃[J]. Food Microbiology, 2000, 17(3): 329-340. DOI:10.1006/fmic.1999.0316.endprint
[8] 中国商业联合会商业标准中心, 国家加工食品质量监督检验中心(广州), 广州市产品质量监督检验所. GB/T 9695.5—2008 肉与肉制品 pH测定[S]. 北京: 中国标准出版社, 2008.
[9] 中华人民共和国卫生部. GB 4789.2—2010 食品安全国家标准 食品微生物学检验 菌落总数测定[S]. 北京: 中国标准出版社, 2010.
[10] 上海市食品卫生监督检验所. GB/T 5009.44—2003 肉与肉制品卫生标准的分析方法[S]. 北京: 中国标准出版社, 2003.
[11] 白艳红. 低温熏煮香肠腐败机理及生物抑菌研究[D]. 杨凌: 西北农林科技大学, 2005: 12-13.
[12] 于海, 秦春君, 葛庆丰, 等. 中式香肠加工及贮藏中脂肪氧化对其品质特性的影响[J]. 食品科学, 2012, 35(13): 119-125.
[13] 吴亮亮. 宁夏传统特色低温清真滩羊肉食品研发[D]. 银川: 宁夏
大学, 2016: 24.
[14] 卫生部兰州生物制品研究所, 中国疾病预防控制中心营养与食品安全所. GB 4789.12—2003 食品卫生微生物学检验 肉毒梭菌及肉毒毒素检验[S]. 北京: 中国标准出版社, 2003.
[15] 中华人民共和国卫生部. GB 4789.10—2010 食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验[S]. 北京: 中国标准出版社, 2010.
[16] 中华人民共和国卫生部. GB 4789.5—2012 食品安全国家标准 食品微生物学检验 志贺氏菌检验[S]. 北京: 中国标准出版社, 2012.
[17] 中华人民共和国卫生部. GB 4789.4—2010 食品安全国家标准 食品微生物学检验 沙门氏菌检验[S]. 北京: 中国标准出版社, 2010.
[18] 江苏省疾病预防控制中心, 上海市卫生监督所, 黑龙江省食品卫生监督检验所. GB 2726—2005 熟肉制品卫生标准[S]. 北京: 中国标准出版社, 2005.
[19] 贺旺林, 俞龙浩. 基于腐败微生物的低温肉制品货架期预测研究进展[J]. 黑龙江八一农垦大学学报, 2015(2): 51-56. DOI:10.3969/j.issn.1002-2090.2015.02012.
[20] 马跃龙, 俞淑, 薛峰, 等. 调理肉制品挥发性盐基氮的研究[J]. 农产品加工(学刊), 2012(5): 112-113; 119. DOI:10.3969/jissn.1671-9646(X).2012.05.035.
[21] 孙群. 肉制品脂类氧化: 硫代巴比妥酸试验测定醛类物质[J]. 食品科学, 2002, 22(8): 331-334.
[22] 赵淑娥. 硫代巴比妥酸法(TBA模型)预测鱼糜制品保藏貨架期研究[J]. 江西食品工业, 2012(2): 26-27.
[23] 姜晓文, 韩剑众. 生鲜猪肉持水性的核磁共振研究[J]. 食品工业科技, 2009(7): 128-130; 133.
[24] 李欣, 苏珊珊, 马俪珍, 等. 利用LF-NMR研究牛肉粒微波干燥过程中水分迁移和分布变化[J]. 食品科技, 2013(1): 145-149. DOI:10.13684/j.cnki.spkj.2013.01.055.
[25] 李伟妮, 韩剑众. 冷藏山羊肉品质变化的核磁共振研究[J]. 食品工业科技, 2010(1): 125-127.
[26] BERTRAM H C, KARLSSON A H, RASMUSEN M, et al. Origin of multi-exponential T2 relaxation in muscle my-owater[J]. Journal of Agricultural and Food Chemistry, 2001, 49(6): 3092-3100.
[27] 夏天兰, 刘登勇, 徐幸莲, 等. 低场核磁共振技术在肉与肉制品水分测定及其相关品质特性中的应用[J]. 食品科学, 2011, 32(21): 253-256.
[28] MORTENSEN M, ANDWESEN H J, ENGELSEN S B, et al. Effect of freezing temperature, thawing and cooking rate on water distribution in two pork qualities[J]. Meat Science, 2006, 72(1): 34-42.
[29] 戴妍, 常海军, 郇兴建, 等. 不同二次杀菌处理的南京盐水鸭产品风味变化及感官特性[J]. 南京农业大学学报, 2011(5): 122-128.
[30] 潘兴云, 薛妍君, 蒋林惠, 等. 肉多汁性的研究及核磁共振技术在多汁性检测中的前景[J]. 科技信息, 2010(24): 6-7.
[31] 朱晓红, 李春, 胡海涛, 等. 结合LF-NMR研究不同处理对酱牛肉保水性的影响[J]. 食品工业科技, 2012(4): 92-96. DOI:10.13386/j.issn1002-0306.2012.04.085.endprint
