放电等离子烧结钛基磷酸三钙陶瓷复合材料的力学性能与生物活性
2017-09-06郭誉刘咏谭彦妮周睿韦伟汤菡纯
郭誉,刘咏,谭彦妮,周睿,韦伟,汤菡纯
(中南大学 粉末冶金国家重点实验室,长沙 410083)
放电等离子烧结钛基磷酸三钙陶瓷复合材料的力学性能与生物活性
郭誉,刘咏,谭彦妮,周睿,韦伟,汤菡纯
(中南大学 粉末冶金国家重点实验室,长沙 410083)
采用放电等离子烧结法制备钛基磷酸三钙(Ti/α-TCP)复合材料,利用扫描电镜(SEM),能谱分析仪(EDS)和X射线衍射仪(XRD)对该材料的组织结构与界面反应进行观察与分析,并测试其抗压强度与生物活性,研究烧结温度与钛含量对Ti/TCP复合材料组织与性能的影响。结果表明:烧结温度在900 ℃以上时,Ti与α-TCP界面发生反应;增加钛含量有利于提高复合材料的强度。在Ti/α-TCP混合粉末中添加钛网作为骨架时,界面反应更复杂,并且温度越高,反应产物越多,当烧结温度达到1 100 ℃时,生成Ti 的氧化物以及TixPy和CaTiO3。在900 ℃烧结的70Ti/α-TCP/钛网复合材料抗压强度最高,达到590 MPa,浸入模拟体液中14天后表面形成一层厚厚的磷灰石,该材料作为骨植入替换材料具有很大的应用价值。
钛/磷酸三钙复合材料;钛网;放电等离子烧结;抗压强度;生物活性
钛及钛合金由于具有良好的生物相容性和优异的力学性能、与人体骨相近的弹性模量以及良好的耐腐蚀性能,已逐渐替代不锈钢和Co-Cr合金成为应用最广泛的金属基生物材料[1−2]。然而,作为一种骨替代材料,钛及其合金由于是生物惰性材料,在与骨组织接触中难以形成化学键合,远期临床结果可能引起假体松动[3]。另外,由于钛及钛合金的弹性模量和人体骨之间的差异易引起应力屏蔽,造成种植体周围骨组织吸收,最终引起假体松动而使种植失败。另一种广泛应用的生物材料是 CaP 陶瓷化合物,典型代表有羟基磷灰石(HA)和磷酸三钙[Ca3(PO4)2]等。CaP陶瓷化合物和骨组织有相似的化学组成和很好的生物相容性,因此被广泛用作人体硬组织种植材料[4−5],但陶瓷材料的脆性本质和力学性能差的特性也限制了其发展[6]。结合钛及钛合金与CaP陶瓷材料的共同优点制备综合性能更佳的骨替换材料已成为该研究领域的热点。一种方法是将CaP陶瓷覆盖在钛基体上形成复合涂层,实现生物性能和力学性能的共同表达[7−8],但存在结合强度低,涂层易剥落等问题[9]。另一种方法是将钛与具有生物活性的陶瓷材料均匀混合制备复合材料,既保持陶瓷材料的生物活性,又能避免涂层脱落的问题[10−11]。磷酸三钙包括低温β型磷酸三钙(β-TCP)和高温α型磷酸三钙(α-TCP)。3种典型的CaP陶瓷材料的生物降解性依次为α-TCP>β-TCP>HA[12],而将α-TCP陶瓷材料与钛复合的研究还未见报道,本文作者将α-TCP与金属钛结合,通过放电等离子烧结法(spark plasma sintering, SPS)制备钛基磷酸三钙复合材料,对复合材料的形貌、结构以及抗压强度与生物活性进行分析与测试,研究钛含量对复合材料组织与性能的影响,并研究用钛网作为骨架对该材料力学性能的增强效果,对于改善钛基骨替换材料的长期稳定性具有重要意义。
1 实验
1.1 原料
硝酸钙(Ca(NO3)2·4H2O),国药集团化学试剂有限公司,分析纯;磷酸铵(NH4H2PO4),国药集团化学试剂有限公司,分析纯;氨水,广州西陇,广州市西陇化工有限公司,质量分数为25%;商业钛粉,宝鸡富士特钛业有限公司,粒径小于44 μm,纯度99.8%。
1.2 α-TCP粉末制备
按照n(Ca):n(P)为3:2的比例称量Ca(NO3)2·4H2O和NH4H2PO4,分别加入到纯水中,配制相同体积的Ca(NO3)2·4H2O溶液和NH4H2PO4溶液。在37 ℃恒温磁力搅拌下,将Ca2+溶液用酸式滴定管缓慢滴入PO43−溶液中(滴加速度为2 mL/min),再滴加氨水至pH值为7.5,用保鲜膜封好,搅拌4 h,然后通过真空泵抽滤。将样品放于恒温干燥箱中,在80 ℃温度下干燥12 h,得到白色块体,研磨成粉后置于高温箱式炉中,在1 250 ℃煅烧2 h后迅速取出,放于空气中自然冷却,然后放入氧化锆材质的球磨罐中,在250 r/min 的转速下球磨12 h,得到粒径细小的α-TCP粉末。
1.3 Ti/α-TCP复合材料制备
按照钛粉与α-TCP粉末的体积比分别为5:5,6:4和7:3的比例量取钛粉与α-TCP粉,放入不锈钢材质的球磨罐内,在200 r/min 的转速下混合4 h,使粉末充分混合均匀并减小粉末粒径。将钛粉与α-TCP粉末的体积比分别为5:5,6:4和7:3的3组混合粉末分别标记为50Ti/α-TCP,60Ti/α-TCP和70Ti/α-TCP。混合粉末进行放电等离子烧结,得到3组高度为15mm,直径10 mm的圆柱形Ti/α-TCP复合材料试样,分别记为50Ti/α-TCP,60Ti/α-TCP 和 70Ti/α-TCP复合材料。烧结温度分别为800,900和1 000 ℃,保温10 min,烧结压力为30 MPa。
1.4 70Ti/α-TCP/钛网复合材料制备
为了研究钛网作为骨架对复合材料抗压强度的增强效果,将60目的商业纯钛网剪成形状统一的圆片并堆叠成垛,放于模具中,加入70Ti/α-TCP 混合粉末至钛网骨架中,振实摇晃均匀后再进行SPS,烧结温度分别为800,900,1 000和1 100 ℃,保温10 min,烧结压力为30 MPa,得到70Ti/α-TCP/钛网复合材料。
1.5 性能分析与测试
用X射线衍射仪(D/max-2550,Cu靶的Kα线)测试混合粉末和烧结样品的物相组成,加速电压为40 kV,电流为200 mA,扫描速率为10 (°)/min。用场发射扫描电镜(Nova Nano SEM 230)观察烧结样品的形貌。对复合材料进行压缩性能测试,并利用扫描电镜观察压缩断口形貌。测试样品为高径比为1.5的圆柱状试样。为了研究Ti/α-TCP复合材料的体外生物活性,将直径和厚度分别为5mm和2mm的小圆片状样品浸泡在模拟体液(SBF)中一段时间,然后利用扫描电镜观察表面沉积物形貌,用X射线衍射仪测试沉积物的相组成。
2 结果与讨论
2.1 原料粉末
图1(a)~(c)分别是原始Ti粉,α-TCP粉以及60Ti/α-TCP混合粉末的SEM形貌。从图看出,Ti粉和α-TCP粉末都是不规则形状,混合球磨后这2种粉末的粒径明显减小,都为10 μm左右,2种粉末难以分辨但未出现团聚现象。图2所示为60Ti/α-TCP混合粉末的XRD谱,由图可见混合粉末中只有Ti和α-TCP两相,球磨混粉过程中未发生反应产生新相。

图1 Ti粉、α-TCP粉末和60Ti/α-TCP混合粉末的SEM形貌Fig.1 SEM images of the Ti powder (a), α-TCP powder (b) and 60Ti/α-TCP mixing powders (c)

图2 60Ti/α-TCP混合粉末的XRD谱Fig.2 XRD pattern of 60Ti/α-TCP mixing powders
2.2 Ti/α-TCP 复合材料
当Ti与α-TCP的体积比为8:2时,烧结试样开裂而无法测试压缩性能,可能是由于钛晶粒长大剧烈而导致材料强度大幅降低,因此不再考虑Ti与α-TCP的体积比为8:2的复合材料。图3所示为50Ti/α-TCP,60Ti/α-TCP和70Ti/α-TCP混合粉末在不同温度下放电等离子烧结后所得Ti/α-TCP复合材料的抗压强度,表1所列为各复合材料的致密度。由图可见,50Ti/α-TCP和60Ti/α-TCP混合粉末都是在900 ℃烧结后具有最高抗压强度,分别为171.2和289.6 MPa,当温度升高到1 000 ℃时强度略有降低,分别为166.2和245.5 MPa。70Ti/α-TCP复合材料的抗压强度最高,在900 ℃烧结下抗压强度为411.3 MPa,并且烧结温度升高到1 000℃时,抗压强度仍有小幅增加。

图3 不同温度下烧结的Ti/α-TCP复合材料抗压强度Fig.3 Compressive strength of Ti/α-TCP composites sintered at different temperatures

表1 不同温度下烧结的Ti/α-TCP复合材料致密度Table 1 Relative density of Ti/α-TCP composites sintered at different temperatures
图4所示为不同温度下烧结的70Ti/α-TCP复合材料XRD谱及局部放大图。从图看出,当烧结温度为800 ℃时,70Ti/α- TCP复合材料仍然由α-TCP和Ti组成;当温度升高到900 ℃时,Ti全部被氧化成Ti6O;而当温度升高到1 000 ℃时,Ti6O进一步氧化成Ti3O相。这是由于钛在烧结过程中被磷酸三钙中的氧元素氧化,也可能是烧结气氛中低含量的氧导致钛被氧化。因此,为了避免化学反应生成氧化物脆性相而导致材料强度降低,SPS温度应不超过900 ℃。
对于同一成分的Ti/α-TCP复合材样品,随烧结温度从800 ℃升到900 ℃,由于致密度增加,两相之间烧结更致密,因此抗压强度提高。当烧结温度升到1 000 ℃时,50Ti/α-TCP和60Ti/α-TCP复合材料的抗压强度略有下降,是由于各反应产物之间的热物理性能差异,导致烧结冷却过程中试样内部产生热错配应力而诱发微裂纹,且生成的产物都是脆性相,导致材料的抗压强度降低[13]。而对于70Ti/α-TCP来说,在烧结温度从900 ℃升高到1 000 ℃时抗压强度仍有小幅提高,是因为钛含量增加对提高材料强度的影响大于反应生成新的脆性相降低抗压强度的影响。
图5所示为不同温度下烧结的70Ti/α-TCP复合材料表面及压缩断口SEM形貌。图中较亮的组织为Ti,暗的组织为Ca3(PO4)2,不同温度下烧结的材料表面形貌差别不大,但可看出在900 ℃的烧结温度下,样品孔隙最少。不同温度下烧结的材料,其压缩断口差别较明显,烧结温度为800 ℃时,由于烧结温度过低,Ti和α-TCP之间没有形成冶金结合,且Ti烧结所需的温度低于α-TCP,压缩断口中看到大小不等的块状组织与颗粒,可理解为一定程度上的粉末堆积,大块的为钛,小碎颗粒为α-TCP,没有形成致密的烧结体,导致看不到明显光滑的纯钛区域断口,材料主要为脆性断裂;在900和1 000 ℃下烧结的70Ti/α-TCP复合材料,致密度提高,金属钛区域在压缩时出现一定的塑性变形,导致断口出现部分河流花纹,呈现明显撕裂纹,如图(e)中红色小圆圈内,还有小孔隙和韧窝,而磷酸三钙陶瓷相为脆性断裂,因此70Ti/α-TCP复合材料表现为混合断裂。
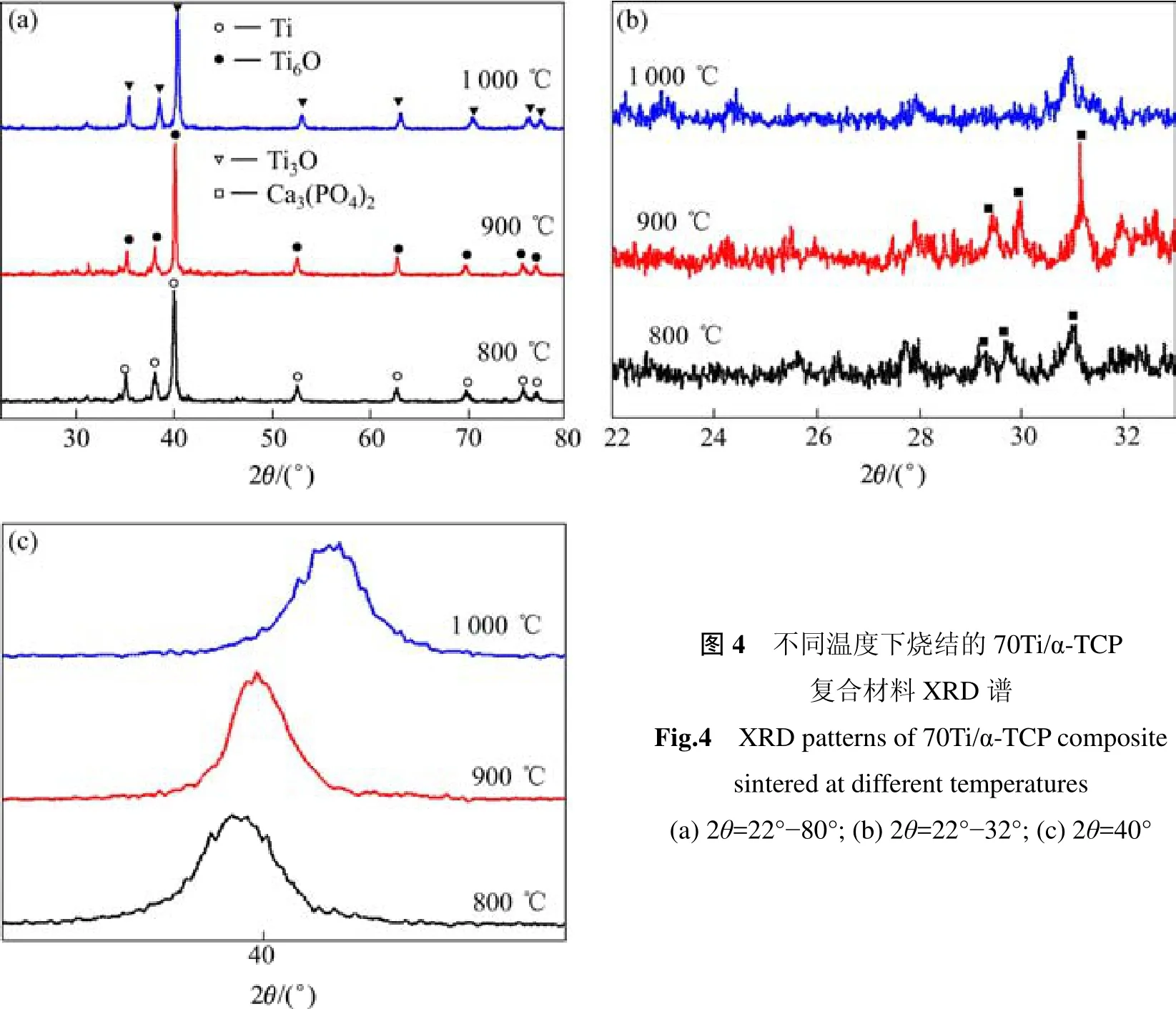

图5 不同温度下烧结的70Ti/α-TCP复合材料表面及压缩断口SEM形貌Fig.5 SEM images of surface (a), (b), (c) and compressive fracture surface (d), (e), (f) of 70Ti/α-TCP composite sintered at different temperatures (a), (d) 800 ℃; (b), (e) 900 ℃; (c), (f) 1 000 ℃
2.3 Ti/α-TCP/钛网复合材料
图6所示为在70Ti/α-TCP混合粉末中加入钛网骨架制备的70Ti/α-TCP/钛网复合材料XRD谱及局部放大图。由图可见,烧结温度为800和900 ℃时,Ti相和α-TCP相基本没有变化,Ti在900 ℃被氧化成Ti6O。温度上升到1 000 ℃时,烧结体中出现Ti3O,Ti4P3和少量TiO2等新相;烧结温度达到1 100 ℃时,α-TCP基本消失,出现Ti2O, Ti4P3, TixPy和少量的TiO2与CaTiO3。图7所示为分别在800,900和1 000 ℃下烧结的70Ti/α-TCP/钛网复合材料中O,P,Ca和Ti元素的线扫能谱图。从图中看出,800 ℃烧结的材料中,P,Ca和Ti元素含量在金属和陶瓷两相界面发生突变,烧结温度为900 ℃时,这些元素的含量变化减缓,当温度达到1 000 ℃时,变化更加平缓,特别是P元素基本上没有变化。
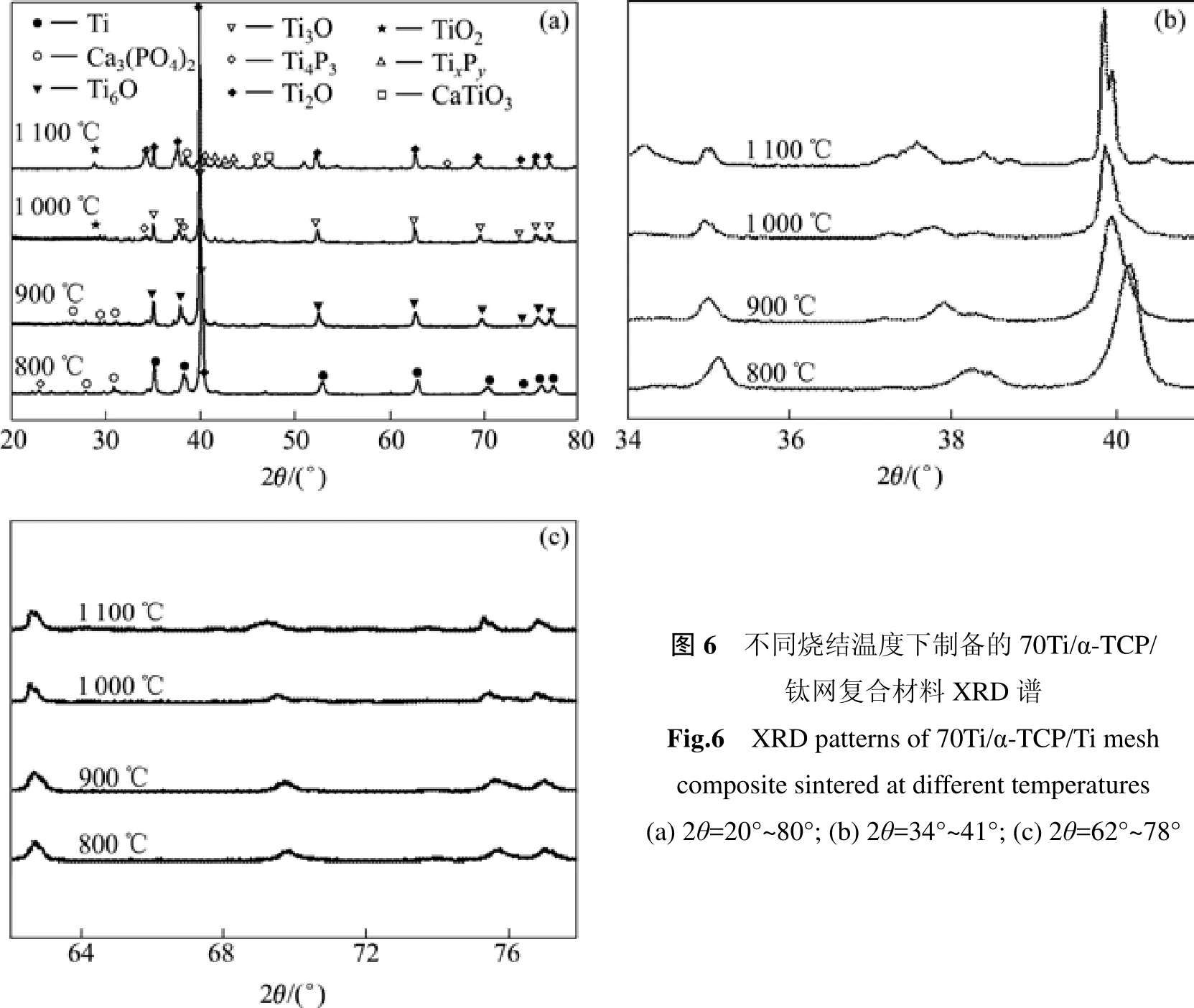

图7 不同温度下烧结的70Ti/α-TCP/钛网复合材料中O,P,Ca 和Ti元素的线扫图Fig.7 O, P, Ca and Ti elment profiles (EDX) in 70Ti/α-TCP/Ti mesh composite sintered at 800 ℃ (a) 900 ℃ (b) and 1 000 ℃ (c)
添加钛网骨架的材料相比未添加钛网出现更多的反应产物,图6(a)中纯钛与钛氧化物的衍射峰差别不明显,但从钛和钛氧化物主峰角度附近的放大图可看到明显的区别。当温度上升到1 000 ℃时,α-TCP开始与Ti发生反应,产生新相Ti3O,Ti4P3和少量TiO2。首先,α-TCP中的氧元素扩散到两相界面使钛发生氧化[14],最终氧化成TiO2,此时氧的扩散速度降低[15]。随烧结温度升高,钛的氧化程度提高,当烧结温度升高到1 100 ℃时,α-TCP基本反应完全,并出现新相TixPy和少量CaTiO3。由于α-TCP在复合物中的含量较低,较低烧结温度下α-TCP相的衍射峰不明显,因此高温反应后产生的新相的峰也不明显,基本观察不到α-TCP相的峰。烧结过程中Ti和α-TCP发生反应主要是通过P元素扩散的方式[16],可用Mondal等[17]的理论来说明:Ca3(PO4)2在高温下分解成CaO和P2O5,P2O5再与Ti反应生成TixPy和TiO2,TiO2与CaO进一步反应生成CaTiO3,剩余的P2O5在高温下挥发。因此,为了最大程度地抑制Ti与α-TCP发生反应生成新相,从而保持材料的最优性能,70Ti/α-TCP/钛网复合材料的最佳烧结温度应为900 ℃。
图8所示为在900 ℃烧结的70Ti/α-TCP/钛网复合材料横截面SEM形貌,可见钛网均匀分布在70Ti/α-TCP中,且没有出现明显孔隙和裂纹。图9所示为在不同温度下烧结的70Ti/α-TCP/钛网复合材料抗压强度,随烧结温度由800 ℃升高到1 100 ℃,抗压强度先增大后减小,烧结温度为900 ℃时材料的抗压强度达到最大值590 MPa,在1 100 ℃烧结时抗压强度最小,为232 MPa。

图8 900 ℃下烧结的70Ti/α-TCP/钛网复合材料截面SEM形貌Fig.8 SEM image of the cross section of 70Ti/α-TCP/Ti mesh composite sintered at 900 ℃

图9 不同温度下烧结的70Ti/α-TCP/钛网复合材料抗压强度Fig.9 Compressive strength of 70Ti/α-TCP/Ti mesh composite sintered at different temperatures
以层状堆垛钛网作为骨架可提高70Ti/α-TCP复合材料的强度,在烧结温度为900 ℃时尤为明显,抗压强度从375.8 MPa升高到590 MPa。有以下几方面的原因:1) 在样品烧结致密度较高的情况下,钛骨架均匀紧密分布在基体中,相对于金属陶瓷复合粉末,钛网的刚度较大,可提高复合材料的强度[18];2) 当复合材料在应力作用下断裂失效时,钛网作为骨架在一定程度上对抗材料失效,消耗能量,从而提高材料的强度;3) 压缩过程中,钛网和Ti/α-TCP粉末之间的烧结致密性、 界面之间的摩擦和机械咬合进一步抵抗材料失效,从而提高材料的抗压强度[19]。当烧结温度超过900 ℃时,70Ti/α-TCP/钛网复合材料的抗压强度显著降低,这是由于脆性反应产物对材料的影响进一步加大,同时高温下晶粒长大也使强度降低。
图10所示为900 ℃下烧结的70Ti/α-TCP/钛网复合材料在模拟体液中浸泡14 d后的表面形貌与能谱分析。从图10(a)可明显看出材料表面沉积大量小颗粒,Ti和α-TCP混合两相区域的沉积物厚度明显大于钛网区域,使得钛网和70Ti/α-TCP的边界易于区分。从图10(b)可看出沉积物为小球状颗粒,小裂纹为干燥收缩所致。对沉积物进行能谱分析(图10(c)),结果显示沉积物主要为富钙和富磷的磷灰石,Ca与P的原子比为1.6。从图10(d)可鉴定表面沉积物为磷灰石,说明样品与模拟体液发生了化学反应[20]。Ti和SBF溶液中的—OH−离子在材料表面形成Ti-OH基团,为磷灰石的形成提供有利的形核位置[21]。Ti-OH基团与SBF溶液中的Ca2+生成钛化钙产物,再结合P离子生成无定型的磷灰石[22]。从生物学的角度来说,由于模拟体液与人体血浆的离子浓度相近,样品在模拟体液中生成的磷灰石与人体骨的结构和化学组成也相似,生物材料植入活体中生成具有生物活性的类骨磷灰石是植入材料与活体骨之间发生化学键合的必要条件,可见本研究中的复合材料具有很好的生物活性。活性,可作为骨替换材料。

图10 70Ti/α-TCP/钛网复合材料在模拟体液中浸泡14 d后的表面形貌与能谱分析Fig.10 SEM images and EDX profiles of 70Ti/α-TCP/Ti mesh composite after immersion in SBF for 14 days (sintered at 900 ℃) (a) Surface SEM images of composite; (b), (c), (d) SEM images, EDX profiles and XRD pattern of the surface deposition, respectively
3 结论
1) Ti/α-TCP复合材料的抗压强度随钛含量增加而提高。在烧结温度为1 000 ℃时,70Ti/α-TCP复合材料的抗压强度达到426.8 MPa。
2) 在Ti/α-TCP复合材料的高温烧结过程中,Ti与α-TCP发生化学反应,温度越高,反应越复杂,为了避免化学反应而导致材料强度降低,SPS的温度应控制在900 ℃以下。
3) 在70Ti/α-TCP 中添加钛网作为骨架制备70 Ti/α-TCP/钛网复合材料,抗压强度提高,在烧结温度为900 ℃时抗压强度为590 MPa。且具有优异的生物
REFERENCES
[1] KOLK A, HANDSCHEL J, DRESCHER W, et al. Current trends and future perspectives of bone substitute materials-From space holders to innovative biomaterials[J]. Journal of Cranio-Maxillofacial Surgery, 2012, 40(8): 706−718.
[2] KHORASANI A M, GOLDBERG M, DOEVEN E H, et al. Titanium in biomedical applications—properties and fabrication: a review[J]. Journal of Biomaterials and Tissue Engineering, 2015, 5(8): 593−619.
[3] 苏冰. 生物活性陶瓷/钛复合植入体的构建及性能研究[D].上海: 上海交通大学, 2006. SU Bing. Preparation and characteristics of bioactive ceramics/ titanium composites and their porous implant[D]. Shanghai: Shanghai Jiaotong University, 2006.
[4] LEGEROS R Z. Calcium phosphate-based osteoinductive materials[J]. Chemical Reviews, 2008, 108(11): 4742−4753.
[5] SURMENEV R A, SURMENEVA M A, IVANOVA A A. Significance of calcium phosphate coatings for the enhancement of new bone osteogenesis–A review[J]. Acta Biomaterialia, 2014, 10(2): 557−579.
[6] DENRY I, KUHN L T. Design and characterization of calcium phosphate ceramic scaffolds for bone tissue engineering[J]. Dental Materials, 2016, 32(1): 43−53.
[7] HUANG Jincong, NI Yongjin, WANG Zhoucheng. Preparation of hydroxyapatite functionally gradient coating on titanium substrate using a combination of electrophoretic deposition and reaction bonding process[J]. Surface & Coatings Technology, 2010, 204(21/22): 3387−3392.
[8] 赵玉涛, 程晓农, 戴起勋, 等. 射频磁控溅射制备HA(+ ZrO2+Y2O3)/Ti6Al4V复合生物活性涂层[J]. 无机材料学报, 2006, 21(5): 1237−1243. ZHAO Yutao, CHENG Xiaonong, DAI Qixun, et al. HA(+ ZrO2+Y2O3)/Ti6A14V bioaetive composite coating fabrieated by RF magnetron sputtering[J]. Journal of Inorganic Materials, 2006, 21(5): 1237−1243.
[9] TANIGAWA H, ASOH H, OHNO T, et al. Electrochemical corrosion and bioactivity of titanium–hydroxyapatite composites prepared by spark plasma sintering[J]. Corrosion Science, 2013, 70(3): 212−220.
[10] GEMELLI E, JESUS J D, CAMARGO N H A, et al. Microstructural study of a titanium-based biocomposite produced by the powder metallurgy process with TiH2 and nanometric β-TCP powders[J]. Materials Science and Engineering: C, 2012, 32(4): 1011−1015.
[11] JURCZYK K, NIESPODZIANA K, JURCZYK M U, et al. Synthesis and characterization of titanium-45S5 Bioglass nanocomposites[J]. Materials & Design, 2011, 32(5): 2554−2560.
[12] CARRODEGUAS R G, DE AZA S. α-Tricalcium phosphate: Synthesis, properties and biomedical applications[J]. Acta Biomaterialia, 2011, 7(10): 3536−3546.
[13] 宁聪琴, 周玉, 贾德昌. 钛/羟基磷灰石生物复合材料的力学性能与生物学行为[J]. 硅酸盐学报, 2000, 28(5): 483−486. NING Congqing, ZHOU Yu, JIA Dechang. Mechanical properties and biological behavior of titanium/hydroxyapatite biocomposites[J]. J Chin Ceram Soc, 2000, 28(5): 483−486.
[14] ARIFIN A, SULONG A B, MUHAMAD N, et al. Material processing of hydroxyapatite and titanium alloy (HA/Ti) composite as implant materials using powder metallurgy: A review[J]. Materials & Design, 2014, 55(6): 165−175.
[15] NELEA V, MOROSANU C, BERCU M, et al. Interfacial titanium oxide between hydroxyapatite and TiAlFe substrate[J]. Journal of Materials Science: Materials in Medicine, 2007, 18(12): 2347−2354.
[16] JI Huaxia, PONTON C B, MARQUIS P M. Microstructural characterization of hydroxyapatite coating on titanium[J]. Journal of Materials Science: Materials in Medicine, 1992, 3(4): 283−287.
[17] MONDAL D, NGUYEN L, OH I, et al. Microstructure and biocompatibility of composite biomaterials fabricated from titanium and tricalcium phosphate by spark plasma sintering[J]. Journal of Biomedical Materials Research-Part A, 2013, 101A (5): 1489−1501.
[18] JANSEN J A, VON RECUM A F, VAN DER WAERDEN J, et al. Soft tissue response to different types of sintered metal fibre-web materials[J]. Biomaterials, 1992, 13(13): 959−968.
[19] XU H H K, QUINN J B, TAKAGI S, et al. Strong and macroporous calcium phosphate cement: Effects of porosity and fiber reinforcement on mechanical properties[J]. Journal of Biomedical Materials Research, 2002, 57(3): 457−466.
[20] ZHANG Lei, HE Zhengyuan, ZHANG Yueqin, et al. Enhanced in vitro bioactivity of porous NiTi–HA composites with interconnected pore characteristics prepared by spark plasma sintering[J]. Materials & Design, 2016, 101(5): 170−180.
[21] LI Panjian, KANGASNIEMI I, DE GROOT K, et al. Bonelike hydroxyapatite induction by a gel-derived titania on a titanium substrate[J]. J Am Ceram Soc, 1994, 77(5): 1307−1312.
[22] TAKADAMA H, KIM H M, KOKUBO T, et al. TEM-EDX study of mechanism of bonelike apatite formation on bioactive titanium metal in simulated body fluid[J]. Journal of Biomedical Materials Research, 2002, 57(3): 441−448.
(编辑 汤金芝)
Mechanical properties and bioactivity of spark plasma sintered titanium/tricalcium phosphate biocomposites
GUO Yu, LIU Yong, TAN Yanni, ZHOU Rui, WEI Wei, TANG Hanchun
(State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China)
Ti/α-TCP biocomposites with different titanium contents were fabricated by spark plasma sintering (SPS), and the microstructures and interfacial reactions of the composites were investigated by scanning electron microscopy (SEM), energy dispersive spectropy (EDS) and X-ray diffraction analyses (XRD). The compressive strength and bioactivity in a simulated body fluid (SBF) of the composites were investigated, and the effects of sintering temperature and titanium content on the structure and properties of composites were also studied. The results show that some interfacial reactions between Ti and α-TCP appear when the sintering temperature is above 900 ℃, and higher strength can be obtained with higher titanium content. More complex interfacial reactions appear when titanium mesh scaffold is added to the mixed powders, and more reactions products are obtained at higher temperature. The main reaction products are Ti oxides, TixPyand CaTiO3in the composite when the sintering temperature is 1 100 ℃. The composites of 70Ti/α-TCP incorporated with Ti mesh sintered at 900 ℃ shows the highest compressive strength of 590 MPa and a thick apatite layer formed on the composites surface after being immersed in SBF for 14 days, indicating that it has a great potential application value as bone implant replacement material.
Ti/α-TCP biocomposites; titanium mesh; spark plasma sintering; compressive strength; bioactivity
R318.08
A
1673-0224(2017)04-576-09
国家自然科学基金资助项目(51504295)
2017−02−22;
2017−03−20
谭彦妮,副教授,博士。电话:0731-88877669;E-mail: tanyanni@csu.edu.cn
