NaCl含量对盐助燃烧合成制备超细TiAl粉体的影响及作用机理
2017-09-06袁觅文董鹏喇培清欧玉静
袁觅文,董鹏,喇培清,欧玉静
(兰州理工大学 省部共建有色金属先进加工与再利用国家重点实验室,兰州 730050)
NaCl含量对盐助燃烧合成制备超细TiAl粉体的影响及作用机理
袁觅文,董鹏,喇培清,欧玉静
(兰州理工大学 省部共建有色金属先进加工与再利用国家重点实验室,兰州 730050)
以NaCl为稀释剂,KClO3为发热剂,Ti粉和Al粉为原料,用自蔓延燃烧合成法制备TiAl粉体,用XRD、EDS、SEM等测试分析手段对TiAl粉体进行表征。结果表明:燃烧合成的产物中主要物相为TiAl和少量的Ti3Al。当稀释剂NaCl的质量分数k值从0%增加到15%时,TiAl粉体的平均粒度从1.7 μm降低到0.7 μm。且随NaCl含量增加,其包裹保护作用增强,粉末产物中氧元素含及氧化物TiO2含量降低。当NaCl含量为15%时,产物中TiO2的含量为0.9%。在反应过程中,由于NaCl的传质作用,使得反应得以更加充分地进行。当NaCl加入量为15%时,TiAl相的质量分数达到最大值85.2%。
超细;TiAl粉体;NaCl含量;稀释剂;助盐燃烧合成法
TiAl金属间化合物由于具有低密度、高熔点、高的比强度和高的抗高温蠕变等优良性能,被广泛应用在发动机高压压缩叶片、高压涡轮叶片、排气管、喷嘴等部件上,成为最具竞争力的结构材料之一。目前制备TiAl金属间化合物的方法有金属熔炼、机械合金化、粉末冶金等方法[1−3]。美国Bhattacharya等通过高能球磨法制备得到纳米晶TiAl合金粉末,但合金粉末的产率只有65%~80%[4]。北京航空航天大学LIU等采用氧等离子体−金属反应法制备出TiAl合金纳米粉末,其平均粒径可达30 nm。但制备后的TiAl合金纳米粉末中Ti的含量明显低于母合金中Ti的含量,造成资源浪费,而且在纳米粉末颗粒表面形成了厚度约2 nm~3 nm的非晶态氧化铝层,影响了纯度[5]。以上方法各有弊端。盐助燃烧合成法是一种通过无机盐促进反应时的物质传输使得反应得以快速充分进行的制备材料的方法,且在制备超细粉体方面有很广泛的应用[6−9]。而本课题组前期研究表明[10−12],盐助燃烧合成能提高粉末产物纯度和降低粉末粒度,故本研究采用盐助燃烧合成法方法制备TiAl粉体,以期得到纯度更高和粒度更细小的粉体,并探讨燃烧合成中盐辅助对钛化物影响的作用机理。
1 实验
1.1 TiAl金属间化合物粉体的制备
TiAl粉体通过自蔓延反应合成制备,其主要的化学反应为:
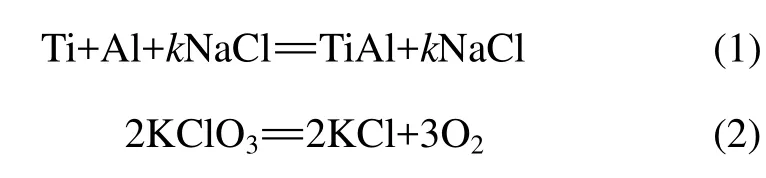
反应式(1)中的k为反应物总质量的质量分数,k分别为0%,5%,10%和15%。
将反应物的物料质量定为500 g,每组中加入5%的KClO3作为反应的发热剂,同时按比例加入不同质量的NaCl。先将物料进行简单的手工混合,然后再放入行星式球磨机中进行8 h球磨。磨球材质为氧化锆,球料比为2:1,转速为150 r/min。球磨完成后,将物料在压料机中压成圆饼坯,尺寸为直径80 mm,厚约为30 mm。随后将坯料放入高压反应釜中,在坯料上面放置一块2 g的KClO3作引燃剂,然后密封反应釜,开始加热。将反应釜中的空气用氩气洗净后,冲入2 MPa氩气作为保护气体。当釡内温度上升到约260 ℃时,引燃剂燃烧引发坯料发生自蔓延反应。反应结束后待反应釜冷却,取出反应产物。产物表面呈灰黑色,内部为银灰色,并呈现金属光泽。随后将产物粉碎成细粉末状,倒入大烧杯中用蒸馏水进行充分搅拌,以溶解掉产物中的NaCl等盐渍,洗涤后将产物用真空泵进行抽滤,从滤纸上取得所需产物。
1.2 分析与测试
产物粉末用D/MAX−2400型X射线衍射仪进行物相分析,扫描速度为2 (°)/min,角度范围为10°~90°,工作电压和电流分别为40 kV、150 mA;取少量产物置于5 mL试管中,将试样管放入超声波清洗器中进行1 h超声处理,使粉体在乙醇中均匀分散。处理完成后,用吸管吸取少量液体滴到扫描电子显微镜的铜质载物台上,待酒精完全挥发后,即可用JSM−6701F冷场发射型扫描电镜分析产物的微观形貌和成分;用Image-Pro Plus和Origin 软件分析统计SEM图片得到粉末粒度,每个组份统计5张照片。
2 实验结果
将洗涤后得到的产物进行XRD分析,其图谱如图1所示。由图1可知,燃烧合成法得到四个组份的产物中以FCC结构的TiAl相为主,此外还有少量的Ti3Al相,未发现氧化物相TiO2和Al2O3的衍射峰。TiAl和Ti3Al均属于TiAl系反应产物的最终相,TiAl3、TiAl2等中间产物相并没有被检测到,说明整个反应进行得比较完全。依据XRD结果对产物各物相的质量分数进行分析,其结果如表1所列。由表可知,随NaCl含量增加,TiAl相的质量分数增加,氧化物TiO2含量降低。对主体产物相TiAl的XRD衍射图谱进行分析,通过谢乐公式计算出TiAl相的平均晶粒尺寸,结果如表1所列。从表中可以看出TiAl相的平均晶粒尺寸随NaCl含量增加而减小,但变化不大,其尺寸在50~100 nm范围内,属于纳米晶。
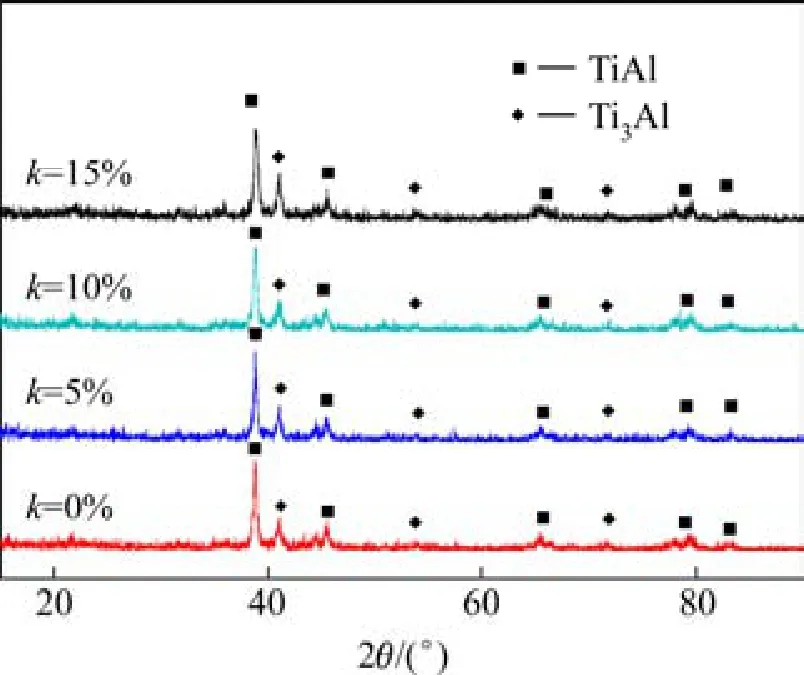
图1 加入不同量的NaCl反应后产物的XRD谱Fig.1 XRD patterns for TiAl powders with different NaCl contents

表1 不同NaCl含量产物中TiAl相的平均晶粒尺寸及各相的质量分数Table 1 The TiAl grain size and the mass fraction of phases in the product with different NaCl contents
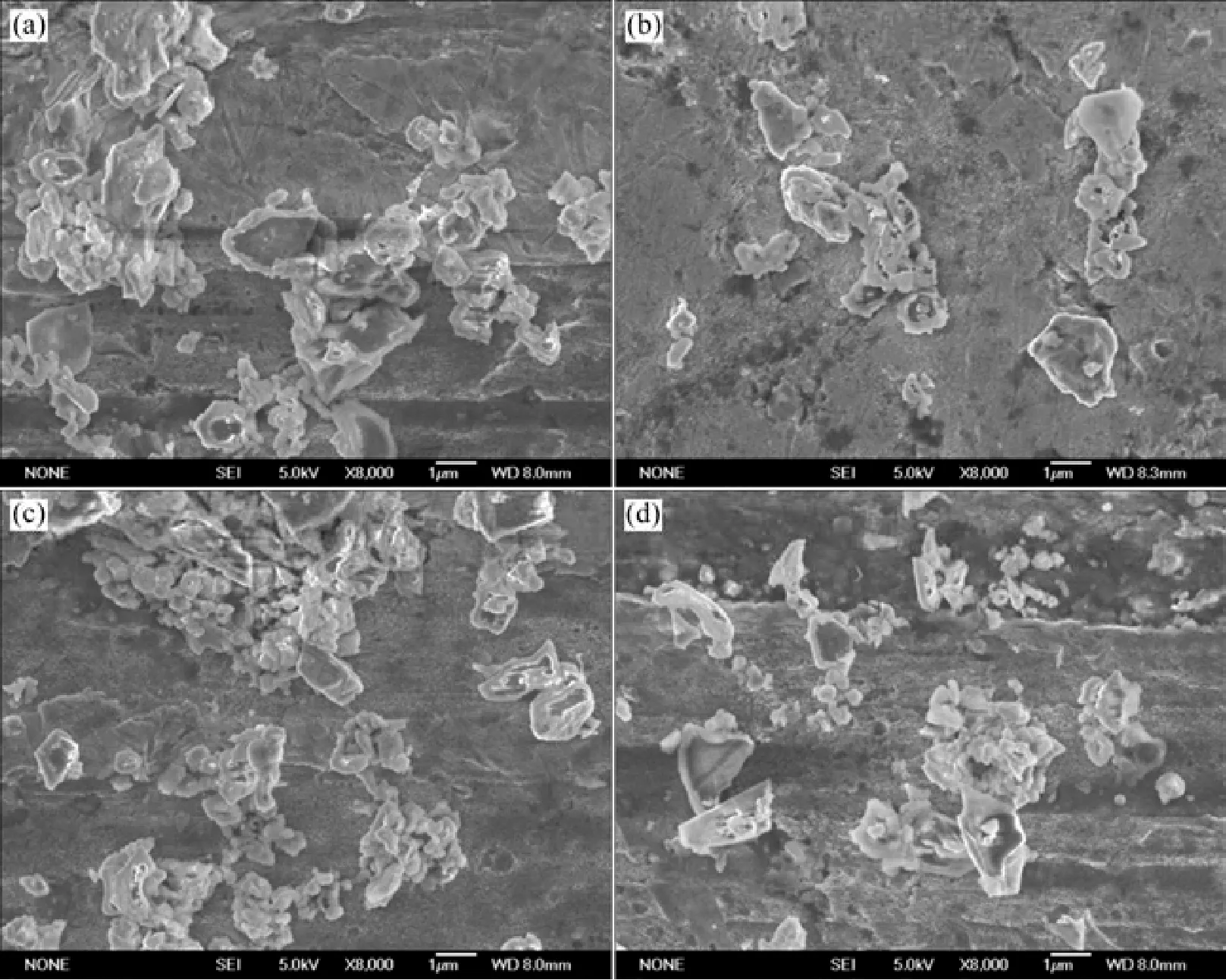
图2 不同NaCl含量TiAl粉末的SEM图Fig.2 SEM images of TiAl powders with different NaCl contents (a) k=0; (b) k=5%; (c) k=10%; (d) k=15%
图2为加入不同量的NaCl稀释剂后,粉末产物的扫描电镜图。由图可以看出,粉碎后产物的颗粒形状呈不规则的多面体形貌,颗粒的棱角较为明显。另外,颗粒粒度分布较广,既有颗粒尺寸为2~3 μm的大颗粒,也有亚微米级的细小颗粒。图2(a)为不加入NaCl稀释剂,反应后产物的颗粒形貌,此时颗粒较大,平均颗粒尺寸约为1.7 μm。如图2(b)~(d)所示,随NaCl含量增加,细小颗粒明显增多,产物颗粒出现细化趋势。
图3和表2为对反应产物进行EDS能谱分析的结果。由EDS结果可以看到,反应产物中主要含有Ti,Al和O元素。由于EDS对轻质元素检测不准确,故O元素含量变化只做参考,不做定量分析。计算得到Ti,Al原子比例较大地偏离了理论比例1:1,在NaCl含量为10%的时候最高,Ti/Al原子比例达到0.77。但整体来说,Ti、Al原子比随NaCl含量增加而呈现上升趋势。从能谱分析结果中可以看出O元素的含量随NaCl含量的增加而降低,此结果与XRD结果基本一致。
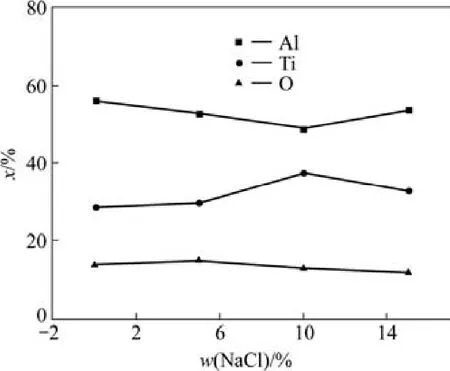
图3 不同NaCl含量反应产物中主要元素的EDS结果曲线Fig.3 The curves of primary element contents in products through EDS with different NaCl contents
图4所示为将洗涤后的TiAl粉末产物进行粒度分析后得到的柱状图。粒度分布的结果大致与扫描电镜图片得到的结果一致:反应得到的TiAl颗粒的粒度范围较广,颗粒尺寸从几百纳米到几微米不等,但整体符合正态分布规律。从图4(a)可以看出,当反应不加稀释剂NaCl时,产物颗粒较大,且粒度分布范围广。由图4(b)~(d)可看出,随NaCl含量增加,产物颗粒粒度分布逐渐集中,且亚微米级别的细小颗粒所占的比例增大。不同NaCl含量下的TiAl颗粒的平均粒度如图5所示。随NaCl含量增加,产物颗粒的平均粒度从1.7 μm降低到0.7 μm。

表2 不同NaCl含量TiAl材料产物的EDS分析结果Table 2 EDS results of TiAl products with different NaCl contents

图4 不同NaCl含量TiAl材料的粒度分布Fig.4 The histogram of particle size distribution of TiAl powders with different NaCl contents (a) k=0; (b) k=5%; (c) k=10%; (d) k=15%
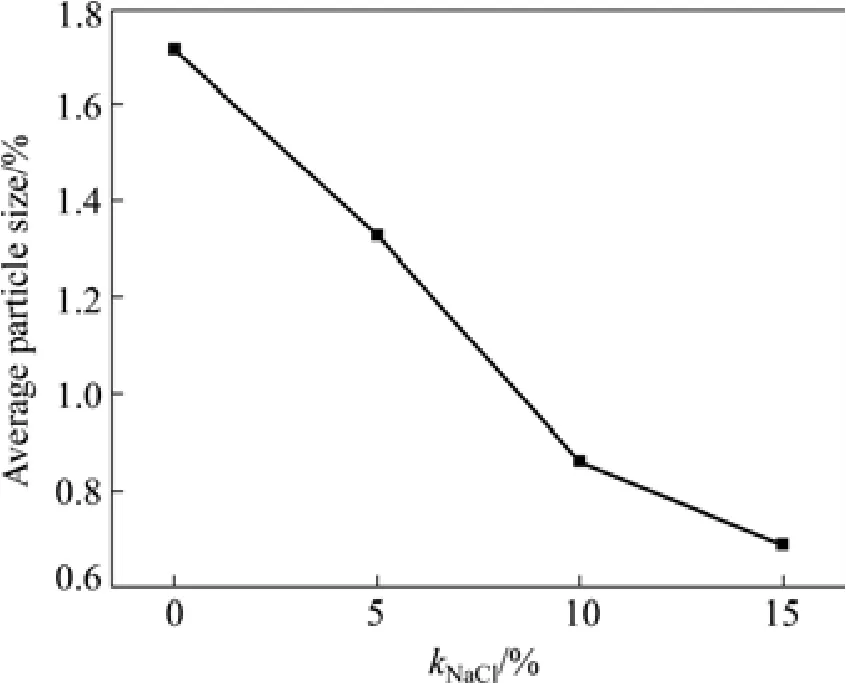
图5 不同NaCl含量TiAl材料的平均粒度Fig.5 The average particle size of TiAl powders with different NaCl contents
3 讨论
对粉末产物进行检测发现产物的主要物相为TiAl和TiAl3。TiO2和Al2O3相在XRD中未检测到,但在EDS结果中10%左右的O原子比例和Ti,Al原子比例的偏离说明有氧化物存在。而在实际的燃烧反应过程中,反应不是一步而成的,而是分为若干个步骤,所以在反应产物中会有中间相存在[13]。其反应步骤如式(3)~(5)所示:
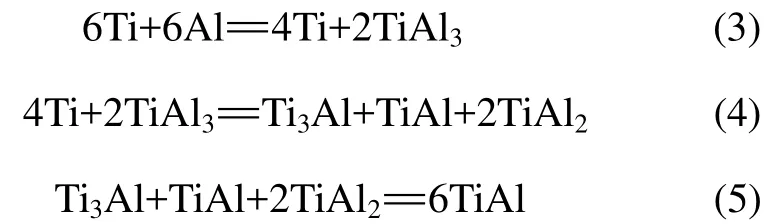
TiAl系反应的动力学一般用球壳模型来描述[16],反应过程如图6所示。整个反应过程可以大致分为三个阶段。第一个阶段为反应未开始的固相扩散阶段。在反应未开始之前,温度可超过200 ℃,此时的反应物料之前已发生固相扩散反应,反应生成微量的TiAl3。但由于反应微弱,其影响可以忽略不计。第二阶段为燃烧反应开始阶段。当温度上升到约250 ℃时,引燃剂自燃,使得局部反应温度迅速达到反应温度,反应物开始反应。在此温度下,发热剂KClO3分解产生的热量,再加上反应本身放出的热量,反应的绝热温度Tab>2 000 K,使得反应迅速并蔓延至整个物料。此时,反应物中的Al粉、稀释剂NaCl和KClO3分解后产生的KCl都处于熔融状态。而融化的Al与未融化的Ti颗粒有很好的润湿性,故Al液在毛细管力的作用下向Ti颗粒周围渗透,大幅增加了Al液与Ti的接触面积。此阶段Ti与Al的大面积接触,生成TiAl系反应的唯一初生相Ti3Al[14−15],如式(3)所示。此反应持续且迅速进行,直到Al液消耗殆尽为止。此阶段的液相正好为整个反应的质量和能量传输提供了有利条件。反应体系中液相的增多,使得扩散机制大大增强。与时间呈线性关系。第三阶段为燃烧反应后期。由于Al在Ti中的固溶度远大于Ti在Al中的固溶度,故此阶段,Al是主要的扩散元素[16]。此时,已生成的TiAl3中的Al继续向内扩散,与内部的Ti颗粒结合,在Ti颗粒表面反应生成Ti3Al、TiAl和TiAl2。而此时的反应体系中仍然存在TiAl3,故在此阶段Ti、TiAl2、TiAl、TiAl3和Ti3Al之间会存在竞争性扩散,最后将Ti和TiAl3都先后耗尽。然后Ti3Al和TiAl2相继减少,TiAl相不断增加,直至反应进行完全。TiAl相的长大速率与反应时间呈t−1/2的关系[17],所以越到反应后期,反应速率越慢,故会有未反应的Ti3Al与TiAl一同被保留下来。此过程的化学反应方程如式(5)。由于反应体系自身放出的热量不足以维持反应蔓延,故在反应物料中加入KClO3作为发热剂[18],放出热量以维持反应。KClO3分解时会产生氧气和KCl。KCl在体系中的作用和NaCl一样(作为一种稀释剂)。KCl和NaCl的熔点略高于Al,所以在反应开始时,三者几乎同时融化为液相,为反应的质量和能量的传输提供了介质,促进了反应的进行。而在反应后期,离反应中心区域较远的KCl和NaCl因温度较低而首先凝固,将体系中的液相分隔开来,阻碍了物质的传输。不仅如此,还会使得晶粒的增长受到限制,最终产物中的颗粒细小。且随NaCl含量增加,这种阻碍作用变明显,粉末颗粒尺寸减小,如图2所示。另外,KClO3分解产生的一部分氧气会向外溢出;另一部分保留在体系内,形成气孔;还有一部分氧气会与Ti、Al反应生成TiO2和Al2O3,所以EDS结果显示有O存在。由于氧化物含量太低,从XRD结果中并没有检测出氧化物相的特征峰。且由于反应后期凝固的NaCl和KCl会对产物有包裹作用,阻碍氧气与产物接触,从而限制了氧化物的产生。如图3所示,O元素含量随NaCl含量增加而下降。
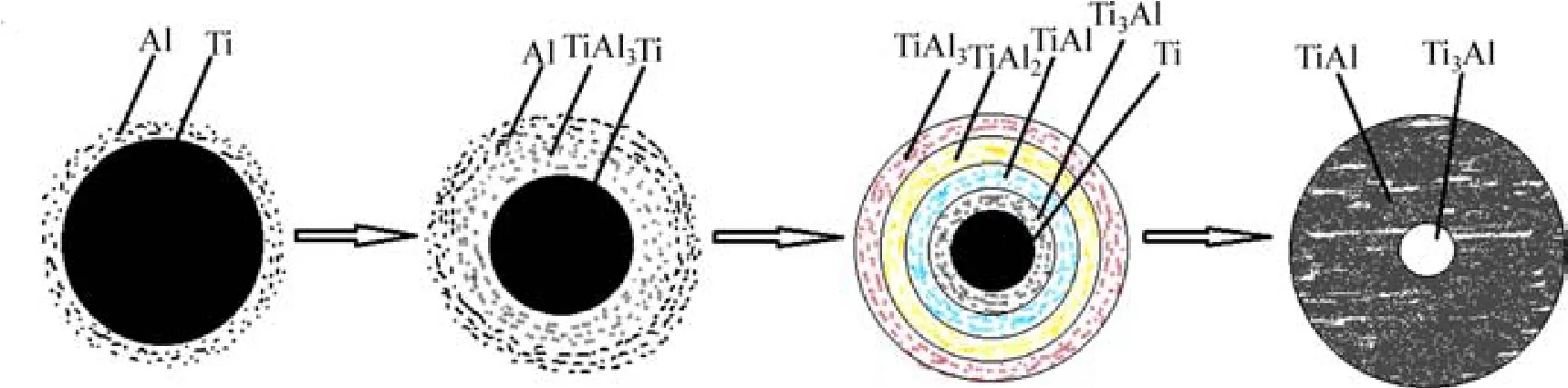
图6 Ti-Al体系的反应机理Fig.6 The reaction mechanism of Ti-Al
NaCl的加入主要有三个作用:一方面,NaCl作为一种稀释剂加入反应物料中,在反应时融化为液态。它作为液态介质的一部分,大大促进了整个反应体系的物质和能量的传递[17],使得反应得以迅速而充分地进行。这也是随NaCl含量增加,中间产物相Ti3Al呈降低趋势的原因。另一方面,在反应结束后,NaCl和KCl都结晶保留在产物中。而NaCl与产物界面的结合力较小,从而使整块产物式样易于粉碎。随NaCl含量增加这种易碎效果更明显。最后,NaCl作为一种稀释剂加入,在熔化过程中会吸热,使得反应体系的整体温度降低[19],反应产物的冷却时间缩短。这一原因造成了晶粒的尺寸随NaCl含量的增加而减小。
影响TiAl粉末粒度的因素主要有两方面:一方面是燃烧产物的易碎程度,另一方面产物晶粒的尺寸。对于产物的易粉碎性,主要受产物中缺陷的影响:比如残留氧气形成的气孔,和凝固的NaCl与产物因冷却过程中体积变化不一致而产生的孔隙及裂纹,增大了其易粉碎性能。同时,NaCl加入对晶粒尺寸也有影响。在反应前期,融化的NaCl的可以提供更多的液相介质,增强了原子的扩散,有利于晶体的异质形核数量,从而降低晶粒尺寸。综合以上两方面因素可知,随NaCl含量增加,TiAl颗粒的粒度显著降低,达到了亚微米级,如图5所示。
4 结论
1) 以NaCl为稀释剂,通过盐助燃烧合成法制备TiAl金属间化合物粉末,其主要的产物为TiAl和少量的Ti3Al。但由于有发热剂KClO3存在,反应产物中还有少量的TiO2。
2) 随NaCl含量增加,由于其包裹保护作用,制备出的TiAl粉体纯度升高,当NaCl含量为15%时,TiAl质量分数为85.2%。
3) 制备得到的TiAl粉末粒度随NaCl含量增加而显著降低,且粒度分布更加集中。当NaCl含量为15%时,颗粒的平均粒度最小,为0.7 μm,粒度达到了亚微米级。
REFERENCES
[1] LI Huizhong, ZHOU Li, WEI Zhang, et al. High temperature deformability and microstructural evolution of Ti-47Al-2Cr-0.2Mo alloy[J]. Journal of Alloys and Compounds, 2010, 508(2): 359−363.
[2] 刘咏, 黄伯云, 贺跃辉, 等. 元素粉末冶金方法制备TiAl基合金[J]. 粉末冶金材料科学与工程, 1999, 4(3): 189−194. LIU Yong, HUANG Boyun, HE Yuehui, et al. Preparation of TiAl alloy elements in powder metallurgy method[J]. Materials Science and Engineering of Powder Metallurgy, 1999, 4(3): 189−194.
[3] 喻吉良, 李中奎, 郑欣, 等. 不同工艺制备的 TiAl 金属间化合物微观组织特征[J]. 稀有金属材料与工程, 2012, 41(11): 2054−2057. YU Jiliang, LI Zhongkui, ZHENG Xin, et al. Microstructure characteristics of TiAl intermetallic compound prepared by different fabrication processes[J]. Rare Metal Materials and Engineering, 2012, 41(11): 2054−2057.
[4] BHATTACHARYA P, BELLON P, AVERNACK R S, et al. Nanocrystalline TiAl powders syndiesized by high-energy ball milling: Effects of milling parameters on yield and contamination[J]. Journal of Alloys and Compounds, 2004, 368(1): 187−196.
[5] LIU T, ZHANG T W, ZHU M, et al. Syndesis and structures of Al-Ti nanoparticles by hydrogen plasma-metal reaction[J]. Journal of Nanoparticle Research, 2012, 14(3): 738−745.
[6] HAYK H N, TAE H L, VLADISLAV R, et al. NaF-assisted combustion synthesis of MoSi2nanoparticles and their densification behavior[J]. Journal of Physics and Chemistry of Solids, 2017, 102: 34−41.
[7] NIU Jing, SHOTA S, YI Xuemei, et al. Fabrication of AlN particles and whiskers via salt-assisted combustion synthesis[J]. Ceramics International, 2015, 41B(3): 4438−4443.
[8] YANG Jun, LI Xiaoci, DENG Xizhu, et al. Salt-assisted solution combustion synthesis of ZnFe2O4nanoparticles and photocatalytic activity with TiO2(P25) as nanocomposite[J]. Journal of the Ceramic Society of Japan, 2012, 120(1408): 579−583.
[9] NIU Jing, HARADA Kazuto, SUZUKI Shota, et al. Fabrication of mixed alpha /beta-SiAlON powders via salt-assisted combustion synthesis[J]. Journal of Alloys and Compounds, 2014, 604: 260−265
[10] 李秀萍, 赵荣祥, 李秀荣, 等. 燃烧法快速合成轻质纳米氧化铈及其脱色性能[J]. 中国粉体技术, 2012, 18(4): 10−14. LI Xiuping, ZHAO Rongxiang, LI Xiurong, et al. Combustion method to synthesis of lightweight nanometer cerium oxide and its decoloring performance[J]. China Powder Science and Technology, 2012, 18(4): 10−14.
[11] LA Peiqing, OU Yujing, HAN Shaobo, et al. Effect of carbon content on morphology, size and phase of submicron tungsten carbide powders by salt-assisted combustion synthesis[J]. Rare Metal Materials and Engineering, 2016, 45(4): 0853−0857.
[12] 王小翠, 喇培清, 李贤明, 等. NaCl和KClO3含量对盐助燃烧合成的NiTi粉体组成和结构的影响[J]. 当代化工, 2015, 44(9): 2061−2065. WANG Xiaocui, LA Peiqing, LI Xianming, et al. Effect of NaCl and KClO3content on constitution and structure of NiTi powder prepared by SACS[J]. Contemporary Chemical Industry, 2015, 44(9): 2061−2065.
[13] 李志强, 韩杰才, 赫晓东, 等. 燃烧合成TiAl金属间化合物的反应机制[J]. 稀有金属材料与工程, 2002, 3(1): 4−7. LI Zhiqiang, HAN Jiecai, HE Xiaodong, et al. The reaction mechanism of combustion synthesis of TiAl intermetallic compounds[J]. Rare Metal Materials and Engineering, 2002, 3(1): 4−7.
[14] 王学成, 张小明, 柴惠芬, 等. 燃烧合成TiAl合金结构转变动力学的端部淬火熄灭法分析[J]. 稀有金属材料与工程, 1999, 28(3): 161−165. WANG Xuecheng, ZHANG Xiaoming, CHAI Huifen, et al. Combustion synthesis of TiAl alloy structural transformation kinetics of end quenching method[J]. Rare Metal Materials and Engineering, 1999, 28(3): 161−165.
[15] KATTNER U R, LIN, et al. Thermodynamic assessment and calculation of the Ti-Al system[J]. Metallurgical Transactions APhysical Metallurgy and Materials Science, 1992, 23A(8): 2081−2090.
[16] 杨兵. 元素粉末法制备TiAl基合金[J]. 粉末冶金技术, 1999, 17(4): 286−290. YANG Bing. Powder prepared TiAl base alloy element[J]. Powder Metallurgy Technology, 1999, 17(4): 286−290.
[17] 陈玉勇, 苏勇君, 孔凡涛. TiAl金属间化合物制备技术的研究进展[J]. 稀有金属材料与工程, 2014, 43(3): 757−762. CHEN Yuyong, SU Yongjun, KONG Fantao. Research progress in preparation of tial interemetallic based compound[J]. Rare Metal Materials and Engineering, 2104, 43(3): 757−762.
[18] NERSISYAN H H, LEE J H, et al. A study of tungsten nanopowder formation by selfpropagating high temperature synthesis[J]. Combustion and Flame, 2005, 142(3): 241−248
[19] NERSISYAN H H, LEE J H. The role of the reaction medium in the self propagating high temperature synthesis of nanosized tantalum powder[J]. Combustion and Flame, 2003, 135(4): 539−545.
(编辑 高海燕)
Effect and action principle of NaCl content on superfine TiAl powder prepared by SACS
YUAN Miwen, DONG Peng, LA Peiqing, OU Yujing
(State Key Laboratory of Advanced Processing and Recycling of Nonferrous Metals, Lanzhou University of Technology, Lanzhou 730050, China)
The superfine TiAl powders with different NaCl contents were synthesised by salt-assisted combustion synthesis (SACS) using NaCl as diluent, KClO3as exothermal agent and Ti, Al powders as raw materials. And its composition and characteristic were investigated by XRD, SEM and EDS. The results show that the product mainly contain TiAl phase and a few Ti3Al phase. The particle size of TiAl powder decreases from 1.7 μm to 0.7 μm with increasing mass fraction of NaCl from 0% to 15%. At the same time, the oxide content decreases due to the surrounding effect. The XRD results also show the same tendency of TiO2phase. When the NaCl content is 15%, the content of TiO2in the product is 0.9%. During the reaction, NaCl promotes the transport of substance. Therefore, when the NaCl content is 15%, the mass fraction of TiAl reaches the highest value of 85.2%.
superfine; TiAl powder; NaCl content; diluent agent; SACS
TG146.2
A
1673-0224(2017)04-556-07
国家自然科学基金资助项目(51561020)
2016−11−21;
2016−12−28
喇培清,教授,博士。电话:0931-2976725;E-mail: pqla@lut.cn
