ATP适体接枝Fe3O4纳米粒子的制备及化学发光酶检测应用
2017-09-06严喜鸾陈馨高文菊魏婷婷林月敏艾凡荣
严喜鸾 陈馨 高文菊 魏婷婷 林月敏 艾凡荣
(1南昌大学资源环境与化工学院,南昌330031)(2南昌大学机电工程学院,南昌330031)(3南昌大学转化医学研究院,南昌330031)
ATP适体接枝Fe3O4纳米粒子的制备及化学发光酶检测应用
严喜鸾1陈馨1高文菊1魏婷婷1林月敏1艾凡荣*,2,3
(1南昌大学资源环境与化工学院,南昌330031)
(2南昌大学机电工程学院,南昌330031)
(3南昌大学转化医学研究院,南昌330031)
制备了油酸修饰的Fe3O4纳米粒子,利用盐酸多巴胺对其表面进行氨基化改性,制得水分散性良好的Fe3O4纳米粒子,用X射线衍射、透射电镜、傅里叶变换红外光谱仪、振动样品磁强计和紫外-可见吸收光谱进行表征。随后,将氨基修饰的三磷酸腺苷(ATP)适体接枝到Fe3O4纳米粒子上,结合荧光素酶化学发光法进行ATP的定量检测,并应用于市售酸奶中乳酸菌ATP含量的检测,其灵敏度高、重现性好。各项实验结果表明所制备的Fe3O4纳米粒子是一种分散性好、易分离的载体,其粒径均一、稳定、磁性强、与适体结合性能好,拓展了Fe3O4纳米粒子在分析检测领域的应用。
Fe3O4;纳米粒子;氨基功能化;适体;化学发光检测
0 引言
化学发光是在化学反应过程中产生的光辐射现象,通过检测其发光值可以测定反应物、催化剂、增敏剂、抑制剂等物质的含量[1],化学发光分析法不需外来光源、灵敏度高、检测范围宽、仪器设备简单[2],在食品、环境和临床检测等方面有良好的应用前景[3-6]。适体是通过指数级富集的配体进化技术(systematicevolutionofligandsbyexponential enrichment,SELEX)获得的寡核苷酸链,能以较高的亲和力与配体结合,含有20~80个碱基[7]。近年来,SELEX技术发展迅速[8],适体种类不断增多,应用范围逐渐扩大,不仅可用于血小板衍生因子[9]、多巴胺[10]、黄曲霉毒素[11]等小分子物质的检测,还可用于病毒[12]和细菌[13]等活性物质的检测。将适体固定在磁性纳米粒子、金电极、膜材料、碳纳米材料等支持物上[15-18],可在复杂环境中特异性地识别出目标物,实现物质的分离[19]。其中磁性纳米粒子中的Fe3O4纳米粒子由于具有超顺磁性、生物相容性好且不影响适体的性能,是一种良好的适体结合的载体[20-22]。
本文首先采用共沉淀法,制备了油酸修饰的Fe3O4纳米粒子,采用盐酸多巴胺对其表面进行氨基化改性,获得水溶性Fe3O4纳米粒子。然后以戊二醛为交联剂,将氨基修饰的ATP适体连接到氨基化的Fe3O4纳米粒子上,并通过鸟嘌呤(guanine,G)碱基与苯甲酰甲醛溶液发生瞬时衍生反应产生化学发光[23],定量检测优化Fe3O4纳米粒子的量。采用自制Fe3O4纳米粒子作为载体,先结合ATP适体,再加入不同浓度的ATP,利用荧光素酶进行ATP的化学发光检测,结果表明该方法可用于ATP的定量检测。同时,由于酸奶中含有大量的乳酸菌,单个活菌体内含有10-18mol的ATP[24],而每毫升市售酸奶中乳酸菌的量可达2.65×1010个以上[25],故将自制Fe3O4纳米粒子应用于市售酸奶中乳酸菌ATP的化学发光检测,以此验证自制Fe3O4纳米粒子的实际生物检测应用。实验示意图如图1所示。

图1 ATP适体接枝Fe3O4纳米粒子的制备及化学发光示意图Fig.1Preparation and chemiluminescence schematic presentation of ATP aptamer grafted Fe3O4nanoparticles
1 实验部分
1.1 实验试剂
ATP荧光素酶检测试剂盒购于Thermo Fisher Scientific公司(USA);苯扎氯铵购于上海阿拉丁生化科技股份有限公司;盐酸多巴胺购于上海麦克林生化科技股份有限公司;三羟甲基氨基甲烷、牛血清白蛋白、苯甲酰甲醛、5-腺苷三磷酸二钠盐(ATP);胞苷-5-三磷酸二钠盐(CTP)、鸟苷-5-三磷酸二钠盐(GTP)、尿苷-5-三磷酸三钠盐(UTP)均购于上海爱紫特生物科技有限公司;ATP适体(核酸序列为5-AgAgAACCTgggggAgTATTgCggAggAAggTTTTTTT-3-NH2)由上海生工生物工程有限公司合成;市售酸奶购于江西阳光乳业股份有限公司;其他试剂均购于国药集团化学试剂有限公司。所有的药品都是分析纯。
吡啶清洗液(pH 6.0,吡啶-盐酸);BA杂交液(pH 8.0,20 mmol·L-1三羟甲基氨基甲烷与0.5 mol·L-1氯化钠);WB洗涤液(pH 8.0,7 mmol·L-1三羟甲基氨基甲烷,0.17 mol·L-1氯化钠,0.05%吐温20);AA适体反应液(pH 8.3,20 mmol·L-1三羟甲基氨基甲烷,300 mmol·L-1氯化钠,5 mmol·L-1氯化镁);四丁基氢氧化铵-磷酸缓冲液(pH 8.5,四丁基氢氧化铵-磷酸)。
1.2 实验仪器
集热式恒温磁力搅拌器(DF-101S,河南巩义予华仪器设备有限公司);分析天平(BSA124S,赛多利思科学仪器有限公司);磁性分离器(CS15000,美国Invritroge公司);移液器(德国Eppendorf公司10~1 000 μL);BPCL微弱发光仪(BPCL-1-TGC,中国科学院生物物理研究所);恒温震荡仪(HZ-9211KB,太仓市科教器材厂);超声仪(SB-80,宁波新芝生物科技有限公司);超纯水机(UPHW-111-90T,四川优普超纯科技有限公司)。
1.3 实验方法
1.3.1 Fe3O4纳米粒子的制备
1.税收规划有助于提高企业竞争力。在激烈的市场竞争中,在生产、营销和营销企业中,他知道并利用税收规划,他在竞争中获胜。
称取0.860 g FeCl2·4H2O和2.350 g FeCl3· 6H2O,分别用20 mL超纯水超声溶解,加入250 mL三口烧瓶中,置于恒温油浴锅中,室温搅拌2~3 min;迅速加入3.75 mL NH3·H2O,搅拌均匀,缓慢地滴加0.3 mL油酸,升温至80℃反应1 h。反应完成后,冷却至室温,加入30 mL氯仿,然后加入100 mL NaCl溶液(1 mol·L-1),静置分层,弃上层溶液。用30 mL乙醇洗涤,磁铁收集Fe3O4粒子并分散于氯仿溶液中,制得油酸改性的Fe3O4纳米粒子,备用。
1.3.2 氨基化改性
取1 mL油酸改性的Fe3O4纳米粒子,加入15 mg盐酸多巴胺溶液中(先用20 mL超纯水溶解,随后加入100 μL浓度为1 mol·L-1的盐酸溶液调pH=4.0),振荡5 min;磁性分离去掉废液,乙醇超声分散,离心15 min(转速为12 000 r·min-1),弃上清液,加入10.0 mL超纯水超声分散,制得氨基化改性的Fe3O4纳米粒子,4℃保存。
1.3.3 与ATP适体的连接
取不同量氨基改性的Fe3O4纳米粒子(0.2、0.4、0.6、0.8、1.0、1.2 μmol),吡啶缓冲液清洗3次,磁性分离,加入200 μL戊二醛溶液,室温振荡(转速为170 r·min-1,下同)3 h。分别加入10 pmol ATP适体,室温振荡1 h。WB清洗液洗涤3次,磁性分离,用10 μL四丁基磷酸盐缓冲液将Fe3O4纳米粒子转移至一端开口的圆柱形玻璃瓶,置于BPCL微弱发光仪中,加入90 μL苯甲酰甲醛溶液测量发光值,取自最高信号值起之后的10 s的积分值作为信号值。
1.3.4 ATP的化学发光检测
取1.0 μmol氨基改性的Fe3O4纳米粒子,吡啶缓冲液清洗3次,磁性分离,加入200 μL戊二醛溶液,室温振荡3 h。加入10 pmol ATP适体,室温振荡1 h。WB清洗液洗涤3次,加入200 μL 2%的BSA溶液,室温振荡1 h。WB清洗液洗涤3次,将Fe3O4纳米粒子加入100 μL ATP(浓度为2、4、6、8、10、12 μmol·L-1)溶液中,室温振荡1 h。WB清洗液洗涤3次,磁性分离,用10 μL超纯水将Fe3O4纳米粒子转移至一端开口的圆柱形玻璃瓶,置于BPCL微弱发光仪中,加入90 μL荧光素酶缓冲液测量发光值,取自最高信号值起之后的10 s的积分值作为信号值。
1.3.5 化学发光法检测ATP的特异性及干扰性实验
1.3.6 酸奶中乳酸菌ATP含量的检测
乳酸菌ATP的提取[24]:分别取100、300、600 μL酸奶用超纯水稀释至1 mL,12 000 r·min-1离心10 min,去上清液,加1%苯扎氯铵溶液1 mL悬浮沉淀,常温反应3 min,12 000 r·min-1离心10 min得上清液备用。
取1.0 μmol氨基改性的Fe3O4纳米粒子,吡啶缓冲液清洗3次,磁性分离,加入200 μL戊二醛溶液,室温振荡3h。加入10 pmol ATP适体,室温振荡1 h。WB清洗液洗涤3次,加入200 μL 2%的BSA溶液,室温振荡1 h。WB清洗液洗涤3次,磁性分离,加入100 μL乳酸菌ATP提取物中,室温振荡1 h。WB清洗液洗涤3次,磁性分离,用10 μL超纯水将Fe3O4纳米粒子转移至一端开口的圆柱形玻璃瓶,置于BPCL微弱发光仪中,加入90 μL荧光素酶缓冲液测量发光值,取自最高信号值起之后的10 s的积分值作为信号值。
2 结果与讨论
2.1 多巴胺改性Fe3O4纳米粒子的表征
图2为制备得到的磁性粒子的X射线衍射图,粒子物相为反尖晶石结构的Fe3O4,峰形窄且尖锐,说明结晶完整。图a和b分别为盐酸多巴胺溶液改性,氨基修饰前后的Fe3O4纳米粒子的X射线衍射图。从图中可以明显的看到氨基修饰前后衍射峰基本没有变化,表明在改性中Fe3O4的晶体结构没有改变,但由亲油性变成亲水性。从图上得到改性前后的磁性微粒的衍射峰都出现在2θ=30.430°,35.800°,43.480°,57.350°,62.920°处,与Fe3O4的立方晶面相对应。图中20~30之间有1个微弱的弥散峰,应该是由于Fe3O4粒子表面存在的油酸及多巴胺所致。根据Scherrer公式:

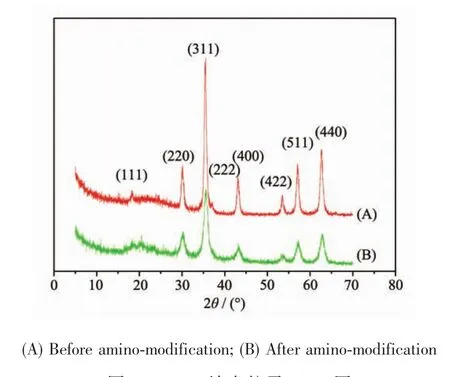
图2 Fe3O4纳米粒子XRD图Fig.2XRD patterns of the Fe3O4nanoparticles
其中K为Scherrer常数,取0.89,λ为X射线波长,β为半高宽,θ为布拉格角,取晶面计算得D=12 nm。
图3为改性后的Fe3O4粒子的透射电镜图照片,显示粒子分散性较好,为规则球形,粒径约为12 nm,与XRD结果基本一致,其值小于Fe3O4的超顺磁性临界尺寸15 nm,具有超顺磁性。由Fe3O4粒子高倍透射电镜图(图3(B))所示,在Fe3O4纳米粒子表面有一层明显的多巴胺保护层,多巴胺上的氨基可用于后续适体的接枝。

图3氨基改性后Fe3O4纳米粒子透射电镜照片Fig.3TEM images of the amino-modified Fe3O4nanoparticles
图4 (A)中(a)、(b)分别为多巴胺改性前油酸修饰的Fe3O4纳米粒子(OA-Fe3O4)和多巴胺改性后Fe3O4纳米粒子(DPA-Fe3O4)在室温下的磁滞回线。由图中可知,样品均具有良好的超顺磁性;油酸修饰的Fe3O4纳米粒子经多巴胺改性后,饱和磁化强度(Ms)略有下降,这是由于改性后多巴胺取代油酸连接到Fe3O4磁性粒子上,因此在测试样品质量相同的情况下,磁性部分的减少导致Ms的降低。图4(B)为改性前的Fe3O4纳米粒子在磁铁的作用下被吸附的图像,在磁铁的作用下,10 s内粒子就被吸附靠近磁铁,表明Fe3O4纳米粒子的磁性良好。
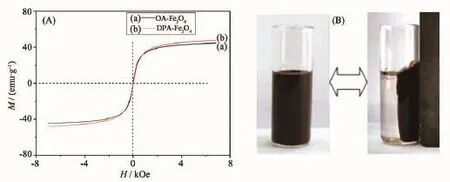
图4(A)Fe3O4纳米粒子氨基改性前后磁滞回线;(B)氨基改性前Fe3O4纳米粒子的磁响应Fig.4(A)Hysteresis loop of Fe3O4nanoparticles before and after amino modification;(B)Magnetic responsiveness of Fe3O4nanoparticles
图5 (A)为多巴胺改性前后的Fe3O4粒子红外光谱分析图,改性前后均保留了569 cm-1处Fe-O键的吸收峰;同时3 443 cm-1处的吸收峰变强,是改性后表面修饰的氨基所发生的伸缩振动和表面-OH的特征吸收峰叠加而导致。改性前OA-Fe3O4纳米粒子,2 918和2 848 cm-1处的吸收峰对应油酸中的CH2链,1 665和1 520 cm-1处的吸收峰对应油酸中羧基的延伸链,表明油酸可通过化学键连接到纳米粒子表面;氨基改性后DPA-Fe3O4纳米粒子的羧基和亚甲基的特征吸收峰都消失,且1 619 cm-1处N-H延伸链、1 490 cm-1处苯环C-C振动键和1 260 cm-1处苯酚的C-O键的吸收峰出现,表明氨基改性成功。
图5(B)为氨基改性前后的Fe3O4纳米粒子紫外可见光谱图,盐酸多巴胺(DPA)标准液在220和280 nm处有吸收峰,盐酸多巴胺改性的Fe3O4纳米粒子(DPA-Fe3O4)在220 nm处出现吸收峰,而未改性的Fe3O4纳米粒子无吸收峰出现,说明多巴胺成功连接在Fe3O4上。

图5 氨基改性前后Fe3O4纳米粒子表征Fig.5Characterization of Fe3O4nanoparticles before and after amino-modification
2.2 改性后Fe3O4纳米粒子接枝ATP适体
ATP适体上含有G碱基,与苯甲酰甲醛溶液反应后产生瞬时发光,可由微弱发光仪检测到。适体量增大,化学发光值也随之增大。通过固定加入ATP适体量(10 pmol),改变加入的Fe3O4纳米粒子的量,来优化实验中Fe3O4纳米粒子量。实验结果如图6所示,随着Fe3O4粒子量的增大,ATP适体连接到纳米级Fe3O4粒子上,化学发光值先升高后下降,由于过量的Fe3O4纳米粒子会导致发光的减弱,故加入1 μmol的Fe3O4纳米粒子较为适宜。
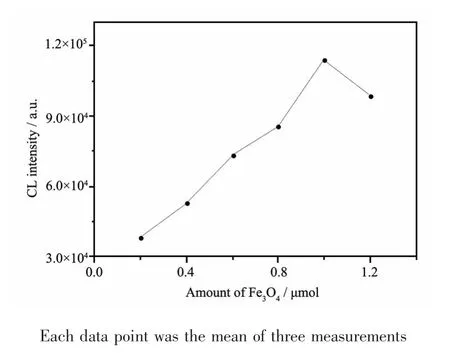
图6 加入不同量Fe3O4纳米粒子的发光值Fig.6Changes of chemiluminescence intensity with different amounts of Fe3O4nanoparticle
2.3 ATP的定量检测
ATP适体包裹ATP分子形成稳定卷曲的三维结构附着在Fe3O4纳米粒子上,ATP与荧光素酶反应产生化学发光,通过检测不同浓度(2、4、6、8、10、12 μmol·L-1)的ATP的发光值,绘制了ATP量与化学发光值关系。如图7所示,R2=0.9963,在该范围内线性良好,可用于ATP的定量检测,信噪比为3∶1,检测限为0.68 μmol·L-1。
图8为化学发光法检测ATP的干扰性实验考察结果。溶液为CTP、GTP、UTP时,化学发光值低,表明实验特异性好;溶液为ATP和CTP、GTP、UTP的混合物时,对化学发光值影响不大,表明该实验方法可靠。
我们还进行了酸奶中乳酸菌ATP的检测。先提取出酸奶中乳酸菌的ATP,再利用Fe3O4纳米粒子进行实验,特异性捕获ATP,化学发光法检测其发光值。由表1可知随着酸奶量的增大,所含乳酸菌的量增多,则提取的ATP含量高,化学发光值增大,实验重复性好。根据图7的化学发光检测ATP工作曲线计算,每毫升酸奶的乳酸菌中所含ATP的量为3.98×10-8mol,说明制备的Fe3O4纳米粒子可作为载体应用于分析检测领域。
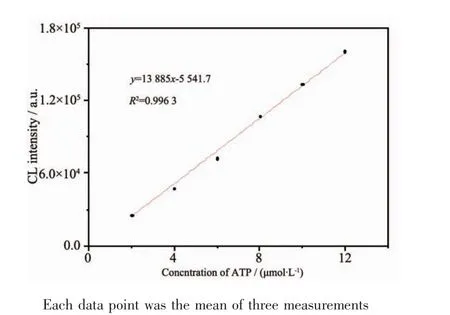
图7 化学发光检测ATP工作曲线图Fig.7Curve of chemiluminescence detection for ATP
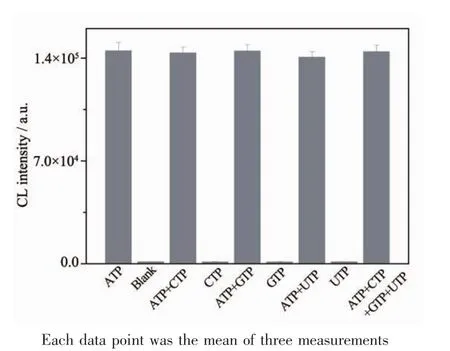
图8 不同溶液中ATP发光值的测定Fig.8Comparison of ATP chemiluminescence intensity in different solutions

表1 不同量酸奶中乳酸菌ATP化学发光值的测定Table 1ATP chemiluminescence determination of lactic acid bacteria in different volumes of yogurt
3 结论
(1)采用共沉淀法制备了油酸修饰的纳米Fe3O4粒子,并用盐酸多巴胺对粒子进行氨基化改性。
(2)成功地将ATP适体连接到氨基改性的Fe3O4纳米粒子上,磁性分离出Fe3O4纳米粒子,用化学发光法优化了Fe3O4纳米粒子的量。
(3)氨基改性的Fe3O4纳米粒子,先结合ATP适体,再用于ATP的定量检测,线性好,检测范围广。
(4)氨基改性的Fe3O4纳米粒子分散性好、稳定性好,可作为一种良好的载体应用于生物分离及分析检测等领域。
[1]Lara F J,García-Campaña A M,Aaron J.Anal.Chim.Acta, 2010,679(1/2):17-30
[2]Lara F J,García-Campaña A M,Velasco A I.Electrophoresis., 2010,31:19982027
[3]Lara F J,Airado-Rodríguez D,Moreno-González D,et al. Anal.Chim.Acta,2016,913:22-40
[4]Iranifam M.TrAC Trends Anal.Chem.,2014,59:156-183
[5]Ocaña-González J A,Ramos-Payán M,Fernández-Torres R, et al.Talanta,2014,122:214-222
[6]Calokerinos A.Anal.Lett.,2011,44(1/2/3):176-215
[7]Famulok M,Mayer G.Chem.Biol.,2014,21(9):1055-1058
[8]Wu Y X,Kwon Y J.Methods,2016,106:21-28
[9]Zhu D,Yang R X,Tang Y,et al.Biosens.Bioelectron., 2016,85:429-436
[10]Zhu L,Xu G,Song Q,et al.Sens.Actuators,B,2016,231: 506-512
[11]Sharma A,Catanante G,Hayat A,et al.Talanta,2016,158: 35-41
[12]Nguyen V,Seo H B,Kim B C,et al.Biosens.Bioelectron., 2016,86:293-300
[13]Kim Y S,Chung J,Song M Y,et al.Biosens.Bioelectron., 2014,54:195-198
[14]Qi Y,Xiu F,Zheng M,et al.Biosens.Bioelectron.,2016,83: 243-249
[15]Iranifam M.TrAC Trends Anal.Chem.,2013,51:51-70
[16]Hai H,Yang F,Li J.Microchim.Acta,2014,181(9/10):893-901
[17]Ji X B,Yao C G,Wan Y,et al.Chin.J.Chem.,2016,34: 331-336
[18]Zhu L,Xu G,Song Q,et al.Sens.Actuators,B,2016,231: 506-512
[19]LI Hong(李红),JI Liang-Nian(计亮年),LI Wei-Shan (李伟善),et al.Chinese J.Inorg.Chem.(无机化学学报), 2003,19(3):225-232
[20]Tombácz E,Turcu R,Socoliuc V,et al.Biochem.Biophys. Res.Commun.,2015,468(3):442-453
[21]Mohammadi A,Barikani M,Lakouraj M M.Mater.Sci.Eng. C,2016,66:106-118
[22]XIAO Wang-Chuan(肖旺钏),WANG Ye-Min(王叶敏), WANG Ren-Zhang(王仁章),et al.Chinese J.Inorg.Chem. (无机化学学报),2014,30(11):2559-2563
[23]Kai M,Ohkura Y,Yonekura S,et al.Anal.Chim.Acta, 1994,287(1):75-81
[24]Hattori N,Sakakibara T,Kajiyama N,et al.Anal.Biochem., 2003,319(2):287-295
[25]HUANG Jun-Hong(黄君红),PENG Li-Zhen(彭丽珍), WANG Ai-Lan(王爱兰).Chinese J.Microecology(中国微生态学杂志),2001,13(6):324-325
Nanoparticles Grafted by ATP Aptamer:Preparation and Application in Chemiluminescence Enzyme Analysis
YAN Xi-Luan1CHEN Xin1GAO Wen-Ju1WEI Ting-Ting1LIN Yue-Min1AI Fan-Rong*,2,3
(1School of Resources,Environmental&Chemical Engineering,Nanchang University,Nanchang,330031,China)
(2School of Mechanic&Electronic Engineering,Nanchang University,Nanchang,330031,China)
(3Institute of Translational Medicine,Nanchang University,Nanchang,Nanchang,330031,China)
Oleic acid-modified Fe3O4nanoparticles was prepared and dopamine hydrochloride was chosen to amino-modify these nanoparticles.The Fe3O4nanoparticles have good water-dispersible,and were characterized by X-ray diffraction(XRD),transmission electron microscopy(TEM),Fourier transformed infrared(FTIR) spectroscopy,vibrating sample magnetometer and ultravioletvisible spectroscopy(UV-Vis)spectra.Then,aminomodified adenosine triphosphate(ATP)aptamer was grafted onto Fe3O4nanoparticles,and the amount of ATP was detected with luciferase chemiluminescence method.Meanwhile,the amount of ATP of lactic acid bacteria in commercially yogurt was tested,which had high sensitivity and good reproducibility.The results showed that these functionalized-Fe3O4nanoparticles could act as good dispersion,easy separation carrier,which indicated uniform particle size,good stability,strong magnetism and excellent binding ability with ATP aptamer.The development of Fe3O4nanoparticles largely expanded its application in the field of analysis.
Fe3O4;nanoparticles;aptamer;ATP;chemiluminescence detection
O614.81+1
A
1001-4861(2017)02-0340-07
10.11862/CJIC.2017.034
2016-08-31。收修改稿日期:2016-11-21。
国家自然科学基金(No.81102289,51102131,31660491)和江西省自然科学基金(No.20132BAB205106,20142BAB216033)资助项目。
*通信联系人。E-mail:afr3755875@126.com
