新型纳米棒药物载体的合成及性能研究进展
2017-09-06李薇赵一凡曹媛媛胡平静李祥子
李薇,赵一凡,曹媛媛,胡平静,李祥子,2
(1皖南医学院药学院,安徽 芜湖 241002;2江苏大学化学与化工学院,江苏 镇江 212013)
新型纳米棒药物载体的合成及性能研究进展
李薇1,赵一凡1,曹媛媛1,胡平静1,李祥子1,2
(1皖南医学院药学院,安徽 芜湖 241002;2江苏大学化学与化工学院,江苏 镇江 212013)
纳米棒拥有独特的结构、优良的性能和重要的生物医学应用价值,已逐步成为一类新型药物载体。本文介绍了近年来纳米棒作为药物载体的相关研究,分别对金纳米棒、羟磷灰石纳米棒、介孔硅纳米棒等典型药物载体的制备和应用进行了详细阐述,重点分析了金纳米棒、Au@SiO2复合纳米棒、Au@C复合纳米棒以及中空金纳米棒等药物载体的一般合成工艺,简述了这些基于金纳米棒载体的表面修饰、功能化、负载及控释技术。随后对常见的纳米棒载体的药物控释性能进行了比较和评价,提出了3种常见的纳米棒载体缓释方式:一是载体直接分散缓释法,该法经济易行,但所需载体用量较大且易损失;二是透析袋式缓释法,该法所需载体用量较小、无需分离,但需购置半透膜;三是比色皿式缓释法,该法主要针对于光敏性载体。详细讨论了纳米棒载体的尺寸和体外细胞毒性,并对纳米棒载体的体内分布、免疫清除等体内代谢性能进行了介绍,最后对纳米棒载体的发展进行了展望,认为基于纳米棒的多刺激响应型异质载体、中空纳米棒载体和纳米管类载体可能是今后的研究热点。
纳米棒载体;复合材料;纳米材料;分布;细胞毒性
随着纳米技术在生物医学领域中的广泛研究,功能纳米材料已在免疫检测、基因研究、生物分离、癌症诊断等方面得到了人们的极大关注[1-2]。纳米材料作为药物载体拥有低毒高效、循环半衰期长等优点,且在靶细胞处可具有更强的通透性和滞留效应,现已被广泛用于药物控释及癌症诊疗等纳米医学领域[3-4]。当前,基于纳米颗粒(如脂质体、凝胶束、金纳米粒子、聚合物纳米粒子)和碳纳米管[5]的药物载体已有大量研究且少量被商业化,然而智能控释、靶向运输、载药容量、生物相容性及刺激响应性等依旧是纳米载体研究中亟待攻克的关键问题。人们在探索这些问题的过程中,发现棒状纳米药物可通过能量依赖和分散作用的机制被细胞摄入,表现出更好的药物代谢动力学性能和更佳的抗肿瘤作用[6-7]。且有研究表明,纳米载体的形状、尺寸、表面基团、沉降及扩散等因素对其在细胞中的摄入效果有很大影响[8]。纳米棒作为一种新型纳米载体具有更大的相对表面积、更快的细胞通透性、更大的载药量、更长的血循环时间和更高的细胞摄入率,在癌症治疗等方面要比常见的零维纳米载体更加有效[9-10]。有关纳米棒载体的研究在近几年才逐步发展起来,本文就对纳米棒载体的研究进展进行了综述,重点介绍了金纳米棒载体的合成及性能,以期为今后纳米棒载体的深入研究提供参考。
1 基于Au纳米棒的药物载体
1.1 Au纳米棒载体
在各种无机棒状纳米载体中,金纳米棒(GNRs)因其奇特的光学及电子性能已成为生物医学领域中的研究热点。金纳米棒作为药物载体一般具有以下几方面的优点:①金纳米棒具有独特的径向表面等离子体共振效应,能吸收红外光并将其转变为热量,进而在靶向传递、光热治疗、光学成像及CT造影等方面发挥积极作用[11],这种光热效应可通过纳米棒的长径比及环境位点进行调节,进而获得更宽的光谱范围和更好的生物传感功能;②金纳米棒在细胞成像时具有很强的双质子活性,可有效避免在光辐射下产生的光闪烁或光漂白[12];③金纳米棒表面易功能化,经特定聚合物修饰后,可有效增强其与抗癌药物间的静电作用,这种静电作用不仅易形成、成本低,而且有利于载药容量的提高和药物释放的调控[13];④金纳米棒具有较大的比面积和表面能,可有效提高其与有机配体、抗癌药物及生物大分子(如DNA、siRNA、抗体等)之间的连接[14];⑤金纳米棒拥有较好的生物相容性,易通过Au—S键与细胞发生关联[15]。可见,金纳米棒具有优异光学性能、可调长径比及易生物功能化等优点,可集药物传输和光热治疗于一体,发挥协同的抗癌效果。然而,为提高金纳米棒的载体性能,在合成过程中一般需要进行相应的工艺处理,如图1所示。
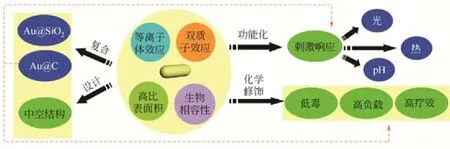
图1 基于金纳米棒载体的一般合成工艺
作为一种纳米药物载体,刺激响应性是载体智能释药的重要条件[16]。为此,通常需对金纳米棒进行表面功能化处理[17-19]。若利用硫醇化的聚乙二醇(SH-PEG)和聚丙烯酸(PAA)对金纳米棒进行修饰,然后负载阿霉素(DOX),可获得一种兼具药物传输和荧光成像功能的PAA-PEG-GNRs@DOX生物探针,对癌细胞进行化疗的同时可实现光响应诊疗[20]。CHEN等[21]合成出腺嘌呤包覆的金纳米棒,发现“腺嘌呤-甲氧檗因-腺嘌呤”特殊键的形成不仅可以促进金纳米棒对甲氧檗因的负载,而且可以利用该键在低pH或高温下不稳定的特性,实现金纳米棒对药物的酸敏性和光敏性控释。PACARDO等[22]以光敏性的氮杂右旋糖酐为“帽试剂”、叶酸为靶向试剂、环糊精为功能化试剂巧妙设计出的一种多功能金纳米棒。研究发现该体系中的氮杂右旋糖酐起到酸敏性分子开关的作用,叶酸可有效提高金纳米棒对Hela细胞的靶向性,该载体不仅可在紫外光下释放阿霉素,而且能发挥热疗作用,故而有效提高了其抗癌效果。有研究发现,功能化的金纳米棒还能集诊断和基因治疗于一体,如美国学者研究出一种基于金纳米棒的酸性纳米载体可同时传输DOX和siRNA,在化疗的同时实现了siRNA介导的基因抑制。并发现相比Au-DOX纳米棒载体,Au-DOX-OCT(奥曲肽)纳米载体表现出更高的BON细胞摄入率,靶向Au-DOX-OCTASCL1 siRNA对NE癌细胞表现出更高的基因抑制作用[23]。为实现对刺激响应的精准控制,最近,CHEN等[24]成功利用聚醚酰亚胺(PEI)将DOX和DNA两种靶向分子同时构筑到金纳米棒载体上,一方面利用Na2S2O3与金纳米棒反应引发DOX的释放,另一方面利用局部近红外光辐射引发DNA的释放,从而实现了对金纳米棒载体的选择性连续控释。
尽管金纳米棒是一种优秀的多功能纳米源,但其作为载体在合成工艺上也存在一些不足,如纳米棒合成过程中残留的表面活性剂(十六烷基三甲基溴化铵,CTAB)具有较强的毒性,载体的负载效率、稳定性及药物控释动力学性能均有待提高。为此,在金纳米棒的合成工艺中,表面化学修饰则是弥补以上不足的另一重要手段。例如,利用聚苯乙烯磺酸钠(PSS)对负载DOX的金纳米棒进行修饰,可降低金纳米棒表面残留的表面活性剂(CTAB)毒性,并可有效提高其药物负载效率(55%±6%),同时发现该金纳米棒在pH为5时可持续释放药物,表现出较高的生物稳定性和更优的抗癌效果[25]。研究还表明,鉴于聚吡咯也可在近红外光区产生强烈吸收,经聚吡咯修饰的金纳米棒可表现出更强烈的双质子光热效应和很好的光稳定性,这种纳米棒对正常组织表现出较低的光热损伤,但可有效抑制肿瘤细胞的增值[26]。
1.2 Au@SiO2复合纳米棒载体
金纳米棒因其可调的光热转化性能已被证实是一种良好的光热疗试剂[27],然而很多研究表明单纯金纳米棒的近红外吸收峰在光照后会因“熔融效应”而减弱,其光稳定性不好且易团聚[26]。此外,单纯金纳米棒作为载体时,其残留的表面活性剂(CTAB)因有毒性也需彻底清除。为此,相比单纯的表面修饰,异质复合则是提高金纳米棒载体性能的更佳途径,其不仅可有效降低材料毒性、防止团聚,而且能改善其载药性能和生物相容性。生物相容性高的介孔硅因其多孔结构可有效提高载药量,故而成为常见的用于复合的壳材料,不过合成工艺也会对复合纳米棒的性能产生一定的影响。例如,FENG等[28]在Aurod@SiO2的合成研究中发现,用HCl-CH3OH萃取清除表面活性剂(CTAB)的效率较低,且会导致金纳米棒的形貌会因氧气的选择性刻蚀而发生变化。而用NH4NO3-CH3OH萃取,不仅可彻底清除CTAB,而且不会破坏内部金纳米棒结构,所得棒状载体拥有更大的载药量(负载效率为82.5%)和更好的抗癌作用(YCC-2细胞)。ZHU等[29]在金纳米棒的复合过程中发现,PSS、CTAB、mSiO2包覆的金纳米棒具有显著毒性,而聚乙二醇(PEG)、dSiO2、TiO2包覆的金纳米棒并没有导致细胞凋亡。相对单纯的表面活性剂(PSS、PEG),经mSiO2、dSiO2及TiO2等无机物复合的金纳米棒则表现出更高的细胞摄入率。
对金纳米棒进行异质复合不仅可降低载体细胞毒性、提高载药性能,还可使其拥有良好的刺激响应性。ZHANG等[30]设计出Au@mSiO2核壳纳米棒结构,利用介孔硅的高比表面积获得了高的载药容量,同时利用金纳米棒实现了对抗癌药物的光敏性释放。TANG等[31]通过沉淀聚合法将一种具有体相变性能的P(NIPAM-co-NHMA)修饰到Au@mSiO2纳米棒表面,获得兼具热敏/光敏性能的新型复合纳米棒。研究发现该载体中DOX释放表现出明显的温度依赖性:37℃时该载体只释放很少量DOX,对正常组织的毒副作用较低。经近红外光的照射后,该载体可局部升温至47℃,并引起DOX的热敏性释放,进而对肿瘤细胞起到了化疗和光热疗的双重功效。然而,在进行组合诊疗的同时,载药量、光照时间以及载体浓度等也是需要探索的问题。例如,LI等[32]利用磺酸基杯[4]芳烃(SC[4]A)为AuNR@MSN复合载体设计了一种“纳米阀”,获得一种拥有超分子开关功能的癌症治疗异质平台。其中金纳米棒吸收近红外光产生的热可降低SC[4]A环与季铵盐(QAS)柄之间的结合力,促使SC[4]A环脱落,进而打开纳米穴实现药物的控制性释放(图2)。此外,具有偶氮苯结构的轮烷也可作“金纳米棒@介孔硅”异质结构的分子开关,在近红外光照射下实现对斑马鱼胚胎的药物控释(图3)[33]。

图2 基于Au@MSN纳米棒的SC[4]A纳米穴[32]
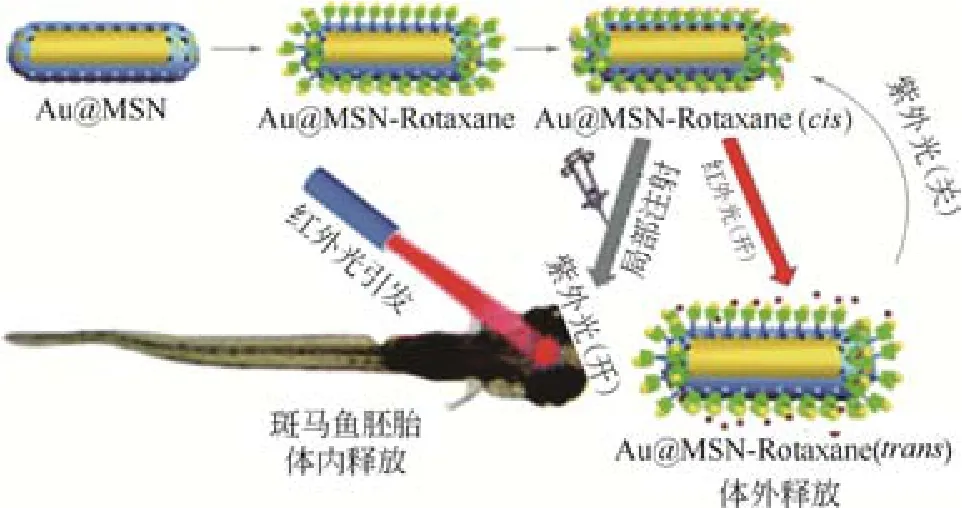
图3 光响应Au@MSN–rotaxane纳米棒[33]
1.3 Au@C复合纳米棒载体
除了介孔硅可作为金纳米棒的壳材料以外,碳因其良好的稳定性、光学性能和生物相容性也常被作为包覆材料。最近,湖南大学WANG等[34]就利用超稳定的荧光碳层包覆金纳米棒,获得一种多功能Au@C纳米核壳结构。并发现在该体系中,π-π键的存在不仅有利于核酸适配体及药物分子在碳壳上的负载,而且有利于载体对癌细胞的靶向性成像和治疗。该核壳纳米棒的结构稳定且兼具荧光性能,故在监控载体释药的同时可进行组合治疗,从而有望成为生物医学领域中的一个很有前景的纳米载体平台。
1.4 基于Au纳米棒的中空载体
随着人们对基于金纳米棒载体研究的不断深入,在保持金纳米棒固有特性的同时,还需进一步提高其载释药性能。在介孔硅的启示下,中空微纳结构的设计已成为金纳米棒载体一个新方向。例如,XIONG等[35]成功合成出一个基于笼中金纳米棒(CGNRs)的新型光敏性药物传输体系,从而获得了更大的负载量,同时还可通过调节笼厚度和金纳米棒长度控制其对近红外光的吸收,使得该载体在载药后可对肿瘤组织同时进行化疗和热疗(图4)。CHEN等[36]将金纳米棒设计到聚合物电解质的胶囊内部,并通过物理吸附作用将DOX负载到聚合物层,形成无毒、稳定、强靶向性的FA-MC@ GNRs/DOX体系(图5)。该载体的外形虽不是棒状,但仍是基于金纳米棒的中空结构,其中胶囊内的金纳米棒在近红外光照射下产生热量致使聚合物分解,实现药物和光热的组合治疗。这类基于金纳米棒的中空载体一般具有更大的载药量、温和的合成条件、可控的表面性能和更多的刺激响应途径,有望在载药传输过程中减少毒副作用。
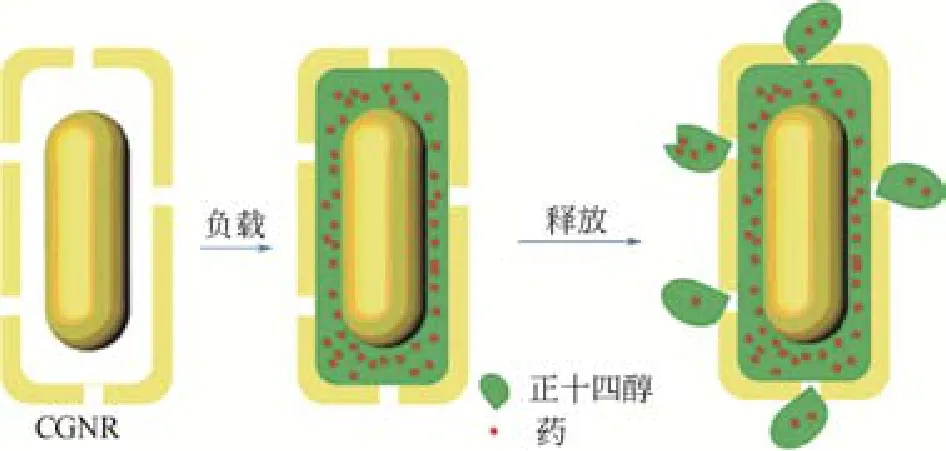
图4 笼中金纳米棒的合成[35]
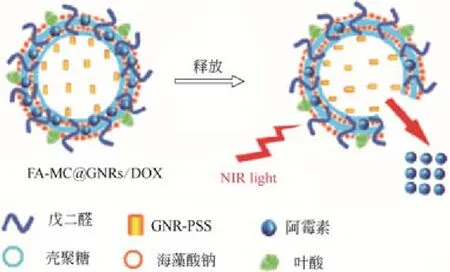
图5 FA-MC@GNRs/DOX的合成[36]
2 基于羟磷灰石纳米棒的药物载体
早在1973年,磷酸钙就被GRAHAM 和VAN DER EB作为一种非病毒基因工具[37],后因其优异的生物相容性和生物降解性而被广泛用于基因转染等生物医学领域。传统的原位共沉淀技术虽可获得磷酸钙与DNA的复合物,但需在严格的生理条件下进行,以便保护DNA分子活性,而生理条件下却易导致该纳米复合物的集聚和沉淀,复合物的尺寸难控、转染效率低。因此,如何控制纳米磷酸钙的形貌并提高其载体性能便成为一个重要挑战。相比磷酸钙,羟磷灰石[Ca10(PO4)6(OH)2,HAP]因有更好的生物相容性、生物活性以及易合成等优势,而成为一种更具潜力的载体材料[38-39]。有研究表明,针状、棒状及盘状纳米羟磷灰石对NR8383细胞和原发性巨噬细胞均表现出较低的毒性[40]。其中棒状羟磷灰石在合成工艺上更具有可控性,如JI等[41]利用化学沉积和水热技术可以很好的控制羟磷灰石纳米棒的尺寸和结构,其微孔径为1.6~2.7nm,可有效延长5-氟尿嘧啶的缓释时间,故可逐步成为一种更具前景的药物释放体系。如WU等[42]利用共聚物(PLGA-mPEG)辅助技术获得HAP纳米棒,并发现当Ca2+浓度为0.2mol/L时,HAP纳米棒表现出超高的DNA绑定能力和转染效率,相比介孔硅载体,其负载容量增大了1~2倍。此外,羟磷灰石的酸溶性能使其经常被设计为酸敏性载体。如CHEN等[43]研究发现HAP纳米棒对水飞蓟宾的负载可达825mg/g,该药物在不同pH的模拟胃液和模拟肠液中表现出不同的释药性能。
为进一步提高HAP纳米棒的载体性能,人们也对其进行了功能化和异质复合研究。例如,韩国学者SINGH等[44]通过柠檬酸掺杂的溶胶-凝胶技术合成出带绿色自荧光的HAP纳米棒(fHA),该纳米棒可高效负载阿仑唑奈(10%),药物持续释放时间超过3天。随后,他们又用不同厚度的介孔硅对该fHA纳米棒进行复合,进一步提高了载体的负载容量。介孔硅可将自荧光产生的CO2–·自由基保护在载体内部,故可明显改善其荧光性能[45]。印度学者BHARATH等[46]以CTAB为表面活性剂,通过一锅法水热技术合成出Fe3O4纳米粒子修饰的HAP纳米棒,该磁性复合纳米棒对蛋白质的负载量可达166.67mg/g,并在低pH下实现蛋白质的最大释放。比利时学者FILIPPOUSI等[47]用锶取代钙合成出锶羟磷灰石纳米棒,并用于疏水性利培酮和亲水性普拉克索两种药物的负载,发现药物释放依赖于药物的亲水性能。
3 基于介孔硅纳米棒的药物载体
介孔硅除了可作为一种良好的壳材料以外,其本身也可以直接作为药物载体。介孔硅的孔尺寸可调、表面易修饰,可通过分子尺寸和表面静电两种方式选择性负载药物,现已广泛用于药物传输、传感、生物分离等领域。其中介孔硅纳米棒经修饰后会拥有更好的亲水性能、更优的分散性能、更佳的细胞摄入率以及更快的尿清除率,更利于在生物医学方面发挥应用。SENTHILKUMAR等[48]通过壳聚糖包覆介孔硅纳米棒(CS-NR-MSP)获得一种靶向传递体系。研究发现,经叶酸连接后,CS-NR-MSP纳米棒的靶向性明显增强,其相比球状粒子具有更高的细胞摄入率。SHI等[49]利用3,4-二羟(基) 苯丙氨酸在碱性条件下的自聚合实现了对介孔硅纳米棒的异质复合,获得基于生物聚合物的PLA-b-APDOPA/PDOPA @SiO2纳米棒胶囊,该棒状胶囊具有良好的生物相容性和载释药性能。
4 其他纳米棒载体
多功能性是纳米载体的重要特征,对纳米棒载体,除了研究载释药性能以外,额外的光磁性能引入也是提高载体应用价值的重要手段。①磁性纳米棒载体。纳米棒的形状各向异性可诱导产生强烈的不均匀局域磁场,使其能在磁共振成像、靶向传输、磁热转化等方面发挥积极作用[50]。对非磁纳米棒进行表面磁性修饰是获得磁性棒状药物载体的主要方式[46],如GIRI等[51]通过双硫键将超顺磁Fe3O4纳米粒子修饰到介孔硅纳米棒的孔口,不仅实现了该载体的磁靶向功能,而且可利用二氢硫辛酸等生物抗氧化剂的还原作用引发介孔硅孔内荧光素的控释。②荧光纳米棒载体。荧光材料的修饰可使纳米棒载体能用于荧光成像。PADHYE等[52]用聚乙烯亚胺对 β-NaYF4:Gd3+/Tb3+晶态稀土类纳米棒进行表面修饰,使其兼具良好的荧光寿命(约3.5ms)和超顺磁性能[χ约为3.8×10-5emu/(g•Oe) ],且β-NaYF4:Gd3+/Tb3+的浓度增大会增强产物的T1加权磁共振成像性能。该纳米棒同时具备酸敏性释药、高效荧光及超顺磁性能三大功能,可作为一种优秀的药物传输平台用于癌症治疗、生物分离、磁共振成像等方面。WANG等[53]利用水热技术合成出长时间连续发光的 β-Ga2O3:Cr3+纳米棒,并可同时实现对DOX的酸敏性释放和体内成像。③有机纳米棒载体。除了无机纳米载体以外,有机纳米棒载体也同样得到了人们的关注[50]。鉴于介孔硅纳米棒容易被HF移除,故可作为模板成功合成出PMAA@壳聚糖中空有机纳米棒,该中空纳米棒结构不仅负载容量高,而且拥有酸敏性释放DOX的功能,故可在癌症治疗方面发挥积极作用(图6)[54]。FAN等[55]巧妙利用α-环糊精与聚乙二醇及聚乙烯亚胺之间不同的包合行为,构筑出一种超分子“刚柔体系”,获得了一种可生物降解的有机纳米棒。发现该纳米棒的体外基因转染效率是球状纳米粒子的4倍,证实了载体形状也是影响其基因转染效率的重要因素。最近,LI等[56]在双亲聚乙二醇-聚己内酯共聚物的组装过程中,通过调节氯化钠浓度,成功获得棒状有机高分子胶束。与传统的球形胶束相比,该棒状胶束具有更长的血循环时间和更高的细胞摄入率,故在提高药物传输效率和增强药物疗效方面更具优势。④棒状病毒载体。TIAN等[57]以无毒的棒状烟草斑纹病毒为载体,利用酸敏性的腙键将DOX组装到烟草斑纹病毒的内腔,该纳米棒载体表现出较好的酸敏性释药性能,抗癌效果得以增强。
5 纳米棒载体的性能
作为一种新型药物载体,纳米棒的成分、尺寸、载释药性能、生物相容性、生物活性等均是影响其生物医学应用的关键要素,同时也是当前纳米棒载体研究领域中的重要挑战。
5.1 药物控释性能
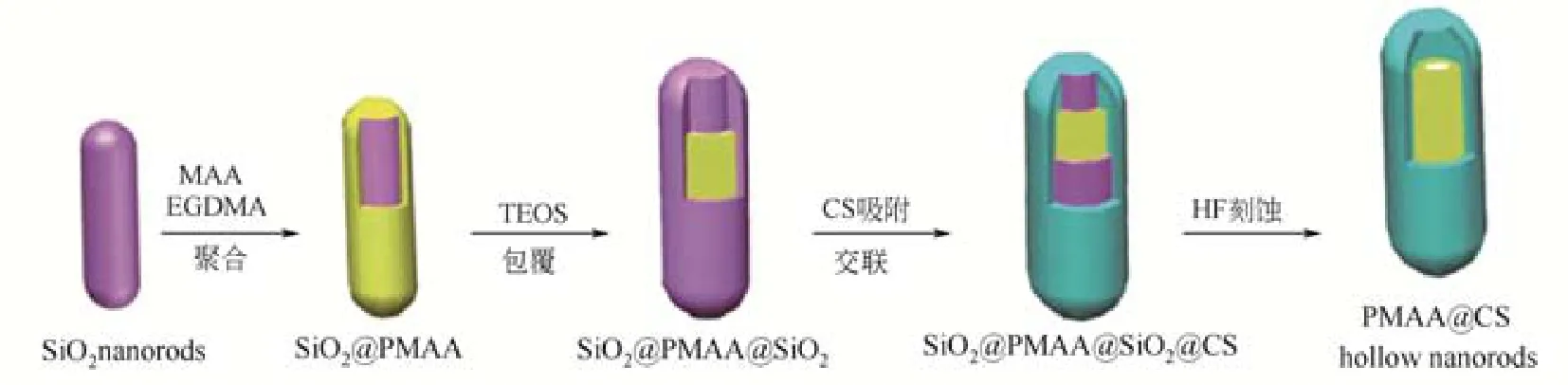
图6 中空聚合纳米棒的合成[54]
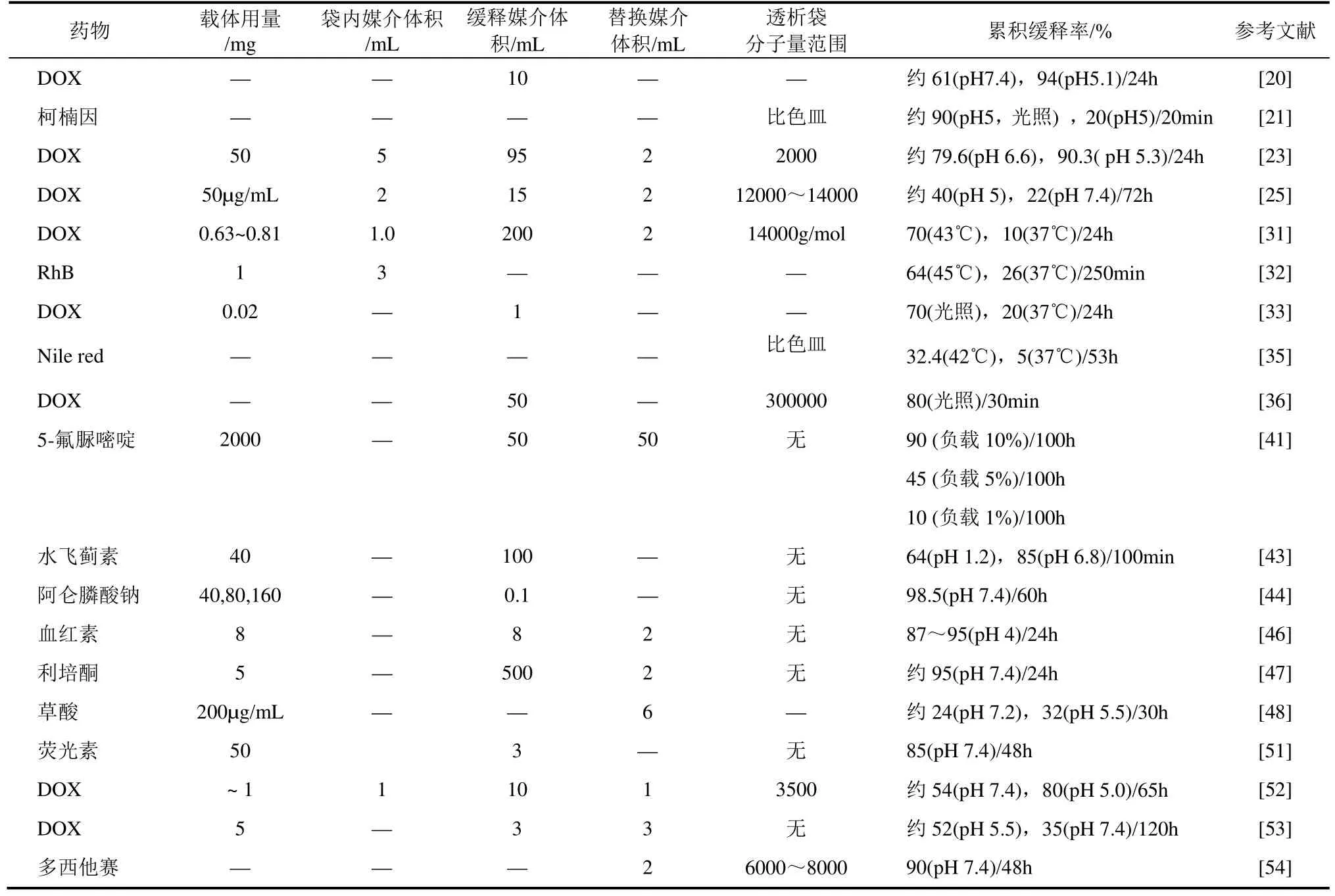
表1 常见纳米棒载体的体外释药参数
控制性释药是纳米载体的显著特征,也是其生物应用的优势所在。刺激性响应是实现纳米棒载体智能释药的重要途径,常见的刺激类型包括酸敏型[20-21,23,25,43,46,48,52-53]、光敏型[21-22,33,36]、热敏型[31-35]及氧化还原反应型[24,51]等,通过调节载体的共价键、静电作用、主客体效应以及空间效应等实现对药物的控释。就纳米棒载体释放的药物成分而言(见表1),一般有临床药物、血红蛋白、荧光素以及染料分子等,其中DOX是当前研究载药性能的最常见模型药物。对载药后载体的释药方式一般3种。①载体直接放入缓释液中进行释放,通过离心分离提取上清液进行药物浓度检测。该法经济易行,但所使用的载体用量相对较多,且离心过程中存在损失;②载体放入透析袋中,然后将透析袋放入缓释液中进行释放,所用透析袋的切割分子量范围为2000~300000。该法优点是载体用量相对较少,无需对载体进行分离,就可通过缓释媒介替换法提取检测液,通过累积释放率研究载体释放行为。但该法所使用的透析袋需要单独购置,且透析袋本身也会在一定程度上延长药物的释放时间。③直接用比色皿进行释放研究,该法通常更加适用于光敏性和热敏性载体[21,35]。不同体系中的纳米棒载体,由于载体用量、载药容量、缓释媒介体积、透析袋孔径等存在差别,故其累积释放率也存在一定的区别。从纳米棒载体的成分上看,金纳米棒的径向表面等离子体共振效应,使其具有光热转化功能,加之表面修饰和异质复合,使得基于金纳米棒的载体可以通过pH、红外光及热3种方式引发药物的释放,这不仅可以有效增强金纳米棒载体的累积释放率,而且可以实现同一载体在不同环境下的分批次控释,进而实现协同抗癌的效果。相比之下,羟磷灰石、介孔硅等其他纳米棒载体一般常通过pH进行引发,实现对药物的酸敏性释放,其中介孔硅的多孔结构也使其拥有了独特的负载性能和潜在的控释优势。对于酸敏性的纳米棒载体来说,其在pH为5的弱酸性环境下,药物的累积释放率相对更高,故可有效提高在肿瘤靶点的释药效率。此外,叶酸分子的引入可有效增强纳米棒载体对特殊肿瘤细胞的靶向性,因而可提高载体的生物活性[36]。
5.2 体外细胞毒性
体外细胞水平研究无需动物,具有快速、经济、重复性高以及可定量化的优点,是目前研究纳米载体毒性的最常规途径,因而在一些新型纳米材料的生物相容性评估方面具有重要价值,并能为纳米载体的体内研究提供参考。众所周知,当纳米载体的尺寸降低时,其表面积会呈指数倍增加,载体表面变得更加活泼、化学催化性能增强,促使纳米载体的表面与细胞之间会产生相互作用,故而直接影响到其细胞毒性。纳米棒载体的细胞摄入及转染研究均需要载体的尺寸适当,以便载体能顺利进入细胞内部,实现药物的细胞内释放或基因介导。从表2可以看出,除了复合金纳米棒的尺寸略大以外,纯金纳米棒载体的尺寸均相对较小,其直径一般为10nm左右,长度一般介于30~50nm,有利于被细胞摄入,更重要的是这种长径比的金纳米棒拥有优异光热转化性能,可发挥光热疗的协同功效。通过表2纳米棒载体在载药前后的数据对比,不难发现单纯金纳米棒载体的生物相容性一般较好。相对于单纯的抗癌药物,载有抗癌药物的金纳米棒载体表现出更好的疗效,且在材料与细胞共孵育过程中加以红外光照射,还可发挥热疗作用,进一步增加抗癌效果。其他组分的棒状载体尺寸相对较大,不过长度在500nm的纳米棒亦可被细胞摄入,这些数据也为今后纳米棒载体的深入研究奠定基础。从纳米棒载体的毒性研究手段来看,纳米棒载体的体外细胞毒性一般均采用MTT或CCK-8实验进行验证,细胞株一般选用肿瘤细胞,其中以Hela细胞株更为多见,载体与细胞的共孵育时间多为24h,90%以上细胞存活率的耐受载体浓度一般小于300μg/mL。然而,在纳米棒载体的毒性研究过程中,载体的组分、尺寸、表面性质、细胞株类型、细胞孵育条件及材料在细胞中的共孵育时间等因素都会在很大程度上影响到其体外细胞毒性。如PEER等[58]发现表面纳米化载体的8天释放率要比未纳米化载体慢25%~30%,这主要是由于纳米化可诱导载体表面的不完全润湿。故而至今也很难建立一个统一标准对纳米棒的体外毒性进行评估,且载体体外细胞毒性的研究结果与其体内毒性也没有必然的联系。
5.3 体内代谢性能
体内研究一般是指载体的动物实验,是继体外研究之后的重要延伸,也是评估载体性能的更科学手段。纳米载体进入体内涉及到血循环、体内分布、免疫清除等关键问题。然而,由于纳米棒是近两年兴起的新型载体,其生物性能研究主要还处于体外细胞水平,体内研究相对较少,且主要体现在载体的体内分布研究。
微颗粒血循环的安全性是发展微米级药物载体的重要条件[59],目前纳米棒载体的尺寸直接影响到细胞对载体的吞噬效率、生物响应、体内分布以及载体清除等,故而也是控制其安全性的首要因素[60-61]。研究表明,直径250nm、长度500nm的较大尺寸的纳米棒也可以进行宫颈癌荷瘤鼠的皮下注射(5mg/mL,100~300µg)及静脉注射(5mg/mL,5mg),并没有发现任何血管堵塞,这为纳米棒载体的体内研究提供了尺寸参考[53]。
纳米棒在体内被网状内皮系统识别和吞噬是不可避免的,而网状内皮系统的吞噬也在一定程度上决定了载体的体内分布。因此,载体的体内分布和免疫清除等研究也就逐渐得到了人们的关注[62]。JIN等[19]将0.2mL纳米棒载体(0.25mg/mL)从静脉注射到荷瘤鼠体内,利用ICP-MS技术研究了载体的24h体内分布,发现肝脏和脾中的载体浓度相对更高,而心脏、肾、肺、胃、肠、肌肉、脑及血液中载体浓度在注射后均出现明显降低,其中载体在血液中的清除率最快。CHEN等[36]通过荧光染色法研究了FA-MC@GNRs/MPA纳米棒在正常小鼠体内的分布,发现注射4h后载体主要集中在肝脏中,24h后主要分布在肝脏和肠中,48h后可逐步从肠中排出,心脏、脾、肺及肾脏中的含量很低。对荷瘤鼠来说,因叶酸的靶向作用,48h后载体仍可选择性的集聚于肿瘤部位。同样,基于金纳米棒的GNR/Gd–DTPA–CS@PEG载体经静脉注射到荷瘤(CT-26)鼠体内,6h后仍可在肿瘤部位出现强烈荧光信号,进而可用于核磁共振监控下的肿瘤光热治疗[63]。CAI等[64]对修饰前后的Gd(OH)3:Eu荧光纳米棒在正常小鼠体内的分布进行了比较研究,发现静脉注射1天后,Gd(OH)3:Eu纳米棒主要集聚于肝脏、脾和肺。而通过“环形精氨酸-甘氨酸-天冬氨酸”嫁接后的Gd(OH)3∶Eu纳米棒在注射10天后仍可集聚于脾、肺和肾中。而载体在肺中的集聚主要是由于肺中具有大量微血管网络结构的缘故[65]。由上可知,纳米棒载体的尺寸和表面性能极大地影响了其体内分布,粒径较大时容易被清除,表面电荷及疏水性能等亦可诱导不同的免疫反应。对于荷瘤鼠来说,纳米棒载体因具有一定的靶向性,一般会优先集聚于肿瘤部位。因而,在纳米棒载体的体内研究中,为获得更长的循环时间又不影
响载药量,一般需对纳米棒载体进行修饰、嫁接及复合处理,以便获得多功能纳米棒载体,进而实现体内肿瘤的协同诊疗。

表2 一些典型的纳米棒载体尺寸与细胞毒性
6 结语
随着人们对多功能药物载体研究的不断深入,纳米棒载体已在生物医学领域得到了日益强烈的关注,并在靶向输药、协同诊疗、降低毒副作用等方面发挥了积极作用,已逐渐发展为一种更加优越的新型药物载体。展望纳米棒载体的发展,以下几个方面将可能逐渐成为今后的研究热点:①基于纳米棒的多刺激响应型异质载体;②中空纳米棒载体;③纳米管类载体。当然,纳米棒载体的载释药性能、生物相容性、智能靶向性、多功能协同作用、毒副作用以及生理代谢等问题仍然面临重要挑战,需要进一步的深入研究。
[1] DOANE T L,BURDA C. The unique role of nanoparticles in nanomedicine: imaging,drug delivery and therapy[J]. Chemical Society Reviews,2012,41(7):2885-2911.
[2] CHAUHAN V P,POPOVIĆ Z,CHEN O,et al. Fluorescent nanorods and nanospheres for real-timein vivoprobing of nanoparticle shape-dependent tumor penetration[J]. Angewandte Chemie International Edition,2011,50:11417-11420.
[3] SHI J J,VOTRUBA A R,FAROKHZAD O C,et al. Nanotechnology in drug delivery and tissue engineering:from discovery to applications [J]. Nano Letters,2010,10(9):3223-3230.
[4] GE S,LIU W,LIU H,et al. Colorimetric detectionofthe flux of hydrogen peroxidereleased from living cells based on the highperoxidase-like catalytic performance of porous PtPd nanorods[J]. Biosensors and Bioelectronics,2015,71:456-462.
[5] POURJAVADI A,TEHRANI Z M,SHIRVANI T,et al. Dendritic multi-walled carbon nanotube with thermoresponsive shells:a good carrier for anticancer drugs[J]. Journal of Industrial and Engineering Chemistry,2016,35:332-340.
[6] LI Y,YANG Y,AN F,et al. Carrier-free,functionalized pure drug nanorods as a novel cancer-targeted drug delivery platform[J].Nanotechnology,2013,24(1):015103.
[7] ZHOU M J,ZHANG X J,YANG Y L,et al. Carrier-free functionalized multidrug nanorods for synergistic cancer therapy[J].Biomaterials,2013,34(35):8960-8967.
[8] CHO E C,ZHANG Q,XIA Y N. The effect of sedimentation and diffusion on cellular uptake of gold nanoparticles[J]. Nature Nanotechnology,2011,6(6):385-391.
[9] CHAUHAN V P,POPOVIĆ Z,CHEN O,et al. Fluorescent nanorods and nanospheres for real-timein vivoprobing of nanoparticle shape-dependent tumor penetration[J]. Angewandte Chemie International Edition,2011,50(48):11417-11420.
[10] DENG Y Y,LI E D,CHENG X J,et al. Facile preparation of hybrid core–shell nanorods for photothermal and radiation combined therapy[J]. Nanoscale,2016,8:3895–3899.
[11] THAM H P,CHEN H Z,TAN Y H,et al. Photosensitizer anchored gold nanorods for targeted combinational photothermal and photodynamic therapy[J]. Chemical Communications,2016,52:8854-8857.
[12] GAO N,CHEN Y,LI L,et al. Shape-dependent two-photon photoluminescence of single gold nanoparticles[J]. The Journal of Physical Chemistry C,2014,118:13904-13911.
[13] YOU J,ZHANG G D,LI C,Exceptionally high payload of doxorubicin in hollow gold nanospheres for near-Infrared light-triggered drug release[J]. ACS Nano,2010,4:1033-1041.
[14] BAO J,CHEN W,LIU T T,et al. Bifunctional Au-Fe3O4nanoparticles for protein separation[J]. ACS Nano,2007,1:293-298.
[15] YANG P,XU Q Z,JIN S Y,et al. Synthesis of Fe3O4@phenol formaldehyde resin core-shell nanospheres loaded with Au nanoparticles as magnetic FRET nanoprobes for detection of thiols in living cells[J]. Chemistry A:European Journal,2012,18:1154-1160.
[16] RITTIKULSITTICHAI S,KOLHATKAR A G,SARANGI S,et al.Multi-responsive hybrid particles:thermo-,pH-,photo-,and magneto-responsive magnetic hydrogel cores with gold nanorod optical triggers[J]. Nanoscale,2016,8:11851-11861.
[17] CUI D X,HUANG P,ZHANG C L,et al. Dendrimer-modified gold nanorods as efficient controlled gene delivery system under near-infrared light irradiation[J]. Journal of Controlled Release,2011,152(1):e137-e139.
[18] 王倩,刘丽炜,朱泠西,等. 低分子量聚乙烯亚胺/金纳米棒纳米载体的制备及毒性研究[J]. 发光学报,2015,36(11):1271-1277.WANG Q,LIU L W,ZHU L X,et al. Synthesization and toxicity of low-molecular-weight PEI/gold nanords nanosystem[J]. Chinese Journal of Luminescence,2015,36(11):1271-1277.
[19] JIN H,LIU X F,GUI R J,et al. Facile synthesis of gold nanorods/hydrogels core/shell nanospheres for pH and near-infrared-light induced release of 5-fluorouracil andchemo-photothermal therapy[J]. Colloids and Surfaces B:Biointerfaces,2015,128:498-505.
[20] WANG T T,ZHANG X L,PAN Y,et al. Fabrication of doxorubicin functionalized gold nanorod probes for combined cancer imaging and drug delivery[J]. Dalton Transactions,2011,40(38):9789-9794.
[21] CHEN M,QIU P C,HE X X,et al. The adenine DNA self-assembly of pH- and nearinfrared-responsive gold nanorod vehicles for the chemothermal treatment of cancer cells[J]. Journal of Materials Chemistry B,2014,2(21):3204-3213.
[22] PACARDO D B,NEUPANE B,RIKARD S M,et al. A dual wavelength-activatable gold nanorod complex for synergistic cancer treatment[J]. Nanoscale,2015,7(28):12096-12103.
[23] XIAO Y L,JASKULA-SZTUL R,JAVADI A,et al. Co-delivery of doxorubicin and siRNA using octreotide-conjugated gold nanorods for targeted neuroendocrine cancer therapy[J]. Nanoscale,2012,4(22):7185-7193.
[24] CHEN S,HUANG H,ZHANG L,et al. Alternate release of different target species based on the same gold nanorods and monitored by cell imaging[J]. Colloids and Surfaces B:Biointerfaces,2016,145:671-678.
[25] VENKATESAN R,PICHAIMANI A,HARI K,et al. Doxorubicin conjugated gold nanorods:a sustained drug delivery carrier for improved anticancer therapy[J]. Journal of Materials Chemistry B,2013,1(7):1010-1018.
[26] DU C L,WANG A H,FEI J B,et al. Polypyrrole-stabilized gold nanorods with enhanced photothermal effect towards two-photon photothermal therapy [J]. Journal of Materials Chemistry B,2015,3(22):4539-4545.
[27] HU B,WANG N,HAN L,et al. Core-shell-shell nanorods for controlled release of silver that can serve as a nanoheater for photothermal treatment on bacteria[J]. Acta Biomaterialia,2015,11:511-519.
[28] FENG J,WANG Z F,SHEN B,et al. Effects of template removal on both morphology of mesoporous silica-coated gold nanorod and its biomedical application[J]. RSC Advances,2014,4(54):28683-28690.
[29] ZHU X M,FANG C H,JIA H L,et al. Cellular uptake behaviour,photothermal therapy performance,and cytotoxicity of gold nanorods with various coatings[J]. Nanoscale,2014,6(19):11462-11472.
[30] ZHANG Z J,WANG L M,WANG J,et al. Mesoporous silica-coated gold nanorods as a light-mediated multifunctional theranostic platform for cancer treatment[J]. Advanced Materials,2012,24(11):1418-1423.
[31] TANG H Y,SHEN S,GUO J,et al. Gold nanorods@mSiO2with a smart polymer shell responsive to heat/near-infrared light for chemo-photothermal therapy[J]. Journal of Materials Chemistry,2012,22(31):16095-16103.
[32] LI H,TAN L L,JIA P,et al. Near-infrared light-responsive supramolecular nanovalve based on mesoporous silica-coated gold nanorods[J]. Chemical Science,2014,5(7):2804-2808.
[33] LI M H,YAN H,TEH C,et al. NIR-triggered drug release from switchable rotaxane-functionalized silica-covered Au nanorods[J].Chemical Communications,2014,50(68):9745-9748.
[34] WANG X W,GAO W,FAN H H,et al. Simultaneous tracking of drug molecules and carriers using aptamer- functionalized fluorescent superstable gold nanorod-carbon nanocapsules during thermo-chemotherapy[J]. Nanoscale,2016,8(15):7942-7948.
[35] XIONG W,MAZID R,YAP L W,et al. Plasmonic caged gold nanorods for near-infrared light controlled drug delivery[J].Nanoscale,2014,6(23):14388–14393.
[36] CHEN H Y,DI Y F,CHEN D,et al. Combined chemo- and photo-thermal therapy delivered by multifunctional theranostic gold nanorod-loaded microcapsules[J]. Nanoscale,2015,7(19):8884-8897.
[37] GRAHAM F L.,VAN DER EB A J. A new technique for the assay of infectivity of human adenovirus 5 DNA[J]. Virology,1973,52(2):456-467.
[38] SUN R X,YANG L L,ZHANG Y X,et al. Novel synthesis of AB-type carbonated hydroxyapatite hierarchical microstructures with sustained drug delivery properties[J]. CrystEngComm,2016,18:8030-8037.
[39] CHEN X,YANG B,QI C,et al. DNA-templated microwave-hydrothermal synthesis of nanostructured hydroxyapatite for storing and sustained release of an antibacterial protein[J]. Dalton Transactions,2016,45:1648-01656.
[40] ALBRECHT C,SCHERBART A M,VAN BERLO D,et al.Evaluation of cytotoxic effects and oxidative stress with hydroxyapatite dispersions of different physicochemical properties in rat NR8383 cells and primary macrophages[J]. Toxicology in Vitro,2009,23:520-530.
[41] JI Y Q,WANG A L,WU G,et al. Synthesis of different sized and porous hydroxyapatite nanorods without organic modifiers and their 5-fluorouracil release performance[J]. Materials Science and Engineering C,2015,57:14-23.
[42] WU G J,ZHOU L Z,WANG K W,et al. Hydroxylapatite nanorods:an efficient and promising carrier for gene transfection[J]. Journal of Colloid and Interface Science,2010,345(2):427-432.
[43] CHEN L,ZHU H L,YANG S,et al. Nanostructured calcium phosphate carriers for deliver of poor water-soluble drug silybin[J].Materials Letters,2015,143:252-255.
[44] SINGH R K,KIM T H,PATEL K D,et al. Development of biocompatible apatite nanorodbased drug-delivery system within situfluorescence imaging capacity[J]. Journal of Materials Chemistry B,2014,2(14):2039-2050.
[45] SINGH R K,KIM T H,PATEL K D,et al. Novel hybrid nanorod carriers of fluorescent hydroxyapatite shelled with mesoporous silica effective for drug delivery and cell imaging[J]. Journal of the American Ceramic Society,2014,97(10):3071-3076.
[46] BHARATH G,PRABHU D,MANGALARAJ D,et al. Facilein situgrowth of Fe3O4nanoparticles on hydroxyapatite nanorods for pH dependent adsorption and controlled release of proteins[J]. RSC Advances,2014,4(92):50510-50520.
[47] FILIPPOUSI M,SIAFAKA P I,AMANATIADOU E P,et al.Modified chitosan coated mesoporous strontium hydroxyapatite nanorods as drug carriers[J]. Journal of Materials Chemistry B,2015,3(29):5991-6000.
[48] SENTHILKUMAR R,KARAMAN D Ş,PAUL P,et al. Targeted delivery of a novel anticancer compound anisomelic acid using chitosan-coated porous silica nanorods for enhancing the apoptotic effect[J]. Biomaterials Science,2015,3(1):103-111.
[49] SHI D J,ZHANG L,SHEN J L,et al. Fabrication of rod-like nanocapsules based on polylactide and 3,4-dihydroxyphenylalanine for a drug delivery system[J]. RSC Advances,2015,5(125):103414-103420.
[50] CHEN M L,SHEN L M,CHEN S,et al.In situgrowth of β-FeOOH nanorods on graphene oxide with ultra-high relaxivity forin vivomagnetic resonance imaging and cancer therapy[J]. Journal of Materials Chemistry B,2013,1(20):2582-2589.
[51] GIRI S,TREWYN B G,STELLMAKER M P,et al.Stimuli-responsive controlled-release delivery system based on mesoporous silica nanorods capped with magnetic nanoparticles[J].Angewandte Chemie,2005,117:5166 -5172.
[52] PADHYE P,ALAM A,GHORAI S,et al. Doxorubicin-conjugated β-NaYF4:Gd3+/Tb3+multifunctional,phosphor nanorods:a multimodal,luminescent,magnetic probe for simultaneous optical and magnetic resonance imaging and an excellent pH-triggered anti-cancer drug delivery nanovehicle[J]. Nanoscale,2015,7(46):19501-19518.
[53] WANG X S,LI W S,SITU J Q,et al. Multi-functional mesoporous β-Ga2O3:Cr3+nanorod with long lasting near infrared luminescence forin vivoimaging and drug delivery[J]. RSC Advances,2015,5:12886-12889.
[54] SUN Y J,DONG W B,WANG H Y,et al. Template synthesis of PMAA@chitosan hollow nanorods for docetaxel delivery[J]. Polymer Chemistry,2013,4(8):2489-2495.
[55] FAN M M,ZHANG W Z,CHENG C,et al. Evaluation of rod-shaped nanoparticles as carriers for gene delivery[J]. Particle & Particle Systems Characterization,2014,31(9):994-1000.
[56] LI D,TANG Z M,GAO Y Q,et al. A bio-inspired rod-shaped nanoplatform for strongly infecting tumor cells and enhancing the delivery efficiency of anticancer drugs[J]. Advanced Functional Materials,2016,26(1):66-79.
[57] TIAN Y,GAO S J,WU M,et al. Tobacco mosaic virus based 1D nanorod-drug carrierviathe integrin-mediated endocytosis pathway[J]. ACS Applied Materials & Interfaces,2016,8 (17):10800-10807.
[58] PEER A,DHAKAL R,BISWAS R,et al. Nanoscale patterning of biopolymers for functional biosurfaces and controlled drug release[J].Nanoscale,2016,8:18654-18664.
[59] ARIGA K,LVOV Y M,KAWAKAMI K,et al. Layer-by-layer self-assembled shells for drug delivery[J]. Advanced Drug Delivery Reviews,2011,63:762-771.
[60] LIN Y,YAO W,CHENG Y,et al. Multifold enhanced T2relaxation of ZnFe2O4nanoparticles by jamming them inside chitosan nanospheres[J]. Journal of Materials Chemistry,2012,22:5684-5693.
[61] AILLON K L,XIE Y,EL-GENDY N,et al. Effects of nanomaterial physicochemical properties onin vivotoxicity[J]. Advanced Drug Delivery Reviews,2009,61:457-466.
[62] POWERS K W,PALAZUELOS M,MOUDGIL B M,et al.Characterization of the size,shape,and state of dispersion of nanoparticles for toxicological studies[J]. Nanotoxicology,2007,1:42-51.
[63] ZHANG C Y,ZHANG F,WANG W,et al. Chitosan coated gold nanorod chelating gadolinium for MRI-visible photothermal therapy of cancer[J]. RSC Advances,2016,6:111337-111344.
[64] CAI B Y,HUANG Z B,WU Z,et al. Fabrication of RGD-conjugated Gd(OH)3:Eu nanorods with enhancement of magnetic resonance,luminescence imaging andin vivotumor targeting[J]. Dalton Transactions,2016,45:14063-14070.
[65] WU Z,HUANG Z,YIN G,et al. Fabrication of Gd/Eu-codoped SmPO4nanorods for dual-modal magnetic resonance and bio-optical imaging[J]. Journal of Colloid and Interface Science,2016,466:1-11.
Fabrication and properties of novel nanorods drug carriers
LI Wei1,ZHAO Yifan1,CAO Yuanyuan1,HU Pingjing1,LI Xiangzi1,2
(1The School of Pharmacy,Wannan Medical College,Wuhu 241002,Anhui,China;2School of Chemistry & Chemical Engineering,Jiangsu University,Zhenjiang 212013,Jiangsu,China)
Nanorods with unique structure,excellent performance and important biomedical applications value,have gradually become a novel drug carrier. The paper discussed the recent research progresses in nanorods drug carriers,including fabrications and applications of some typical drug carriers,such as Au nanorods,hydroxyapatite(HAP)nanorods, and mesoporous silica(MSP) nanorods. The general synthesis process of drug carries(Au nanorods,Au@SiO2nanorods,Au@C nanorods,hollow Au nanorods)were primarily analyzed. The surface modification,functionalization,loading and controlled release of those carries based on Au nanorods were briefly discussed. The controlled-release properties of some familiar nanorods carriers were analyzed and compared. Three common release methods for nanorods carries were presented. Direct-release with the as-dispersed carries,is economical and practicable,but the required carrier dosage is large and easy to loss. The release method with dialysis bag requires the lower carrier dosage,does not need separation but needs to purchase dialysis bag. The third method,release in cuvette,is mostly used at photosensitive carriers. Furthermore,the size andin vitrocytotoxicity of nanorods carriers were discussed in detail,and their metabolism propertiesin vivosuch asdistribution and immune clearance were also introduced. Finally,the outlook on the development of nanorods carriers was presented. Future research on nanorods carries maybe focus on multiple stimuli-responsive heterogeneous carries based on nanorods,hollow nanorods carries and nanotube carries.
nanorods carriers;composites;nanomaterials;distributions;cytotoxicity
R318.08;R914
:A
:1000-6613(2017)09-3436-11
10.16085/j.issn.1000-6613. 2017-0159
2017-01-23;修改稿日期:2017-03-23。
安徽省高校自然科学基金重点项目(KJ2015A158)、安徽省高校优秀青年人才支持计划重点项目(gxyqZD2016169)、中国博士后科学基金面上项目(2015M581731)、江苏省博士后科研资助计划项目(1501066C)及大学生创新创业计划项目(201610368119,201510368040,201510368121)。
李薇(1988—),女,硕士研究生。联系人:李祥子,博士,教授,研究方向为功能纳米材料,E-mail:li-xiang-zi@163.com。
