MIF基因沉默对肝癌细胞系增殖凋亡及ERK/RSK2信号通路的影响
2017-09-04周鸣余蕾李琴山王碧杨国珍
周鸣,余蕾,李琴山,王碧,杨国珍
(1.贵州医科大学 医学检验学院,贵州 贵阳550025;2.贵州医科大学附属医院贵州省产前诊断中心,贵州 贵阳550002)
MIF基因沉默对肝癌细胞系增殖凋亡及ERK/RSK2信号通路的影响
周鸣1,余蕾2,李琴山2,王碧2,杨国珍1
(1.贵州医科大学 医学检验学院,贵州 贵阳550025;2.贵州医科大学附属医院贵州省产前诊断中心,贵州 贵阳550002)
目的 探讨RNA干扰介导的巨噬细胞移动抑制因子(MIF)基因沉默对肝癌细胞系SMMC-7721与HepG2凋亡的影响及可能的作用机制。方法 将MIF-siRNA干扰序列转染SMMC-7721与HepG2细胞,以Con-siRNA序列转染的细胞作为对照。采用实时荧光定量聚合酶链反应(qRT-PCR)及Western blot检测MIF沉默效果,CCK-8法测定细胞增殖情况,流式细胞术检测细胞凋亡率。采用Western blot检测MIF沉默后凋亡相关基因BCL-2、BAX、P53的蛋白水平及细胞外信号调节激酶(ERK)、P90核糖体s6激酶2(RSK2)、糖原合成激酶3β(GSK3β)、Bad蛋白水平及其磷酸化水平。结果 沉默组细胞中MIF mRNA及蛋白表达水平与对照组比较,差异有统计学意义(P<0.05),沉默组低于对照组;两组细胞增殖能力比较,差异有统计学意义(P<0.05),MIF沉默组细胞增殖能力低于对照组;两组凋亡率比较,差异有统计学意义(P<0.05),MIF沉默组细胞凋亡率高于对照组;两组细胞BAX、P53、BCL-2蛋白水平比较,差异有统计学意义(P<0.05),MIF沉默组细胞BAX、P53的蛋白表达水平高于对照组,而BCL-2蛋白水平低于对照组;沉默组与对照组细胞中ERK、RSK2及Bad蛋白水平比较,差异均无统计学意义(P>0.05),而沉默组与对照组细胞中GSK3β、p-GSK3β、p-ERK、p-RSK2及p-Bad蛋白水平比较,差异均具有统计学意义(P<0.05)。结论 MIF基因沉默抑制SMMC-7721与HepG2细胞的增殖能力并促进细胞凋亡可能是通过调节ERK/RSK2信号通路实现的。
巨噬细胞移动抑制因子;基因沉默;肝癌细胞系;凋亡;细胞外信号调节激酶
原发性肝癌以肝细胞肝癌(hepatocellular carcinoma,HCC)为主,发病率近年来逐渐增高,在所有恶性肿瘤中居世界第6位,国内第3位[1]。巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)是一种功能多样的细胞因子,研究表明[2-4],其在多种肿瘤组织细胞中高表达,并参与了肿瘤的发生发展和侵袭转移。近年来研究发现[5-7],MIF在多数肝癌患者血清及肝癌组织中呈高表达并促进肝癌细胞增殖,但目前国内外关于MIF与肝癌细胞凋亡之间关系的研究较少。因此,本课题拟利用siRNA介导的 MIF基因沉默来研究其对肝癌细胞系SMMC-7721与HepG2凋亡的影响并探讨可能的分子信号通路,为选择MIF作为肝细胞癌治疗靶点提供依据。
1 材料与方法
1.1 试剂及仪器
MIF-siRNA和Con-siRNA序列由吉凯基因公司合成(MIF-siRNA序列:正向5'-GGGUCUACAUC AACUUCAACUAUUAdTdT-3',反向3'-dTdTCCCAG AUGUAGUUGAUAAU-5';Con-siRNA序列:正向5'-UUCUCCGAACGUGUCACGUdTdT-3',反向3'-dTdT AAGAGGCUUGCACAGUGCA-5'),配制终浓度为20μmol。LipofectamineTM2000、DMEG高糖培养基、胎牛血清、胰蛋白酶(北京鼎国昌盛生物公司),Trizol试剂(大连宝生物公司),兔抗人MIF、BCL-2、BAX、P53、与GAPDH一抗、羊抗兔二抗(英国Abcam公司),ERK、p-ERK、RSK2、p-RSK2、GSK-3β、p-GSK-3β、Bad与p-Bad一抗(美国Santacruze公司),蛋白Marker、PVDF膜、脱脂奶粉、TBST、ECL发光试剂盒等(北京康为世纪生物公司),CCK-8试剂盒(上海谷研生物公司),SMMC-7721与HepG2细胞系(中国科学院上海生化与细胞所)传代后用于本实验。蛋白膜成像扫描仪(美国BioRad公司)。
1.2 MIF-siRNA转染细胞
当六孔板中SMMC-7721与HepG2细胞生长至60%左右,每孔用5μl MIF-siRNA和Con-siRNA稀释液进行转染(siRNA工作浓度为50 nmol),方法参照LipofectamineTM2000说明书。
1.3 qRT-PCR及Western blot检测MIF沉默效果
转染 48 h后,收集 MIF沉默组和对照组SMMC-7721与HepG2细胞,Trizol法提取总RNA并测定浓度。以人GAPDH为内参,按照试剂盒说明书配制反应体系,采用Fast 7500 Real Time System进行实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction,qRT-PCR)检测,每个样品设3个复孔。反应条件为95℃30 s,95℃3 s,60℃30 s,共40个循环。数据分析采用比较CT法(ΔΔCT),相对表达量(RQ)=2-ΔΔCT,取3次平均值作图。Western blot方法见1.6。引物序列如下:GAPDH-正向:5'-GGAGCCAAAAGGGTCATCATCT C-3',GAPDH-反向:5'-GAGGGGCCATCCACAGTC TTCT-3';MIF-正向:5'-CTATTACGACATGAACG CG-3',MIF-反向:5'-CAACTCCACCTTCGCCTAA-3'。
1.4 CCK-8检测细胞增殖
转染SMMC-7721与HepG2 24 h后,收集细胞并接种于96孔板中,每孔100μl培养液,约2 500个细胞,每组设3个复孔。于接种第1天至第5天采用 CKK-8法检测 MIF沉默对 SMMC-7721及HepG2细胞增殖的影响。每孔加入100μl新鲜培养基和10μl CCK-8溶液,于37℃、5%二氧化碳CO2培养箱中孵育2 h,测定细胞在A450 nm处的吸收值,连测5 d,实验重复3次。绘制细胞生长曲线。
1.5 流式细胞术检测细胞凋亡率
MIF-siRNA转染SMMC-7721与HepG2 48 h后,胰蛋白酶消化处理并离心收集沉默组和对照组细胞各5×105个于1.5 ml EP管中,每管加入500μl结合缓冲液悬浮细胞,加入5μl Annexin V-FITC及10μl PI混匀并室温避光放置约20 min,然后采用流式细胞术检测细胞凋亡情况。实验重复3次。
1.6 Western blot检测蛋白水平
转染 48 h后,收集沉默组和对照组SMMC-7721与HepG2细胞,提取总蛋白并测定浓度。取100μg总蛋白,加入5×Loading Buffer,沸水浴处理10 min,再冰浴5 min,-20℃保存备用。经SDS-PAGE凝胶电泳、转膜与封闭后用MIF、BCL-2、BAX、P53、ERK、p-ERK、RSK2、p-RSK2、GSK-3β、p-GSK-3β、Bad、p-Bad与GAPDH一抗及二抗杂交,加上发光混合液后采用蛋白膜成像扫描仪检测结果。蛋白相对表达量=目的蛋白灰度值/GAPDH灰度值。
1.7 统计学方法
采用SPSS17.0进行统计学分析,数据采用均数±标准差(±s)表示,组间比较采用t检验,P< 0.05为差异有统计学意义。
2 结果
2.1 MIF沉默效果
MIF siRNA转染细胞48 h后提取细胞总RNA与蛋白分别进行qRT-PCR与Western blot检测。结果显示,与对照组SMMC-7721及HepG2细胞相比,沉默组2种细胞中MIF mRNA与对照组比较,差异有统计学意义(t=5.011和5.274,P=0.007和0.006),沉默组2种细胞中蛋白水平与对照组比较,差异有统计学意义(t=12.875和14.423,P=0.000和0.000),沉默组表达降低。表明MIF siRNA的沉默效果较好。见图1。
2.2 细胞增殖结果
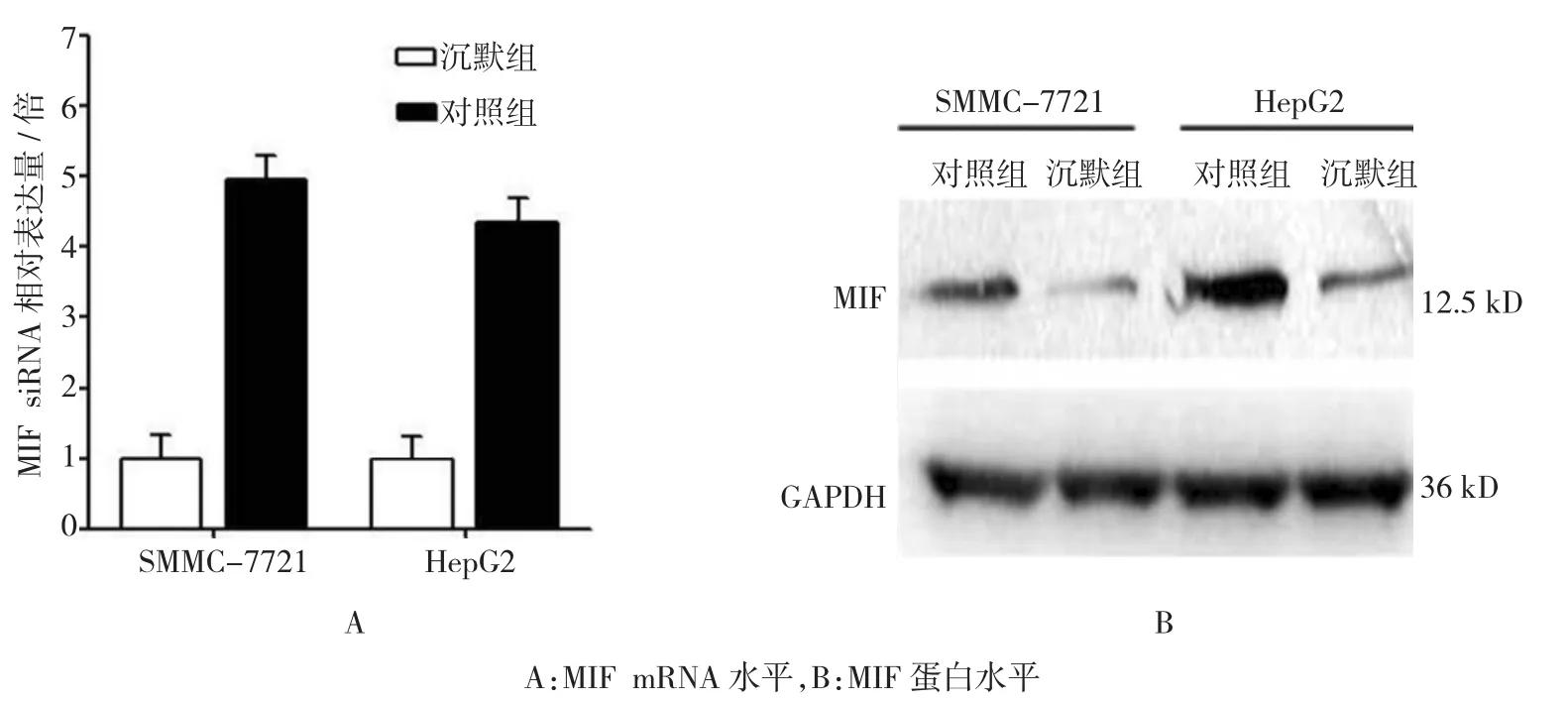
图1 MIF siRNA沉默效果

图2 细胞增殖能力
采用CCK-8法检测MIF沉默对2种细胞增殖能力的影响。结果显示,与对照组相比,MIF沉默第3天至第5天,沉默组SMMC-7721及HepG2细胞的增殖能力差异有统计学意义(t=5.155、3.362和4.492,P=0.007、0.028和 0.011;t=3.319、3.552和4.042,P=0.029、0.024和0.016)。沉默组均下降。表明MIF基因沉默抑制了SMMC-7721与HepG2细胞的增殖能力。见图2。
2.3 细胞凋亡情况
采用流式细胞术检测 MIF siRNA转染SMMC-7721与HepG2细胞48 h后细胞凋亡率。结果显示,两组SMMC-7721与HepG2细胞的早期凋亡率比较,差异有统计学意义(t=3.670和2.941,P= 0.021和0.042),MIF沉默组SMMC-7721与HepG2细胞的早期凋亡率增加,而2种细胞晚期凋亡率比较,差异有统计学意义(t=6.552和11.803,P=0.003和0.000)。表明MIF被沉默后,促进了细胞凋亡,尤其是促进了晚期细胞凋亡。见图3。
2.4 凋亡相关基因的蛋白水平
Western blot检测结果显示,两组细胞BAX、 P53、BCL-2蛋白水平比较,差异有统计学意义(P<0.05),MIF沉默组细胞BAX、P53的蛋白表达水平高于对照组,而BCL-2蛋白水平低于对照组。表明MIF被沉默后,促凋亡基因表达增加,抗凋亡基因表达减少。见表1、2,图4。
2.5 ERK通路蛋白激酶及磷酸化水平
Western blot检测结果显示,沉默组与对照组SMMC-7721和HepG2细胞中ERK、RSK2与Bad总蛋白水平比较,均差异无统计学意义(P>0.05)。沉默组SMMC-7721与HepG2细胞中GSK-3β蛋白水平与对照组相比,差异有统计学意义(P<0.05)。沉默组高于对照组。沉默组SMMC-7721与HepG2细胞中p-ERK、p-RSK2、p-Bad和p-GSK-3β蛋白水平与对照组相比,均差异有统计学意义(P<0.05),沉默组下调。表明MIF基因沉默影响了ERK信号通路中相关蛋白的活性。见图5,表3、4。

图3 细胞凋亡情况
表1 两组SMMC-7721细胞中相关蛋白相对表达量比较 (n=3,±s)

表1 两组SMMC-7721细胞中相关蛋白相对表达量比较 (n=3,±s)
组别P53对照组 0.73±0.04 0.61±0.08 0.22±0.02 0.15±0.03沉默组 0.12±0.01 0.16±0.03 0.45±0.06 0.47±0.05 t值 25.625 9.122 6.299 9.505 P值 0.000 0.001 0.003 0.001MIFBCL-2BAX
表2 两组HepG2细胞中相关蛋白相对表达量比较 (n=3,±s)
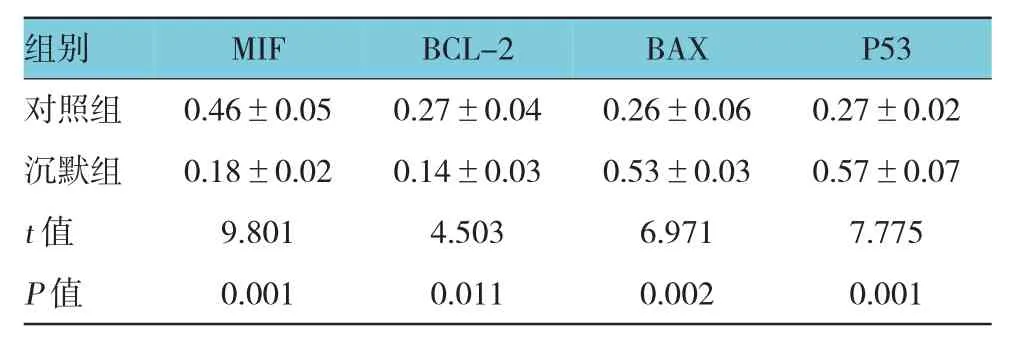
表2 两组HepG2细胞中相关蛋白相对表达量比较 (n=3,±s)
组别P53对照组 0.46±0.05 0.27±0.04 0.26±0.06 0.27±0.02沉默组 0.18±0.02 0.14±0.03 0.53±0.03 0.57±0.07 t值 9.801 4.503 6.971 7.775 P值 0.001 0.011 0.002 0.001MIFBCL-2BAX
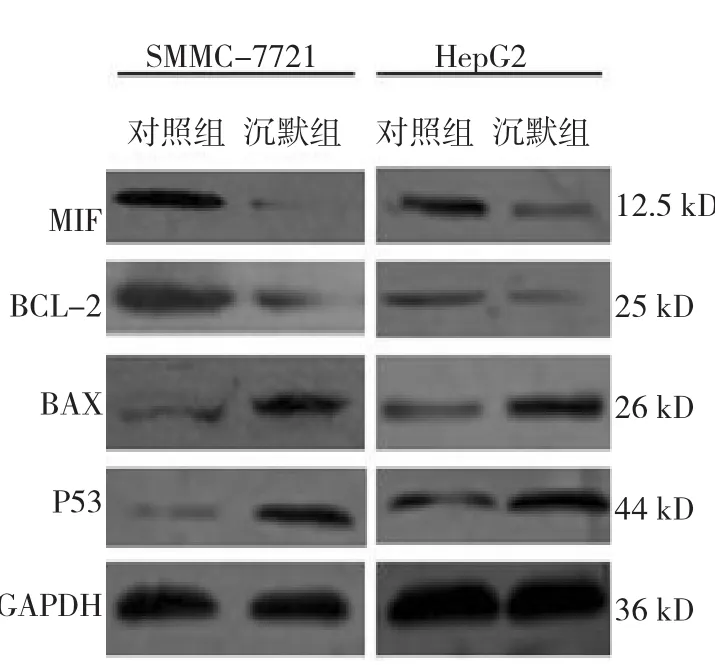
图4 两组细胞凋亡相关基因的蛋白水平
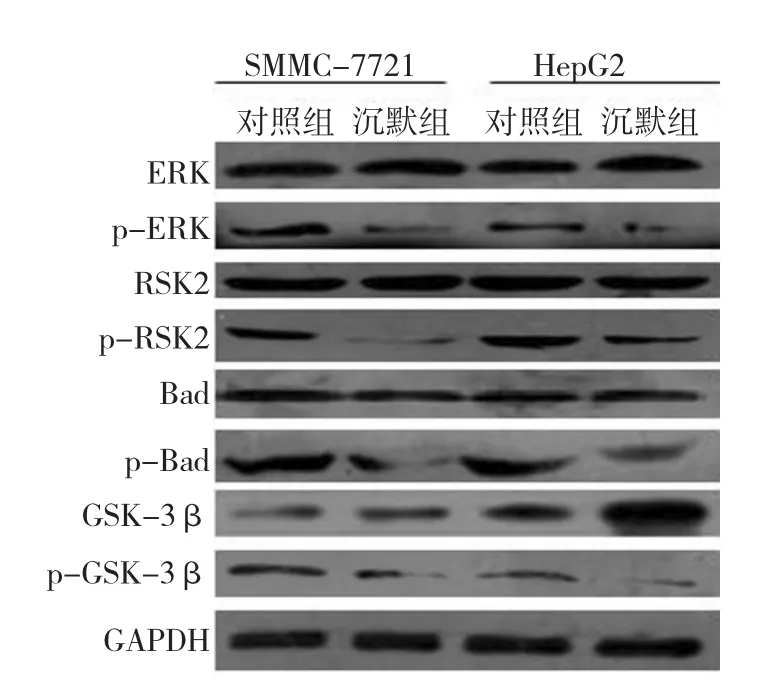
图5 两组细胞ERK通路蛋白激酶及磷酸化水平
表3 两组SMMC-7721细胞中相关蛋白相对表达量比较 (n=3,±s)
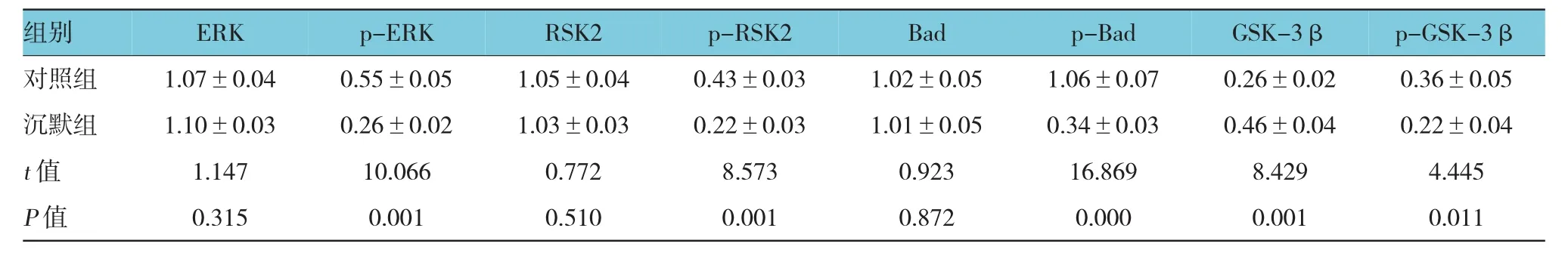
表3 两组SMMC-7721细胞中相关蛋白相对表达量比较 (n=3,±s)
组别p-Bad对照组 1.07±0.04 0.55±0.05 1.05±0.04 0.43±0.03 1.02±0.05 1.06±0.07沉默组 1.10±0.03 0.26±0.02 1.03±0.03 0.22±0.03 1.01±0.05 0.34±0.03 t值P值ERKp-ERKRSK2p-RSK2Badp-GSK-3β 0.26±0.02 0.36±0.05 0.46±0.04 0.22±0.04 8.429 4.445 0.001 0.011 GSK-3β1.147 0.315 10.066 0.001 0.772 0.510 8.573 0.001 0.923 0.872 16.869 0.000
表4 两组HepG2细胞中相关蛋白相对表达量比较 (n=3,±s)

表4 两组HepG2细胞中相关蛋白相对表达量比较 (n=3,±s)
组别p-Bad对照组 0.91±0.03 0.32±0.03 1.03±0.02 0.72±0.06 0.85±0.03 0.91±0.03沉默组 0.94±0.06 0.12±0.02 0.99±0.05 0.37±0.07 0.83±0.04 0.35±0.05 t值P值ERK p-ERK RSK2p-RSK2Bad GSK-3β 0.786 0.476 10.142 0.001 1.043 0.356 6.976 0.002 0.606 0.577 18.559 0.000 p-GSK-3β 0.32±0.04 0.25±0.04 1.12±0.05 0.13±0.02 24.042 5.091 0.000 0.007
3 讨论
HCC作为人类最常见的一种恶性肿瘤,已成为仅次于胃癌和肺癌的第3大杀手[8]。肿瘤的发展依赖于降低肿瘤细胞凋亡的发生,因此,促进肿瘤细胞凋亡是一种抑制肿瘤发展的潜在策略。MIF广泛存在于各种组织,最初被认为是一种炎症介质,具有抑制巨噬细胞移动和黏附、参与机体炎症反应和调控细胞增殖分化等作用[9-10]。研究发现[11-12],MIF与肿瘤的发生发展关系密切,且MIF在肝癌患者血清、肝癌组织及肝癌细胞系中呈现高表达[13-14],其可能参与了肝癌的发生和发展。但目前关于MIF与肝癌细胞凋亡之间的研究较少。因此,本课题拟利用siRNA介导的 MIF基因沉默来研究其对肝癌细胞系SMMC-7721与HepG2凋亡的影响并探讨可能的分子作用机制。
本研究首先将MIF-siRNA转染肝癌细胞系SMMC-7721与HepG2,48 h后采用qRT-PCR及 Western blot技术检测MIF基因沉默效果,结果显示,与对照组相比,沉默组SMMC-7721与HepG2细胞中MIF mRNA及蛋白水平降低,表明MIF基因沉默效果良好。CCK-8实验结果表明MIF沉默明显抑制了2种肝癌细胞的增殖,与HUANG等[15]研究结果一致。流式细胞术检测结果显示,MIF基因沉默增加了肝癌细胞的凋亡率,且更促进了细胞不可挽回的晚期凋亡,该结果表明,MIF基因表达水平与肝癌细胞凋亡之间存在密切关系。然后采用Western blot方法检测了几种常见的凋亡相关基因的蛋白水平,结果显示,MIF基因沉默可明显下调抗凋亡蛋白Bcl-2水平并上调促凋亡蛋白P53与Bax水平。P53基因与细胞基因组完整性、修复DNA损伤、促进癌细胞凋亡等关系密切,其可以通过激活BAX并下调BCL-2的表达来共同发挥作用,但P53促进肿瘤细胞凋亡的作用可被MIF抑制[16-17],该结果从分子水平上表明MIF基因沉默对肝癌细胞凋亡的促进作用。
ERK通路是丝裂原活化蛋白激酶信号通路重要组成部分,在调控细胞增殖、存活与凋亡方面发挥重要作用[18]。为进一步探讨MIF基因沉默促进肝癌细胞凋亡的分子作用机制,检测了细胞中ERK通路中相关基因的蛋白水平。Western blot结果显示,与对照组相比,沉默组细胞中ERK、RSK和Bad的蛋白水平并未发生明显变化,而p-ERK、p-RSK2、p-Bad和p-GSK-3β的蛋白水平下调,GSK-3β蛋白水平上调。蛋白激酶的磷酸化水平直接影响了该激酶自身的活性及其下游新号分子的活化进而调控信号传导过程。RSK2是ERK下游的一级效应蛋白,活化后可通过调节与增殖凋亡相关蛋白GSK-3β、Bad等一些下游靶蛋白影响细胞增殖、凋亡等。本研究表明,MIF基因沉默后,细胞中p-ERK水平下降,减少的p-ERK直接导致下游RSK2磷酸化水平的降低,同样,p-RSK2水平下降影响了直接下游蛋白GSK-3β的磷酸化,p-GSK-3β下调可抑制细胞的增殖与存活。Bad也是RSK2的底物蛋白之一,MIF沉默下调了p-Bad水平,进而促进了细胞的凋亡。
综上所述,siRNA介导的MIF基因沉默抑制肝癌细胞系SMMC-7721与HepG2的增殖能力并促进细胞凋亡可能是通过调节ERK/RSK2信号通路发挥作用。该研究为选择MIF作为肝癌的治疗靶点提供一定的依据,但癌症的发生过程涉及多种因素的参与,仍需进一步深入地研究。
[1]LI M,QIAO C,QIN L,et al.Application of traditional Chinese medicine injection in treatment of primary liver cancer:a review[J]. J Tradit Chin Med,2012,32(3):299-307.
[2]LO M C,YIP T C,CHENG W,et al.Role of MIF/CXCL8/CXCR2 signaling in the growth of nasopharyngeal carcinoma tumor spheres[J].Cancer Letters,2013,335(1):81-92.
[3]CHEN L Z,ZHOU X,FAN L X,et al.Macrophage migration inhibitory factor promotes cyst growth in polycystic kidney disease[J]. Journal of Clinical Investigation,2015,125(6):2399-2412.
[4]马宁,周云.胃癌组织中miR-451与MIF的表达及与临床病理的关系[J].中国老年学杂志,2015,3:655-656.
[5]ZHAO Y M,WANG L,DAI Z,et al.Validity ofplasma macrophage migration inhibitory factor for diagnosis and prognosis of hepatocellular carcinoma[J].Int J Cancer,2011,129(10): 2463-2472.
[6]WANG D,LUO L,CHEN W,et al.Significance of the vascular endothelial growth factor and the macrophage migration inhibitory factor in the progression of hepatocellular carcinoma[J].Oncology reports,2014,31(3):1199-1204.
[7]陶斌胜,熊茂明,曹立宇.肝癌组织中MIF、TNF-α的表达及临床意义[J].临床与实验病理学杂志,2011,11:1177-1180.
[8]LI Z,JING A R,WANG S B,et al.Clinicopathological predictors of poor survival and recurrence after curative resection in hepatocellular carcinoma without portal vein tumor thrombosis[J]. Pathology&Amp,Oncology Research,2015,21(1):131-138.
[9]WANG K,LIANG Q,WEI L,et al.MicroRNA-608 acts as a prognostic marker and inhibits the cell proliferation in hepatocellular carcinoma by macrophage migration inhibitory factor[J].Tumour Biol,2016,37(3):3823-3830.
[10]SAULER M,BUCALA R,LEE P J.Role of macrophage migration inhibitory factor in age-related lung disease[J].AJP: Lung Cellular and Molecular Physiology,2015,309(1):1-10.
[11]HU C T,GUO L L,FENG N,et al.MIF,secreted by human hepatic sinusoidal endothelial cells,promotes chemotaxis and outgrowth of colorectal cancer in liver prometastasis[J].Oncotarget,2015,6(26):22410-22423.
[12]AXEL D,CHRISTIAN P,DANIELA M,et al.Inhibition of MIF leads to cell cycle arrest and apoptosis in pancreatic cancer cells[J].Journal of Surgical Research,2010,160(1):29-34.
[13]KAMEL M M,SAAD M F,MAHMOUD A A,et al.Evaluation ofserum PIVKA-II and MIF as diagnostic markers for HCV/HBV induced hepatocellular carcinoma[J].Microb Pathog, 2014,77:31-35.
[14]于晓辉,段惠春,杨晓萍,等.肝细胞性肝癌血清中MIF、IL-17、IL-10的检测及其临床意义[J].中国肿瘤临床,2013,12:714-716.
[15]HUANG X H,JIAN W H,WU Z F,et al.Small interfering RNA(siRNA)-mediated knockdown of macrophage migration inhibitory factor(MIF)suppressed cyclin D1 expression and hepatocellular carcinoma cell proliferation[J].Oncotarget,2014,5 (14):5570-5580.
[16]FUKAYA R,OHTA S,YAGUCHI T,et al.MIF maintains the tumorigenic capacity of brain tumor-initiating cells by directly inhibiting p53[J].Cancer Res,2016,76(6):1305-1314.
[17]WANG H,YANG Z,LIU C,et al.RBP-J-interacting and tubulin-associated protein induces apoptosis and cell cycle arrestin human hepatocellu larcarcinoma by activating the p53-Fbxw7 pathway[J].Biochem Biophys Res Commun,2014, 454(1):71-77.
[18]CUI YT,LU PR,SONG G,et al.Involvement of PI3K/Akt, ERK and p38 signaling pathways in emodin-mediated extrinsic and intrinsic human hepatoblastoma cell apoptosis[J].Food and Chemical Toxicology,2016,92:26-37.
(张蕾 编辑)
Effect of silencingMIFgene by RNAi on proliferation,apoptosis and ERK/RSK2 signal pathway in hepatic carcinoma cell line
Ming Zhou1,Lei Yu2,Qin-shan Li2,Bi Wang2,Guo-zhen Yang1
(1.School of Medical Laboratory Sciences,Guizhou Medical University,Guiyang,Guizhou 550025, China;2.Guizhou Provincial Prenatal Diagnosis Center,the Affiliated Hospital of Guizhou Medical University,Guiyang,Guizhou 550002,China)
Objective To investigate the effect of silencingMIFgene by RNA interference on apoptosis of hepatic carcinoma cell lines SMMC-7721 and HepG2 and the potential mechanism.Methods The MIF-siRNA interference sequence was transfected into SMMC-7721 and HepG2 cells,Con-siRNA transfected cells were used as the control group.The silencing effect ofMIFgene was detected by qRT-PCR and Western blot.The ability of cell proliferation was evaluated by CCK-8 method.The cell apoptosis rate was detected by flow cytometry.The protein levels of Bcl-2,Bax,p53,extracellular signal-regulated kinase (ERK),p-ERK,p90 ribosomal s6 kinase 2(RSK2), p-RSK2,glycogen synthase kinase 3β(GSK3β),p-GSK3β,Bad and p-Bad were tested by Western blot.Results The expression levels of MIF gene in the cells of the silent groups were significantly lower than that in the controlgroup(P<0.05).The ability of cell proliferation in theMIFsilent groups was obviously lower than that in the control group (P<0.05).The cell apoptosis rates in theMIFsilent groups were significantly higher than that in the control group(P<0.05).Bax and p53 protein levels in the cells of theMIFsilent groups were higher than those of the control group,while the Bcl-2 protein level was lower than that of the control group (P<0.05).Meanwhile,the protein levels of ERK,RSK2 and Bad were not significantly different between the twoMIFsilent groups and the control group(P>0.05).However,the protein levels of GSK3β,p-GSK3β,p-ERK,p-RSK2 and p-Bad were significantly different between the two silent groups and the control group (P<0.05).Conclusions Silence ofMIF gene inhibits the proliferation and promotes the apoptosis of both SMMC-7721 and HepG2 cells maybe via regulation of the ERK/RSK2 signaling pathway.
MIF;gene silencing;hepatic carcinoma cell line;apoptosis;ERK
R735.7
A
2017-01-16
杨国珍,E-mail:myyl2004@163.com ·22·
10.3969/j.issn.1005-8982.2017.19.005
1005-8982(2017)19-0022-06
