吡非尼酮对大鼠肾间质纤维化的防治作用研究*
2017-09-04徐建华肖红波程玉花王瑜张桂玲吕金雷邵毅
徐建华,肖红波,程玉花,王瑜,张桂玲,吕金雷,邵毅
(1.南昌大学第一附属医院 肾内科,江西 南昌 330006;2.北京大学深圳医院 肾内科,广东 深圳 518036;3.南昌大学第一附属医院 眼科,江西 南昌 330006)
吡非尼酮对大鼠肾间质纤维化的防治作用研究*
徐建华1,肖红波2,程玉花1,王瑜1,张桂玲1,吕金雷1,邵毅3
(1.南昌大学第一附属医院 肾内科,江西 南昌 330006;2.北京大学深圳医院 肾内科,广东 深圳 518036;3.南昌大学第一附属医院 眼科,江西 南昌 330006)
目的 研究吡非尼酮(PFD)对大鼠肾间质纤维化的作用及其作用机制,为临床使用吡非尼酮提供理论依据。方法 24只标准雄性SD大鼠,随机分为3组:正常组(NC组)、模型组(M组)及吡非尼酮治疗组(S组)。M组及S组行左侧输尿管结扎术,复制肾间质纤维化模型。S组予吡非尼酮250 mg/(kg·d)灌胃,NC组及M组大鼠予等量1%羧甲基纤维素钠溶液灌胃。分别于手术后第1、3、5、7天处死各组大鼠各2只,取梗阻侧肾脏。HE染色观察各组肾组织病理变化,实时荧光定量聚合酶链反应(qRT-PCR)检测结缔组织生长因子(CTGF)mRNA表达水平,Western blot检测转化生长因子-β(TGF-β)及α-平滑肌激动蛋白(α-SMA)的蛋白表达水平。结果 NC组未显示肾纤维化,M组显示大鼠肾间质纤维化及炎症细胞浸润。NC组TGF-β、α-SMA蛋白表达均较低,M组TGF-β、α-SMA蛋白及CTGF mRNA表达较NC组均升高,差异有统计学意义(P<0.05),且随着梗阻时间延长,各物质表达量增高,但第7天M组及S组上述物质表达量较第5天减少,且M组与S组之间表达差异无统计学意义(P>0.05);S组上述物质各时间点表达则较M组均减少,差异有统计学意义(P<0.05)。结论 吡非尼酮可能通过抑制大鼠肾组织TGF-β和CTGF的表达进而减少成纤维细胞转化为肌成纤维细胞,减少细胞外基质(ECM)的沉积,发挥抗肾纤维化作用。
吡非尼酮;单侧输尿管梗阻;肾间质纤维化;结缔组织生长因子;转化生长因子-β;α-平滑肌肌动蛋白
纤维化过程是组织损伤后的一种病理生理过程,是指由各种致病因子所致结缔组织异常增生,如果损伤因素长期不能去除,纤维化的长期持续存在最终将导致器官的结构改变和功能减退。肾小管间质纤维化(tubulointerstitial fibrosis,TIF),是各种致病病因引起进行性肾损害的主要病理特征,是导致终末期肾病(end-stage renal disease,ESRD)的根本病理改变之一,是多种肾疾病发展至终末期肾衰竭的共同病理特征[1],TIF的出现往往预示着预后不良,可以作为肾功能恶化的一个十分准确的预测指标,其程度与肾功能减退密切相关[2]。阻断肾纤维化的形成及其发展,就能有效地阻止慢性肾病的进展及肾衰竭的发生。但是目前对纤维化疾病的治疗仅限于非特异性抗炎药物、免疫抑制剂及糖皮质激素等的应用,临床上尚缺乏真正用于治疗纤维化过程的有效药物。吡非尼酮(Pirfenidone,PFD)是目前已经证实的少数可延缓甚至逆转纤维化的药物之一。已有实验证实其能阻止甚至逆转细胞外基质(extrac ellular matrix,ECM)的积聚,能够有效地延缓肺纤维化、肝纤维化、青光眼术后滤过道瘢痕化等的进展[3-4],但是关于其在肾间质纤维化中的作用报道甚少。本研究以单侧输尿管梗阻复制肾间质纤维化模型,探讨其作用及可能的机制。
1 材料与方法
1.1 实验动物及试剂
实验动物:24只标准雄性SD大鼠,体重150~180 g(购自南昌大学医学院实验动物科学部)。术前检查均无全身病变。主要试剂:PDF(P2116;美国Sigma公司),1%羧甲基纤维素钠溶液,小鼠抗大鼠α-SMA单克隆抗体(美国Abcam公司),转化生长因子-β(transforming growth factor-β,TGF-β)抗体(美国Abcam公司),辣根酶标记山羊抗小鼠IgG(北京中山金桥生物技术有限公司)。Trizol总RNA抽提试剂盒、逆转录试剂盒,实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒(北京全式金生物技术有限公司),qRT-PCR引物(上海生工生物工程股份有限公司)。
1.2 动物模型的分组、复制及取材
1.2.1 模型的分组和复制 24只标准雄性SD大鼠,每笼6只,于标准实验室环境常规喂养,适应性喂养1周后,随机分为正常组(NC组,n=8),模型组(M组,n=8)及PFD治疗组(S组,n=8)。M组及S组大鼠均在8%水合氯醛腹腔注射麻醉下接受手术,于左侧腹部取一长约3 cm纵行切口,逐层分离,暴露肾脏及膀胱,沿着肾脏膀胱走向寻找输尿管,分离并结扎左侧输尿管,关闭腹腔。各组大鼠正常饮食、进水。S组大鼠自手术当天起给予PFD 250 mg/(kg·d)灌胃,PFD溶于1%羧甲基纤维素钠溶液。NC组及M组大鼠自手术当天起给予等量1%羧甲基纤维素钠溶液灌胃。分别于手术后第1、3、5及7天处死各组大鼠各2只。
1.2.2 取材 处死前称大鼠体重,用8%水合氯醛腹腔注射麻醉,取左侧肾脏,去除包膜和结缔组织,洗净,沥干血迹,迅速置于液氮中过夜,次日转移至-80℃冰箱保存,备HE染色、Western blot及qRT-PCR检测用。所有实验步骤通过动物伦理委员会同意。
1.3 肾组织病理形态学观察
取出的肾组织经10%中性甲醛固定,常规包埋,按3μm的厚度行连续切片,行HE染色。
1.4 qRT-PCR检测梗阻侧肾组织中结缔组织生长因子(CTGF)mRNA表达水平
分别取M组及S组大鼠肾组织100 mg,按总RNA提取试剂盒、逆转录试剂盒说明书分别提取各组总RNA及逆转录合成cDNA模板,取2μl cDNA用于qRT-PCR反应。qRT-PCR所用引物序列见表1,β-actin mRNA作为内参照。qRT-PCR反应条件:预变性94℃30 s,变性94℃5 s,退火60℃,40个循环,每次实验设3复孔,独立实验重复3次。SDS软件分析cDNA扩增的相对表达量,实时定量PCR仪(ABI7500)检测出相对表达量RQ值(RQ值=2-Ct)用于统计学分析。

表1 β-actin及CTGF引物序列
1.5 Western blot检测TGF-β和α-SMA蛋白的表达
取液氮保存的肾组织,使用RIPA蛋白裂解液提取总蛋白,并用BCA法检测蛋白浓度。取30μg蛋白样品变性后经8%SDS-PAGE电泳3 h,200 mA转膜90 min至NC膜上,5%脱脂牛奶室温封闭1 h,分别用鼠抗大鼠TGF-β单抗(1∶1 000)、鼠抗大鼠α-SMA多抗(1∶100)、鼠抗大鼠β-actin单抗(1∶2 500)4℃孵育过夜,辣根过氧化物酶标记抗鼠IgG二抗(1∶1 000)室温1 h,洗膜后ECL显色成像。相同实验条件重复3次。以β-actin为内参照,通过计算目标蛋白与β-actin蛋白的灰度比值进行半定量分析。
1.6 统计学方法
应用SPSS18.0统计软件进行数据处理,计量数据用均数±标准差(±s)表示,多时间点比较采用重复测量设计的方差分析,同一时间点组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠实验过程中生活状态的比较
NC组大鼠反应灵敏、食欲佳、睡眠良好;手术后3 d,M组大鼠毛色开始逐渐变黄、色泽变黯淡、反应迟钝、食量下降、体重增加慢、自觉活动减少,梗阻时间越长,表现越明显;S组上述表现处于NC组及M组之间。
2.2 肾脏病理变化
HE染色显示NC组大鼠肾小管间质无明显纤维化,M组大鼠自第1天开始即有较为明显的间质增生、纤维化、炎症细胞浸润等,提示本次实验模型复制成功,可行后续实验。S组肾间质纤维化和炎症细胞浸润较M组减少。见附图。
2.3CTGF mRNA相对表达量
qRT-PCR结果显示,行单侧输尿管结扎术后第1、3、5及7天,M组及S组大鼠CTGF mRNA表达采用重复测量设计的方差分析,结果:第1、3及5天CTGF mRNA表达量有差异(F=19.721,P=0.046),随着梗阻时间越长,表达量越高,但第7天M组与S组表达量减少,且两组之间表达差异无统计学意义(F=0.127,P=0.739)。见表2。
2.4 各组TGF-β及α-SMA蛋白表达水平
正常组大鼠肾脏中仅有少量TGF-β、α-SMA表达,单侧输尿管结扎术后,M组及S组大鼠TGF-β及α-SMA蛋白表达采用重复测量设计的方差分析,结果:①与NC组比较,TGF-β第1、3及5天表达有差别(F=35.341,P=0.025),α-SMA第1、3、5及7天表达有差别(F=34.357,P=0.026),梗阻时间越长,表达量越高;②S组与M组比较,TGF-β第1、3及5天表达量降低(F=8.742,P=0.039),α-SMA第1、3及5天表达量降低(F=8.233,P=0.042);③第7天TGF-β及α-SMA S组与M组之间表达趋势无差别(F= 1.157和2.749,P=0.343和0.173)。见表3。
表2 肾组织CTGF mRNA表达变化 (n=8,±s)
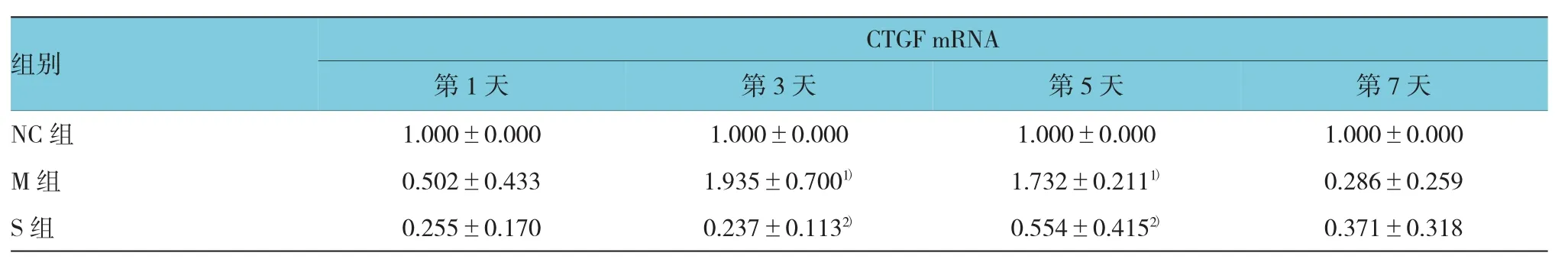
表2 肾组织CTGF mRNA表达变化 (n=8,±s)
注:1)与第1天M组比较,P<0.05;2)与相同时间M组比较,P<0.05
?
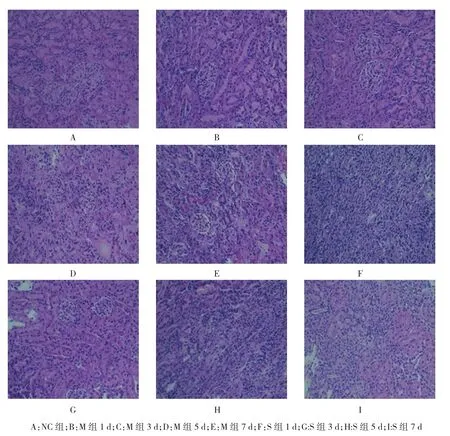
附图 各组肾组织病理变化 (HE,×200)
表3 各组肾组织TGF-β、α-SMA蛋白相对表达量 (n=8,±s)

表3 各组肾组织TGF-β、α-SMA蛋白相对表达量 (n=8,±s)
注:1)NC组比较,P<0.05;2)与相同时间M组比较,P<0.05
T G F -β α -S M A组别第7天N C组 1 . 0 0 0 ± 0 . 0 0 0 1 . 0 0 0 ± 0 . 0 0 0 1 . 0 0 0 ± 0 . 0 0 0 1 . 0 0 0 ± 0 . 0 0 0 1 . 0 0 0 ± 0 . 0 0 0 1 . 0 0 0 ± 0 . 0 0 0 1 . 0 0 0 ± 0 . 0 0 0 1 . 0 0 0 ± 0 . 0 0 0 M组 2 . 2 8 0 ± 0 . 4 5 21) 2 . 6 3 8 ± 0 . 4 7 01)2 . 9 2 8 ± 0 . 7 0 21)2 . 3 9 6 ± 0 . 5 4 31)2 . 2 1 3 ± 0 . 4 7 41)3 . 8 6 8 ± 1 . 1 4 51)5 . 8 3 1 ± 1 . 4 0 01)4 . 0 4 2 ± 1 . 1 4 31)S组 1 . 1 0 7 ± 0 . 5 2 92) 1 . 7 0 9 ± 0 . 2 6 41)2)1 . 5 5 0 ± 0 . 4 8 01)2)2 . 9 7 2 ± 0 . 7 5 21)1 . 3 0 9 ± 0 . 2 9 01)2)3 . 6 3 ± 1 . 0 2 31)2)3 . 1 1 8 ± 0 . 8 1 61)2)2 . 7 7 ± 0 . 6 7 81)第1天第3天第5天第7天第1天第3天第5天
3 讨论
纤维化主要病理改变为器官组织内纤维结缔组织增多,ECM沉积,实质细胞减少,持续进展可致器官结构破坏和功能减退,乃至衰竭,严重威胁人类健康和生命。任何引起ECM合成增加以及降解减少的因素都能够导致ECM的沉积。肾小管间质纤维化是各种肾病进展至终末期的共同通路,也是判断预后的关键指标,延缓肾间质纤维化的进展是治疗各种肾疾病、改善预后的有效方法[5]。
肾间质纤维化的发生机制较为复杂,至今尚未明确,TGF-β是参与多种纤维化过程的中枢因子,能够促进成纤维细胞的增殖和生长,增加胶原的合成以及减少ECM的降解。而CTGF是实现TGF-β主要纤维化效应的下游介质。ITO等[6]观察到,肾间质纤维化病变区内CTGF mRNA表达和肌成纤维细胞同步增加。TGF-β可以通过多种途径诱导CTGF的表达,实现其纤维化效应。FAN等[7]观察到,TGF-β可刺激体外培养的人近曲小管上皮细胞发生表型转化而转变为肌成纤维细胞,并可以高表达CTCF并增加ECM的合成[8]。肌成纤维细胞是间质细胞外基质持续增加的主要来源细胞[9],在TGF-β刺激下,体外培养的肾间质成纤维细胞可以高表达CTCF并增加ECM的合成。黄海长等[10]证明CTGF可直接诱导体外培养的肾间质成纤维细胞转化为肌成纤维细胞。肌成纤维细胞胞质内的α-SMA是其活跃的标志性抗原[11],α-SMA能较好地反映肾间质纤维化程度,其数量与肾间质纤维化程度密切相关,可作为判断预后的良好指标。张春等[12]研究提示,CTGF可能通过与胞膜上特定配体结合,启动细胞内信号转导,促进了α-SMA基因的转录,进而增加了α-SMA蛋白合成。
目前,对于器官纤维化,尚无效果特别肯定的药物,主要仍是使用激素及免疫抑制剂,但其效果甚微,且副作用较大。PFD是一种新型抗纤维化药物,属于一种羟基吡啶,化学名为5-甲基-1苯基-2 [1H]-吡啶酮,分子量为185.2,具有广谱的抗纤维化作用,其在多种器官纤维化中均被证实有良好的抗纤维化作用,IYER等[13]用博来霉素诱导的肺纤维化仓鼠证实PFD可以抑制纤维化肺组织的脯氨酸羟化酶的活性,减少羟脯氨酸的生成,抑制Ⅰ型、Ⅲ型胶原基因的转录,减少肺胶原的含量。GARCIA等[14]证实PFD可明显抑制肝硬化大鼠的Ⅰ型、Ⅱ型、Ⅳ型胶原mRNA的表达,血中羟脯氨酸水平下降,明显改善肝纤维化,SHIMIZU等[15]通过切除大鼠5/6肾脏复制慢性肾衰竭模型,并饲喂PFD,可使残余肾皮质中的Ⅰ型、Ⅳ型胶原mRNA和羟脯氨酸水平下降,与对照组相比,纤维化程度明显减轻。PFD抗纤维化的主要机制被认为是[16]:①抑制TGF-β过度表达。TGF-β是参与多种纤维化过程的中枢因子,对炎症具有放大作用,是单核巨噬细胞强有力的趋化剂,活化的巨噬细胞可以分泌TGF-β,TGF-β可以通过正反馈的形式诱导自身的合成和分泌,故TGF-β在整个纤维化的病理生理过程中保持高水平。研究证实PFD能够减少肺、肾等器官成纤维细胞TGF-β表达,并与胶原合成和基质减少相关。②清除活性氧(ROS)。在纤维化发病过程中的早期炎症阶段,炎症细胞产生的髓过氧化物酶、超氧化物歧化酶可以催化过氧化物形成ROS。ROS可引起脂质过氧化反应、放大炎症反应,使体内蛋白及酶变性、DNA氧化损伤;此外,它还可以作为细胞内重要信使,活化多条信号通路,间接引起组织损伤。几乎所有纤维化都与氧化应激有关。PFD可清除体内ROS,减轻纤维化程度。③抑制肿瘤坏死因子TNF-α的生成,减轻炎症反应。TNF-α主要由活化的单核/巨噬细胞产生,是重要的炎症因子,可以引起和加重炎症反应,引起组织的损伤,启动组织修复及纤维化过程。研究证实,吡非尼酮可以在翻译水平上抑制巨噬细胞TNF-α的生成。
在相同梗阻时间下M组TGF-β、α-SMA的蛋白表达及CTGF mRNA表达均高于S组,但第7天M组及S组上述物质表达量较第5天减少,且M组与S组之间表达差异无统计学意义,提示PFD可能通过抑制CTGF的表达而减少以α-SMA为活化标志的肾间质肌成纤维细胞的数量和表达,减少细胞外基质的合成,从而延缓肾间质纤维化的进展,该治疗在早期可显著缓解肾组织纤维化,但梗阻时间越长,肾脏积水越明显,肾实质破坏越明显,药物作用较前有所下降。
PFD作为一种新型的抗纤维化药物,其对于纤维化疾病的预防和治疗作用机制研究还不是十分透彻,与此同时,PFD与肾增生性疾病的研究目前尚处于初级阶段,因此,进一步探究PFD在肾疾病的应用具有十分重要的意义。研究表明,PFD具有良好的穿透性,同时具有作用广泛、副作用小的特点,这使得PFD能够更好地应用于其他纤维增生性疾病,为临床治疗提供新的思路和希望,具有极大的应用前景。
[1]MISSERI R,RINK R C,MELDRUM D R,et al.Inflammatory mediators and growth factors in obstructive renal injury[J].J Surg Res,2004,119(2):149-159.
[2]HEALY E,BRADY H R.Role of tubule epithelial cells in the pathogenesis of tubulointerstitial fibrosis induced by glomerular disease[J].Curr Opin Nephrol Hypertens,1998,7(5):525-530.
[3]CHAN A L,RAFII R,LOUIE S,et al.Therapeutic update in idiopathic pulmonary fibrosis[J].Clin Rev Allergy Immunol,2013, 44(1):65-74.
[4]邵毅,余瑶,裴重刚,等.吡非尼酮滴眼液在兔眼小梁切除术后抗瘢痕作用研究[J].中国现代医学杂志,2015,25(2):13-17.
[5]李娣昕,曾红兵,纪春阳,等.吡非尼酮对单侧输尿管梗阻大鼠肾小管间质纤维化的影响[J].医药导报,2011(6):716-720.
[6]ITO Y,ATEN J,BENDE R J,et al.Expression of connective tissue growth factor in human renal fibrosis[J].Kidney Int,1998, 53(4):853-861.
[7]FAN J M,YEEYANG N G,HILL P,et al.Transforming growthfactor-β regulates tubular epithelial-myofibroblast transdifferentiation in vitro[J].Kidney Int,1999,56:1455-1467.
[8]YOKOI H,MUKOYAMA M,NAGAE T,et al.Reduction in connective tissue growth factor by antisense treatment ameliorates renal tubulointerstitial fibrosis[J].J Am Soc Nephrol,2004,15(6): 1430-1440.
[9]BADID C,VINCENT M,FOUQUE D,et al.Myofibroblast:a prognostic marker and target cell in progressive renal disease[J]. Ren Fail,2001,23(3/4):543-549.
[10]黄海长,李惊子,王海燕.结缔组织生长因子诱导肾成纤维细胞转为成肌纤维细胞[J].科学通报,2002(1):37-40.
[11]贾皑,苌新明,张盈涛,等.螺内酯对实验大鼠肝组织TGFβ1、PDGF-BB及α-SMA表达的影响[J].西安交通大学学报(医学版),2004(1):64-66.
[12]张春,朱忠华,刘建社,等.结缔组织生长因子在单侧输尿管梗阻大鼠肾脏中的表达及其意义 [J].中国病理生理杂志,2007(9): 1786-1790.
[13]IYER S N,GURUJEYALAKSHMI G,GIRI S N.Effects of pirfenidone on transforming growth factor-beta gene expression at the transcriptional level in bleomycin hamster model of lung fibrosis[J].J Pharmacol Exp Ther,1999,291(1):367-373.
[14]GARCIA L,HERNANDEZ I,SANDOVAL A,et al.Pirfenidone effectively reverses experimental liver fibrosis[J].J Hepatol,2002, 37(6):797-805.
[15]SHIMIZU T,FUKAGAWA M,KURODA T,et al.Pirfenidone prevents collagen accumulation in the remnant kidney in rats with partial nephrectomy[J].Kidney Int Suppl,1997,63:S239-S243.
[16]薛克营,张浩,陈燕.新型抗纤维化药物吡非尼酮[J].中国新药杂志,2005(8):1070-1073.
(张蕾 编辑)
Effect of Pirfenidone on renal interstitial fibrosis in rats*
Jian-hua Xu1,Hong-bo Xiao2,Yu-hua Cheng1,Yu Wang1, Gui-ling Zhang1,Jin-lei Lü1,Yi Shao3
(1.Department of Nephrology,the First Affiliated Hospital of Nanchang University,Nanchang, Jiangxi 330006,China 2.Department of Nephrology,Shenzhen Hospital of Peking University, Shenzhen,Guangdong 518036,China;3.Department of Ophthalmology,the First Affiliated Hospital of Nanchang University,Nanchang,Jiangxi 330006,China)
Objective To investigate the effect of Pirfenidone(PFD)on renal interstitial fibrosis in rat model of unilateral ureteral occlusion(UUO)and to reveal the anti-fibrosis mechanism of PFD.Methods Twenty-four standard male SD rats were randomly divided into three groups:normal control group(N),UUO model group(M)and Pirfenidone treated group(S).The rats of the M and S groups underwent left urethral ligation to make the renal interstitial fibrosis model.The S group was given PFD 250 mg/(kg·d)for gavage,meanwhile the N and M groups were given 1%sodium carboxymethyl cellulose solution for gavage.Two rats were sacrificed from each group on day 1,3,5 and 7 after UUO operation,the kidney of the obstructive side was taken for further research.In each group,pathological changes were observed by HE staining,qRT-PCR was applied to detect the mRNA expression of connective tissue growth factor(CTGF),Western bolt was applied to detect the protein expressions of TGF-β and α-SMA.Results There was obvious renal interstitial fibrosis in the M group.Compared with the N group,the expressions of TGF-β and α-SMA proteins and the mRNA expression of CTGF were significantly increased in the M group(P<0.05).Compared with the M group,the expressions of above parameters in the S group were decreased significantly(P<0.05).The level of TGF-β was positively correlated with the level of α-SMA (P<0.05). Conclusions Pirfenidone has anti-fibrosis effect on rat UUO model by inhibiting renal TGF-β and CTGF expressions,which may control the fibroblast transformation and reduce the extracellular matrix deposition in the renal tissue.
Pirfenidonde;unilateral ureteral obsrtruction;renal interstitial fibrosis;connective tissue growth factor; tranforming growth factor beta
R-332
A
2016-12-15
国家自然科学基金(No:81400372,81660129);全国临床医药研究专项基金(No:L2012052);广东省自然科学基金(No:S2013040015040);江西省自然科学基金青年基金(No:20132BAB215004,20114BAB215036)
吕金雷,E-mail:lvjinlei97@163.com,Tel:13064127385
徐健华现工作单位为江西省直医疗门诊部,330046
10.3969/j.issn.1005-8982.2017.19.001
1005-8982(2017)19-0001-06
