格列美脲羟丙基-β-环糊精包合物的制备及其光谱研究
2017-09-03朱庆英卓晓婵
朱庆英,卓晓婵
(惠州学院 化学与材料工程学院,广东 惠州 516007)
格列美脲羟丙基-β-环糊精包合物的制备及其光谱研究
朱庆英1,卓晓婵
(惠州学院 化学与材料工程学院,广东 惠州 516007)
通过冷冻干燥法制备羟丙基-β-环糊精和格列美脲包合物,用相溶解度法测定格列美脲和羟丙基-β-环糊精的包合常数,并用紫外光谱、红外光谱(FTIR)和1H NMR对包结物进行验证.结果表明,格列美脲和羟丙基-β-环糊精形成1:1的可溶性包合物,25°C时包合稳定常数为2140.9L·mol-1,形成包合物后格列美脲的水溶性增强近七倍.
格列美脲;羟丙基-β-环糊精;包合物;相溶解度
格列美脲是第三代磺酰脲类口服降糖药,主要通过控制体内的血糖水平而治疗非胰岛素依赖性糖尿病,因其水溶解性较差,导致生物利用度低,加大患者治疗成本[1-2].羟丙基-β-环糊精水溶性好,热稳定性强,对肾脏无毒性,对肌肉和粘膜几乎无刺激,溶血作用低,被认为是最有前途的药物载体材料之一[3-5].本实验通过相溶解度法测定格列美脲和羟丙基-β-环糊精的包合摩尔比及其稳定常数,采用冷冻干燥法制备HP-β-CD和格列美脲包合物,有望提高格列美脲的溶解度和生物利用度,为格列美脲羟丙基-β-环糊精包合物的开发和医药应用提供基础实验数据.
1 材料与方法
1.1 实验仪器与试剂
UV-2550紫外可见分光光度计(日本岛津公司);傅立叶变换红外光谱仪(Tensor37,Bruker公司);DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器);(锐影)X射线粉末衍射仪(Empyrean,荷兰帕纳科公司);WHY-2水浴恒温振荡器(江苏金坛市环宇科学仪器厂).
格列美脲(湖北康宝泰精细化工有限公司,纯度99%);羟丙基-β-环糊精(山东滨州智源生物科技有限公司);实验室用水为超纯水,其余试剂均为分析纯.
1.2 标准曲线的确定
称取干燥的格列美脲固体12.5 mg,用pH7.4的磷酸缓冲溶液定容至50 mL的容量瓶中,得0.25 mg/mL的格列美脲标准溶液,用pH7.4的磷酸缓冲溶液配制浓度依次为15 μg/mL,25 μg/mL,35 μg/mL,45 μg/mL,55 μg/mL,65 μg/mL的格列美脲系列溶液,在波长为230nm处测定吸光度A,经线性回归得到标准曲线方程.
1.3 相溶解度研究
称取一定量的HP-β-CD,用pH7.4的磷酸缓冲溶液定容至100mL的容量瓶中,用pH7.4的磷酸缓冲溶液配制浓度依次为0-9mmol/L的HP-β-CD溶液.参照Higuchi和Connors方法,取上述溶液10mL分别置于50mL的容量瓶中,依次加入过量的格列美脲粉末,密封,然后置于水浴恒温摇床振摇(25±0.5℃,165r·min-1),72h达到平衡,平衡后用0.22 μm的微孔滤膜过滤,取滤液在230 nm处测定吸光度A,代入标准曲线方程.以HP-β-CD浓度(mmol/L)为横坐标,格列美脲浓度(mmol/L)为纵坐标,作相溶解度图.HP-β-CD和格列美脲包合物的平衡常数(K)根据式(1)计算:

1.4 格列美脲包合物的制备
用冷冻干燥法[6-7]来制备格列美脲和HP-β-CD包合物.按摩尔比1:1精确称量格列美脲和HP-β-CD.HP-β-CD溶解于适量的蒸馏水中制成饱和溶液;格列美脲经适量溶剂溶解后逐滴加入到饱和溶液中,40℃恒温搅拌2.5h后,-18℃冷冻24 h,用真空干燥机干燥即可得包合物.称取质量并计算收率.收率根据式(2)计算

1.5 包合物的光谱表征
1.5.1 紫外吸收光谱(UV)
将一定浓度的格列美脲缓冲溶液,HP-β-CD水溶液,格列美脲/HP-β-CD水溶液,格列美脲/HP-β-CD物理混合物水溶液,测定吸光度,比较吸收峰变化.
1.5.2 红外吸收光谱(IR)
用溴化钾压片法,对格列美脲,HP-β-CD,格列美脲/HP-β-CD物理混合物和格列美脲/HP-β-CD包合物,分别在400-4000 cm-1的波数范围进行红外吸收光谱测定.
1.5.3 一维核磁氢谱(1H NMR)表征
分别对羟丙基-β-环糊精和格列美脲/羟丙基-β-环糊精包合物,在核磁共振波谱仪上,进行1H NMR测定(D2O为溶剂).
1.6 水溶性的测定
称取过量的格列美脲,格列美脲/HP-β-CD物理混合物,三批格列美脲/HP-β-CD包合物样品分别置于10 mL容量瓶中,加水配成过饱和溶液,置于水浴恒温摇床振摇(25±0.5℃,125r·min-1)2h,用0.22 μm的微孔滤膜迅速过滤,将滤液稀释适当倍数后于230 nm处测定吸光度A,代入标准曲线方程,经计算得到格列美脲,格列美脲/HP-β-CD物理混合物,三批格列美脲/ HP-β-CD包合物样品在水中的溶解度.
2 结果与讨论
2.1 标准曲线
用pH7.4的磷酸缓冲溶液做参比溶液,在上述条件下测得格列美脲标准曲线方程为A=0.032C-0.01,C(μg/mL),(r=0.9991,n=6),表明格列美脲在测定的浓度范围内线性关系良好.
2.2 相溶解度研究
图2为格列美脲和HP-β-CD的相溶解图.可以看出,随着HP-β-CD浓度的增加,格列美脲浓度成线性增加.根据Higuchi[8]和Connors方法可知,相溶解度图的斜率为0.0131(<1),表明格列美脲药物分子和HP-β-CD形成了摩尔比为1:1包合物.根据公式(1)计算25°C时包合物的平衡常数K为2140.9L·mol-1.
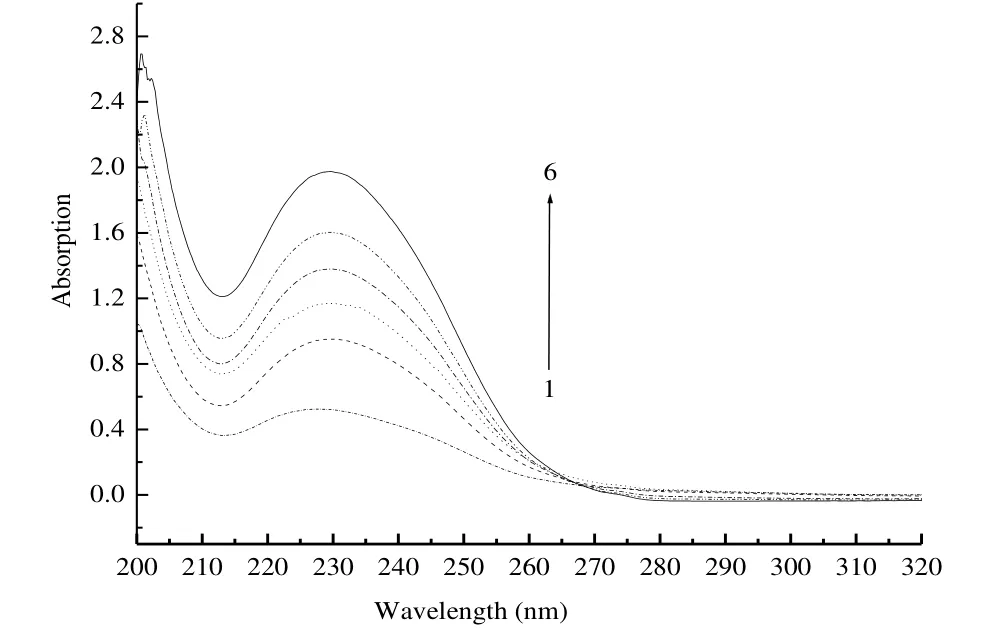
图1 格列美脲与不同浓度HP-β-CD的紫外吸收图

图2 格列美脲和HP-β-CD相溶解度图
2.3 格列美脲/HP-β-CD包合物的收率
通过冷冻干燥法制得羟丙基-β-环糊精和格列美脲包合物,收率见表1.

表1 格列美脲/羟丙基-β-环糊精包合物的收率
由表1可得,格列美脲/羟丙基-β-环糊精包合物的平均收率为73.84%.
2.4 紫外吸收光谱
图3和表2给出了格列美脲,HP-β-CD,格列美脲/ HP-β-CD物理混合物和格列美脲/HP-β-CD包合物的紫外吸收光谱变化.

图3 格列美脲/HP-β-CD物理混合物(a),格列美脲(b),格列美脲/HP-β-CD包合物(c),HP-β-CD(d)紫外谱图

表2 物质紫外吸收峰谷位置的波长变化
由图3及表2可见,格列美脲与羟丙基-β-环糊精包合物的紫外光谱不同于格列美脲,羟丙基-β-环糊精以及二者的混合物的紫外光谱,峰谷的位置发生了明显的位移,说明了格列美脲与羟丙基-β-环糊精包合物的形成.
2.5 红外吸收光谱
根据格列美脲(a),HP-β-CD(b),HP-β-CD/格列美脲物理混合物(c),HP-β-CD/格列美脲包合物(d)四个样品的红外光谱图(图4)进行比较分析.由图可以看出,HP-β-CD(曲线b),HP-β-CD/格列美脲物理混合物(曲线c),HP-β-CD/格列美脲包合物(曲线d)的红外光谱图相似,说明HP-β-CD的骨架结构没有发生变化.曲线b是H P-β-CD的红外光谱,3 418 cm-1处为O-H伸缩振动吸收峰,而格列美脲与羟丙基-β-环糊精形成包合物后,HP-β-CD的O-H伸缩振动吸收峰发生蓝移,从3 418 cm-1蓝移到3 390 cm-1(曲线d),振动频率降低,由此可得知包合作用使H P-β-CD环境的变化而引起O-H伸缩振动吸收峰的位移.在格列美脲的红外光谱(曲线a)中,3 368 cm-1和3 286 cm-1处为仲酰胺N-H不对称和对称伸缩振动吸收峰,2 858 cm-1处为C-H对称伸缩振动吸收峰,这三个峰在HP-β-CD和格列美脲包合物(d)上消失,这与包合物的形
2成有关是因为格列美脲分子进入HP-β-CD空腔内发生疏水作用和形成氢键.然而这三个峰在HP-β-CD/格列美脲物理混合物(c)上都存在,且由图可知,HP-β-CD和格列美脲物理混合物(c)是格列美脲和HP-β-CD红外光谱吸收峰的叠加.当客体小分子格列美脲在包合物中所占的分量较小时,其特征峰很容易被HP-β-CD的吸收峰减弱.在曲线a和曲线c上看到1 348 cm-1处S=O不对成伸缩振动吸收峰,在曲线d上消失,与HP-β-CD空腔形成包合物所致.另外在1 705 cm-1,1 671 cm-1和1 543 cm-1处是格列美脲分子内C=O伸缩振动吸收峰,在曲线c和d上都有体现,受到β-环糊精空腔大小的限制,说明处于HP-β-CD空腔外.这种状态与形成包合比为1:1的结果相一致,格列美脲分子体积较大,被部分包合在HP-β-CD空腔内.

图4 格列美脲(a),HP-β-CD(b),HP-β-CD/格列美脲物理混合物(c),HP-β-CD/格列美脲包合物(d)红外光谱图
2.6 一维核磁氢谱(1H NMR)表征
通过1H NMR的化学位移,可以反映出主客体分子间是否形成包合物的简单有效方法.羟丙基-β-环糊精的1~6H具体化学位移,和羟丙基-β-环糊精与格列美脲形成包合物后的化学位移变化Δδ(ppm),(Δδ=δinclusin-δfree)如表3所示.

表3 不同状态下HP-β-CD的1~6H的化学位移值
从表3中可以看出,包合之后HP-β-CD空腔内的的H-3和H-5有明显的化学位移变化(0.017和0.023ppm),HP-β-CD的空腔外的H-2和H-4变化较小,表明了格列美脲进入HP-β-CD内部空腔,形成了较稳定的包合物.
2.7 水溶性的测定
将方法1.6测得的数据代入标准曲线方程,得到格列美脲,羟丙基-β-环糊精/格列美脲物理混合物,三批羟丙基-β-环糊精/格列美脲包合物样品在水中的溶解度,见表4.由表4可知,格列美脲在水中的溶解度为6.94μg/mL,HP-β-CD/格列美脲物理混合物在水中的溶解度比格列美脲提高近三倍,而HP-β-CD/格列美脲包合物在水中的溶解度比格列美脲提高近七倍.因此,格列美脲与HP-β-CD形成包合物后,其亲水性得到了较大的提高.

表4 样品水溶性的测定结果
3 结论
本文通过相溶解度法得知羟丙基-β-环糊精和格列美脲结合形成了1∶1的可溶性包和物,在25℃时包合稳定常数是2140.9L·mol-1.通过冷冻干燥法制备格列美脲/HP-β-CD包合物,并用紫外光谱、红外光谱和1HNMR对包结物进行验证分析,得知HP-β-CD/格列美脲包和物是客体分子格列美脲以无定形状态分散到羟丙基-β-环糊精空腔中.包结物的水溶性实验结果得知包合后的格列美脲的水溶性增强了近七倍.
[1]PAN M,BIN G,JUNLI M,et al.Glimepiride induces proliferation and differentiation of rat osteoblasts via the PI3-kinase/Akt pathway[J].Metabolism Clinical and Experimental,2010,59:359-366.
[2]王大伟,刘琪,刘明,等.LNG-HP-β-CD包合物制备、表征及其紫外稳定性研究[J].光谱学与光谱分析,2011,31(3):808-811.
[3]BREWSTER M E,LOFTSSON T.Cyclodextrins as pharmaccutical solubilizers[J].Advanced Drug Delivery Reviews,2007(59):645-666.
[4]GOULD S,SCOTT R C.2-Hydroxypropyl-β-cyclodextrin(HP-β-CD):A toxicology review[J].Food and Chemical Toxicology,2005,43(10):1451-1459.
[5]PADURARU O M,BOSINCEANU A,TANTARU G,et al.Effect of hydroxypropyl-β-cyclodextrin on the solubility of an antiarrhythmic agent[J].Industrial&Engineering Chemistry Research,2013(52):2174-2181.
[6]RAZA A,SUN H F,BANO S,et al.Preparation,characterization,and in vitro anti-inflammatory evaluation of novel water soluble kamebakaurin/hydroxypropyl-β-cyclodextrin inclusion complex[J].Journal of Molecular Structure,2017(1130):319-326.
[7]CAMILAS M,CRISTIANE M,ANA C N,et al.Curcumin-β-cyclodextrin inclusion complex:Stability,solubility,characterisation by FT-IR,FT-Raman,X-ray diffraction and photoacoustic spectroscopy,and food application[J].Food Chemistry,2014(153):361-370.
[8]HIGUCHI T,CONNORS K A.Phase-solubility techniques[J].Advances in Analytical Chemistry and Instrumentation,1965(4):117-212.
【责任编辑:吴跃新】
The Study on the Preparation and Spectroscopic Properties of Glimepiride and Hydroxypropyl-β-Cyclodextrin Inclusion Complex
ZHU Qingying,ZHUO Xiaochan
(School of Chemistry and Material Engineering,Huizhou University Huizhou 5160007,Guangdong,China)
Gliepiride-hydroxypropyl-β-cyclodextrin inclusion complex(GP-HPCD)was prepared by the method of freeze drying.The stability constant was determined by the experiment of phase solubility.The inclusion complex was verified by Ultraviolet spectrum (UV),Fourier transform infrared spectroscopy(FTIR)and 1H NMR.It was found that the formation of the soluble inclusion complex with 1:1 molar ratio of gliepiride and hydroxypropyl-β-cyclodextrin,and the stability constant was 2140.9L·mol-1 at 25°C by the experiment of phase solubility.The solubility experiment of the inclusion complex indicated that the solubility of gliepiridein in the inclusion complex increased 7-fold.
glimepiride;hydroxypropyl-β-cyclodextrin;inclusion complex;phase solubility
O629.1
A
1671-5934(2017)03-0047-05
2017-04-15
惠州学院自然科学研究项目(hzux1201511)
作者简介:朱庆英(1975-),女,江苏宜兴人,讲师,博士,研究方向为超分子化学反应,E-mail:1378094994@qq.com
