白酒发酵副产物黄水抑菌特性及稳定性研究
2017-09-03徐亚超刘安军
徐亚超,盛 杰,刘安军,*
(1.天津科技大学食品工程与生物技术学院,天津 300457;2.威海海洋职业学院食品工程系,山东 威海 264200)
白酒发酵副产物黄水抑菌特性及稳定性研究
徐亚超1,盛 杰2,刘安军1,*
(1.天津科技大学食品工程与生物技术学院,天津 300457;2.威海海洋职业学院食品工程系,山东 威海 264200)
以食品中几种常见的腐败菌和致病菌,包括金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、沙门氏菌、根霉、青霉、毛霉、曲霉为供试菌,研究白酒发酵副产物黄水的抑菌效果及其稳定性。采用牛津杯法测定抑菌活性;采用二倍稀释法测定黄水对菌种的最低抑菌浓度;以金黄色葡萄球菌和大肠杆菌为指示菌,研究pH值、温度、紫外线、盐、蔗糖含量和金属离子种类对黄水抑菌稳定性的影响。结果表明:黄水对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和沙门氏菌4 种细菌以及青霉、曲霉2 种真菌具有很好的抑菌活性,而对毛霉和根霉抑菌效果不明显。以体积分数计,黄水对4种细菌的最低抑菌浓度均为6.25%,对青霉和曲霉两种真菌的最低抑菌浓度分别为1.56%和3.13%。黄水呈酸性时抑菌活性增强,呈碱性时抑菌活性稍有下降,但活性仍较高;经高温处理后,抑菌活性稍有下降;紫外线对其抑菌活性几乎无影响;随着糖含量和盐含量的增加,抑菌活性稍有增强;金属离子对其抑菌稳定性几乎无影响,而且Fe2+还有增强其抑菌活性的作用。
白酒发酵;黄水;抑菌特性;稳定性
黄水是固态法酿造白酒过程产生的副产物,又称黄浆水,为棕黄色微黏稠液体。在生产浓香型白酒时,以高粱或其他的谷作物如大米、小麦、豆类等为原料,加入曲种后送水于池内,然后进行发酵[1]。原料中的淀粉经过厌氧发酵,在酶和酵母的作用下生成酒[2-3]。在发酵过程中,微生物代谢所生成的水与酒醅中未被微生物利用的水分逐渐沉降,从而将酒醅中的有机酸、可溶性淀粉、氨基酸、单宁、还原糖和香味前体物质等溶于其中,并沉积到窖底而形成黄水[4-5]。因此黄水中主要含有酸类、醛类、醇类和酯类等呈香呈味物质[6-7],还含有糖类物质、含氮化合物、少量的色素及单宁等有机物[8]。由于生产白酒的各个企业所使用的原料种类、原料配比、窖龄和窖池质量等因素的差异,导致各个企业产出的黄水其主要成分以及含量存在差异[9](黄水的常规分析各指标为:总固形物含量12.7~17.1 g/100 mL、酸度6.91~7.83 mg/L、淀粉含量2.11%~4.42%、还原糖含量2.23%~4.75%、酒精体积分数3.22%~5.31%、pH 2.95~3.88、黏度35.2~51.7 Pa·s、总氮含量0.27%~0.35%、总酸含量23.8~38.2 g/L、总酯含量1.38~2.78 g/L、单宁及色素含量0.13%~0.23%[10]。黄水的化学需氧量为25 000~40 000 mg/L,五日生化需氧量为25 000~30 000 mg/L,远远超过国家允许的废水排放标准,部分厂家直接将黄水排放到河流中,这必然会严重污染环境[11]。因此,关于如何处理以及合理开发利用黄水资源的研究越来越受到酿酒行业的重视[12]。目前,对于黄水的应用主要集中在用于勾调低档白酒、养窖、培养人工窖泥、利用其中的有机酸酿造食醋或利用其中的氨基酸生产酱油等。
黄水中含有丰富的有机酸[13-14],杨新力[15]研究发现,利用混合有机酸来充当食品防腐剂比单一成分的有机酸在防腐方面有更明显的效果。研究者对黄水进行简单处理后用于酱油的防腐,取得了很好的效果。而对于黄水抑菌特性以及抑菌稳定性的研究目前还鲜见报道。
1 材料与方法
1.1 材料与试剂
黄水由江苏大风歌酒业有限公司提供。
金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bascillus subtilis)、大肠杆菌(Escherichia coli)、沙门氏菌(Salmonella enteritidis)、根霉(Rhizopus sp.)、青霉(Penicillium sp.)、曲霉(Aspergillus sp.)、毛霉(Mucor racemosus sp.)均由天津科技大学食品工程与生物技术学院实验室保藏[16]。
牛肉膏蛋白胨培养基:牛肉膏3 g、蛋白胨10 g、氯化钠5 g、琼脂15 g,蒸馏水1 000 mL。pH 7.0~7.2,121 ℃灭菌15 min,用于细菌的培养。
马铃薯葡萄糖培养基:马铃薯(去皮切块)300 g、葡萄糖20 g、琼脂20 g、氯霉素0.1 g,蒸馏水1 000 mL,121 ℃灭菌20 min,用于真菌的培养[17]。
1.2 仪器与设备
YXQ-LS-75SII立式压力蒸汽灭菌锅 上海博迅有限公司医疗设备厂;HH-8恒温水浴锅 金坛市金城国胜实验仪器厂;XW-80A微型漩涡混合器 上海沪西分析仪器厂;SHJ超净工作台 上海汇龙仪表电子有限责任公司;PHS-3C pH计 上海理达仪器厂;LRH-150生化培养箱 上海一恒科技有限公司。
1.3 方法
1.3.1 菌种的活化及菌悬液的制备
将供测试的细菌和真菌分别接种于牛肉膏蛋白胨和马铃薯葡萄糖固体斜面培养基上,细菌置于37 ℃恒温培养箱培养24 h,真菌置于28 ℃恒温培养箱培养48 h,连续传代2 次。将活化好的细菌分别挑取一环制成初始菌悬液。使用前,采用平板菌落计数法,将初始菌悬液稀释成菌浓度为106~107CFU/mL的菌悬液[18]。霉菌用无菌生理盐水将其产生的孢子从斜面洗下,置于离心管中,涡旋振荡20 min,用已灭菌的脱脂棉过滤,制成初始菌悬液备用。使用前采用血球计数法,将初始菌悬液稀释成菌浓度为106~107CFU/mL的菌悬液。
1.3.2 黄水抑菌活性的测定
采用牛津杯法[19-20]。在培养皿中倒入已融化的固体培养基,待其冷却凝固后,加入100 µL 1.3.1节制备好的供试菌菌悬液,然后用无菌涂布棒涂布均匀。再用镊子等距离、平稳地将4 个经灭菌的牛津杯放在涂布好的固体培养基平面上,用移液枪在其中3 个牛津杯中分别加入200 µL黄水,另一个牛津杯中加入200 µL无菌生理盐水作为对照,每种菌种按上述方法平行操作3 次[21]。细菌置于37 ℃恒温培养箱中培养24 h,真菌置于28 ℃恒温培养箱中培养48 h。取出后,对其抑菌圈直径进行测量。抑菌圈直径越大,表明抑菌效果越好。
1.3.3 黄水最低抑菌浓度的测定
采用二倍稀释法。首先,准备经灭菌的并带有棉塞的试管9 支,用记号笔编号1~9,先将每支试管中加入经灭菌的液体培养基5.0 mL,再向第1支试管中加入黄水5.0 mL,充分混匀后取5.0 mL注入到第2支试管中,以此类推进行1∶2~1∶128的稀释,使黄水的体积分数分别为50.00%、25.00%、12.50%、6.25%、3.13%、1.56%、0.78%。最后第8支试管不加黄水,只加培养基和菌种作为阳性对照组,第9支试管中加入黄水5.0 mL,充分混匀后量取5.0 mL弃去,不加菌种作为阴性对照组。取1.3.1节制备好的菌悬液100 µL分别加入到1~8 号试管中充分混匀,每个样品设3 个重复。细菌组置于37 ℃恒温培养箱中培养24 h,真菌组置于28 ℃恒温培养箱中培养48 h后观察结果。当阳性对照组试管内呈浑浊状,而阴性对照组试管内呈透明状时,观察1~7号试管的透明度情况:若实验组试管内出现浑浊状,则说明该稀释倍数下的培养基内有微生物生长;若试管内为透明,则说明该稀释倍数下没有微生物生长。选出所用黄水体积分数最低的透明管,该体积分数即为对该菌种的最低抑菌浓度[22-24]。
1.3.4 黄水抑菌稳定性测定
实验以革兰氏阳性菌金黄色葡萄球菌和革兰氏阴性菌大肠杆菌为供试菌种。
1.3.4.1 pH值对黄水抑菌稳定性的影响
分别用0.1 mol/L的HCl和0.1 mol/L的NaOH溶液调节培养基的pH值,配制成pH值分别为5、6、7、8、9的牛肉膏蛋白胨培养基[25]。采用1.3.2节的方法进行抑菌活性的测定,以无菌水做空白对照,每个样品做3个平行。37 ℃恒温培养箱中培养24 h,测定抑菌圈直径。
1.3.4.2 温度对黄水抑菌稳定性的影响
将黄水分别在0、20、40、60、80、100、121 ℃条件下处理30 min,恢复至室温后,采用1.3.2节的方法进行抑菌活性的测定,以无菌水做空白对照,每个样品做3 个平行[26]。37 ℃恒温培养箱中培养24 h,测定抑菌圈直径。
1.3.4.3 紫外线对黄水抑菌稳定性的影响
将黄水分别在紫外灯下照射0、20、40、60、80、100、120 min后[27],采用1.3.2节的方法进行抑菌活性的测定,以无菌水做空白对照,每个样品做3 个平行。37 ℃恒温培养箱中培养24 h,测定抑菌圈直径。
1.3.4.4 盐和糖含量对黄水抑菌稳定性的影响
向培养基中加入不同质量分数的NaCl(0.0%、0.5%、1.0%、1.5%、2.0%和2.5%)和蔗糖(0%、2%、4%、6%、8%和10%),制成盐和糖含量不同的微生物培养平板[28]。采用1.3.2节的方法进行抑菌活性的测定,以无菌水做空白对照,每个样品做3 个平行。37 ℃恒温培养箱中培养24 h,测定抑菌圈直径。
1.3.4.5 金属离子种类对黄水抑菌稳定性的影响
向黄水中分别加入Ca2+、Fe2+、Mg2+、Na+、K+5 种金属离子溶液,并调节金属离子的浓度为1 mol/L[29],采用1.3.2节的方法进行抑菌活性的测定,以无菌水做对照,每个样品做3 个平行。37 ℃恒温培养箱中培养24 h,测定抑菌圈直径。
2 结果与分析
2.1 黄水的抑菌活性

表1 黄水对常见腐败菌和致病菌的抑制效果Table 1 Inhibitory effect of yellow water against common spoilage and pathogenic microbes
由表1可知,黄水对革兰式阳性菌和革兰氏阴性菌均有较强的抑制效果,对青霉和曲霉也表现出较强的抑制效果,其抑菌圈直径均达到了25 mm左右,而对根霉和毛霉无明显的抑菌圈出现,表明对其抑菌效果不明显或无抑菌效果。因此推断,黄水对大部分细菌均有较强的抑菌活性,对于真菌而言,只对部分真菌存在抑菌活性。
2.2 黄水对常见菌的最低抑菌浓度

表2 黄水对常见菌的最低抑菌浓度Table 2 Minimum inhibitory concentration of yellow water against common bacteria and fungi
由表2可知,以体积分数计,黄水对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和沙门氏菌4 种细菌的最低抑菌浓度均为6.25%,对青霉和曲霉两种真菌的最低抑菌浓度分别为1.56%和3.13%。由此可得,黄水对真菌的抑制效果强于细菌。
2.3 黄水抑菌稳定性的测定结果
2.3.1 pH值对黄水抑菌活性的影响
由图1可知,pH值对黄水的抑菌活性有影响,在pH 7的中性环境中,黄水对金黄色葡萄球菌的抑菌圈直径为24.3 mm,对大肠杆菌的抑菌圈直径为25.9 mm。在酸性环境中黄水的抑菌作用增强,当培养基的pH值为5时黄水对金黄色葡萄球菌和大肠杆菌的抑菌圈直径分别达到了36.5 mm和37.6 mm。在碱性环境中黄水的抑菌作用减

图1 pH值对黄水抑菌活性的影响Fig. 1 Effect of pH on the antibacterial activity of yellow water
2.3.2 温度对黄水抑菌活性的影响

图2 温度对黄水抑菌活性的影响Fig. 2 Effect of temperature on the antibacterial activity of yellow water
由图2可知,随着温度的升高,黄水对金黄色葡萄球菌和大肠杆菌的抑菌活性稍有下降。在121 ℃的高温条件下处理30 min后,黄水对金黄色葡萄球菌和大肠杆菌的抑菌圈直径分别为22.6 mm和23.7 mm,抑菌活性仍很高。结果说明温度对黄水的抑菌活性影响不大,黄水在抑菌方面具有良好的热稳定性。
2.3.3 紫外线照射对黄水抑菌活性的影响

图3 紫外线对黄水抑菌活性的影响Fig. 3 Effect of ultraviolet light on the antibacterial activity of yellow water
由图3可知,黄水在经过紫外线照射后,其抑菌活性几乎没有受到影响。经紫外线照射120 min后,黄水对金黄色葡萄球菌和大肠杆菌的抑菌圈直径仍为25 mm左右,与未经紫外线照射相比几乎没有变化。说明黄水对紫外线的照射呈现较好的稳定性。因此,在食品生产过程中,可以在使用黄水进行防腐的同时,采用紫外照射进行相应的杀菌处理。
2.3.4 盐和糖含量对黄水抑菌活性的影响

图4 盐质量分数对黄水抑菌活性的影响Fig. 4 Effect of sodium chloride on the antibacterial activity of yellow water
由图4可知,盐质量分数对黄水的抑菌活性有影响,盐质量分数在0.0%~2.5%的范围内时,随着培养基中盐质量分数的增加,黄水对金黄色葡萄球菌和大肠杆菌的抑菌圈直径由25 mm左右增加到28 mm左右。
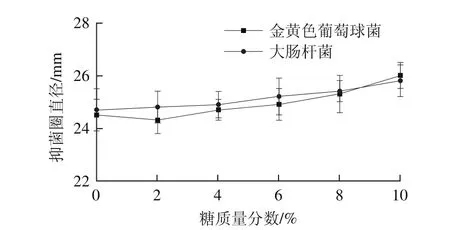
图5 糖质量分数对黄水抑菌活性的影响Fig. 5 Effect of saccharose on the antibacterial activity of yellow water
由图5可知,糖质量分数在0%~10%时,随着糖质量分数的升高,黄水的抑菌活性也稍有提升。这表明盐和糖对黄水的抑菌活性有一定的增效作用,原因可能是糖和盐能影响微生物生长的渗透压,从而抑制细菌的生长。
2.3.5 金属离子种类对黄水抑菌活性的影响

图6 金属离子对黄水抑菌活性的影响Fig. 6 Effect of metal ions on the antibacterial activity of yellow water
由图6可知,与对照组相比,黄水中加入Ca2+、Mg2+、Na+和K+后,其抑菌活性无明显变化。加入Fe2+后,黄水对金黄色葡萄球菌和大肠杆菌的抑菌圈直径分别由24.6 mm和25.8 mm增长到36.5 mm和39.2 mm,其抑菌活性明显增强,原因可能是Fe2+本身对菌体的生长存在弱,当培养基的pH值为9时黄水对金黄色葡萄球菌和大肠杆菌的抑菌圈直径分别降至21.5 mm和20.6 mm,但抑菌效果仍然较强。一定的抑制作用。由此可见,黄水的抑菌活性几乎不受Ca2+、Mg2+、Na+和K+的影响,且Fe2+对黄水的抑菌活性还有一定的增强作用。因此,黄水可以应用在含有Ca2+、Mg2+、Na+、K+和Fe2+金属离子较丰富的食品中作为防腐剂使用。
3 结 论
黄水对革兰氏阳性菌金黄色葡萄球菌、枯草芽孢杆菌和革兰氏阴性菌大肠杆菌、沙门氏菌均有较强的抑制作用。对青霉和曲霉也表现出较强的抑制效果,对根霉和毛霉无抑菌效果。由此可得出,黄水对实验所用细菌均有较强的抑菌活性,对于真菌而言,只对部分真菌存在抑菌活性。
最低抑菌浓度实验表明,黄水对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和沙门氏菌4 种细菌的最低抑菌浓度均为6.25%。对青霉和曲霉两种真菌的最低抑菌浓度分别为1.56%和3.13%。
抑菌稳定性实验表明,pH值对黄水的抑菌活性有影响,在酸性环境中黄水的抑菌作用增强,在碱性环境中黄水的抑菌作用减弱,但抑菌效果仍然较强。因此,在食品应用中,应用在pH值较低的食品中能更好的发挥其抑菌作用。温度对黄水的抑菌活性影响不大,黄水在抑菌方面具有良好的热稳定性,因此,可以将其应用在需要高温蒸煮和高压杀菌的食品当中。黄水的抑菌活性几乎不受紫外线照射的影响,因此,在食品生产过程中,可以在使用黄水进行防腐的同时,用紫外进行相应的杀菌处理。盐、糖对黄水的抑菌活性有一定的增效作用。原因可能是糖和盐能影响微生物生长的渗透压,从而抑制细菌的生长,因此,黄水在盐和糖含量较高的食品中作为防腐剂使用能更好地发挥其抑菌作用。Ca2+、Mg2+、Na+和K+的加入对黄水的抑菌活性几乎无影响,Fe2+对黄水的抑菌活性却有一定的增强作用,原因可能是Fe2+本身对菌体的生长存在一定的抑制作用。因此,黄水可以应用在含有Ca2+、Mg2+、Na+、K+和Fe2+金属离子较丰富的食品中作为防腐剂使用。
综上所述,黄水具有较高的抑菌活性,而且抑菌活性稳定性良好。黄水作为粮食发酵产物又具有较高的安全性,来源丰富[30],而且还含有丰富的氨基酸以及醇类和酯类等呈香呈味物质。因此,将黄水进行简单地处理后,应用到食品中作为天然防腐剂具有良好的前景,还能实现废物利用。但由于黄水中成分复杂,对于究竟是其中的哪些成分起到了抑菌作用及其抑菌机理还需要进一步的探讨与研究,以便对其在食品中的应用提供充分的理论依据。
[1] 赫江华. 黄水调味液在新型白酒中的应用[J]. 酿酒科技, 2005(1): 52-53. DOI:10.3969/j.issn.1001-9286.2005.01.011.
[2] 赵东, 牛广杰, 彭志云, 等. TA.XTplus物性测试仪对黄水分析初探[J].酿酒, 2013(3): 28-30. DOI:10.3969/j.issn.1002-8110.2013.03.009.
[3] 杨小柏, 沈才洪, 赵元森. 黄水功能调味液的研制开发[J]. 酿酒科技, 2001(6): 89-90. DOI:10.13746/j.njkj.2001.06.039.
[4] 张宿义, 卢中明, 周军. 黄水调味液在白酒调味中的应用[J]. 酿酒科技, 2002(3): 45-46. DOI:10.13746/j.njkj.2002.03.015.
[5] 叶鑫, 石冰, 于恩平, 等. 超临界CO2萃取黄水中香料物质的研究[J].酿酒, 2004, 31(4): 18-20. DOI:10.3969/j.issn.1002-8110.2004.04.015.
[6] 张晓磊, 史潜玉, 王化斌, 等. 白酒酿造副产物黄水中挥发性化合物的研究[J]. 酿酒, 2010, 37(2): 41-44. DOI:10.3969/ j.issn.1002.2010.02.018.
[7] 刘琼, 张跃进. 酿酒副产物黄水的综合利用[J]. 酿酒, 2001, 28(4): 39-42. DOI:10.3969/j.issn.1002-8110.2001.04.009.
[8] 罗惠波, 张宿义, 卢中明. 浓香型白酒黄水的应用探索[J]. 酿酒, 2004, 31(2): 71-72. DOI:10.3969/j.issn.1002-8110.2004.02.031.
[9] 徐传鸿, 余有贵, 张文武. 黄水的理化分析及其应用研究进展[J]. 食品安全质量检测学报, 2014, 5(12): 4011-4017.
[10] 彭太升. 黄水调酒液在浓香型白酒中的应用[J]. 酿酒, 2011, 38(6): 36-37. DOI:10.3969/j.issn.1002-8110.2011.06.016.
[11] 吴廷东, 卜春文. 黄水的酯化与脱色处理[J]. 酿酒科技, 1999(1): 39-40. DOI:10.13746/j.njkj.1999.01.012.
[12] 谭光迅, 李净. 黄水的组分分析及应用研究进展[J]. 酿酒科技, 2010 (10): 90-92. DOI:10.13746/j.njkj.2010.10.023.
[13] 张志刚, 何汝良, 程江红. 黄浆水酿醋工艺研究[J]. 中国酿造, 2005, 24(6): 29-30.
[14] 范文来, 徐岩. 应用HS-SPME技术测定固态发酵浓香型酒醅微量成分[J]. 酿酒, 2008, 35(5): 94-98.
[15] 杨新力. 黄浆水提取混合有机酸及其应用[J]. 酿酒科技, 1991(3): 33-35. DOI:10.13746/j.njkj.1991.03.013.
[16] 王英臣. 酸浆宿萼中酸浆苦素抑菌稳定性的研究[J]. 食品科学, 2014, 35(7): 68-71. DOI:10.7506/spkx1002-6630-201407014.
[17] SOARES M B, BELLINTANI M C, RIBEIRO I M, et al. Inhibition of macrophage activation and lipopolysaccaride-induced death by seco-steroids purif i ed from Physalis angulata L.[J]. European Journal of Pharmacology, 2003, 459(1): 107-112. DOI:10.1016/S0014-2999(02)02829-7.
[18] 原江锋, 王大红, 何灵美, 等. 连翘叶提取物抑菌作用以及稳定性研究[J]. 食品工业科技, 2013, 34(5): 57-59. DOI:10.13386/ j.issn1002-0306.2013.05.003.
[19] PUUPPONEN-PIMIÄ R, NOHYNEK L, MEIER C, et al. Antimicrobial properties of phenolic compounds from berries[J]. Journal of Applied Microbiology, 2001, 90(4): 494-507. DOI:10.1046/ j.1365-2672.2001.01271.x.
[20] 陈沙, 罗秋水, 张凤英. 越橘粗提物体外抑菌活性及稳定性的研究[J]. 食品工业科技, 2012, 33(9): 158-162. DOI:10.13386/ j.issn1002-0306.2012.09.093.
[21] 邬国胜, 李敏, 应国清. 竹醋液抑菌活性及其稳定性研究[J]. 浙江工业大学学报, 2011, 39(1): 44-46. DOI:10.3969/ j.issn.1006-4303.2011.01.010.
[22] MATHABE M C, NIKOLOVA R V, LALL N, et al. Antibacterial activities of medicinal plants used for the treatment of diarrhoea in Limpopo Province, South Africa[J]. Journal of Ethnopharmacology, 2006, 105(1/2): 286-293. DOI:10.1016/j.jep.2006.01.029.
[23] AMOO S O, NDHLALA A R, FINNIE J F, et al. Antibacterial, antifungal and anti-inf l ammatory properties of Burchellia bubalina[J]. South African Journal of Botany, 2009, 75(1): 60-63. DOI:10.1016/ j.sajb.2008.07.010.
[24] YASUNAKA K, ABE F, NAGAYAMA A, et al. Antibacterial activity of crude extracts from Mexican medicinal plants and pured coumarins and xanth-ones[J]. Journal of Ethnopharmacology, 2005, 97(2): 293-299. DOI:10.1016/j.jep.2004.11.014.
[25] 陈佳佳, 刘凡, 廖森泰, 等. 桑叶提取物抑菌活性及抑菌稳定性研究[J]. 食品工业科技, 2012, 33(9): 88-91. DOI:10.13386/ j.issn1002-0306.2012.09.016.
[26] 赵淑艳, 呼世斌, 吴焕利, 等. 山茱萸提取物抑菌活性成分稳定性的研究[J]. 食品科学, 2008, 29(1): 98-101. DOI:10.3321/ j.issn:1002-6630.2008.01.016.
[27] 张传军, 刘超, 姜晓坤. 薤白乙醇提取物的抑菌特性[J]. 食品科学, 2011, 32(5): 119-122.
[28] 张媛媛, 冯亚净, 李书国. 五味子乙醇提取物的抑菌稳定性及抑菌机理研究[J]. 粮油食品科技, 2016, 24(1): 55-60. DOI:10.16210/ j.cnki.1007-7561.2016.01.013.
[29] 孟良玉, 兰桃芳, 卢佳琨, 等. 蜂胶提取物中抑菌成分稳定性研究[J].食品科学, 2010, 31(21): 98-100.
[30] 姚琪, 涂向勇, 姚继承. 酿酒副产物的综合利用新途径[J]. 酿酒, 2009, 36(6): 69-72. DOI:10.3969/j.issn.1002-8110.2009.06.029.
Antimicrobial Properties and Stability of Yellow Water, a Byproduct of Chinese Liquor Fermentation
XU Yachao1, SHENG Jie2, LIU Anjun1,*
(1. College of Food Engineering and Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China; 2. Department of Food Engineering, Weihai Ocean Vocational College, Weihai 264200, China)
Several common food spoilage bacteria and pathogens, Staphylococcus aureus, Bacillus subtilis, Escherichia coli, Salmonella, Rhizopus, Penicillium, Mucor, and Aspergillus were used as test bacteria and fungi to explore the antimicrobial properties and stability of yellow water, a byproduct of Chinese liquor fermentation. Antimicrobial properties were measured by the Oxford cup method and minimum inhibitory concentration (MIC) was determined by the double dilution method. Staphylococcus aureus and Escherichia coli were used as indicator bacteria to investigate the effects of pH, temperature, ultraviolet, sodium chloride, saccharose and metal ions on the stability of the antimicrobial. The results showed that yellow water could inhibit Staphylococcus aureus, Bacillus subtilis, Escherichia coli, Salmonella, Penicillium and Aspergillus, but had little effect on the growth of Mucor and Rhizopus. The MIC values were 6.25% for all four species of bacteria, and 1.56% and 3.13% for Penicillium and Aspergillus, respectively. Antimicrobial activity of yellow water increased at acidic pH, and decreased slightly at alkaline pH, but it was still high. Antimicrobial activity of yellow water decreased slightly after high temperature treatment but was hardly affected by ultraviolet light. This antimicrobial activity was slightly enhanced with increased concentrations of sodium chloride and saccharose. Metal ions showed little effect on the stability of the antibacterial. Moreover, Fe2+could enhance the antimicrobial activity.
Chinese liquor fermentation; yellow water; antimicrobial properties; stability
10.7506/spkx1002-6630-201715020
TS201.3
A
1002-6630(2017)15-0122-05
徐亚超, 盛杰, 刘安军. 白酒发酵副产物黄水抑菌特性及稳定性研究[J]. 食品科学, 2017, 38(15): 122-126. DOI:10.7506/ spkx1002-6630-201715020. http://www.spkx.net.cn
XU Yachao, SHENG Jie, LIU Anjun. Antimicrobial properties and stability of yellow water, a byproduct of Chinese liquor fermentation[J]. Food Science, 2017, 38(15): 122-126. (in Chinese with English abstract)
10.7506/spkx1002-6630-201715020. http://www.spkx.net.cn
2016-07-04
农业部低盐、低硝腌腊肉制品生产关键技术装备研究与示范项目(201303082-3)
徐亚超(1992—),女,硕士研究生,研究方向为功能性食品。E-mail:1136466907@qq.com
*通信作者:刘安军(1963—),男,教授,博士,研究方向为功能性食品。E-mail:laj@tust.edu.cn
