NaOH/AQ预处理对玉米秸秆脱木质素及酶解性能的影响
2017-09-03刘雯雯沈葵忠房桂干田庆文
刘雯雯, 梁 龙, 沈葵忠,2*, 房桂干, 田庆文
(1. 中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室;江苏省 生物质能源与材料重点实验室, 江苏 南京 210042; 2. 中国林业科学研究院 林业新技术研究所, 北京 100091)
·研究报告——生物质材料·
NaOH/AQ预处理对玉米秸秆脱木质素及酶解性能的影响
刘雯雯1,2, 梁 龙1, 沈葵忠1,2*, 房桂干1, 田庆文1
(1. 中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室;江苏省 生物质能源与材料重点实验室, 江苏 南京 210042; 2. 中国林业科学研究院 林业新技术研究所, 北京 100091)
对玉米秸秆进行氢氧化钠/蒽醌(NaOH/AQ)去木质化预处理,考察了预处理温度、 时间和NaOH用量对玉米秸秆脱木质素程度的影响,并探讨了脱木质素程度对提高预处理后物料酶解性能的影响。L9(34)正交试验得出较适宜预处理工艺条件为:温度160 ℃,时间60 min,NaOH用量(以绝干原料质量计)2.8 %;其他条件为AQ用量0.05 %,固液比1∶5(g∶mL),此时木质素脱除率为75 %,酶解后聚糖转化率达到73.79 %。随着物料脱木质素程度的提高,其酶解效率相应增加;当木质素脱除率达到一定程度后,预处理后的聚糖转化率达到最大值,继续提高木质素脱除率,聚糖转化率反而降低。响应面优化的酶水解工艺条件为纤维素酶用量30 FPU/g,β-葡萄糖苷酶10 IU/g,反应时间72 h,温度50 ℃,底物质量分数2.5 %,此时还原糖得率为85.62 %。对酶解液进行HPLC分析,酶解液中的葡萄糖质量浓度为14.83 g/L,木糖质量浓度为4.83 g/L。XRD分析显示,预处理前后纤维素的晶型没有变化,而结晶度由31.40 %提高至46.91 %,表明物料中木质素和半纤维素发生了不同程度的溶出。
玉米秸秆;NaOH/AQ预处理;酶水解;聚糖转化率
自然界中生物质资源储量丰富,地球上的植物每年通过光合作用所固定的碳可达到2×1011t,能量高达3×1021J[1]。生物质原料通过物理法、 化学法、 生物酶解法等方法可转化为低聚糖或可发酵糖,并可进一步制备得到生物基材料或燃料乙醇等高附加值产品,减少人类对化石燃料的依赖[2]。在生物质的多种预处理方法中,生物酶解法由于具有高效、 低污染、 低能耗等优势而被广泛研究和应用[3]。生物质原料主要由纤维素、 半纤维素、 木质素和少量的果胶组成,其中,纤维素大分子是由葡萄糖通过β-1,4糖苷键联结而成的线性高分子聚合物,常以结晶的聚集态存在;半纤维素与木质素相互交联形成致密的保护层,覆盖于纤维素表面,加上生物质的复杂结构和天然不均一性,阻碍了生物酶对纤维素的可及性,构成了生物质酶解过程中的屏障,降低了生物质原料酶解转化效率[4-5]。为了提高生物质原料的酶解转化率,研究者们开发出各种预处理方法,如稀酸预处理、 碱预处理和亚硫酸盐预处理等,其中碱预处理在脱除木质素、 增加孔隙率、 提高酶对纤维素的可及度、 减少酶解抑制物等方面具有明显优势,成为有效的预处理方法之一,受到越来越多的关注[5-9]。碱预处理常用的试剂有氢氧化钠、 碳酸钠、 氨和石灰等[10],其中,NaOH最为常用。影响NaOH脱木质素的因素很多,主要有反应温度、 时间、 碱用量和固液比等,采用不同预处理条件,会使样品的脱木质素程度不同,进而对后续酶解产生不同的影响。Wang等[11]研究了百慕大海草在不同NaOH用量(0.75 %~3 %)预处理前后结构和化学组分的变化,结果发现在NaOH用量1 %以上时实现了明显的去木质化作用。蒽醌(AQ)或蒽醌衍生物是目前使用最多的有机氧化助剂,在碱性溶液中可降低脱木质素的活化能,提高脱木质素速率并加深脱木质素程度,在蔗渣清洁制浆中取得了良好的效果[12]。本研究使用氢氧化钠/蒽醌(NaOH/AQ)对玉米秸秆进行去木质化预处理,以木质素脱除率和聚糖转化率为考察指标,采用单因素和正交试验对预处理条件进行了优化,并探讨了玉米秸秆NaOH/AQ预处理过程中木质素脱除率对提高后续酶解效率的影响,旨在探索低成本、 高效率的碱预处理工艺,为生物质大规模联合利用提供基础数据。
1 实 验
1.1 原料、试剂及仪器
玉米秸秆(山东日照),全秆运输至南京实验室,去叶后按相应的国家标准分析原料组分,结果为水分9.96 %、 纤维素(硝酸乙醇法)36.51 %、 聚戊糖23.38 %、 酸不溶木质素(Klason法)17.57 %、 酸溶木质素1.95 %、 苯醇抽出物7.01 %、 灰分3.62 %。原料经去叶洗涤、 切断、 粉碎,筛选出粒径0.18~0.85 mm的部分分装保存于聚氯乙烯塑料袋中,于0~5 ℃冷藏保存,备用。3,5-二硝基水杨酸(DNS)、 酒石酸钾钠、 无水亚硫酸钠、 苯酚、 葡萄糖,均为分析纯。纤维素酶(Celluclast 1.5 L, 酶活127 FPU/mL)和β-葡萄糖苷酶(Novozyme 188,酶活350 IU/mL)来自Novozymes公司,酶活按文献[13]提供的方法测定。
T6新世纪紫外分光光度计,北京普析通用仪器有限公司;Agilent 1100液相色谱仪,美国安捷伦公司;Aminex HPX-87P、 Aminex HPX-87H糖色谱柱,美国伯乐公司;D8-FOCUS型X射线衍射仪,德国布鲁克公司。
1.2 NaOH/AQ预处理过程及优化
先将样品取出平衡水分并测定干度。然后取150 g绝干原料放入3 L蒸煮罐中,加入1.2 %~4.4 % NaOH(以绝干原料质量计)和0.05 %蒽醌(以绝干原料质量计),并补充水分至绝干原料与水分固液比1∶5(g∶mL,下同),然后将蒸煮罐置于空气浴中,加热,由20 ℃经60 min升至140~180 ℃,然后保温15~120 min进行反应。反应结束后转移物料至37.4 μm滤袋中挤出并收集液体,供分析预处理液组分;洗涤预处理后固体物料(简称物料)至洗出液呈中性,固体物料经离心并挤压脱水、打散后放入聚乙烯袋中密封平衡水分,冷藏,供化学分析和酶水解使用。
在单因素试验基础上,采用L9(34)正交试验进行工艺条件优化,选择NaOH用量、 预处理时间和预处理温度3个因素,固定固液比1∶5和AQ用量0.05 %。
1.3 酶水解实验及响应曲面优化
取NaOH/AQ预处理后的物料,采用纤维素酶(Celluclast 1.5 L)和β-葡萄糖苷酶(Novozyme 188)进行酶解。分别取1 g绝干物料放入250 mL的锥形瓶中,按固液比1∶40加水,然后分别加入30 FPU/g纤维素酶(以绝干原料质量计,下同)和10 IU/gβ-葡萄糖苷酶,用1 mol/L的乙酸-乙酸钠缓冲溶液调节pH值至4.8。酶解实验在50 ℃恒温培养振荡器中进行,在转速130 r/min下振荡72 h;酶解结束后,加热试样使酶失活,冷却后放入高速离心机中离心5 min,过滤分离酶解液和残渣。酶解液用来测定还原糖得率、 糖组分和酸溶木质素含量。
在前期实验基础上,选取纤维素酶用量、 反应时间、 反应温度作为Box-Behnken设计的自变量,聚糖转化率为响应值,采用3因素3水平的响应面分析方法优化酶解条件,进行中心组合优化试验。
1.4 分析表征
1.4.1 原料和物料的组分分析 原料和预处理后物料中的酸不溶木质素、 酸溶木质素及其他组分按照美国NREL方法进行分析[14-15]。
1.4.2 木质素脱除率 木质素脱除率由预处理前后固体物料的总木质素质量分数计算获得,见式(1):
(1)
式中:RL—木质素脱除率,%;L1—原料中总木质素质量分数,%;L2—预处理后物料中总木质素质量分数,%。
由于玉米秸秆为禾本科原料,含有较多酸溶木质素,式中的原料和预处理后物料的总木质素质量分数均包括酸不溶木质素和酸溶木质素。
1.4.3 糖组分及总糖转化率的测定 采用Agilent 1100色谱仪以及Aminex HPX-87P色谱柱检测酶解液的糖组分,主要是葡萄糖和木糖。原料中糖组分的分析按照文献[14]的方法,预处理后物料酶解液中的糖组分分析按照文献[15]的方法。 色谱检测条件:柱温80 ℃,流量为0.6 mL/min,进样量10~50 μL,HPLC级水作为流动相,检测器采用示差折光检测器(RI)。
1.4.4 还原糖得率及聚糖转化率的测定 按照文献[16]的方法绘制还原糖质量浓度标准曲线,经拟合获得还原糖质量浓度和吸光度关系方程,见公式(2),其中R2=0.995,并通过公式(3)计算还原糖得率。
A=1.753C+0.001
(2)
(3)
式中:C—还原糖质量浓度,g/L;A—吸光度;YR—还原糖产率,%;m1—预处理后物料绝干质量,g;V—水解液总体积,L;n—测定还原糖质量浓度时稀释的倍数。
聚糖转化率是指原料的纤维素和半纤维素转化成葡萄糖和木糖的转化率,可以通过测定酶解后还原糖得率计算获得[16],具体计算公式见式(4):
(4)
式中:YC—聚糖转化率,%;y—预处理后物料得率,%;YT—还原糖的理论得率,%(针对纤维素水解得到葡萄糖时,YT=111.1 %,针对聚戊糖水解得到木糖时,YT=113.6 %,YT根据原料中葡萄糖和木糖的比例进行取值);yc—原料中的聚糖质量分数为原料中纤维素和聚戊糖之和, 59.89 %。
1.4.5 结晶度分析 玉米秸秆原料和预处理后固体物料采用梯度乙醇逐级脱水,再进行低温真空干燥和研磨,所得样品的结晶度用X 射线衍射仪采用分峰法测定。测试条件:用Cu的Kα谱线和Ni作为辐射源,λ=0.154 nm,电压10 kV,测角仪的移动速度为2(°)/min。结晶度计算见式(5):
(5)
式中:ICr—结晶度指数,%;I002—002晶面的最大衍射强度;Iam—非结晶背景衍射的散射强度。
2 结果与分析
2.1 不同预处理条件对木质素脱除率和酶解的影响

图 1 反应时间对木质素脱除率及酶解的影响Fig. 1 Effects of retention time on lignin removing rate and polysaccharide conversion rate
2.1.1 反应时间 固定固液比1∶5,反应温度150 ℃,NaOH用量2.8 %,AQ用量0.05 %,探讨了反应时间(15、 30、 60、 90和120 min)对物料木质素脱除率和聚糖转化率的影响,结果如图1所示。
从图1可以看出,开始阶段,随着反应时间的增加,木质素的脱除率增大,预处理后物料的得率相应降低;反应后期(≥60 min),木质素脱除率增加变缓,物料得率的下降趋势也变缓。物料的聚糖转化率随反应时间增加呈现先升高再降低的趋势,当反应时间为60 min时,聚糖转化率达到较高值,此后聚糖转化率下降,这可能是因为随着反应时间的延长,碳水化合物开始较多地发生降解,导致物料得率的下降,虽然脱木质素程度提高,但聚糖转化率呈现下降趋势。因此,反应时间不宜过长,过长的反应时间(≥90 min)会增加碳水化合物的降解,从而影响聚糖转化率。综合考虑,合适的反应时间为60 min。
2.1.2 NaOH用量 固定反应温度160 ℃、 时间60 min、 固液比1∶5、 AQ用量0.05 %,探讨了NaOH用量为1.2 %、1.6 %、2.4 %、2.8 %、3.2 %、3.6 %、4.0 %和4.4 %对木质素脱除率及聚糖转化率的影响,结果见图2。
由图2可以看出,随着NaOH用量的增加,物料木质素脱除率迅速增加,当NaOH用量超过3.2 %时,木质素脱除率增加变缓,表明进入缓慢脱木质素阶段。与此同时,伴随脱木质素程度的增加,NaOH预处理后物料得率也较快下降。在NaOH用量为1.2 %时,物料得率为63.07 %;NaOH用量为4.4 %时,物料得率仅为38.48 %。
从图2还可以看出,随着NaOH用量的增加,物料的聚糖转化率先增加,后期出现较快速的下降。这是因为采用较高的NaOH用量,虽然脱木质素作用增加会提高物料的酶解率,但同时也因为失去木质素的保护作用,物料中碳水化合物的碱性降解增加,导致物料得率快速下降,物料酶解率的增加不足以抵消物料得率下降造成的损失。当NaOH用量为2.4 %~3.6 %时,木质素脱除率为62 %~87 %,物料的聚糖转化率也较高,其中,NaOH用量为2.8 %时,聚糖转化率达到极值。因此,选择NaOH用量为2.8 %。
2.1.3 反应温度 温度也是影响NaOH预处理的重要因素之一。固定固液比1∶5,反应时间60 min, NaOH用量2.8 %,AQ用量0.05 %,探讨了预处理温度(140、 150、 160、 170和180 ℃)对木质素脱除率和聚糖转化率的影响,结果如图3所示。
从图3中可以看出,随着反应温度的增加,脱木质素化作用增加。当反应温度从140 ℃增加到160 ℃时,木质素脱除率快速增加,继续增加反应温度,木质素脱除率增加趋缓。另一方面,随着反应温度的增加,预处理后物料得率持续下降,反应温度为140 ℃时,物料得率为73.57 %;当温度增加到180 ℃,物料得率下降到50.02 %,此时木质素脱除率也仅为66.03 %,表明预处理温度过高时,物料中的纤维素和半纤维素发生了较大程度的降解。因此,对于NaOH预处理,过高的预处理温度并不能取得较好的预处理效果。
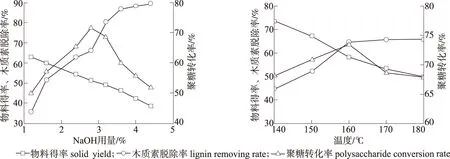
图 2 NaOH用量对木质素脱除率及酶解的影响 图 3 温度对木质素脱除率及酶解的影响
Fig. 2 Effects of NaOH charges on lignin removing rate and polysaccharide conversion rate Fig. 3 Effects of temperature on lignin removing rate and polysaccharide conversion rate
物料的聚糖转化率随温度升高呈先增加后降低的趋势。较低温度时,虽然物料得率较高,但由于物料去木质化程度较低,导致物料的酶解率较低,最终物料的聚糖转化率不高;较高反应温度(≥170 ℃)时,物料的木质素脱除率增加,酶解率增加,但由于物料得率下降,导致最终物料的聚糖转化率下降。聚糖转化率最高值73.5 %出现在木质素脱除率为64 %时,此时温度为160 ℃。
2.2 NaOH/AQ预处理的正交试验优化
确定L9(34)正交试验设计的反应温度(A)、 NaOH用量(B)和反应时间(C)3个因素水平为:反应温度150、 160和170 ℃,NaOH用量1.6 %、 2.8 %和4.0 %,反应时间30、 60和90 min。其他反应条件为固液比1∶5,AQ用量0.05 %。正交试验结果见表1。

表 1 正交试验结果Table 1 Results of orthogonal experiment
由表1可知,试验3、 6和9木质素脱除率均达到了85 %以上,说明这3组试验对玉米秸秆的去木质化效果均较好,但却没有取得与之相应的聚糖转化率;而试验2、 3和5的聚糖转化率均达到70%以上,但其木质素脱除率却并不一致。这说明虽然在一定范围内提高木素脱除率可显著提高酶解的聚糖转化率,但酶解效率不仅与脱木质素总量有关,也会受到木质素在物料中的分布位置和分布面积影响[13]。对取得较高聚糖转化率的3组试验进一步分析,试验2的木质素脱除率只有50.17 %,而聚糖转化率也低于试验3和5,表明在该条件下,脱木质素程度还没达到合适的范围,酶解效率还有提升的空间。试验3和试验5的聚糖转化率虽然相差不大,但试验3的木质素脱除率达到87.53%,由于脱木质素程度过高会加速物料中碳水化合物的降解,从而影响到酶解效率,因此初步确定试验5(A2B2C3)为较适宜的预处理条件。而通过极差分析可知,各因素对木质素脱除率的影响次序为NaOH用量>反应时间>反应温度;对聚糖转化率的影响次序为反应时间>NaOH用量>反应温度,因此反应时间对聚糖转化率的影响比较显著,为了进一步优化反应时间,以A2B2C3和A2B2C2条件进行验证实验,聚糖转化率分别为72.31 %和73.79 %,表明在较短反应时间条件下也能达到较好的预处理效果,最终确定最优工艺条件为A2B2C2,即温度160 ℃、 NaOH用量2.8 %、 反应时间60 min,此时木质素脱除率为75 %。
2.3 X射线衍射分析

图4 样品的X射线衍射图Fig. 4 XRD patterns of samples
图4为预处理前后玉米秸秆的XRD图。从图4可以看出,玉米秸秆预处理前后结晶度指数或多或少发生了改变,但纤维素的晶型没有变化。结晶度由原料的31.40 %提高为预处理后物料的46.91 %,可能与物料中木质素和半纤维素发生不同程度的溶出有关。
2.4 酶解条件的响应曲面优化
使用上述正交试验优化的最佳试验条件制备的物料进行酶解,对纤维素酶用量(X1)、 酶解时间(X2)以及酶解温度(X3)进行3因素3水平响应面分析试验,试验过程中其他酶解条件为底物质量分数2.5 %,β-葡萄糖苷酶10 IU/g,pH值4.8,转速130 r/min,试验设计及结果见表2。

表 2 响应面试验结果Table 2 The results of the response surface optimization


表 3 回归模型方差分析Table 3 Variance analysis of regression model
3 结 论
3.1 以玉米秸秆为原料探讨NaOH/AQ预处理玉米秸秆过程中,不同工艺条件对原料木质素脱除率和最终酶解效率的影响。经正交试验分析,发现酶解不仅与物料的木质素质量分数有关,也与木质素的分布位置和分布面积有关。优化的预处理工艺条件为:温度160 ℃,反应时间60 min,NaOH用量2.8 %,其他条件为AQ用量0.05 %,固液比1∶5(g∶mL),此时木质素脱除率为75 %,酶解后聚糖转化率达到73.79 %。
3.2 对预处理前后玉米秸秆进行XRD分析发现,预处理前后纤维构型并没有发生明显的变化,结晶度由原料的31.40 %提高为预处理后物料的46.91 %,可能与物料中木质素和半纤维素发生不同程度的溶出有关。
3.3 对预处理后物料的酶解条件进行响应面试验优化,得到最佳工艺条件为:纤维素酶用量30 FPU/g,β-葡萄糖苷酶10 IU/g,反应时间72 h,温度50 ℃,底物质量分数2.5 %,此时还原糖得率为85.62 %。用HPLC对经最佳酶解工艺条件处理的酶解液进行分析,物料经纤维素酶和β-葡萄糖苷酶水解后,葡萄糖质量浓度为14.83 g/L,木糖质量浓度为4.83 g/L。
[1] 陈砺,王红林,方利国. 能源概论[M]. 北京:化学工业出版社,2009:105.
[2]张建安,刘德华. 生物质能转化技术[M]. 北京:化学工业出版社,2009:9-12.
[3]KUMAR R,SINGH S,SINGH O V. Bioconversion of lignocellulosic biomass:Biochemical and molecular perspectives[J]. Journal of Industrial Microbiology & Biotechnology,2008,35(5):377-391.
[4]SUN S N,CAO X F,ZHANG X M,et al. Characteristics and enzymatic hydrolysis of cellulose-rich fractions from steam exploded and sequentially alkali delignified bamboo(Phyllostachyspubescens)[J]. Bioresource Technology,2014,163(7):377-380.
[5]CHEN M,ZHAO J,XIA L M. Comparison of four different chemical pretreatments of corn stover for enhancing enzymatic digestibility[J]. Biomass and Bioenergy,2009,33(10):1381-1385.
[6]QING Q,ZHOU L,GUO Q,et al. A combined sodium phosphate and sodium sulfide pretreatment for enhanced enzymatic digestibility and delignification of corn stover[J]. Bioresource Technology,2016,218:209-216.
[7]JIN S,ZHAGN G,ZHAGN P,et al. High-pressure homogenization pretreatment of four different lignocellulosic biomass for enhancing enzymatic digestibility[J]. Bioresource Technology,2015,181:270-274.
[8]HENDRIKS A,ZEEMAN G. Pretreatments to enhance the digestibility of lignocellulosic biomass[J]. Bioresource Technology,2009,100(1):10-18.
[9]田庆文,房桂干,沈葵忠. 不同预处理方法对玉米秸秆酶解性能的影响[J]. 林业工程学报,2017,2(2):90-95.
[10]JUN S K,LEE Y Y,KIM T H. A review on alkaline pretreatment technology for bioconversion of lignocellulosic biomass[J]. Bioresource Technology,2016,199:42-48.
[11]WANG Z Y,KESHWANI D R,REDDING A P,et al. Sodium hydroxide pretreatment and enzymatic hydrolysis of coastal Bermuda grass[J].Bioresource Technology,2010,101(10):3583-3585.
[12]HUANG G L,SHI J X,LANGRISH T A G. Environmentally friendly bagasse pulping with NH4OH-KOH-AQ[J]. Journal of Cleaner Production,2008,16(12):1287-1293.
[13]GHOSE T. Measurement of cellulase activities[J]. Pure and Applied Chemistry,1987,59(2):257-268.
[14]SLUITER B H A,HAMES B,RULIZ-PEINADD R,et al. Determination of structural carbohydrates and lignin in biomass,NREL/TP-510-42618[R]. Golden:National Renewalbe Energy Laboratory,2010.
[15]SLUITER B H A,HAMES B,RULIZ-PEINADD R,et al. Determination of sugars,byproducts,and degradation products in liquid fraction process samples,NREL/TP-510-42623[R]. Golden:National Renewalbe Energy Laboratory,2006.
[16]房桂干,刘姗姗,沈葵忠. 杨木废弃物稀酸水解预处理条件的响应面优化[J]. 生物质化学工程,2014,48(6):18-24.
计量标准器具 竭诚欢迎使用检定
松香色度标准块
本产品具有国内行业中质量检验的权威性
长期、周到的售后服务让客户无后顾之忧
松香色度标准装置(又名《松香颜色分级标准》玻璃比色块),是符合我国松香光学特性具有完整体系的松香颜色分级标准。1982年荣获林业部科技成果二等奖。1987年至今,被《脂松香》、《松香试验方法》国家标准所采用,并多次经国家质量监督检验检疫总局复查考核合格。

Effects of NaOH/AQ Pretreatment on Delignification and Enzymatic Digestibility of Corn Stover
LIU Wenwen1,2, LIANG Long1, SHEN Kuizhong1,2, FANG Guigan1, TIAN Qingwen1
(1. Institute of Chemical Industry of Forest Products,CAF;National Engineering Lab. for Biomass Chemical Utilization;Key and Open Lab. of Forest Chemical Engineering,SFA;Key Lab. of Biomass Energy and Material,Jiangsu Province, Nanjing 210042, China; 2. Research Institute of Forestry New Technology,CAF, Beijing 100091, China)
The optimized conditions of NaOH/AQ pretreatment and the effects of the lignin removing rate on the enzymatic digestibility of the pretreated corn stover were investigated. The optimized conditions of the NaOH/AQ pretreatment obtained by the orthogonal experimental design were the reaction temperature 160 ℃,the reaction time 60 min, the NaOH dosage(based on the mass of dried material)2.8 %,the anthraquinone(AQ) dosage 0.05 % and the solid to liquor ratio 1∶5(g∶mL). Under these conditions,the lignin removing rate reached 75 % and the polysaccharides conversion rate of the enzymatic digestibility reached 73.79 %. The enzymatic efficiency of the pretreated samples improved with the increase of the lignin removing rate. The maximum polysaccharide conversion rate of the pretreated biomass could be obtained as the lignin removing rate reached some degree and then the polysaccharides conversion rate decreased with the continued increase of the lignin removing rate. The optimized conditions of enzymatic hydrolysis by using response surface experimental design were as follows:the temperature 50 ℃,the time 72 h,the substrate consistency 2.5 %, the cellulase dosage 30 FPU/g and the cellubiase enzyme dosage 10 IU/g. Then the reducing sugar yield was 85.62 %. The HPLC analyses showed that the glucose and xylose mass concentrations in the enzymatic hydrolyzates were 14.83 and 4.83 g/L,respectively. The results of XRD showed that the crystal form of cellulose before and after pretreatment didn′t change and the crystallinity of the pretreated corn stover was increased to 46.91 % from 31.40 % because of the dissolving of lignin and hemicellulose.
corn stover;NaOH/AQ pretreatment;enzymatic hydrolysis;polysaccharide conversion rate

联系地址:210042 南京市锁金五村16号中国林科院林产化学工业研究所电 话:(025)85482449,85482448联系人:谭卫红传 真:(025)85482450
2016-04-21
江苏省自然科学基金资助项目(BK20160151);江苏省生物质能源与材料重点实验室项目(JSBEM2014012) 作者简介:刘雯雯(1991— ),女,江苏淮安人,硕士生,研究方向为制浆造纸及生物质预处理技术;E-mail:wenwenready@163.com
10.3969/j.issn.1673-5854.2017.04.006
TQ35
A
1673-5854(2017)04-0039-08
*通讯作者:沈葵忠,研究员,研究领域为制浆造纸新技术及生物质预处理技术;E-mail:shenkuizhong@aliyun.com。
