利用牡蛎制备ACE抑制肽的工艺优化
2017-09-03沈建东张凌晶刘光明曹敏杰
邱 娟,沈建东,翁 凌,2,张凌晶,2,刘光明,2,曹敏杰,2,*
利用牡蛎制备ACE抑制肽的工艺优化
邱 娟1,沈建东1,翁 凌1,2,张凌晶1,2,刘光明1,2,曹敏杰1,2,*
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.水产品深加工技术国家地方联合工程研究中心,福建 厦门 361021)
运用正交试验和响应面法优化牡蛎血管紧张素转换酶(angiotensin-Ⅰ converting enzyme,ACE)抑制肽的分步酶解制备工艺。采用复合蛋白酶和碱性蛋白酶对牡蛎进行分步酶解,以十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析和ACE抑制率为考核指标优化工艺参数。结果表明,第1步复合蛋白酶最佳工艺参数为:料液比1∶4、加酶量1.2%、pH 7.0、反应温度50 ℃、酶解时间1 h;第2步碱性蛋白酶最佳工艺参数为:加酶量0.42%、pH 8.3、反应温度53 ℃、酶解时间73 min。凝胶过滤色谱法测得牡蛎酶解液分子质量在3 000 D以下小肽所占比例为99.72%,其ACE抑制活性IC50为0.8 mg/mL。同时,氨基酸组成分析表明,牡蛎肽中Glu含量最高,Cys含量最低;必需氨基酸和疏水性氨基酸含量分别占总氨基酸的36.6%和37.2%。本研究制备的低分子质量、高ACE抑制活性牡蛎肽,可为牡蛎资源的开发利用提供理论参考。
牡蛎;酶解;ACE抑制肽;分子质量分布;氨基酸组成
牡蛎是福建省重要的经济贝类,2014年产量达161.2万 t,占全国总量的37%[1],资源极为丰富。牡蛎含有多种活性物质,是我国第一批被列为药食同源的食品[2-3],牡蛎中必需氨基酸完全程度和质量比例优于人乳和牛乳[4-5]。研究表明,蛋白质降解后可生成小分子质量肽类,某些肽类具有抗氧化、降血压、抗菌等生物活性功能。目前,牡蛎以鲜食和干制为主,随着消费者对高质量海洋食品需求的提高,行业加工水平低和产品种类少等问题日益凸显,实现牡蛎精深加工和高值化利用具有重要意义。
血管紧张素转换酶(angiotensin-Ⅰ converting enzyme,ACE)是一种膜结合的二肽羧基酶,对人体血压有重要的调控作用[6-7]。化学合成药物如卡托普利和依那普利等对高血压具有良好治疗效果,但该类药物往往具有一定副作用[8]。天然来源的ACE抑制肽因安全性高、易被人体吸收而受到广泛关注[9]。目前,国内外研究学者已从海参[10]、贻贝[11]、虾壳[12]、牛奶[13]、蛇腹[14]、小球藻[15]、牦牛乳酪蛋[16-17]等中获得ACE抑制肽。以牡蛎为原料制备ACE抑制肽有一定研究[18],然而系统研究其制备工艺较少,直接影响其产业化发展。本研究以福建高产的太平洋牡蛎(Crassostrea gigas)为原料,运用正交试验及响应面分析法优化酶解工艺参数,以获得分子质量小、ACE抑制活性高的牡蛎肽,以期为牡蛎资源的开发利用提供一定的理论基础和技术指导。
1 材料与方法
1.1 材料与试剂
新鲜太平洋牡蛎(Crassostrea gigas) 厦门集美菜市场。
木瓜蛋白酶、中性蛋白酶、复合蛋白酶、风味蛋白酶、碱性蛋白酶 诺维信生物技术有限公司;蛋白标准分子质量 立陶宛Fermentas公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、四甲基乙二胺(tetramethylethylenediamine,TEMED)、丙烯酰胺、N,N-亚甲叉双丙烯酰胺 美国Bio-Rad公司;甘氨酸中国医药集团上海化学试剂公司;Tris-碱 德国Roche公司;马尿酰组胺酰亮氨酸(hippuryl-histidyl-leucine,HHL) 美国Sigma公司。
1.2 仪器与设备
PT-2100组织捣碎机 瑞士Kinematica公司;Lambda 35紫外分光光度计 美国Perkin Elmer公司;Stater 3100 pH计 美国Ohaus公司;Centrifuge 541小型冷冻离心机 德国Eppendorf公司;G-BOX凝胶成像分析系统 英国Syngene公司;1260高效液相色谱仪美国Agilent公司。
1.3 方法
1.3.1 牡蛎基本成分分析
水分含量测定采用直接干燥法,参照GB 5009.3—2010《食品中水分的测定》;粗蛋白含量测定采用凯氏定氮法,参照GB/T 5009.5—2010《食品中蛋白质的测定》;总糖含量测定采用蒽酮硫酸法[19];粗脂肪含量测定采用索氏提取法,参照GB/T 14772—2008《食品中粗脂肪的测定》。
1.3.2 牡蛎肽制备工艺
第1步酶解:取牡蛎肉100 g,加入一定比例蒸馏水组织匀浆,调节pH值至酶解所需,并加入一定量的复合蛋白酶进行恒温酶解,反应结束后95 ℃加热10 min终止反应。所得酶解液进行SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)分析,并测定其ACE抑制率。
第2步酶解:以第1步酶解液为反应底物,调整pH值至酶解所需值,加入一定量的碱性蛋白酶进行恒温酶解,酶解结束后95 ℃加热10 min终止反应。所得酶解液进行SDS-PAGE分析,并测定其ACE抑制率及分子质量分布。
1.3.3 第1步酶解条件优化
1.3.3.1 单因素试验
选定第1步酶解最优蛋白酶,以SDS-PAGE分析和ACE抑制率为指标,比较料液比、加酶量及酶解时间对牡蛎蛋白降解的影响。1)料液比的影响:在加酶量1%、pH 7.0酶解2 h条件下,考察不同料液比(1∶1、1∶2、1∶3、1∶4(g/mL))对牡蛎蛋白酶解和ACE抑制率的影响。2)加酶量的影响:在料液比1∶2、pH 7.0酶解2 h条件下,考察复合蛋白酶添加量(0%、0.1%、0.3%、0.5%、0.8%、1.0%、2.0%)对牡蛎蛋白酶解和ACE抑制率的影响。3)酶解时间的影响:在料液比1∶2、加酶量0.8%、pH 7.0条件下,考察酶解时间(0、1、2、3、4 h)对牡蛎蛋白酶解和ACE抑制率的影响。4)pH值的影响:在料液比1∶2、加酶量0.8%、反应2 h条件下,考察反应pH值(6.0、7.0、8.0、9.0)对牡蛎蛋白酶解和ACE抑制率的影响。
1.3.3.2 正交试验优化
根据牡蛎第1步酶解的最佳单因素条件设计正交试验(表1),以SDS-PAGE分析为依据,分析比较不同试验组条件对牡蛎蛋白的降解情况,筛选第1步酶解最优条件。

表1 正交试验设计Table 1 Coded levels and corresponding actual levels of optimization parameters used in orthogonal array design
1.3.4 牡蛎蛋白第2步酶解条件优化
1.3.4.1 单因素试验
选定第2步酶解最优蛋白酶,以SDS-PAGE分析及ACE抑制率为指标,比较蛋白酶添加量及酶解时间对牡蛎蛋白酶解和ACE抑制率的影响。
1.3.4.2 响应面设计优化
在单因素试验基础上,根据Box-Behnken设计原理进行试验设计,选取加酶量、pH值、反应温度、酶解时间进行酶解条件优化,响应面优化的试验因素及水平设计见表2。

表2 响应面试验因素与水平设计Table 2 Coded levels and corresponding actual levels of optimization parameters used in responses surface analysis
1.3.5 ACE抑制活性的测定
ACE抑制活性的测定参照Wu Qiang等[20]方法,并稍作修改,具体步骤如下:离心管中依次加入125 µL 6.5 mmol/L HHL和50 µL样品,37 ℃预热5 min后加入50 µL ACE,接着在37 ℃条件下水浴反应1 h。反应结束后加入125 µL 1 mol/L HCl溶液终止反应,继续加入750 µL乙酸乙酯提取,吸取500 µL抽提液于2.0 mL离心管中,挥发除去乙酸乙酯后加入1.5 mL去离子水充分溶解,在228 nm波长处测定吸光度。其中,对照组用去离子水代替样品,空白组预先加入HCl,其余条件不变。ACE抑制率计算如下式所示:

式中:A样为样品组吸光度;A样空为样品空白组吸光度;A对为对照组吸光度;A对空为对照空白组吸光度。
1.3.6 牡蛎酶解产物分子质量分布的测定
采用高效凝胶过滤色谱法测定牡蛎酶解液的分子质量分布[20]。其中,标准品为:小清蛋白:11515 D;脯氨酸内肽酶小肽:4907 D;3 个合成小肽ALLAGDPSVLED、YGDEY和AMN的分子质量分别为:1 199、645、334 D。色谱条件:1260 Agilent高效液相色谱纯化系统;色谱柱为TSK gel G2000 SWXL(φ7.8 mm×300 mm);流动相为V(乙腈)∶V(水)∶V(三氟乙酸)=45∶55∶0.1;进样体积为10 µL;流速为0.5 mL/min;柱温为30 ℃;检测波长为220 nm。所得数据利用GPC Offline软件分析,确定样品的分子质量分布。
1.3.7 氨基酸组成分析
氨基酸的测定参考毋瑾超等[21]方法,并作修改,具体步骤为:取酶解液于可密封消化管中,加入6 mol/L HCl和苯酚,在-8 ℃酒精中预冷10 min,抽真空后充入氮气,置于110 ℃水解22 h,反应结束后蒸馏法除去盐酸,经0.22 µm膜过滤后进行高效液相色谱检测。
2 结果与分析
2.1 基本成分分析
为了解所用牡蛎原料基本营养成分,对其水分、粗蛋白、总糖及粗脂肪含量进行测定。牡蛎水分含量为74.52%,粗蛋白含量为12.62%,总糖含量为10.10%,粗脂肪含量为1.89%,表明牡蛎是一种高蛋白、糖原丰富、低脂肪的优质食品。
2.2 牡蛎第1步酶解条件优化

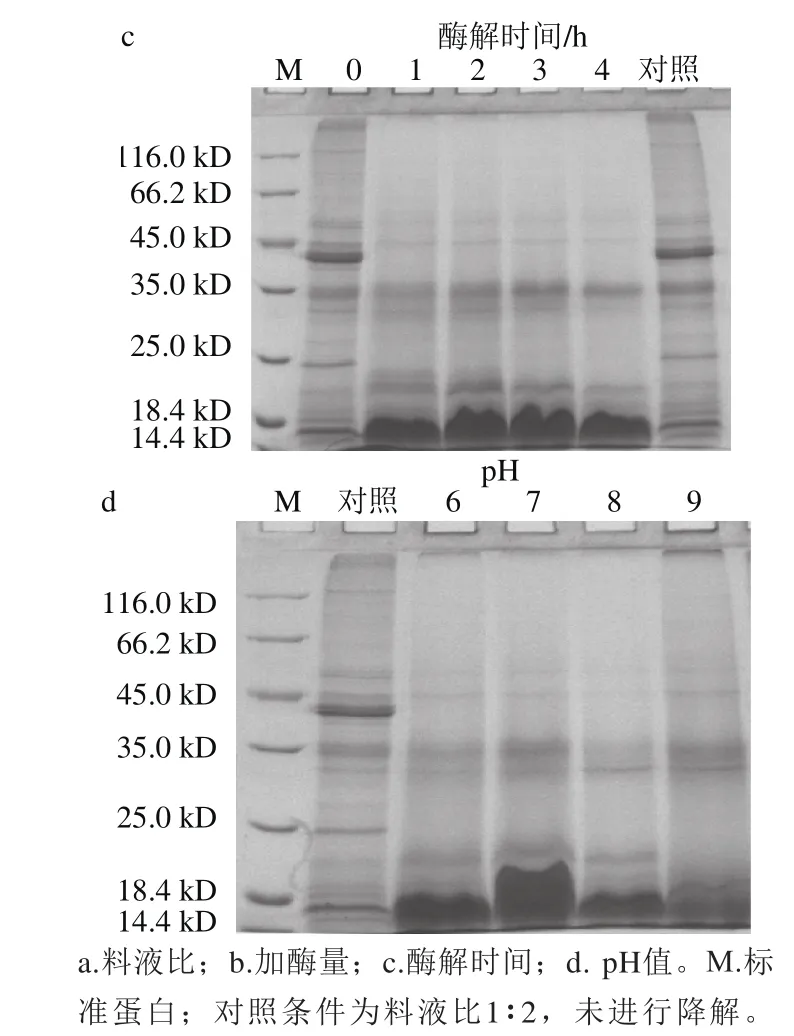
图1 单因素对第1步酶解效果的SDS-PAGE分析Fig. 1 SDS-PAGE analysis of the effects of various factors in the first hydrolysis step on protein breakdown
由图1a可知,随着溶剂用量增加,牡蛎蛋白降解随之加快,同时ACE抑制率结果显示当料液比为1∶2时酶解液活性高于1∶4,故选择料液比为1∶2(图中未体现)。由图1b可知,随着加酶量增大,蛋白逐渐被降解。当加酶量为0.8%时,降解条带和ACE抑制活性基本保持不变,综合考虑选择加酶量为0.8%。同时,综合考虑SDSPAGE分析结果和ACE抑制活性,选择酶解最佳时间为2 h(图1c),pH值为7.0(图1d)。

图2 第1步酶解效果的SDS-PAGE分析Fig. 2 SDS-PAGE analysis of hydrolysates obtained from nine orthogonal array runs
以料液比、加酶量、pH值和酶解时间进行四因素三水平的正交试验,优化第1步酶解工艺。由图2可知,经酶解后,牡蛎全蛋白分子质量主要分布在14.4 kD以上。牡蛎蛋白经复合蛋白酶酶解后,试验组3、9的大部分蛋白被酶解,但在60 kD及14.4 kD附近仍有少量蛋白存在。从成本角度考虑,试验组3酶解时间过长,故选择试验组9为第1步复合蛋白酶的最佳条件,即料液比1∶4、加酶量1.2%、pH 7.0,酶解时间1 h。
2.3 牡蛎第2步酶解最优蛋白酶的选择及响应面试验优化
2.3.1 牡蛎第2步酶解最优蛋白酶的选择
以第1步酶解产物为底物,比较木瓜蛋白酶、中性蛋白酶、风味蛋白酶及碱性蛋白酶4 种酶对第2步酶解的效果。

图3 4 种蛋白酶第2步酶解效果的SDS-PAGE分析Fig. 3 SDS-PAGE analysis of hydrolysates obtained after the second hydrolysis step with four different proteinase
由图3可知,碱性蛋白酶降解效果最好,其次为木瓜蛋白酶,风味蛋白酶效果最差。同时,由图4可知,第1步酶解液的ACE抑制率为73.9%,经第2步酶解后各酶解液的ACE抑制活性均出现不同程度提高,ACE抑制率达90%以上。推测可能是由于二次酶解后水解度进一步提高,生成了新的ACE抑制肽[12]。综合考虑SDS-PAGE分析及ACE抑制率结果,选定碱性蛋白酶进行第2步酶解。

图4 不同蛋白酶酶解产物的ACE抑制率Fig. 4 ACE inhibitory activities of hydrolysates produced by different proteases
2.3.2 牡蛎蛋白第2步酶解的单因素试验结果
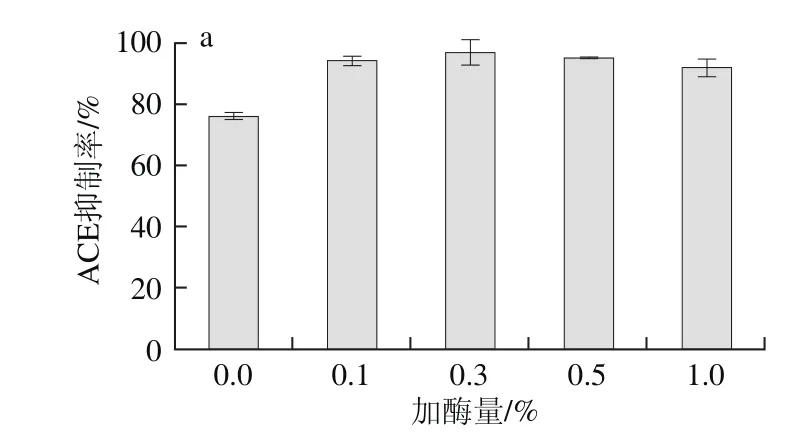

图5 加酶量(a)和酶解时间(b)对ACE抑制率的影响Fig. 5 Effect of alkaline protease dosage and hydrolysis time on ACE inhibitory activity
以碱性蛋白酶为第2步酶解工具酶,探究加酶量及酶解时间对酶解产物ACE抑制活性的影响。由图5a可知,随着加酶量的增加,ACE抑制率呈现先上升后下降的趋势。原因可能在于牡蛎蛋白酶解后ACE抑制肽不断被释放,当酶过量时,部分ACE抑制肽降解成更小的肽或氨基酸,丧失活性[22]。因此,选择加酶量0.3%用于下一步研究。
由图5b可知,随着酶解时间延长,ACE抑制率先上升后趋于平稳,初始酶解阶段,底物与较多蛋白酶反应,ACE抑制肽被快速释放,时间延长后底物和酶量的减少,反应逐渐趋于平缓,ACE抑制肽不再被释放。最终确定酶解时间为60 min,经第2步酶解后产物的ACE抑制率提升至92.7%。根据图5结果,确定牡蛎蛋白第2步酶解工艺为:加酶量0.3%、酶解时间60 min。碱性蛋白酶是在pH值偏碱性范围内水解蛋白质肽键的酶类,其酶活力在pH 8.0、50℃条件下较高(GB/T 23527—2009《蛋白酶制剂》),故选择反应pH 8.0、反应温度50℃。
2.3.3 响应面试验结果
在牡蛎蛋白第2步酶解单因素试验基础上,根据Box-Behnken响应面法的要求,展开29组试验,结果见表3。

表3 响应面试验设计与结果Table 3 Experimental design together with results for response surface analysis

续表3
利用Design-Expert软件,以加酶量、反应温度、pH值及酶解时间为响应变量,以ACE抑制率为响应值对表4进行回归分析,预测模型如下:
Y=93.16+3.32A+2.38B+2.62C-0.15D-2.95AB-2.05AC+2.45AD-1.27BC+2.35BD+1.35CD-3.28A2-2.72B2-3.15C2-2.96D2
利用Design-Expert软件对上述模型及方程系数进行方差分析,结果见表4。

表4 回归模型方差分析及显著性检验Table 4 Analysis of variance of regression model and significance test
由表4可知,模型极显著(P<0.000 1),试验设计可靠。模拟失拟性检验,P=0.621 1>0.05,表明模型拟合度好,能准确地模拟各因素对ACE抑制率的影响。R2=0.948 1,表明模型与实际情况拟合很好,可用于预测ACE抑制率的变化情况。一次项中A、B、C影响极显著,D影响不显著;交互项中AB、AD与BD影响极显著,AC影响显著,BC与CD影响不显著。由图6交互项因素响应面图可知,加酶量与酶解时间、pH值与酶解时间的交互作用较强,而pH值与反应温度、反应温度与酶解时间的交互作用相对较弱。结合上述因素值及各因素对ACE抑制率的影响,得预测最优酶解条件为:加酶量0.42%、pH 8.29、反应温度52.97 ℃、酶解时间72.94 min,该模型预测ACE抑制率为94.54%。考虑到实际情况,修正最优酶解条件为加酶量0.42%、pH 8.3、反应温度53 ℃、酶解时间73 min,经实验验证,在该最优条件下获得的酶解液其ACE抑制率达到94.36%,与预测值相近,证明在实践中应用该模型可行。


图6 交互项的响应面图Fig. 6 Response surface plots showing the interactive effects of factors on ACE inhibitory activity
2.4 牡蛎酶解产物分子质量分布
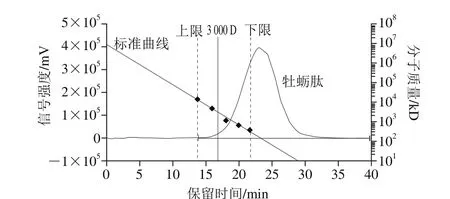
图7 牡蛎肽分子质量分布的凝胶过滤色谱图Fig. 7 Gel filtration chromatogram of oyster peptides
由图7可知,标准品处于一条直线上,线性良好(R=0.9991),能较好地反映酶解产物的分子质量分布情况。计算得知,牡蛎蛋白酶解后分子质量在3 000 D以下部分小肽所占比例为99.72%,表明经复合蛋白酶和碱性蛋白酶两步酶解后,牡蛎蛋白质被完全降解为小分子物质,推测牡蛎产物中高ACE抑制活性组分主要集中在分子质量在3 000 D以下部分,与Miguel等[23]的研究结果一致。
2.5 牡蛎肽的ACE抑制活性

图8 牡蛎肽的ACE抑制活性Fig. 8 ACE inhibitory activity of oyster peptides
对获得的牡蛎肽ACE抑制率进行测定,结果如图8所示。当质量浓度从0 mg/mL增加到1 mg/mL时,ACE抑制活性大幅度上升,抑制率接近60%。当质量浓度大于1 mg/mL时,随着肽质量浓度的增加,ACE抑制率仍不断上升,但增加趋势逐渐趋于平缓。经计算,牡蛎肽ACE抑制活性IC50为0.8 mg/mL,该结果与姜瞻梅等[24]利用酪蛋白制备的ACE抑制肽(IC50为0.68 mg/mL)相当,具有较高ACE抑制活性。胡松青等[25]发现鱼鳞明胶降解产物的ACE抑制活性IC50为0.56 mg/mL,活性稍高于牡蛎肽。此外,张艳萍等[11]发现贻贝降解产物的ACE抑制活性IC50为34.6mg/mL,低于牡蛎肽。实际上,肽的生物活性与其氨基酸组成和序列密切相关[26]。研究认为,当ACE抑制肽的C末端为Tyr、Pro、Trp、Phe和Leu,N末端为Val、Ile、Arg、Tyr、Gly、Ala和Leu时,表现出较强的ACE抑制活性[27-28]。碱性蛋白酶酶解产生的肽 C末端常带有疏水性氨基酸,这种结构符合具有高ACE抑制活性肽的特点,且碱性蛋白酶能够获得较短的肽段,短肽更具潜在的ACE抑制活性[29-30]。此外,牡蛎富含多糖,从牡蛎中提取多糖进行ACE抑制活性的测定,获得其IC50为20.1 mg/mL,明显低于牡蛎肽的ACE抑制活性(IC50=0.8 mg/mL),因此推测抑制活性主要来源于牡蛎肽。不足的是,本研究获得的牡蛎肽仍是混合物,活性肽的主要组分与结构尚不明确,今后有必要对其主要成分进行分离,利用质谱技术或N端测序获得活性肽的一级结构,解明其与ACE作用的机理。
2.6 氨基酸组成分析
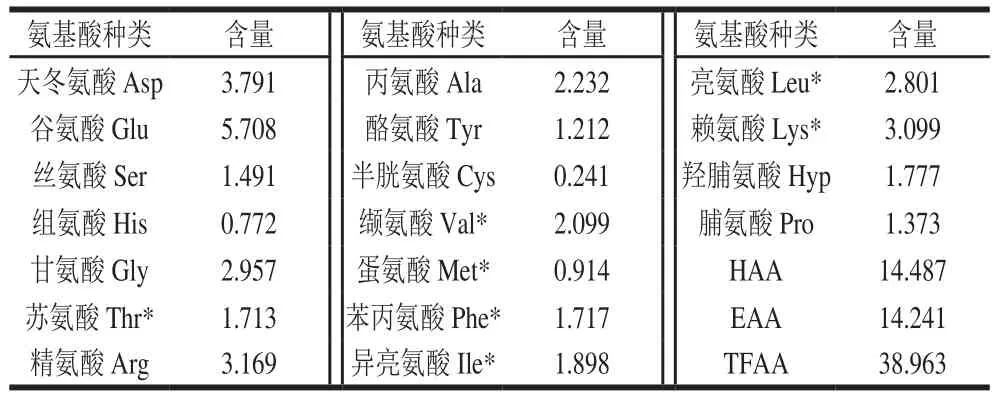
表5 牡蛎肽的氨基酸组成分析Table 5 Analysis of amino acid composition of oyster peptides g/100 g
由表5可知,牡蛎肽氨基酸组成中,Glu含量最高,Asp、Arg次之,Lys和Gly等含量也很高,Cys含量最低。牡蛎肽中必需氨基酸含量占总氨基酸的36.6%,疏水性氨基酸含量占总氨基酸的37.2%,表明其良好的营养价值。由于本研究样品处理以酸水解,Trp被破坏,因此无法提供该氨基酸含量的数据。
3 结 论
通过正交试验和响应面分析法,确定分步酶解牡蛎制备ACE抑制肽的最佳工艺为:第1步:料液比1∶4、复合蛋白酶加酶量1.2%、pH 7.0、酶解时间1 h;第2步:碱性蛋白酶加酶量0.42%、pH 8.3、反应温度53 ℃、酶解时间73 min。制备所得牡蛎肽分子质量在3 000 D以下部分占99.72%,其ACE抑制活性IC50为0.8 mg/mL,具有较高活性。另一方面,牡蛎肽中Glu含量最高,Cys含量最低,必需氨基酸含量和疏水性氨基酸含量分别占总氨基酸的36.6%和37.2%。本研究建立了分步酶解法制备高ACE抑制活性的牡蛎肽工艺,为牡蛎精深加工及高值化利用提供一定的理论依据和技术支持。
[1] 农业部渔业局. 中国渔业年鉴[M]. 北京: 中国农业出版社, 2015.
[2] 汪何雅, 杨瑞金, 王璋. 牡蛎的营养成分及蛋白质的酶法水解[J]. 水产学报, 2003, 27(2): 164-168. DOI:10.3321/j.issn:1000-0615.2003.02.011.
[3] 刘姝, 王淑军, 房耀维, 等. 发酵法制备太平洋牡蛎水解液的功能特性及其抗氧化活性[J]. 水产科学, 2013, 32(11): 641-645. DOI:10.3969/j.issn.1003-1111.2013.11.003.
[4] MENDEZ L A, SANDOVAL C C A, CASSOETCS R B. Effect of substrate and harvest on the amino acid profile of oyster mushroom (Pleurotus ostreatus)[J]. Journal of Food Composition and Analysis, 2005, 18(5): 447-450. DOI:10.1016/j.jfca.2004.02.002.
[5] 曾利荣, 张尔贤. 牡蛎的食用与药用价值及其开发利用[J]. 自然杂志, 1998, 20(6): 322-325.
[6] 林凯, 张兰威, 谯飞, 等. ACE抑制肽构效关系及其酶法制备的研究进展[J]. 食品科学, 2017, 38(3): 261-270. DOI:10.7506/spkx1002-6630-201703042.
[7] 崔楠, 陶晓赟, 李娟, 等. 响应面法优化黄粉虫蛋白制备ACE抑制肽的条件[J]. 食品科学, 2014, 35(15): 156-160. DOI:10.7506/spkx1002-6630-201415032.
[8] BOUGATEF A, NEDJAR-ARROUME N, RAVALLEC-PL R, et al. Angiotensin Ⅰ-converting enzyme (ACE) inhibitory activities of sardinelle (Sardinella aurita) by-products protein hydrolysates obtained by treatment with microbial and visceral fish serine proteases[J]. Food Chemistry, 2008, 111(2): 350-356. DOI:10.1016/ j.foodchem.2008.03.074.
[9] 刘志国, 吴琼, 吕玲肖, 等. 酶解米糠蛋白分离提取ACE抑制肽及其结构研究[J]. 食品科学, 2007, 28(3): 223-227. DOI:10.3321/ j.issn:1002-6630.2007.03.053.
[10] 何丽霞, 李勇. 海参肽生物学功能研究进展[J]. 食品科学, 2015, 36(9): 215-218. DOI:10.7506/spkx1002-6630-201509040.
[11] 张艳萍, 戴志远, 张虹. 贻贝中ACE抑制活性肽的酶解制备及表征[J]. 中国食品学报, 2011, 11(1): 51-59. DOI:10.3969/ j.issn.1009-7848.2011.01.009.
[12] 施旭丹, 罗自生, 那地拉·阿合买提江, 等. 酶解虾壳蛋白制备ACE抑制剂的工艺优化[J]. 食品科学, 2012, 33(11): 131-136.
[13] PIHLANTO A, VIRTANEN T, KORHONEN H. Angiotensin Ⅰconverting enzyme (ACE) inhibitory activity and antihypertensive effect of fermented milk[J]. International Dairy Journal, 2010, 20: 3-10. DOI:10.1016/j.idairyj.2009.07.003.
[14] FERREIRA S H. A Bradykinin-potentiating fractor (BPF) present in the venom of Bothrops jararaca[J]. British Journal of Pharmacology, 1965, 24: 163-169. DOI:10.1111/j.1476-5381.1965.tb02091.x.
[15] KO S C, KANG N, KIM E A, et al. A novel angiotensin Ⅰ-converting enzyme (ACE) inhibitory peptide from a marine Chlorella ellipsoidea and its antihypertensive effect in spontaneously hypertensive rats[J]. Process Biochemistry, 2012, 47(12): 2005-2011. DOI:10.1016/ j.procbio.2012.07.015.
[16] MAO X Y, NI J R, SUN W L, et al. Value-added utilization of yak milk casein for the production of angiotensin-Ⅰ-converting enzyme inhibitory peptides[J]. Food Chemistry, 2007, 103(4): 1282-1287. DOI:10.1016/j.foodchem.2006.10.041.
[17] JIANG J, CHEN S, REN F, et al. Yak milk casein as a functional ingredient: preparation and identification of angiotensin-Ⅰ-converting enzyme inhibitory peptides[J]. Journal of Dairy Research, 2007, 74(1): 18-25. DOI:10.1017/S0022029906002056.
[18] 苑园园, 于宏伟, 田益玲, 等. 酶法制备牡蛎ACE抑制肽的条件优化[J]. 中国食品学报, 2013. 13(3): 116-121. DOI:10.16429/j.1009-7848.2013.03.010.
[19] ROMERO M C, KELLY A L, KERRY J P. Effects of high-pressure and heat treatments on physical and biochemical characteristics of oysters (Crassostrea gigas)[J]. Innovative Food Science and Emerging Technologies, 2007, 8(1): 30-38. DOI:10.1016/j.ifset.2006.05.002.
[20] WU Q, CAI Q F, TAO Z P, et al. Purification and characterization of a noval angiotensin Ⅰ-concerting enzyme inhibitory peptide dedived from abalone (Haliotis discus hannai Ino) gonads[J]. European Food Research and Technology, 2015, 240(1): 137-145. DOI:10.1007/ s00217-014-2315-8.
[21] 毋瑾超, 汪依凡, 方长富. 贻贝蛋白酶解降血压肽的降压活性及相对分子质量与氨基酸组成[J]. 水产学报, 2007, 31(2): 165-170. DOI:10.3321/j.issn:1000-0615.2007.02.006.
[22] 伍强, 蔡秋凤, 翁凌, 等. 利用鲍鱼性腺制备ACE抑制肽[J]. 中国食品学报, 2015, 15(10): 91-99. DOI:10.16429/j.1009-7848.2015.10.013.
[23] MIGUEL M, CONTRERAS M, RECIO I, et al. ACE-inhibitory and antihypertensive properties of a bovine casein hydrolysate[J]. Food Chemistry, 2009, 112: 211-214. DOI:10.1016/j.foodchem.2008.05.041.
[24] 姜瞻梅, 田波, 吴刚, 等. 酶解牛乳酪蛋白制备ACE抑制肽的研究[J]. 中国食品学报, 2007, 7(6): 39-43. DOI:10.3969/ j.issn.1009-7848.2007.06.007.
[25] 胡松青, 张婷婷, 郭莎莎, 等. 鱼鳞明胶ACE抑制肽的制备及其活性研究[J]. 现代食品科技, 2012, 28(11): 1491-1494. DOI:10.13982/ j.mfst.1673-9078.2012.11.037.
[26] LEO F D, PANARESE S, GALLERANI R, et al. Angiotensin converting enzyme (ACE) inhibitory peptides: production and implementation of functional food[J]. Current Pharmaceutical Design, 2009, 15: 3622-3643. DOI:10.2174/138161209789271834.
[27] 安桂香, 庄桂东, 徐振凯, 等. 食物中血管紧张素转化酶抑制肽的研究进展[J]. 食品研究与开发, 2006, 27(6): 173-175. DOI:10.3969/ j.issn.1005-6521.2006.06.064.
[28] 贾俊强, 马海乐, 王振斌, 等. 降血压肽的构效关系研究[J]. 中国粮油学报, 2009, 24(5): 110-114.
[29] BYUN H G, KIM S K. Purification and characterization of angiotensinⅠ converting enzyme (ACE) inhibitory peptides from Alaska pollack (Theragra chalcogramma) skin[J]. Process Biochemistry, 2001, 36(12): 1155-1162. DOI:10.1016/S0032-9592(00)00297-1.
[30] SAITO Y, WANEZAKI K, KAWATO A, et al. Structure and activity of angiotensin Ⅰ converting enzyme inhibitory peptides from sake and sake lees[J]. Bioscience, Biotechnology, and Biochemistry, 1994, 58(10): 1767-1771. DOI:10.1271/bbb.58.1767.
Optimization of Preparation of Angiotensin-Ⅰ Converting Enzyme (ACE) Inhibitory Peptides Derived from Pacific Oyster (Crassostrea gigas)
QIU Juan1, SHEN Jiandong1, WENG Ling1,2, ZHANG Lingjing1,2, LIU Guangming1,2, CAO Minjie1,2,*
(1. College of Food and Biological Engineering, Jimei University, Xiamen 361021, China; 2. National & Local Joint Engineering Research Center of Deep Processing Technology for Aquatic Products, Xiamen 361021, China)
The stepwise enzymatic hydrolysis of Pacific oyster (Crassostrea gigas) for preparing angiotensin-Ⅰ converting enzyme (ACE) inhibitory peptides was optimized by orthogonal array design and response surface methodology (RSM). Pacific oyster was sequentially hydrolyzed by protamex followed by alcalase. Sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) and ACE inhibitory activity analysis were used to determine the optimal hydrolysis conditions. The results showed that the optimal conditions for the first hydrolysis step were determined as follows: solid to liquid ratio, 1:4 (g/mL); pH, 7.0; protamex dosage, 1.2%; hydrolysis duration, 1 h, and those for the second hydrolysis step were temperature were 53 ℃; pH, 8.3; alcalase dosage, 0.42%, and hydrolysis duration, 73 min. Gel filtration chromatography analysis showed that the molecular masses of almost all (99.72%) the peptides produced were lower than 3 000 D. Meanwhile, the oyster peptides revealed high ACE inhibitory activity, with IC50of 0.8 mg/mL. Amino acid composition analysis indicated that glutamic acid was the most abundant amino acid while cysteine was the least abundant one in the peptide products. Among the total amino acids, essential amino acids accounted for 36.6% while hydrophobic amino acids accounted for 37.2%. Our present work can provide a theoretical reference for the development of antihypertensive peptides derived from oyster.
oyster; hydrolysis; ACE inhibitory peptide; molecular mass distribution; amino acid composition
10.7506/spkx1002-6630-201716026
TQ464.7
A
1002-6630(2017)16-0165-08
邱娟, 沈建东, 翁凌, 等. 利用牡蛎制备ACE抑制肽的工艺优化[J]. 食品科学, 2017, 38(16): 165-172. DOI:10.7506/ spkx1002-6630-201716026. http://www.spkx.net.cn
QIU Juan, SHEN Jiandong, WENG Ling, et al. Optimization of preparation of angiotensin-Ⅰ converting enzyme (ACE) inhibitory peptides derived from Pacific oyster (Crassostrea gigas)[J]. Food Science, 2017, 38(16): 165-172. (in Chinese with English abstract)
10.7506/spkx1002-6630-201716026. http://www.spkx.net.cn
2016-07-24
国家自然科学基金面上项目(31471640);厦门南方海洋研究中心项目(14CZP030HJ04)
邱娟(1991—),女,硕士研究生,研究方向为水产品加工。E-mail:18850570649@163.com *通信作者:曹敏杰(1964—),男,教授,博士,研究方向为食品生物技术。E-mail:mjcao@jmu.edu.cn
