基于癸硫醇修饰的银纳米点阵列的苯并(a)芘检测
2017-09-03孙大文蒲洪彬韦庆益
肖 旺,孙大文,蒲洪彬,韦庆益*
基于癸硫醇修饰的银纳米点阵列的苯并(a)芘检测
肖 旺,孙大文,蒲洪彬,韦庆益*
(华南理工大学食品科学与工程学院,现代食品工程研究中心,广东省冷链食品智能感知与过程控制工程技术研究中心,广东 广州 510640)
利用阳极氧化铝模板法制备大面积高度有序的可调控的银纳米点阵列,并在其表面组装一层癸硫醇单分子层用于水中苯并(a)芘(benzo(a)pyrene,BaP)的快速检测。首先,通过扫描电镜、紫外-可见透过光谱、罗丹明6G探针分子对不同扩孔时间制备的银纳米点阵列进行表征,结果表明扩孔时间为80 min制备的基底拉曼增强效果最好,增强因子可达1.6×106。然后,在此基底表面修饰一层癸硫醇分子,利用癸硫醇与BaP之间的疏水相互作用可以实现BaP的预富集,进而实现BaP的高灵敏度、稳定的检测。研究表明:利用此基底检测BaP的检测限可达1.0 ng/mL,特征峰处的相对标准偏差为9.7%,满足高稳定性表面增强拉曼光谱基底的标准。该方法在BaP快速检测方面具有极大的潜力。
表面增强拉曼光谱;苯并(a)芘;银纳米点阵列;阳极氧化铝
苯并(a)芘(benzo(a)pyrene,BaP)是由一个芘分子与一个苯环稠合而成的一种多环芳烃类化合物[1],会暴露在空气、土壤及水等环境中,具有高度致癌性[2]。目前常用于检测BaP的方法包括荧光光谱法[3-4]、液相色谱结合荧光法[5-6]、气相色谱-质谱法[7-9]等。这些方法大多需要昂贵的设备,检测步骤复杂、耗时、需要消耗大量的化学试剂。因此,建立一种快速、高通量、灵敏度高的检测BaP的方法具有重要意义。
表面增强拉曼光谱(surface enhanced Raman spectroscopy,SERS)是一种通过贵重金属纳米结构(金、银、铜)增强分子拉曼信号的振动光谱技术,它不需要标记,具有快速、无损、灵敏高的特点,常用于食品、环境、医学领域的生物或化学分析[10-11]。SERS的增强机理主要包括电磁增强和化学增强,其中电磁增强起主导作用。电磁增强主要是由于金属表面的局域表面等离子体共振(localized surface plasmon resonance,LSRP),通常靠近金属纳米结构边缘或者处于纳米结构间隙的区域会产生更强的LSRP,进而更容易形成SERS“热点”[12]。SERS的化学增强主要是指分析物与金属纳米颗粒之间形成化学键,或在其表面吸附聚集等[13]。
目前,已有相关研究利用SERS技术检测食用油或水中的BaP。由于BaP没有特殊官能团能够与金属纳米结构表面相互作用,很难直接利用金或银纳米结构基底对BaP进行检测,因此需要对基底进行修饰。例如,Du Jingjing等[14]利用硫醇修饰的Fe3O4@Ag磁性纳米粒子检测水中的BaP;Fu Shuyue等[15]利用植酸修饰的金纳米粒子溶胶检测食用油中的BaP。但是基于纳米粒子溶胶的方法大多稳定性较差,这是因为纳米粒子尺寸差异大,检测分子在纳米溶胶体系中分布不均匀,且容易发生聚集。通常利用模板法制备的固体纳米结构基底具有较好的稳定性,本研究利用阳极氧化铝(anodic aluminum oxide,AAO)模板法制备了高度有序的银纳米点阵列,并在纳米点阵列表面组装了一层癸硫醇,利用癸硫醇与BaP之间的范德华力可以实现BaP的预聚集,进而实现BaP的检测。本实验旨在建立一种基于癸硫醇修饰的银纳米点阵列快速、稳定检测BaP的方法,为环境中多环芳烃类污染物的检测提供一种重要的技术手段。
1 材料与方法
1.1 材料与试剂
单通多孔AAO模板(孔径50 nm,孔间距100 nm,孔深300 nm) 上海上木科有限公司;99.999%纯银颗粒 北京中金研新材料科技有限公司;石英片(30 mm×30 mm×1 mm) 江苏久通石英制品有限公司;聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA) 梯希爱(上海)化成工业发展有限公司;BaP、癸硫醇 上海阿拉丁生化科技股份有限公司;乙醇、丙酮、二氯甲烷、磷酸、盐酸、水合四氯化锡均为分析纯。
1.2 仪器与设备
LabRAM HR Evolution显微共聚焦拉曼光谱仪 法国Horiba公司;JC450-4C热蒸发镀膜设备 沈阳聚智真空设备有限公司;KW-4A台式匀胶机 中国科学院微电子研究所;Merlin扫描电子显微镜 德国蔡司公司;L5S紫外-可见分光光度计 上海仪电分析仪器有限公司;BSA224S电子天平 赛多利斯科学仪器(北京)有限公司;SB-25-12DT超声波清洗机 宁波新芝生物科技股份有限公司;JC101电热鼓风干燥箱 上海成顺仪器仪表有限公司;HH-2恒温水浴锅 常州澳华仪器有限公司。
1.3 方法
1.3.1 银纳米点阵列的制备
采用AAO模板法[16-18]制备银纳米点阵列,具体流程如图1所示。操作要点如下:
1)旋涂PMMA:在单通AAO模板正面旋涂2 mL含6% PMMA的二氯甲烷溶液,然后放置在加热板上150 ℃条件下加热30 min。PMMA层在后续的处理过程中可以起到保护作用。
2)去铝基:利用置换反应除去铝基。按无水SnCl4与去离子水体积比1∶4配制SnCl4溶液,将PMMA-AAO模板浸泡在加热到60 ℃的SnCl4溶液中,铝基与SnCl4溶液发生剧烈的置换反应,反应结束后,将PMMA-AAO捞起,依次用质量分数5%的HCl溶液、去离子水冲洗。
3)去阻挡层及扩孔:把PMMA-AAO浸泡在30 ℃条件下质量分数5%的磷酸溶液中,保持PMMA面朝上,分别反应50、65、80 min得到不同孔径的AAO模板。
4)去PMMA及与基片的结合:在培养皿中加入1/3量的丙酮,将清洗干净的石英片放在培养皿中,然后把经过扩孔的PMMA-AAO放在石英片上方,PMMA面朝上,轻轻摇晃培养皿30 s左右,利用镊子拖出PMMA层,使AAO与PMMA分离,浸泡60 min,更换丙酮再次浸泡60 min,最后利用丙酮轻轻冲洗AAO模板样品表面,放入真空干燥箱中烘干备用。
5)真空镀银:将承载不同孔径双通AAO模板的石英片置于真空镀膜机中,在真空度为6×10-5Pa、蒸发速率为0.3~0.4 nm/s的条件下蒸镀一层50 nm厚的银膜。
6)去AAO模板:蒸镀后利用静电胶带去除AAO模板及表层的银,得到附在石英片上的银纳米点阵列。
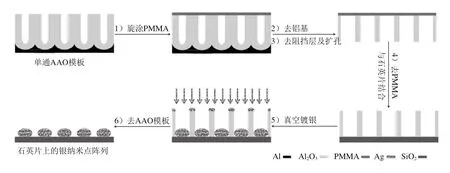
图1 AAO模板法制备银纳米点阵列的流程图Fig. 1 Schematic diagram of the fabrication of Ag nanodot arrays using AAO template method
1.3.2 拉曼探针分子罗丹明6G的SERS检测及增强因子的计算
选用罗丹明6G作为拉曼探针分子,利用制备的银纳米点阵列作为基底采集1.0×10-6mol/L罗丹明6G溶液的SERS。滴加5 µL的罗丹明6G溶液于基底上,自然晾干后采集单点的SERS,每个样品重复测定3 次。检测条件:633 nm激光器;积分时间10 s,累积次数2 次。另外,在相同的测试条件下检测1.0×10-3mol/L罗丹明6G溶液的普通拉曼光谱,利用Gupta等[19]报道的方法计算银纳米点阵列的增强因子:
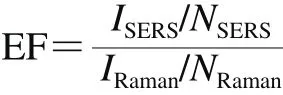
式中:EF为增强因子;IRaman和ISERS分别为探针分子的普通拉曼特征峰强度和SERS特征峰强度;NRaman和NSERS分别为对普通拉曼和SERS有贡献的探针分子数。
1.3.3 癸硫醇修饰
由于BaP无法吸附在银纳米点颗粒表面,很难直接利用银纳米基底检测BaP[20]。在银纳米点阵列表面修饰一层癸硫醇会改变基底的界面性质,另外利用癸硫醇与BaP之间的范德华力可以实现BaP的预聚集。
修饰方法:将制备好的银纳米点阵列用蒸馏水冲洗干净,在20 mL 1 mmol/L的癸硫醇乙醇溶液中浸泡24 h,然后用无水乙醇轻轻冲洗,烘干待用。
1.3.4 BaP检测
取BaP粉末10 mg溶于100 mL无水乙醇中,得到10-4g/mL的BaP乙醇溶液,然后利用去离子水稀释分别得到1×10-5、1×10-6、1×10-7、1×10-8、1× 10-9g/mL的BaP溶液,将修饰后的基底浸泡在BaP溶液中10 min,然后在1.3.2节相同条件下进行检测,每个样品重复测定3 次。另外,利用Mapping直线成像模式采集50 个点的1×10-5g/mL BaP溶液的拉曼光谱,范围100 µm,步长2 µm,研究此基底检测BaP的稳定性。
1.4 数据分析
利用Image J图像处理软件测定纳米点的粒径;利用LabSpec 6软件进行拉曼光谱的前处理:去噪、去背景、标峰位;运用Excel软件进行数据统计分析。
2 结果与分析
2.1 银纳米点阵列的表征
2.1.1 不同扩孔时间AAO模板和Ag纳米点阵列的扫描电子显微镜图像

图2 不同扩孔时间AAO模板和银纳米点阵列的扫描电子显微镜图Fig. 2 SEM images of AAO and Ag nanodot arrays with different expanding times
如图2所示,双通AAO模板和银纳米点阵列大面积高度有序,分布均匀,形状大小较为一致,孔径和粒径的标准差在3 nm以内;随着扩孔时间的延长,双通AAO模板的孔径逐渐增大(从60.4~79.3 nm),同时银纳米点阵列的粒径也相应增大(从59.6~78.4 nm),AAO模板的孔径和银纳米点阵的粒径基本保持一致。但是银纳米点阵的平均粒径比AAO模板的平均孔径略小(差值在1 nm以内),可能是模板有一定的深度,蒸镀过程中银无法完全填满AAO小孔的底部。由以上分析可知,可以通过控制扩孔时间来调控银纳米阵列中颗粒的粒径,进而对SERS活性基底进行优化。
2.1.2 紫外-可见透过光谱结果
由于石英片在可见光范围内是透明的,可以直接通过透过光谱对银纳米点阵列的局域表面等离子体共振进行表征。如图3所示,在400~700 nm范围内,银膜表现出较宽的吸收谱带,而银纳米点阵列则表现出明显的LSRP吸收带,主要集中在450 nm左右。随着纳米点阵列粒径的变大,LSRP吸收带发生一定程度的蓝移,且强度相应变大。发生蓝移的主要原因是:纳米点间距的减小会加快磁场的共振频率进而导致共振峰位向高频移动[21]。由以上分析可知,纳米点粒径越大,LSRP效应越强,依据电磁增强理论,其增强因子将会越大。

图3 不同粒径银纳米点阵列的透过光谱Fig. 3 UV-VIS transmission spectrum of Ag nanodot arrays with different pore diameters
2.1.3 探针分子的拉曼光谱

图4 探针分子罗丹明6G的拉曼光谱Fig. 4 Raman spectra of raman probe molecule (Rhodamine 6G)
为探究不同粒径银纳米点阵列的拉曼增强效果,先利用未修饰过的基底检测探针分子罗丹明6G的拉曼光谱。如图4所示,随着纳米点阵列粒径的增大,拉曼信号显著增强,且粒径为78.4 nm的银纳米点阵列的SERS信号最强,利用1.3.2节公式计算得到其增强因子为1.6×106。这是因为随着纳米点阵列粒径变大,纳米点之间的间距变小,LSRP效应增强,能够产生更多的“热点”,从而拉曼光谱强度增大[22],这与图3紫外-可见光谱表征的结果一致。依据SERS的电磁增强原理,纳米点颗粒之间的距离越近,增强因子会越大[23]。但是,当扩孔时间大于80 min之后,超薄的AAO模板已经没有稳定牢固的构架,给实验操作带来极大的难度。在后续实验中选择粒径为78.4 nm的银纳米点阵列进行修饰,然后检测BaP溶液。
2.2 BaP检测的定性分析
在检测BaP之前,首先在银纳米点阵列表面修饰一层癸硫醇单分子层。图5b为修饰后基底的SERS,明显为癸硫醇的拉曼光谱,其中709 cm-1对应反式C—S键的伸缩振动,890 cm-1对应CH3基团的弯曲振动,1 066 cm-1对应间扭式C—C键的伸缩振动,1 122 cm-1对应反式C—C键的伸缩振动[24]。利用修饰后的基底检测得到10 mg/L BaP样品的拉曼光谱,如图5a所示,与癸硫醇修饰的基底和BaP固体标准品的拉曼峰对比得知,除了包含癸硫醇的拉曼峰(704、875、1 070、1 122 cm-1)之外,还出现一些新的峰(1 232、1 340、1 379、1 578 cm-1等),而这些峰与BaP标准品的峰基本对应,说明修饰后的基底可以实现BaP的检测。在这些新出现拉曼峰中,1 379 cm-1对应芳香环上C—C键的伸缩振动,1 351 cm-1对应C—C—C链的反对称伸缩振动,1 232、1 578 cm-1均与芳香环上H的偏转有关[25-26]。另外,与癸硫醇光谱相比,样品的拉曼峰中C—S键的峰从709 cm-1处偏移到704 cm-1处,说明BaP分子进入了癸硫醇单分子层内部,一定程度上影响了癸硫醇的分子取向[27]。

图5 BaP样品、癸硫醇修饰的基底和BaP固体标准品拉曼光谱Fig. 5 Raman spectra of 10 mg/L BaP, decanethiol-modified substrate, and solid BaP standard
2.3 BaP检测的定量分析
利用修饰后的基底检测了不同质量浓度BaP样品的SERS,对其进行定量分析。图6为去基线后质量浓度1×10-9~1×10-5g/mL BaP样品的拉曼光谱,随着质量浓度的升高,BaP的拉曼特征峰(1 232、1 340、1 379、1 493 cm-1)的强度逐渐增强,说明强度和质量浓度的相关性较好。另外,随着BaP在质量浓度的增大,癸硫醇的特征峰(704、1 122 cm-1)强度有一定的减弱,可能是因为高质量浓度时,较多的BaP分子进入癸硫醇单分子层影响了癸硫醇分子的振动。

图6 不同质量浓度BaP样品的拉曼光谱Fig. 6 Raman spectra of BaP sample at different concentrations
利用1 379 cm-1处的峰强进行定量分析得到如图7所示的拉曼强度-质量浓度曲线,1 379 cm-1处的强度与BaP质量浓度的对数呈现良好的线性关系。线性拟合得到方程y=233.42x+2 1147.9,其中相关系数R2为0.981 7。对BaP溶液的检测限为1×10-9g/mL,虽然未达到GB 5749—2006《生活饮用水卫生标准》中饮用水BaP含量的限量标准(1×10-11g/mL),但通过对基底的进一步优化,该方法仍具有极大的潜力。理论上,SERS基底的增强因子可达106~109,特殊情况下甚至可以达到“单分子水平”检测[28]。本实验中制备的基底增强因子仅为1.6×106,主要是因为扩孔时间大于80 min后,超薄的AAO模板已经没有稳定牢固的构架,操作难度大。为达到国标中的限量标准,在今后的研究中,可以进一步优化制备工艺,制备粒径更大的银纳米点阵列,从而获得更大的增强因子。另一方面,可以制备金银复合纳米点阵列,通常,金银复合纳米结构基底比单独的金或银基底增强因子更大[29]。

图7 BaP样品1 379 cm-1处的拉曼强度与质量浓度的关系图Fig. 7 Raman intensity at 1 379 cm-1 of BaP sample at different concentrations
2.4 稳定性分析
为了探究基底检测BaP的稳定性,利用直线Mapping模式收集了51 个点的拉曼光谱,成像结果如图8所示,图像整体色度较为分明,表明整体的稳定性较好。其中癸硫醇C—S键的特征峰位(705 cm-1)和BaP的定量峰位(1 379 cm-1)处明暗均一,成像效果较好。图9为51 个点1 379 cm-1处的拉曼强度值,计算得到相对标准偏差为9.7%,满足一个高稳定性SERS基底的标准[30]。

图8 质量浓度为mL的BaP样品的拉曼成像图Fig. 8 Raman mapping of 1 ×g/mL BaP solution g/

图9 BaP样品在1 379 cm-1处的拉曼强度Fig. 9 Raman intensity of BaP solution at 1 379 cm-1
本实验建立了一种基于癸硫醇修饰的银纳米点阵列SERS基底快速检测水中BaP的方法。首先,通过扩孔时间可以调控银纳米点阵列的粒径,研究表明粒径越大的银纳米点阵列拉曼增强效果越好。其次,通过在银纳米点阵列表面组装一层癸硫醇实现了水中BaP的高灵敏度、稳定性的检测。利用此基底检测BaP的检测限可达1.0 ng/mL,特征峰处的相对标准偏差为9.7%,满足一个高稳定性SERS基底的标准。该方法在BaP现场检测方面具有极大的潜力。
[1] 王瑞鑫, 冯亚净, 李秀缺, 等. 电化学免疫传感器法快速测定粮油食品中的苯并(a)芘[J]. 现代食品科技, 2016(9): 295-301. DOI:10.13982/j.mfst.1673-9078.2016.9.042.
[2] LUX G, LANGER A, PSCHENITZA M, et al. Detection of the carcinogenic water pollutant benzo[a]pyrene with an electroswitchable biosurface[J]. Analytical Chemistry, 2015, 87(8): 4538-4545. DOI:10.1021/acs.analchem.5b00648.
[3] LI N, LUO H D, JIA Y Z, et al. Rapid determination of benzo(a) pyrene in processed meat and fish samples by second-derivative constant-energy synchronous fluorescence spectrometry[J]. Food Additives & Contaminants Part A Chemistry Analysis Control Exposure & Risk Assessment, 2011, 28(2): 235-242. DOI:10.1080/19 440049.2010.535857.
[4] LI N, LI X Y, ZOU Z X, et al. A novel baseline-correction method for standard addition based derivative spectra and its application to quantitative analysis of benzo(a)pyrene in vegetable oil samples[J]. Analyst, 2011, 136(13): 2802-2810. DOI:10.1039/C0AN00751J.
[5] CHEN Y H, XIA E Q, XU X R, et al. Evaluation of benzo[a]pyrene in food from china by high-performance liquid chromatography-fluorescence detection[J]. International Journal of Environmental Research & Public Health, 2012, 9(11): 4159-4169. DOI:10.3390/ijerph9114159.
[6] YUSTY M A L, DAVIÑA J L C. Supercritical fluid extraction and high-performance liquid chromatography-fluorescence detection method for polycyclic aromatic hydrocarbons investigation in vegetable oil[J]. Food Control, 2005, 16(1): 59-64. DOI:10.1016/ j.foodcont.2003.11.008.
[7] FORSBERG N D, WILSON G R, ANDERSON K A. Addition to determination of parent and substituted polcyclic aromatic hydrocarbons in high-fat salmon using a modified QuEChERS extraction, dispersive SPE and GC-MS[J]. Journal of Agricultural & Food Chemistry, 2011, 59(15): 8108-8116. DOI:10.1021/jf201745a.
[8] SURMA M, SADOWSKA-ROCIEK A, CIEŚLIK E. The application of d-SPE in the QuEChERS method for the determination of PAHs in food of animal origin with GC-MS detection[J]. European Food Research and Technology, 2014, 238(6): 1029-1036. DOI:10.1007/ s00217-014-2181-4.
[9] WANG J H, GUO C. Ultrasonication extraction and gel permeation chromatography clean-up for the determination of polycyclic aromatic hydrocarbons in edible oil by an isotope dilution gas chromatographymass spectrometry[J]. Journal of Chromatography A, 2010, 1217(28): 4732-4737. DOI:10.1016/j.chroma.2010.05.008.
[10] KNEIPP J, KNEIPP H, KNEIPP K. SERS: a single-molecule and nanoscale tool for bioanalytics[J]. Chemical Society Reviews, 2008, 37(5): 1052. DOI:10.1039/B708459P.
[11] ZHENG J, HE L. Surface-enhanced raman spectroscopy for the chemical analysis of food[J]. Comprehensive Reviews in Food Science & Food Safety, 2014, 13(3): 317-328. DOI:10.1111/1541-4337.12062.
[12] ANDERSON D J, MOSKOVITS M. A SERS-active system based on silver nanoparticles tethered to a deposited silver film[J]. Journal of Physical Chemistry B, 2006, 110(28): 13722-13727. DOI:10.1021/ jp055243y.
[13] KADAM P D. Rectocutaneous fistula with transmigration of the suture: a rare delayed complication of vault fixation with the sacrospinous ligament[J]. International Urogynecology Journal, 2016, 27(3): 155-157. DOI:10.1007/s00192-016-2952-5.
[14] DU Jingjing, JING Chuanyong. Preparation of thiol modified Fe3O4@ Ag magnetic sers probe for PAHs detection and identification[J]. Journal of Physical Chemistry C, 2011, 115(36): 17829-17835. DOI:10.1021/jp203181c.
[15] FU Shuyue, GUO Xiaoyu, WANG Hui, et al. Functionalized Au nanoparticles for label-free Raman determination of ppb level benzopyrene in edible oil[J]. Sensors & Actuators B Chemical, 2015, 212: 200-206. DOI:10.1016/j.snb.2015.01.134.
[16] CHEN G, WANG Y, WANG H, et al. A highly sensitive microfluidics system for multiplexed surface-enhanced Raman scattering (SERS) detection based on Ag nanodot arrays[J]. RSC Advances, 2014, 4(97): 54434-54440. DOI:10.1039/C4RA09251A.
[17] FU Q, ZHAN Z, DOU J, et al. Highly reproducible and sensitive SERS substrates with Ag inter-nanoparticle gaps of 5 nm fabricated by ultrathin aluminum mask technique[J]. Acs Applied Materials & Interfaces, 2015, 7(24): 13322-13328. DOI:10.1021/acsami.5b01524.
[18] KONDO T, MASUDA H, NISHIO K. SERS in ordered array of geometrically controlled nanodots obtained using anodic porous alumina[J]. The Journal of Physical Chemistry, 2013, 117(6): 2531-2534. DOI:10.1021/jp306470r.
[19] GUPTA R, WEIMER W A. High enhancement factor gold films for surface enhanced Raman spectroscopy[J]. Chemical Physics Letters, 2003, 374(3/4): 302-306. DOI:10.1016/S0009-2614(03)00737-1.
[20] XU J, DU J, JING C, et al. Facile detection of polycyclic aromatic hydrocarbons by a surface-enhanced Raman scattering sensor based on the Au coffee ring effect[J]. Acs Applied Materials & Interfaces, 2014, 6(9): 6891-6897. DOI:10.1021/am500705a.
[21] HURST S J, KATHRYN P E, QIN L, et al. Multisegmented onedimensional nanorods prepared by hard-template synthetic methods[J]. Cheminform, 2006, 45(17): 2672-2692. DOI:10.1002/anie.200504025.
[22] MEI F, XIAO X, DAI Z, et al. Fabrication and optical properties of controlled Ag nanostructures for plasmonic applications[J]. Journal of Applied Physics, 2013, 114(8): 1078-1081. DOI:10.1063/1.4820270.
[23] ETCHEGOIN P G, LE R E. A perspective on single molecule SERS: current status and future challenges[J]. Physical Chemistry Chemical Physics, 2008, 10(40): 6079. DOI:10.1039/B809196J.
[24] BANTZ K C, HAYNES C L. Surface-enhanced Raman scattering detection and discrimination of polychlorinated biphenyls[J]. Vibrational Spectroscopy, 2009, 50(1): 29-35. DOI:10.1016/ j.vibspec.2008.07.006.
[25] ONCHOKE K K, HADAD C M, DUTTA P K. Structure and vibrational spectra of mononitrated benzo[a]pyrenes[J]. Journal of Physical Chemistry A, 2006, 110(1): 76-84. DOI:10.1021/jp054881d.
[26] 韩颖, 郭明, 魏艳玲, 等. 苯并[a]芘的拉曼光谱计算及分析[J].吉林化工学院学报, 2012(7): 9-12. DOI:10.16039/j.cnki.cn22-1249.2012.07.016.
[27] JONES C L, BANTZ K C, HAYNES C L. Partition layer-modified substrates for reversible surface-enhanced Raman scattering detection of polycyclic aromatic hydrocarbons[J]. Analytical and Bioanalytical Chemistry, 2009, 394(1): 303-311. DOI:10.1007/s00216-009-2701-4.
[28] LIU H W, ZHANG L, LANG X Y, et al. Single molecule detection from a large-scale SERS-active Au79Ag21substrate[J]. Scientific Reports, 2011, 1(10): 112. DOI:10.1038/srep00112.
[29] ZONG S F, WANG Z Y, YANG J, et al. A SERS and fluorescence dual mode cancer cell targeting probe based on silica coated Au@Ag core-shell nanorods[J]. Talanta, 2012, 97(16): 368-375. DOI:10.1016/ j.talanta.2012.04.047.
[30] SHARMA B, CARDINAL M F, KLEINMAN S L, et al. Highperformance SERS substrates: advances and challenges[J]. MRS Bulletin, 2013, 38(8): 615-624. DOI:10.1557/mrs.2013.161.
Rapid Detection of Benzo(a)pyrene Using Decanethiol-Functionalized Ag Nanodot Arrays
XIAO Wang, SUN Dawen, PU Hongbin, WEI Qingyi*
(School of Food Science and Engineering, Academy of Contemporary Food Engineering, Engineering and Technological Research Centre of Guangdong Province on Intelligent Sensing and Process Control of Cold Chain Foods, South China University of Technology, Guangzhou 510640, China)
A large-area, highly-ordered Ag nanodot array was prepared by anodic aluminum oxide (AAO) template method. A monolayer of decanethiol was then assembled on the surface of the nanodot array for the rapid detection of benzo(a)pyrene (BaP). The Ag nanodots array was characterized by scanning electron microscopy (SEM), UV-visible spectroscopy, and rhodamine 6G probe. The results showed that the best Raman enhancement effect of surface enhanced Raman spectroscopy (SERS)-active substrate was achieved by 80 min pore broadening, with an enhancement factor of up to 1.6 × 106. Then, a layer of decanethiol molecules was modified on the surface of the substrate. The pre-concentration of BaP could be achieved by the hydrophobic interaction between decanethiol and BaP. Sensitive and reproducible detection of BaP could be realized. The detection limit (LOD) of BaP was 1.0 ng/mL, and the relative standard deviation (RSD) of characteristic Raman peak was 9.7%, which met the standard for a highly repeatable SERS substrate. This method has a great potential in the rapid detection of BaP.
surface-enhanced Raman spectroscopy; benzo(a)pyrene; Ag nanodot arrays; anodic aluminum oxide
10.7506/spkx1002-6630-201716048
O657.37
A
1002-6630(2017)16-0298-06
肖旺, 孙大文, 蒲洪彬, 等. 基于癸硫醇修饰的银纳米点阵列的苯并(a)芘检测[J]. 食品科学, 2017, 38(16): 298-303. DOI:10.7506/spkx1002-6630-201716048. http://www.spkx.net.cn
XIAO Wang, SUN Dawen, PU Hongbin, et al. Rapid detection of benzo(a)pyrene using decanethiol-functionalized Ag nanodot arrays[J]. Food Science, 2017, 38(16): 298-303. (in Chinese with English abstract)
10.7506/spkx1002-6630-201716048. http://www.spkx.net.cn
2017-02-18
广州市协同创新重大专项(201604020007)
肖旺(1992—),男,硕士研究生,研究方向为食品快速无损检测。E-mail:xiaowangml@163.com
*通信作者:韦庆益(1977—),女,副教授,博士,研究方向为食品快速无损检测。E-mail:feweiqingyi@scut.edu.cn
