川芎嗪联合顺铂对肺腺癌小鼠的抑瘤效果及其作用机制
2017-09-03马方旭张秀珑张志华王布汤建华
马方旭,张秀珑,张志华,王布,汤建华
(1 河北北方学院,河北张家口075000;2 河北北方学院附属第一医院)
川芎嗪联合顺铂对肺腺癌小鼠的抑瘤效果及其作用机制
马方旭1,张秀珑2,张志华2,王布2,汤建华2
(1 河北北方学院,河北张家口075000;2 河北北方学院附属第一医院)
目的 探讨川芎嗪(TMP)联合顺铂(DDP)对肺腺癌小鼠的抑瘤效果及其作用机制。方法 将56只C57BL/6小鼠随机均分为生理盐水组、DDP组、TMP组、TMP联合DDP组。各组右腋皮下接种Lewis肺腺癌细胞,建立移植瘤模型。接种第7天,生理盐水组腹腔注射生理盐水0.2 mL,TMP组腹腔注射TMP 100 mg/kg,DDP组腹腔注射DDP 2 mg/kg,TMP联合DDP组腹腔注射TMP及DDP,剂量同上,每天1次,连续2周。末次注射24 h,各组均眼球取血,检测血清CXCL16、TNF-α;断颈处死,称取瘤质量,计算抑瘤率;取部分肿瘤组织,检测CXCL16、TNF-α蛋白相对表达量。结果 DDP组、TMP组、TMP联合DDP组抑瘤率分别为40.74%、21.69%、61.11%,TMP联合DDP组抑瘤率明显高于DDP组、TMP组(P均<0.05),而DDP组与TMP组比较P>0.05。DDP组、TMP组、TMP联合DDP组血清CXCL16水平及肿瘤组织CXCL16蛋白相对表达量均低于生理盐水组,以TMP联合DDP组最低(P均<0.05);血清TNF-α水平及肿瘤组织TNF-α蛋白相对表达量均高于生理盐水组,以TMP联合DDP组最高(P均<0.05);DDP组与TMP组血清CXCL16、TNF-α水平及肿瘤组织CXCL16、TNF-α蛋白相对表达量比较P均>0.05。结论 TMP、DDP对肺腺癌小鼠均有一定抑瘤作用,二者联合抑瘤效果更佳;其作用机制可能与上调TNF-α表达、下调CXCL16表达有关。
肺腺癌;川芎嗪;顺铂;趋化因子配体16;肿瘤坏死因子α
肺癌是全球范围内发病率最高的恶性肿瘤之一,其中约50%为肺腺癌。手术、放化疗及靶向治疗是目前治疗肺腺癌的主要方法,但总体治疗效果较差。川芎嗪(TMP)是临床常用活血化瘀药川芎的主要活性成分,属于酰胺类生物碱。TMP作为血管新生抑制剂,不但可直接抑制肿瘤生长,还可提高化疗药物免疫调节作用,间接发挥抗肿瘤作用[1]。顺铂(DDP)是临床常用的抗肿瘤药,具有抗肿瘤谱广、作用强,可与多种抗肿瘤药有协同作用且无交叉耐药等特点。故理论上TMP辅助治疗能提高DDP的化疗效果[2],但目前关于二者联合用于肺腺癌治疗的报道较少。CXCL16是近年新发现的一种趋化因子,具有促血管新生作用[3]。TNF-α是目前公认抗肿瘤作用最强的细胞因子。TMP联合DDP是否通过CXCL16、TNF-α发挥作用尚不清楚。2016年2~8月,我们观察了TMP联合DDP对肺腺癌小鼠的抑瘤效果,现分析结果并探讨其可能的作用机制。
1 材料与方法
1.1 材料 健康雄性C57BL/6小鼠56只,5~6周龄,体质量20~22 g,购自中国军事科学院实验动物中心,动物生产许可证号:SCXK2011- 0004。Lewis肺腺癌瘤株,由中国科学院上海生命科学院细胞库提供。HS-1300-U型超净工作台,上海博泰实验设备有限公司;倒置相差显微镜,日本Olympus公司;SpectraMax M3型多功能酶标仪,美国Molecular Devices公司。盐酸川芎嗪注射液,广东南国药业有限公司;注射用顺铂,齐鲁制药有限公司。DMEM高糖培养基,美国Gibco公司;FBS,浙江天杭生物科技股份有限公司;兔抗鼠CXCL16抗体,北京博奥森生物技术有限公司;兔抗鼠TNF-α抗体,武汉博士德生物工程有限公司;免疫组化试剂盒,北京庄盟国际生物基因科技有限公司;EDTA,美国Gibco公司;小鼠CXCL16 ELISA试剂盒,上海研晶生化试剂有限公司;小鼠TNF-α ELISA试剂盒,武汉博士德生物工程有限公司。
1.2 模型制备及分组处理 取Lewis肺腺癌细胞,接种于含15% FBS的DMEM培养基中,37 ℃、5% CO2细胞培养箱中培养48 h,用含EDTA的胰酶消化后传代培养。取对数生长期Lewis肺腺癌细胞,1 500 r/min离心5 min,用生理盐水制备密度为1×107个/mL的细胞悬液。取细胞悬液0.2 mL,接种于小鼠右腋皮下,制备Lewis肺腺癌模型。接种第2天,随机将小鼠分为生理盐水组、TMP组、DDP组、TMP联合DDP组,每组14只。接种第7天,所有小鼠可触及直径2~3 mm的肿瘤,表明模型制备成功。模型制备成功同日,生理盐水组腹腔注射生理盐水0.2 mL,TMP组腹腔注射TMP 100 mg/kg,DDP组腹腔注射DDP 2 mg/kg;TMP联合DDP组腹腔注射TMP 100 mg/kg+DDP 2 mg/kg。每天1次,连续2周。
1.3 相关指标观察
1.3.1 血清CXCL16、TNF-α水平 末次注射24 h,眼球取血,静置30 min,2 000 r/min离心15 min,收集上清液,-80 ℃冰箱保存。采用ELISA法检测血清CXCL16、TNF-α。所有操作严格按试剂盒说明进行。
1.3.2 抑瘤率 各组眼球取血后,断颈处死,分离腋下肿瘤组织,清理干净后称质量,计算抑瘤率。抑瘤率=(对照组肿瘤质量-观察组肿瘤质量)/对照组肿瘤质量×100%。
1.3.3 肿瘤组织CXCL16、TNF-α蛋白表达 采用免疫组化SP法。取各组肿瘤组织,4%多聚甲醛固定,脱水,石蜡包埋,4 μm厚切片。切片经脱蜡水化,97 ℃枸橼酸盐修复液修复,室温冷却10 min,5% BSA常温封闭15 min,分别滴加兔抗小鼠CXCL16一抗(1∶50)或TNF-α一抗(1∶100),以PBS代替一抗作为阴性对照,湿盒30 min,4 ℃冰箱过夜。次日37 ℃复温45 min,甩去多余液体,PBS冲洗。用滤纸将组织周围的液体吸干,加入羊抗兔二抗(1∶200),37 ℃恒温箱孵育30 min,PBS冲洗。DAB避光染色2 min,苏木素复染,氨水返蓝,常规脱水,透明,封片,显微镜下拍照观察。CXCL16或TNF-α蛋白阳性表达定位于胞质或胞膜,呈棕黄色颗粒状。采用Image-proplus6.0软件分析图像,统计积分光密度(IOD)值[4]。以IOD值代表目的蛋白相对表达量。
2 结果
2.1 各组血清CXCL16、TNF-α水平比较 见表1。
2.2 各组抑瘤率比较 生理盐水组、DDP组、TMP组、TMP联合DDP组肿瘤质量分别为(3.78±0.09)、(2.24±0.26)、(2.96±0.25)、(1.47±0.30)g,抑瘤率分别为0、40.74%、21.69%、61.11%。TMP联合DDP组抑瘤率明显高于DDP组、TMP组(P均<0.05),而DDP组与TMP组比较P>0.05。
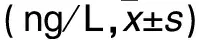
表1 各组血清CXCL16、TNF-α水平比较
注:与生理盐水组比较,*P<0.05;与DDP组比较,#P<0.05;与TMP组比较,△P<0.05。
2.3 各组肿瘤组织CXCL16、TNF-α蛋白表达比较 见表2。
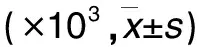
表2 各组肿瘤组织CXCL16、TNF-α蛋白相对表达量比较
注:与生理盐水组比较,*P<0.05;与DDP组比较,#P<0.05;与TMP组比较,△P<0.05。
3 讨论
肺腺癌细胞主要来源于支气管黏膜上皮,一般情况下肿瘤生长较缓慢,但早期即可发生血行转移。因早期无明显临床症状,多数患者就诊时已属中晚期。肺腺癌的治疗方法较多,但含铂类的化疗方案仍占有重要地位。近年来随着对中医药理研究的深入,发现中药辅助西药化疗不但能增加化疗药物敏感性,增强化疗效果,还能降低化疗药物引起的毒副作用,提高患者机体免疫力,延长患者生存期[5,6]。因此,探索高效低毒的增敏剂以增强化疗药物疗效,成为当前研究的热点。
TMP是中药川芎、当归的主要活性成分,其有效化学成分为四甲基吡嗪,具有抗炎、抗凋亡、舒张血管等多种生物学活性,在心脑血管病、消化系统疾病和呼吸系统疾病中应用较为广泛[7]。近年研究发现,TMP不仅能直接杀伤肿瘤细胞,还能间接抑制肿瘤血管生成,继而抑制肿瘤生长[8]。研究发现,TMP能够诱导肺癌细胞G1期阻滞和早期凋亡[9]; TMP能够引起U937细胞中凋亡抑制因子、凋亡促进因子及细胞周期调控蛋白的变化,启动凋亡程序,诱导细胞凋亡[10];TMP还可抑制人骨肉瘤MG-63细胞生长,其机制可能是通过促进MG-63细胞凋亡、诱导细胞G0/G1期阻滞、抑制NF-κB及其靶基因蛋白表达等[11];TMP能通过上调NK细胞等的生物学活性,调控Th2类细胞相关因子的表达,提高机体对肿瘤的免疫应答效果,从而增强机体对肿瘤细胞的免疫杀伤作用,间接发挥抗肿瘤作用[12];TMP还可增强化疗药物对肿瘤细胞的杀伤作用,降低化疗药物引起的毒副作用,改善肿瘤组织周围的微环境及肿瘤细胞的缺氧环境,增强肿瘤在放疗中的敏感性[13,14]。DDP是临床应用最广泛的抗肿瘤药,可与DNA结合形成DDP-DNA复合物,导致DNA复制障碍,从而抑制肿瘤细胞分裂,为非特异性细胞周期化疗药物。有研究表明,TMP联合DDP不仅能增强DDP的化疗效果,还能降低化疗药物引起的毒副作用[15,16]。本研究结果显示,TMP联合DDP组抑瘤率明显高于DDP组、TMP组,而DDP组与TMP组比较差异无统计学意义。说明TMP和DDP均具有抑瘤作用,二者联合应用效果更佳。
CXCL16是近年发现的一种趋化因子,属于CXC趋化因子家族。目前国内外对CXCL16的研究主要集中于心血管疾病、免疫性疾病及炎症性疾病等方面。除在先天性免疫和获得性免疫介导的机体防御中具有重要作用外,CXCL16还能介导细胞间黏附和血管生成[17]。CXCL16与其惟一的受体CXCR6结合,可激活NF-κB和AKT/mTOR等信号通路,促进肿瘤的侵袭和转移[18]。TNF-α是一种具有广泛生物学活性的多肽类细胞因子,是迄今为止抗肿瘤活性最强的细胞因子。TNF-α不仅能通过调控NF-κB信号通路干扰肿瘤血管系统、诱导肿瘤细胞凋亡和增强机体免疫力[19,20],还可诱导肿瘤血管的高渗透性,使肿瘤部位化疗药物浓度升高,提高抗肿瘤效果[21]。本研究结果显示,DDP组、TMP组、TMP联合DDP组血清CXCL16水平及肿瘤组织CXCL16蛋白表达均低于生理盐水组,以TMP联合DDP组最低;血清TNF-α水平及肿瘤组织TNF-α蛋白相对表达量均高于生理盐水组,以TMP联合DDP组最高;DDP组与TMP组血清CXCL16、TNF-α水平及肿瘤组织CXCL16、TNF-α蛋白相对表达量比较均无统计学差异。表明TMP和DDP均能通过抑制CXCL16表达,促进TNF-α表达,抑制肿瘤血管生成,继而抑制肿瘤生长,二者联合应用效果更佳。
综上所述,TMP、DDP对肺腺癌小鼠均有一定抑瘤作用,二者联合应用抑瘤效果更佳;其作用机制可能与上调TNF-α表达、下调CXCL16表达有关,但其具体作用机制尚需进一步研究。
[1] 吴婷婷,丁玉勇.川芎嗪生物活性的研究进展[J].食品研究与开发,2016,37(6):212-217.
[2] 张长洪,张志林,张志华,等.川芎嗪联合顺铂对Lewis肺腺癌小鼠抑制生长的作用[J].中国临床药理学杂志2015,31(11):942-945.
[3] 诸葛欣,孟艳玲,孙宁,等.CXCL16对小鼠Matrigel种植体内促血管新生的作用[J].细胞与分子免疫学杂志,2010,26(11):1095-1096.
[4] 王布,张志林,张志华,等.川芎嗪联合顺铂抗肿瘤血管生成的作用机制研究[J].中国临床药理学杂志,2015,31(11):946-949.
[5] Ling CQ, Yue XQ, Ling C. Three advantages of using traditional Chinese medicine to prevent and treat tumor[J]. J Integr Med, 2014,12(4):331-335.
[6] Qi F, Zhao L, Zhou A, et al. The advantages of using traditional Chinese medicine as an adjunctive therapy in the whole course of cancer treatment instead of only terminal stage of cancer[J]. Biosci Trends, 2015,9(1):16-34.
[7] 吕秀莲.磷酸川芎嗪临床应用概述[J].黑龙江医药,2013,26(1):112-113.
[8] 孙惜时,吴婷婷,冉昇,等.川芎嗪抑制肿瘤血管生成研究进展[J].食品与药品,2013,15(3):223-226.
[9] 牛媛,王成,张晓燕,等.川芎嗪对人肺腺癌A549细胞增殖、迁移和侵袭的作用与机制[J].现代肿瘤医学,2016,24(10):1509-1512.
[10] 王小静,杨桂存,陈红霞,等.川芎嗪对白血病U937细胞增殖和凋亡的作用及其机制研究[J].中国中药杂志,2015,40(11):2186-2190.
[11] 王勇,赵伟.川芎嗪对人骨肉瘤MG-63细胞生长的抑制作用观察及机制探讨[J].山东医药,2013,53(31):4-6.
[12] 杨栋,张培彤.川芎嗪抗肿瘤研究进展[J].辽宁中医杂志,2015,42(11):2245-2248.
[13] 孙岚,刘文励,孙汉英,等.川芎嗪促进放射损伤小鼠骨髓微环境修复VEGF/flk-1途径作用的研究[J].中国中西医结合急救杂志,2005,12(4):195-198.
[14] 唐慎华,贾秀红,李娜,等.川芎嗪联合阿糖胞苷对人白血病U937细胞的增殖、凋亡影响及相关机制的研究[J].滨州医学院学报,2016,39(1):5-8.
[15] 孙宪昌,孙丽霞,史献君,等.川芎嗪拮抗顺铂所致豚鼠耳毒性的作用[J].中国中西医结合杂志,2014,34(8):982-986.
[16] 黄波,郎贤平,王晓东.川芎嗪、顺铂对人小细胞肺癌NCI-H446细胞凋亡的影响及机制探讨[J].山东医药,2011,51(18):5-6.
[17] 孙宁,诸葛欣,王丽莉,等.老年急性冠脉综合征患者CXCL16与血管新生的关系[J].河北医药,2012,34(10):1451-1452.
[18] Wang YH, Dong YY, Wang WM, et al. Vascular endothelial cells facilitated HCC invasion and metastasis through the Akt and NF-κB pathways induced by paracrine cytokines[J]. J Exp Clin Cancer Res, 2013,32(1):1-11.
[19] 向春艳,何小燕,李逐波,等.TNF-α在癌症中的作用研究进展[J].生命科学,2012,24(3):250-254.
[20] 齐宏,毛伟征,马贵亮.TNF-α联合奥沙利铂对胃癌细胞SGC-7901抑制作用的研究[J].中国现代普通外科进展,2013,16(5):337-341.
[21] 曹珊珊,王鹏,李萌.TNF-α联合阿霉素对人胃癌细胞株SGC-7901的作用及其机制研究[J].胃肠病学,2012,17(10):609-613.
河北省医学科学研究重点课题资助计划项目(20170185)。
张秀珑(E-mail: zzh19641229@163.com)
10.3969/j.issn.1002- 266X.2017.28.011
R734.2
A
1002- 266X(2017)28- 0040- 03
2016- 09-27)
