再生障碍性贫血模型建立及鉴定
2017-09-03苏攀柯
苏攀柯
(河南科技大学第一附属医院 河南 洛阳 471003)
再生障碍性贫血模型建立及鉴定
苏攀柯
(河南科技大学第一附属医院 河南 洛阳 471003)
目的建立及鉴定再生障碍性贫血模型。方法再生障碍性贫血动物模型的建立:雌性SD大鼠,体质量200~250 g,清洁级,共20只。随机分为对照组和模型组,每组10只。模型组腹腔注射5-氟尿嘧啶150 mg/kg后的第5天,采用白消安(马利兰片)蒸馏水悬液15 mg/kg灌胃,每周1次,连续3周。分别采用生化仪检测对照组和模型组血液中红细胞、白细胞、血红蛋白含量及红细胞压积;取死亡动物和定期处死动物的股骨制作骨髓涂片,采用联合用药的方案,建立大鼠造血干细胞衰竭型再生障碍性贫血(再障)模型。结果再障动物模型建立成功,模型组骨髓涂片示脂肪化明显,骨髓增生程度降低,血常规结果提示造血细胞减少,非造血细胞增多,各项血常规指标下降明显,符合再障的实验室诊断特点。结论本实验成功建立了SD大鼠再障模型,为干细胞治疗再障的实验研究及药物筛选、药物作用机制的研究,提供了一个比较理想的动物病理模型基础。
再生障碍性贫血;动物模型;5-氟尿嘧啶;白消安;骨髓象
再生障碍性贫血(aplastic anemia,AA)指由接触药物、毒物、病毒或未明原因引起全血细胞减少的同时,伴以骨髓增生减退为特征的贫血。该病的发生与骨髓造血干细胞损伤、造血微环境缺陷、免疫性造血抑制及遗传倾向等多种因素有关[1-2]。亚洲国家AA发病率为(3.9~5.0)/106,明显高于欧美国家的(2.0~2.7)/106[3]。其主要临床表现为贫血、感染和出血。根据临床表现、血象和骨髓象,可将AA分为慢性AA(CAA)和急性AA(AAA),后者亦称为重型AA(SAA)Ⅰ型。如果CAA病情恶化, 则称为SAA-Ⅱ型。虽然美国血液学年会明确提出AA 是自身免疫性疾病,免疫异常表现为T 淋巴细胞功能亢进,但其发病机制仍不清楚[4]。为探究AA 发病机制及筛选有效防治药物,建立合适的AA 动物模型尤为重要。AA约半数是由接触药物或化学因素引起,如化疗药物、工业污染、重金属中毒等[5]。现采用5-氟尿嘧啶联合白消安的方法建立AA小鼠模型,具体如下。
1 材料与方法
1.1实验动物与饲养清洁级雌性成年SD种系大鼠20只,体质量200~250 g,购于郑州大学实验动物中心,动物合格证号:医动字第410116号,饲养条件为人工控温22~26 ℃,14L:10D光照,自由饮水进食,适应饲养环境一周。
1.2主要实验试剂和仪器5-氟尿嘧啶:50 mg/L,天津金耀氨基酸有限公司;白消安: 2 mg/片,GlaxoSmithKline;显微镜:XSJ-D型,日本OLYMPUS光学仪器公司;数码照相机:DPl2型,日本OLYMPUS光学仪器有限公司;电子天平:BS210S型,北京赛多力精密仪器有限公司;微量加样枪(200 、100、20 μl),上海医用激光仪器厂;全自动生化仪:2700型,日本OLYMPUS光学仪器有限公司。
1.3再生障碍性贫血模型的建立20只雌性SD大鼠随机分为对照组(10只)和AA模型组(10只)。AA模型组腹腔注射5-氟尿嘧啶(150 mg/kg),第5天采用白消安蒸馏水悬液灌胃(15 mg/kg),每周1次;对照组同AA模型组,但采用生理盐水替换白消安蒸馏水悬液灌胃。
1.4实验室检查包括血象检查和骨髓象检查,具体如下。
1.4.1血象检查 停药后第7天取材,腹腔注射2%戊巴比妥(30 mg/kg)将动物麻醉,固定动物使其呈仰卧位,打开腹腔。开腹时,尽可能减少出血,将肠管推向一侧,然后用手指轻轻分开脊柱前的脂肪,暴露出腹主动脉,用注射器(5 ml)在腹主动脉分叉处,与血管平行刺入,回抽采血。将采集的2 ml血液立即打入抗凝管中,反复轻摇,使血液与抗凝剂充分结合,送至河南科技大学第一附属医院检验科检测。
1.4.2骨髓象检查 腹主动脉采血结束后,用手术剪刀剪掉大腿部的肌肉,充分暴露股骨,用大剪刀剪断股骨,中号镊子挤出骨髓,如果骨髓不易取出,可用直头眼科镊插入骨髓腔挑出骨髓,置骨髓于清洁的载玻片一端,以一边缘整齐的玻片30 ℃推片,制备骨髓涂片。瑞氏染色后置于镜下观察,当细胞核变蓝终止,缓冲液冲洗,去除多余染液。

2 结果
2.1一般临床症状模型组大鼠于实验3周左右逐渐出现毛发蓬松,食量及饮水量减少,反应迟钝,活动迟缓,卷曲少动,体质量下降;实验第4周开始出现死亡。濒死前所有大鼠均有不同程度的皮肤瘀点,主要出现在耳廓、趾尖、尾巴,对照组大鼠无明显变化。
2.2血象检查与对照组大鼠血常规检查结果相比较,模型组大鼠全血细胞减少,白细胞中以中性粒细胞减少最明显,红细胞数量、白细胞数量和血红蛋白含量均下降,差异有统计学意义(P<0.05)。见表1。
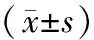
表1 两组动物血常规指标比较
注:与对照组比较,aP<0.05。
2.3骨髓象检查与对照组骨髓涂片结果相比,AA模型组骨髓涂片中骨髓脂肪化明显,细胞数量下降,非造血细胞增多,骨髓有核细胞增生极度低下,细胞数量稀少,造血细胞罕见,骨髓涂片油滴明显增多,即镜下空泡数量明显增多,并出现许多大或特大空泡。
3 讨论
目前,AA 发病机制尚不明确,可能与骨髓造血干细胞异常、端粒酶的改变以及造血微环境异常有关,而淋巴因子或效应T细胞杀伤造血干细胞或祖细胞被认为是AA主要发病机制[6-8]。AA的病理模型有着不可替代的优点:发病原因明确;发病机制相对一致;发病时间较集中;研究对象的数量可以根据实验需要控制;标本易于收集;可详细观察整个患病的过程;进行前瞻性研究;进行一系列临床中不能进行的实验,如新药的临床试验前研究,同型及不同型的各种干细胞移植等[9]。
本实验采用中国协和医科大学血液学研究所赵钧铭等[10]《5-氟尿嘧啶与白消安合用诱导建立大鼠急性再生障碍性贫血模型》的造模方法,5-尿嘧啶主要杀伤处于增殖周期内的细胞,非增殖周期内的造血干细胞则活存下来,5-氟尿嘧啶在骨髓中的浓度约2倍于血浆,因此,5-氟尿嘧啶已广泛地用来富集造血干细胞。根据赵钧铭等的观察,大鼠注射5-氟尿嘧啶后第7天增殖速率明显减低,5-氟尿嘧啶与白消安联合诱导方案,可更彻底地杀伤造血干细胞,起到“聚而杀之”的作用。本实验于停药后第2周处死模型组动物,血液检查示各项指标明显降低,与文献相符。骨髓检查示骨髓脂肪化明显,细胞数量显著下降,非造血细胞增多。本研究采用5-氟尿嘧啶和白消安联合用药方案,成功地建立了大鼠造血干细胞衰竭型AA模型。为干细胞治疗再障的实验研究及药物筛选、药物作用机制的研究,提供了一个比较理想的动物病理模型基础。
[1] Bacigalupo A,Valle M,Podesta M,et al.T-cell suppression mediated by mesenchymal stem cells is deficient in patients with severe aplastic anemia[J].Exp Hematol,2005,33(7):819-827.
[2] Risitano A M,Kook H,Zeng W,et al.Oligoclonal and polyclonal CD4 and CD8 lymphocytes in aplastic anemia and paroxysmal nocturnal hemoglobinuria measured by V beta CDR3 spectratyping and flow cytometry[J].Blood,2002,100(1):178-183.
[3] Fan R,Wang W,Wang X Q,et al.Incidence of adult acquired severe aplastic anemia was not increased in Shanghai, China[J].Ann Hematol,2011,90(10):1239-1240.
[4] Bacigalupo A,Piaggio G,Van Lint M T,et al.Aplastic anemia: pathogenesis and treatment[J].Onkologie,1987,10(3):172-173.
[5] Nara N.Aplastic anemia associated with drug[J].Nihon Rinsho,2012,70 Suppl 6:438-442.
[6] Young N S,Calado R T,Scheinberg P.Current concepts in the pathophysiology and treatment of aplastic anemia[J].Blood,2006,108(8):2509-2519.
[7] 邵宗鸿.原发性骨髓衰竭性贫血[J].中国实用内科杂志,2009,29(7):585-588.
[8] 高丽娜,刘宝山.B7-CD28/CTLA4共刺激途径在再生障碍性贫血免疫机制中的作用[J].天津医药,2010,38(6):536-538.
[9] 王军,张广民,俞发舟,等.联合应用苯与白消安建立大鼠急性再生障碍性贫血模型[J].安徽医科大学学报,2006,41(4):436-438.
[10]赵均铭,褚建新,丁顺利,等.5-氟尿嘧啶与白消安合用诱导建立大鼠再生障碍性贫血模型[J].中华血液学杂志,2011,22(4):202-204.
Establishmentandidentificationofaplasticanemiamodel
Su Panke
(TheFirstAffiliatedHospitalofHenanUniversityofScienceandTechnology,Luoyang471003,China)
ObjectiveTo establish and identify aplastic anemia model.MethodsTwenty female SD rats were randomly divided into control group and model group to establish the animal model of aplastic anemia. At the fifth day after intraperitoneal injection of 5-fluorouracil in the model group, rats in the model group were given gastric reperfusion with suspension of busulfan once a week for three weeks.The contents of erythrocyte, leukocyte, hemoglobin and hematokrit were determined in two groups. Bone marrow smears were produced by thigh-bone from dead rats or rats executed at regular intervals.ResultsAplastic anemia animal model is established successfully. The model group had more fat and less bone marrow hyperplasia in bone marrow smear, and fewer hematopoietic cells, more non hematopoietic cells in blood routine results, consistent with the laboratory diagnosis of aplastic anemia.ConclusionThis study had successfully established aplastic anemia model in the SD rats, providing an ideal animal model for stem-cell treatment, aplastic anemia experiments, drug screening and function mechanism studies.
aplastic anemia; animal model; 5-fluorouracil; busulfan; bone marrow
R 446.1doi:10.3969/j.issn.1004-437X.2017.15.003
2016-12-28)
