左归丸对化疗性卵巢早衰小鼠卵巢组织中缝隙连接蛋白43表达的影响Δ
2017-09-03孙晓峰阳松威贺又舜龚力民湖南中医药大学中医学院长沙4008湖南中医药大学药学院长沙4008中南大学湘雅三医院骨科长沙4003
孙晓峰,阳松威,贺又舜,陈 聪,龚力民,罗 令(.湖南中医药大学中医学院,长沙 4008;.湖南中医药大学药学院,长沙 4008;3.中南大学湘雅三医院骨科,长沙 4003)
左归丸对化疗性卵巢早衰小鼠卵巢组织中缝隙连接蛋白43表达的影响Δ
孙晓峰1*,阳松威2,贺又舜1,陈 聪1,龚力民2,罗 令3#(1.湖南中医药大学中医学院,长沙 410208;2.湖南中医药大学药学院,长沙 410208;3.中南大学湘雅三医院骨科,长沙 410013)
目的:研究左归丸对环磷酰胺(CTX)致卵巢早衰(POF)小鼠卵巢组织中缝隙连接蛋白43(Cx43)表达的影响,探讨左归丸治疗化疗性POF的作用机制。方法:将72只小鼠按体质量随机分为空白组、模型组、戊酸雌二醇片组(阳性对照,0.000 13 g/kg)和左归丸低、中、高剂量组(13.65、40.95、122.85 g/kg),每组10只。除空白组外,其余各组小鼠均ip CTX复制POF模型,每天1次,连续20 d;并同时ig相应药物,每天1次,连续30 d。末次给药2 h后,分别采用反转录-聚合酶链反应法和Western blot法检测卵巢组织中Cx43 mRNA和蛋白表达;并采用免疫组化法检测卵巢组织中Cx43蛋白的分布。结果:与空白组比较,模型组大鼠卵巢组织中Cx43 mRNA及蛋白表达均明显减弱,卵泡与颗粒细胞中Cx43蛋白的分布明显减少(P<0.01);与模型组比较,戊酸雌二醇片组和左归丸中、高剂量组小鼠卵巢组织中Cx43 mRNA及蛋白表达均明显增强,卵泡与颗粒细胞中Cx43蛋白的分布明显增加(P<0.01)。结论:左归丸可上调CTX致POF小鼠卵巢组织中Cx43 mRNA及蛋白表达,增加Cx43在卵泡及颗粒细胞间的分布,改善缝隙连接功能,这可能是其治疗POF的作用机制之一。
左归丸;卵巢早衰;卵巢;缝隙连接蛋白43;小鼠
卵巢早衰(Premature ovarian failure,POF)是指女性在40岁之前出现的以卵巢功能衰退为主的妇科内分泌性疾病,其可引发心脑血管及神经系统病变,严重危害青年妇女的身心健康[1-3]。POF病因复杂,研究发现POF的发生与遗传、染色体异常、自身免疫、医源性损伤及颗粒细胞凋亡等因素有关[3-4]。其中,医源性因素主要指化疗因素,而环磷酰胺(CTX)是常用的化疗药,但其在治疗恶性肿瘤的同时还会对卵巢造成损伤,会加速卵泡闭锁,使卵巢组织纤维化,从而诱导POF的发生[5-6]。中医学认为:“肾藏精,主生殖”。早在《素问·上古天真论》中就明确指出了肾中精气的盛衰决定着机体的生、长、壮、老、已。中医在防治生殖功能衰退方面已有几千年的经验总结,现代研究显示补肾填精中药具有增强生殖机能、抗衰老的作用,补肾填精法代表方剂左归丸在临床上就常用于卵巢早衰、围绝经期综合征、老年骨质疏松症等的治疗[7]。
间隙连接细胞间通讯(Gap junction intercellular communication,GJIC)又称缝隙连接(Gap junction,GJ),是组织细胞间通过连接蛋白(Connexin,Cx)介导从而调节细胞新陈代谢、增殖分化以及机体内环境稳态的重要方式[8-9]。研究发现,GJ广泛存在于卵泡各种细胞间,在颗粒细胞、卵母细胞及膜细胞中均发现Cx的表达,其中Cx37与Cx43是与卵泡及颗粒细胞生理功能关系密切的两种Cx。前期研究已证实,左归丸可调节CTX致POF模型小鼠卵巢组织中Cx37 mRNA及蛋白表达[10-11]。在本实验中,笔者将通过反转录-聚合酶链反应(RT-PCR)法、Western blot法及免疫组化法等技术研究左归丸对CTX致POF模型小鼠卵巢组织中Cx43 mRNA及蛋白表达的影响,探讨左归丸治疗化疗损伤性POF的作用机制,为补肾填精法的应用提供实验依据。
1 材料
1.1 仪器
Piko Real 96荧光定量PCR仪(美国Thermo公司);Motic B5显微摄像图像分析系统(麦克奥迪实业集团公司);164-5050电泳仪(美国Bio-Rad公司);Olympus BX43双目生物摄像显微镜(日本奥林巴斯公司);TGL-16台式冷冻离心机(湖南湘仪实验室仪器开发有限公司)。
1.2 药品与试剂
左归丸(由湖南中医药大学附属第一医院提供,批号:151012,规格:每1 g浸膏含左归丸生药1 g);戊酸雌二醇片(德国拜耳医药保健有限公司,批号:113A,规格:1 mg/片);注射用CTX(通化茂祥制药有限公司,批号:131201,规格:0.2 g/瓶);兔抗Cx43抗体(北京博奥森公司);羊抗兔免疫球蛋白G(IgG)/辣根过氧化酶(HRP)抗体(美国Santa Cruz公司);二喹啉甲酸(BCA)蛋白定量试剂盒(北京碧云天生物研究所,批号:P0010S);Trizol试剂(美国Invitrogen公司,批号:15596-026);第一链cDNA合成试剂盒(立陶宛Fermentas公司,批号:K1631);免疫组化检测试剂盒(北京金杉中桥公司,批号:K126816B)。
1.3 动物
KM小鼠72只,SPF级,♀,体质量(18±2)g,由湖南斯莱克景达实验动物有限公司提供,动物许可证号:SCK(湘)2011-0003。
2 方法
2.1 造模、分组与给药
将72只小鼠按体质量随机分为空白组、模型组、戊酸雌二醇片组(阳性对照,0.000 13 g/kg,根据人临床用量的等效剂量换算而得,蒸馏水溶解)和左归丸低、中、高剂量组(13.65、40.95、122.85 g/kg,根据临床用量的1、3、9倍换算而得),每组12只。空白组小鼠ip等体积生理盐水,其余各组小鼠ip CTX 30 mg/kg复制POF模型,注射体积均为20 mL/kg(生理盐水溶解),每天1次,连续20 d。造模同时,各给药组小鼠ig相应药物,空白组和模型组小鼠ig等体积蒸馏水,20 mL/kg,每天1次,连续30 d。
2.2RT-PCR法检测小鼠卵巢组织中Cx43 mRNA表达
末次给药2 h后脱颈处死小鼠,剖开腹腔,摘取位于子宫末端的卵巢组织,剔除周围附着的脂肪与结缔组织。Trizol试剂提取卵巢组织总RNA,检测RNA纯度及浓度后,琼脂糖电泳法检测RNA完整性。然后参照试剂盒操作说明,将1 μg总RNA反转录合成cDNA后进行扩增。Cx43上游引物序列:5′-TGGTGTCCTTGGTGTCTCTC-3′,下游引物序列:5′-CAGGAGGAGACATAGGCGAG-3′,扩增片段大小:210 bp;甘油醛-3-磷酸脱氢酶(GAPDH)上游引物序列:5′-CTCATGACCACAGTCCATGC-3′,下游引物序列:5′-TTCAGCTCTGGGATGACCTT-3′,扩增片段大小:155 bp。反应条件:94℃、3 min,94℃、30 s,59℃、30 s,72℃、45 s,共40个循环。参照文献[12]方法分析实验数据,以2-ΔΔct法(ct表示基本循环值)测定Cx43 mRNA基因相对表达量。试验重复3次。
2.3 Western blot法检测小鼠卵巢组织中Cx43蛋白表达
取部分小鼠卵巢组织,匀浆后以RIPA裂解液提取卵巢总蛋白,BCA法测定组织中总蛋白含量,然后进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,电转至硝酸纤维素(NC)膜上,以5%脱脂奶粉于37℃脱色摇床中封闭2 h,TBST缓冲液漂洗3次;加入Cx43抗体(1∶300),37℃脱色摇床中孵育2 h,TBST缓冲液漂洗3次;加入二抗(1∶40 000),37℃脱色摇床中孵育1 h;TBST缓冲液漂洗3次后将膜贴于玻璃纸上,以化学发光液(ECL)覆盖后曝光,得到胶片,采用Gel Pro 4.0凝胶光密度(OD)分析软件进行OD值分析。试验重复3次。
2.4 免疫组化法检测小鼠卵巢组织中Cx43分布
4%多聚甲醛浸泡固定卵巢组织样本,石蜡包埋连续切片。采用PV-9000免疫组化二步法,将卵巢切片常规脱蜡入水,以3%过氧化氢(H2O2)孵育,磷酸盐缓冲液(PBS)冲洗3次后滴加一抗(1∶100),于4℃下孵育过夜,PBS冲洗3次。滴加检测试剂1,于37℃下孵育30 min,PBS冲洗3次;再滴加检测试剂2,于37℃下孵育30 min,PBS冲洗3次,二氨基联苯胺(DAB)溶液显色;经自来水冲洗、复染、脱水、透明、封片等步骤后,采用Motic B5显微图像分析系统观察Cx43蛋白的分布并进行OD值分析。
2.5 统计学方法
3 结果
3.1 各组小鼠卵巢组织中Cx43 mRNA及蛋白表达的测定结果
与空白组比较,模型组小鼠卵巢组织中Cx43 mRNA及蛋白表达均明显减弱(P<0.01);与模型组比较,戊酸雌二醇片组和左归丸中、高剂量组小鼠卵巢组织中Cx43 mRNA及蛋白表达明显增强(P<0.01)。各组小鼠卵巢组织中Cx43蛋白表达的电泳图见图1,Cx43 mRNA及蛋白表达测定结果见表1。

图1 各组小鼠卵巢组织中Cx43蛋白表达的电泳图Fig 1 Electrophoresis charts of Cx43 protein expression in ovarian tissue of mice in each group
表1 各组小鼠卵巢组织中Cx43 mRNA及蛋白表达测定结果(±s,n=3)Tab 1 Determination results of Cx43 mRNA and protein expressions in ovarian tissue of mice in each group(±s,n=3)

表1 各组小鼠卵巢组织中Cx43 mRNA及蛋白表达测定结果(±s,n=3)Tab 1 Determination results of Cx43 mRNA and protein expressions in ovarian tissue of mice in each group(±s,n=3)
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01Note:vs.blank group,**P<0.01;vs.model group,##P<0.01
组别空白组模型组戊酸雌二醇片组左归丸低剂量组左归丸中剂量组左归丸高剂量组Cx43蛋白表达量0.990±0.087 0.442±0.185**0.753±0.052##0.518±0.025 0.686±0.036##0.753±0.033##剂量,g/kg 0.000 13 13.65 40.95 122.85 Cx43 mRNA表达量11.858±0.029 1.095±0.047**8.431±0.664##2.050±0.700 4.216±1.105##6.381±0.302##
3.2 各组小鼠卵巢组织中Cx43蛋白分布观察及OD值的测定结果
免疫组化结果显示,空白组小鼠卵巢组织中Cx43蛋白的分布范围较广,不仅在成熟卵泡中大量分布,在颗粒细胞以及卵母细胞间也有分布;模型组小鼠卵巢组织中Cx43蛋白分布范围明显减小,视野范围内基本未见Cx43蛋白的阳性信号;左归丸低、中、高剂量组小鼠卵巢组织中Cx43分布范围逐步增大,在颗粒细胞与卵母细胞中分布差异尤为明显,其分布范围呈明显量-效关系。OD值分析显示,与空白组(0.309±0.079)比较,模型组小鼠卵巢Cx43阳性表达(0.178±0.052)明显减弱(P<0.01);与模型组比较,戊酸雌二醇片组和左归丸中、高剂量组小鼠卵巢组织中Cx43阳性表达(依次为0.246±0.074、0.255±0.098、0.273±0.050)均明显增强(P<0.05或P<0.01),左归丸低剂量组小鼠卵巢组织中Cx43阳性表达(0.229±0.072)增强不明显(P>0.05),该结果与显微观察的Cx43蛋白分布结果一致。免疫组化图见图2。
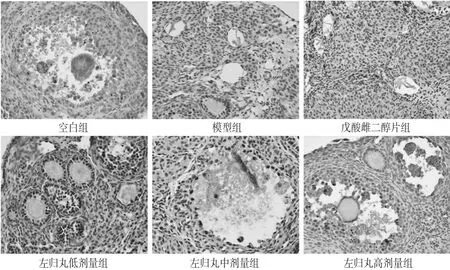
图2 各组小鼠卵巢组织中Cx43蛋白分布的免疫组化图(×400)Fig 2 Immunohistochemistry of Cx43 protein distribution in ovarian tissue of mice in each group(× 400)
4 讨论
哺乳动物的细胞间通讯有3种形式:(1)远程通讯,是以激素为信息传递者,细胞分泌物经血液或淋巴远距离运送到靶细胞;(2)短程通讯,即细胞间经狭窄的间隙传递信息,如化学性突触等;(3)直接通讯,GJ就是细胞间直接通讯的结构基础,两相邻细胞胞膜上的蛋白颗粒彼此相连形成孔对孔的直接交通管道,细胞间可借GJ进行某些小分子物质的交换和离子交换[13]。哺乳动物的卵泡由卵母细胞、颗粒细胞及卵泡基膜构成,颗粒细胞包围着卵母细胞,基膜包被着颗粒细胞且是唯一与卵巢内毛细血管接触的结构,同时卵丘细胞通过突出物与卵母细胞表面突起接触,形成GJ,构成颗粒细胞-颗粒细胞、卵母细胞-颗粒细胞、膜细胞-颗粒细胞之间的通讯途径,且均由GJ介导,对卵泡的生长发育及与卵巢内外环境进行信息传递起着重要的作用[14]。Cx作为GJ的基本结构单位,其构型的改变决定缝隙通道的开启或关闭,又受到激素、钙离子等因素的调控。其中Cx43是卵巢组织中表达最为丰富的Cx,主要表达于卵母细胞与颗粒细胞中,随着卵泡发育逐渐增多,对于颗粒细胞的增殖及分层、维持卵泡的正常结构和功能具有重要作用[15-16]。
化疗药物(如CTX等)在杀伤病变细胞的同时对正常组织和细胞也具有较强的毒副作用,卵巢对化疗药物尤为敏感,化疗时可损害正常细胞的DNA转录及蛋白合成,最终引起卵巢过早萎缩老化[17]。Cx43影响卵泡发育的主要途径有以下几种[18-19]:(1)影响原始生殖细胞迁移及胚胎卵巢发育;(2)维持颗粒细胞正常增殖及分层;(3)抑制卵巢颗粒细胞凋亡;(4)调节卵母细胞减数分裂进程;(5)调节卵巢重塑时期排卵、黄体形成、分化及退化过程;(6)调节激素或细胞因子转录、翻译及表达过程。Cx43的缺失可导致卵泡发育、排卵及早期胚胎发育严重损伤,进而引发POF。
目前临床上对于POF的治疗多采取外源性雌激素替代疗法、诱导排卵、免疫抑制剂及赠卵治疗等。戊酸雌二醇片为临床常用的雌激素替代药,主要用于卵巢早衰、更年期综合征的治疗,可改善卵巢功能衰退引发的性激素分泌失调、下丘脑-垂体-卵巢轴功能紊乱等症状[20-22]。但此类药物长期应用会产生明显副作用,不易为患者接受。中医认为,POF发生的根本原因是天癸耗竭、冲任亏虚,肾-天癸-冲任-胞宫轴功能衰退,可将其归类为“闭经”“年未老而经水断”“白合病”等范畴,临床多以补肾填精为治疗原则。左归丸为补肾填精代表方,常用于治疗卵巢早衰、围绝经期综合征及老年骨质疏松等疾病,疗效确切[7]。前期实验研究发现,左归丸可有效改善CTX致POF小鼠卵巢的储备功能、颗粒细胞凋亡及卵巢组织中Cx37蛋白表达,促进小鼠未成熟卵母细胞发育[11,23-24]。本实验研究发现,CTX主要破坏颗粒细胞间、卵母细胞与颗粒细胞间GJ,表现为Cx43及mRNA表达量呈明显下降趋势,与卵泡闭锁相关。而左归丸可有效改善CTX导致的上述变化,增强颗粒细胞间、卵母细胞与颗粒细胞间联系,促进卵泡的正常发育,这可能是其治疗化疗性POF的机制之一。
[1] Tong Y,Liao WX,Roy AC,et al.Absence of mutations in the coding regions of follicle-stimulating hormone receptor gene in Singapore Chinese women with premature ovarian failure and polycystic ovary syndrome[J].Hoem Metab Res,2001,33(4):221-226.
[2] Venkatesh S,Kumar M,Sharma A,et al.Oxidative stress and ATPase6 mutation is associated with primary ovarian insufficiency[J].Arch Gynecol Obstet,2010,282(3):313-318.
[3] Taylor AE.Systemic adversities of ovarian failure[J].J Soc Gynecol Invest,2001,8(1):S7-S9.
[4] Li Y,Fang Y,Liu Y,et al.MicroRNAs in ovarian fuction and disorders[J].J Ovarian Res,2015,doi:10.1186/ s13048-015-0162-2.
[5] Verma S,Goldammer T,Aitken R.Cloning and expression of activation induced cytidine deaminase from Bos taurus [J].Ver Immunol Immunopathol,2010,134(3/4):151-159.
[6] Matsuda F,Inoue N,Manabe N,et al.Follicular growth and atresia in mammalian ovaries:regulation by survival and death of granulosa cells[J].Reprod Dev,2013,58(1):44-50.
[7] 刘立萍,姜波,李雪峰,等.补肾填精方对去卵巢骨质疏松模型大鼠胶原代谢的影响[J].时珍国医国药,2017,28(2):821-823.
[8] Holder JW,Elmope E,Barrent JC.Gap junction functional cancer[J].Cancer Res,1993,53(1):32-34.
[9] Su V,Lau AF.Connexins:mechanisms regulating protein levels and intercellular communication[J].FEBS Lett,2014,588(8):1212-1220.
[10] Veitch GI,Gittens JE,Shao Q,et al.Selective assembly of connexin37 into heterocellular gap junction at the oocyte/ granulosa cell interface[J].J Cell Sci,2004,doi:10.1242/ jcs.01124.
[11] 阳松威,孙晓峰,贺又舜,等.左归丸对化疗致POF模型小鼠卵巢Cx37及mRNA表达的影响[J].中药新药与临床药理,2016,27(1):33-38.
[12] Licak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.
[13] 侯建华,芩尧,马玉珍.间隙连接蛋白在卵泡发育过程中的作用[J].现代生物医学进展,2012,12(9):1791-1793.
[14] Matzuk MM,Burns KH,Viveiros MM,et al.Intercellular communication in the mammalian ovary:oocytes carry the conversation[J].Science,2002,doi:10.1126/science. 107/965.
[15] Ponsioen B,van Zeijil L,Moolenaar WH,et al.Direct measurement of cyclic AMP diffusion and signaling through connexin43 gap junctional channels[J].Exp Cell Res,2007,313(2):415-423.
[16] Cecconi S,Ciccarelli C,Barrberi M,et al.Granulosa celloocyte interactions[J].Eur J Obstet Gynecol Reprod Biol,2004,115(S1):19-22.
[17] Desmeules P,Devine P.Characterizing the ovotoxicity of cyclophosphamide metabolites on cultured mouse ovaries [J].Toxicol Sci,2006,90(2):500-509.
[18] 连红梅,贾莉婷,张展,等.间隙连接蛋白Cx43和Cx37在多囊卵巢综合征大数据卵巢中的表达及意义[J].中国妇幼保健,2008,23(32):4622-4624.
[19] Borowczy KE,Johnson ML,Bilski JJ,et al.Expression of gap junctional connexins 26,32,and 43 mRNA in ovarian preovulatory follicles and corpora lutea in sheep[J].Can J Physiol Pharmacol,2006,84(10):1011-1012.
[20] 李彦,赵纯全.戊酸雌二醇片在妇产科的临床应用进展[J].中国药房,2014,25(10):933-935.
[21] 阳松威,郭建生,王晓倩,等.补肾疗更浸膏对去势更年期模型大鼠神经内分泌功能失调的作用[J].中成药,2016,38(3):651-654.
[22] 阳松威,郭建生,王晓倩,等.补肾疗更浸膏延缓老年小鼠卵巢功能衰退的实验研究[J].中药新药与临床药理,2015,26(5):613-618.
[23] 阳松威,孙晓峰,贺又舜,等.左归丸对化疗致卵巢早衰小鼠卵巢功能的影响[J].中成药,2016,38(4):717-722.
[24] 孙晓峰.左归丸促进小鼠未成熟卵母细胞体外核成熟的实验研究[J].现代生物医学进展,2011,11(3):444-447.
Effect of Zuogui Pill on the Expression of Gap Junction Protein 43 in Ovarian Tissue of Mice with Chemotherapy-induced Premature Ovarian Failure
SUN Xiaofeng1,YANG Songwei2,HE Youshun1,CHEN Cong1,GONG Limin2,LUO Ling3(1.College of TCM,Hunan University of Chinese Medicine,Changsha 410208,China;2.College of Pharmacy,Hunan University of Chinese Medicine,Changsha 410208,China;3.Dept.of Orthopedics,the Third Xiangya Hospital of Central South University,Changsha 410013,China)
OBJECTIVE:To study the effect of Zuogui pill on the expression of gap junction protein 43(Cx43)in ovarian tissue of mice with premature ovarian failure(POF)induced by intraperitoneal injection of cyclophosphamide(CTX),and explore its mechanism in the treatment of chemotherapy-induced POF.METHODS:72 mice were randomly divided into blank group,model group,Estradiol valerate tablet group(positive control,0.000 13 g/kg),Zuogui pill low-dose,medium-dose,high-dose groups(13.65,40.95,122.85 g/kg)by body mass,10 in each group.Except for blank group,other groups were reduce POF model by ip CTX,once a day,for 20 d.Meanwhile,the mice were intragastrically administrated related medicines,once a day,for 30 d.After 2 h of last administration,reverse transcription-polymerase chain reaction method and Western blot method were used to detect the Cx43 mRNA and protein expressions in ovarian tissue respectively,and immunohistochemistry method was adopted to detect the distribution of Cx43 protein in ovarian tissue.RESULTS:Compared with blank group,Cx43 mRNA and protein expressions in ovarian tissue of mice in model group were obviously weakened,and the distribution of Cx43 protein in follicle and granulocytes were obviously reduced(P<0.01).Compared with model group,Cx43 mRNA and protein expressions in ovarian tissue of mice in Estradiol valerate tablet group and Zuogui pill medium-dose,high-dose groups were obviously strengthened,and the distribution of Cx43 protein in follicle and granulocytes were obviously increased(P<0.01).CONCLUSIONS:Zuogui pill can increase the Cx43 mRNA and protein expressions in ovarian tissue of CTX-induced POF mice,increase the distribution of Cx43 in follicle and granulocytes and gap junction function,which may be one of the treatment mechanism of POF.
Zuogui pill;Premature ovarian failure;Ovarian;Gap junction protein 43;Mice
R285
A
1001-0408(2017)22-3044-04
2016-12-09
2017-02-19)
(编辑:林 静)
国家自然科学基金资助项目(No.81303004);湖南省科技厅资助项目(No.2009RS3018);湖南省教育厅资助项目(No. 09C727)
*副教授,博士。研究方向:中医药对女性生殖的影响。E-mail:2642724115@qq.com
#通信作者:教授,博士。研究方向:骨质疏松性骨折防治。E-mail:307068826@qq.com
DOI10.6039/j.issn.1001-0408.2017.22.06
