白皮杉醇对早期糖尿病肾病大鼠肾脏的影响
2017-09-03刘德慧吴荣艳王丽芳刘宏明任称发许仁聪
何 勇, 刘德慧, 吴荣艳, 谭 菲, 王丽芳, 刘宏明, 任称发, 许仁聪
(赣州市人民医院 1药剂科, 2肾内科, 3赣州市第三人民医院检验科, 江西 赣州 341000)
白皮杉醇对早期糖尿病肾病大鼠肾脏的影响
何 勇1, 刘德慧2△, 吴荣艳3, 谭 菲2, 王丽芳2, 刘宏明2, 任称发2, 许仁聪2
(赣州市人民医院1药剂科,2肾内科,3赣州市第三人民医院检验科, 江西 赣州 341000)
目的: 观察白皮杉醇(PIC)对早期糖尿病肾病大鼠肾脏的影响,并探讨白皮杉醇初步的作用机制。方法: 将大鼠随机分为5组:正常对照(control)组,模型(model)组,白皮杉醇低剂量(PIC-LD)组、中剂量(PIC-MD)组和高剂量(PIC-HD)组。建立糖尿病肾病大鼠模型,PIC-LD、PIC-MD和PIC-HD组大鼠造模成功后分别用白皮杉醇20 mg/kg、40 mg/kg与60 mg/kg灌胃(每天1次),共给药4周。血糖仪检测大鼠血液中的血糖含量,脲酶-谷氨酸脱氢酶法与肌苷酸氧化酶法检测血清中尿素氮与肌酐含量,免疫透射比浊法检测大鼠24 h尿微量白蛋白的含量,HE染色对肾组织进行病理学观察,Western blot法检测肾组织中TGF-β1、p-Smad2、p-Smad3与Smad7的蛋白水平。结果: 与model组相比,PIC-LD、PIC-MD和PIC-HD组大鼠血糖浓度明显下降,血清中尿素氮含量与尿微量白蛋白含量显著下降,肌酐含量无显著变化,肾组织系膜细胞与基质增生减缓,肾小管上皮细胞空泡样变性的程度减轻,肾组织中TGF-β1、p-Smad2、p-Smad3与Smad7的蛋白水平明显下调。结论: 白皮杉醇对早期糖尿病肾病大鼠的肾脏具有保护作用,可能是通过抑制TGF-β/Smad信号通路的活性发挥作用。
糖尿病肾病; 白皮杉醇; TGF-β/Smad信号通路
糖尿病肾病(diabetic nephropathy,DN)是糖尿病引起的最常见并发症之一,由于起病隐匿,早期无明显临床症状,但随着病情发展,病变程度加剧,成为导致终末期肾病和患者死亡的主要原因。DN的主要特征为肾小球和肾小管的结构与功能的改变,体现为高滤过、高灌注状态与肾小球滤过屏障的改变[1]。随着发病率逐年递增,严重危害人类的健康。糖尿病肾病的病理表现为肾小球肥大,基底膜增厚,逐渐发展为间质纤维化,最终进展为慢性肾功能衰竭[2],但具体的发病机制尚未明确。据统计,全球糖尿病患者中约有20%~40%是由于终末期肾病需要进行换肾替代治疗。
白皮杉醇(piceatannol,PIC)是白藜芦醇的衍生物,主要存在于葡萄、大黄与甘蔗等植物中,是一种多酚化合物[3]。国外学者研究发现人工合成的白皮杉醇具有抗氧化、清除自由基、调节免疫力以及抗炎等的生物活性[4-5],白皮杉醇的抗氧化作用比白藜芦醇强。有研究发现白藜芦醇可抵抗脂多糖导致的肾血流动力学变化,通过下调血浆与尿液中一氧化氮的水平而抑制脂多糖引起的肾损伤[6]。基于此,我们通过建立糖尿病肾病大鼠模型,观察白皮杉醇是否对糖尿病肾病大鼠的肾脏具有保护作用,并探讨其初步的作用机制。
材 料 和 方 法
1 实验动物和试剂
健康Wistar大鼠50只,雌雄各半,SPF级,购自北京维通利华实验动物技术有限公司,饲养于恒温、恒湿环境中,正常进食饮水,进行适应性喂养1周。
链脲佐菌素购自Sigma;白皮杉醇购自杭州广林生物医药有限公司;肌酐测试盒与尿素氮测试盒购自宁波瑞源生物科技有限公司;RIPA蛋白裂解液与BCA蛋白定量试剂盒购自江苏碧云天生物科技有限公司;抗TGF-β1、p-Smad2、p-Smad3与Smad7抗体购自Santa Cruz。
2 方法
2.1 动物分组 将大鼠随机分为5组:正常对照(control)组,模型(model)组,白皮杉醇低剂量(low dose,LD)组(PIC-LD组)、中剂量(medium dose,MD)组(PIC-MD组)和高剂量(high dose,HD)组(PIC-HD组)。
2.2 早期糖尿病肾病大鼠模型建立与给药 进行适应性喂养后,正常对照组大鼠继续采用普通饲料喂养;其余各组大鼠均给予高脂高糖饲料喂养1周,禁食12 h,采用无菌枸橼酸钠缓冲液配制的链脲佐菌素(42 mg/kg)腹腔注射,72 h后,尾静脉取血检测血糖,当血糖值≥16.7 mmol/L时确定为造模成功。造模成功后,白皮杉醇低剂量组、中剂量组和高剂量组分别采用20 mg/kg、40 mg/kg与60 mg/kg灌胃,每天1次,连续给药4周。模型组与正常对照组给予等量生理盐水灌胃。
2.3 样本收集 给药完成后,各组大鼠禁食不禁水24 h,置于代谢笼,收集尿液,离心后备用;腹腔注射麻醉后,腹主动脉穿刺取血,置于抗凝真空采血管中,静置1 h,3 000 r/min离心10 min,取上清液备用;采集血液后,摘取双侧肾脏,清洗后左侧肾脏用4%多聚甲醛固定,备用,右侧肾脏切取皮髓交界处组织备用。
2.4 空腹血糖(fasting blood glucose,FBG)、血尿素氮(blood urea nitrogen,BUN)与血清肌酐(serum creatinine, SCr)含量的检测 采用血糖仪检测大鼠血液中的血糖含量,采用脲酶-谷氨酸脱氢酶法与肌苷酸氧化酶法检测血清中尿素氮与肌酐含量。
2.5 尿微量白蛋白(urinary microalbumin,U-mAlb)含量的检测 采用免疫透射比浊法检测大鼠24 h尿微量白蛋白的含量。
2.6 HE染色病理学观察 将已固定好的肾脏组织制作成石蜡切片,分别浸泡在二甲苯I、II溶液中各20 min,再分别浸泡于梯度乙醇各5 min,蒸馏水冲洗,加入苏木素染液浸泡3 min,自来水冲洗,1%盐酸溶液分化20 s,自来水冲洗,0.5%伊红复染60 s,再次放入梯度乙醇中脱水,二甲苯透明,用中性树胶封片,置于显微镜下观察。
2.7 Western blot法 将肾组织样本放置于冰上剪碎,加入RIPA裂解液,于匀浆机中匀浆,4 ℃、10 000 r/min离心5 min,取上清液使用BCA蛋白定量试剂盒进行蛋白定量。随后取等量蛋白,100 ℃水浴变性5 min,用SDS-PAGE分离,转移至硝酸纤维素膜,加入封闭液中室温孵育1 h,加入 I 抗4 ℃孵育过夜,TBST洗涤2次,加入相应 II 抗室温孵育1 h,TBST洗涤2次,使用化学发光法显色,曝光、保存胶片。将胶片进行扫描,用凝胶图像处理系统分析目标条带。
3 统计学处理
用SPSS 15.0统计软件对计量资料进行分析。所有数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),两组均数间比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 各组大鼠空腹血糖、血尿素氮、血清肌酐与尿微量白蛋白水平的变化
Control组大鼠正常饮食,精神状态正常;model组大鼠精神状态萎靡,体重逐渐减轻,空腹血糖浓度显著高于control组(P<0.05),血清中尿素氮含量显著高于control组(P<0.05);PIC-LD、PIC-MD和PIC-HD组大鼠体重无显著变化,空腹血糖下降明显(P<0.05),但并未到达正常范围值,血清中尿素氮含量下降(P<0.05)。各组大鼠血液中肌酐含量的差异不具有统计学显著性,见表1。
与control组相比,model组大鼠尿微量白蛋白含量显著升高(P<0.05);与model组相比,经过药物干预后,大鼠的尿微量白蛋白含量随药物剂量逐渐下降(P<0.05),见表1。

表1 各组大鼠空腹血糖、血尿素氮、血清肌酐与尿微量白蛋白水平的变化
*P<0.05vscontrol group;#P<0.05vsmodel group.
2 各组大鼠肾脏的病理学观察
Control组大鼠的肾小球与系膜基质未出现明显的病理改变;model组大鼠显微镜下可见系膜细胞与基质增生,肾小管上皮细胞呈空泡样变性;PIC-LD、PIC-MD和PIC-HD组大鼠的肾脏病理改变明显减轻,其中PIC-HD组大鼠的病理学形态最接近control组,见图1。

Figure 1.The effect of piceatannol on the pathological changes of kidney in the rats with diabetic nephropathy (×200).
图1 白皮杉醇对糖尿病肾病大鼠肾脏病理学变化的影响
3 各组大鼠肾组织中TGF-β1、p-Smad2、p-Smad3与Smad7蛋白水平的变化
与control组相比,model组大鼠肾组织中TGF-β1、p-Smad2、p-Smad3与Smad7的蛋白水平显著增加(P<0.05);与model组相比,PIC-LD、PIC-MD和PIC-HD组大鼠肾组织中TGF-β1、p-Smad2及p-Smad3的蛋白水平明显下降,而仅PIC-HD组Smad7蛋白较model组降低(P<0.05),见图2。
讨 论
糖尿病肾病是糖尿病患者最严重的微血管并发症之一,是引起末期肾病的主要原因[7]。糖尿病肾病的发病机制十分复杂,目前尚未明确。肌酐一般全部随尿排出,不会被肾小管重吸收,临床研究发现糖尿病肾病早期由于肾小球滤过率并未出现明显变化,所以血肌酐含量不会出现明显波动;尿素氮在一定程度上可反映肾小球的滤过功能,但容易受肾外因素(如蛋白代谢紊乱、消化道出血等)的影响而明显升高,因此,检测血肌酐的含量更能体现糖尿病肾病早期肾脏功能的变化。我们实验发现,糖尿病肾病大鼠血肌酐与正常组并无差异,经过白皮杉醇给药后,血肌酐略微下降,但并不具有统计学意义;另外,白皮杉醇能够明显降低糖尿病肾病大鼠血清尿素氮的含量,提示白皮杉醇可能对糖尿病肾病早期的蛋白代谢紊乱有改善作用。尿微量白蛋白是肾脏早期损伤的重要标志,能够在一定程度上反映肾小球损伤[8]。因此,在临床上常检测尿微量蛋白来监测肾脏是否出现损伤。我们实验结果显示,白皮杉醇能够降低糖尿病肾病大鼠尿微量白蛋白的含量,推测白皮杉醇可能具有保护肾脏的功能。
研究发现TGF-β/Smad信号通路与多个器官的纤维化、硬化有密切联系,是调节组织纤维化的最重要因子[9-10]。转化生长因子β(transforming growth factor β, TGF-β)在人体的肝、肾、皮肤、结缔组织等均有表达,是一种具有多种功能的细胞因子。多项研究表明TGF-β信号通路与细胞增殖、分化,胚胎发育、损伤修复等一系列细胞反应有关[11]。Smad蛋白是目前所知唯一的TGF-β受体胞内激酶底物,是TGF-β信号传导非常重要的分子[12]。活化的TGF-β受体I磷酸化后激活Smad2/3蛋白,形成复合体进入细胞核,从而调节细胞增殖、分化、转移与凋亡,同时引起Smad7从细胞核中移出。研究发现当TGF-β/Smad信号通路处于高度激活状态时,肾脏系膜细胞、肾小管上皮细胞和血管平滑肌细胞中的胶原合成显著增加,形成肾间质纤维化[13],并出现Smad7功能的缺失。我们研究发现,白皮杉醇能够抑制由糖尿病肾病引起的TGF-β1、p-Smad2与p-Smad3蛋白水平的上升,推测白皮杉醇可能通过抑制TGF-β/Smad信号通路的重要因子Smad2和Smad3的磷酸化,且抑制Smad7的蛋白水平,从而具有抑制TGF-β/Smad信号通路的作用。
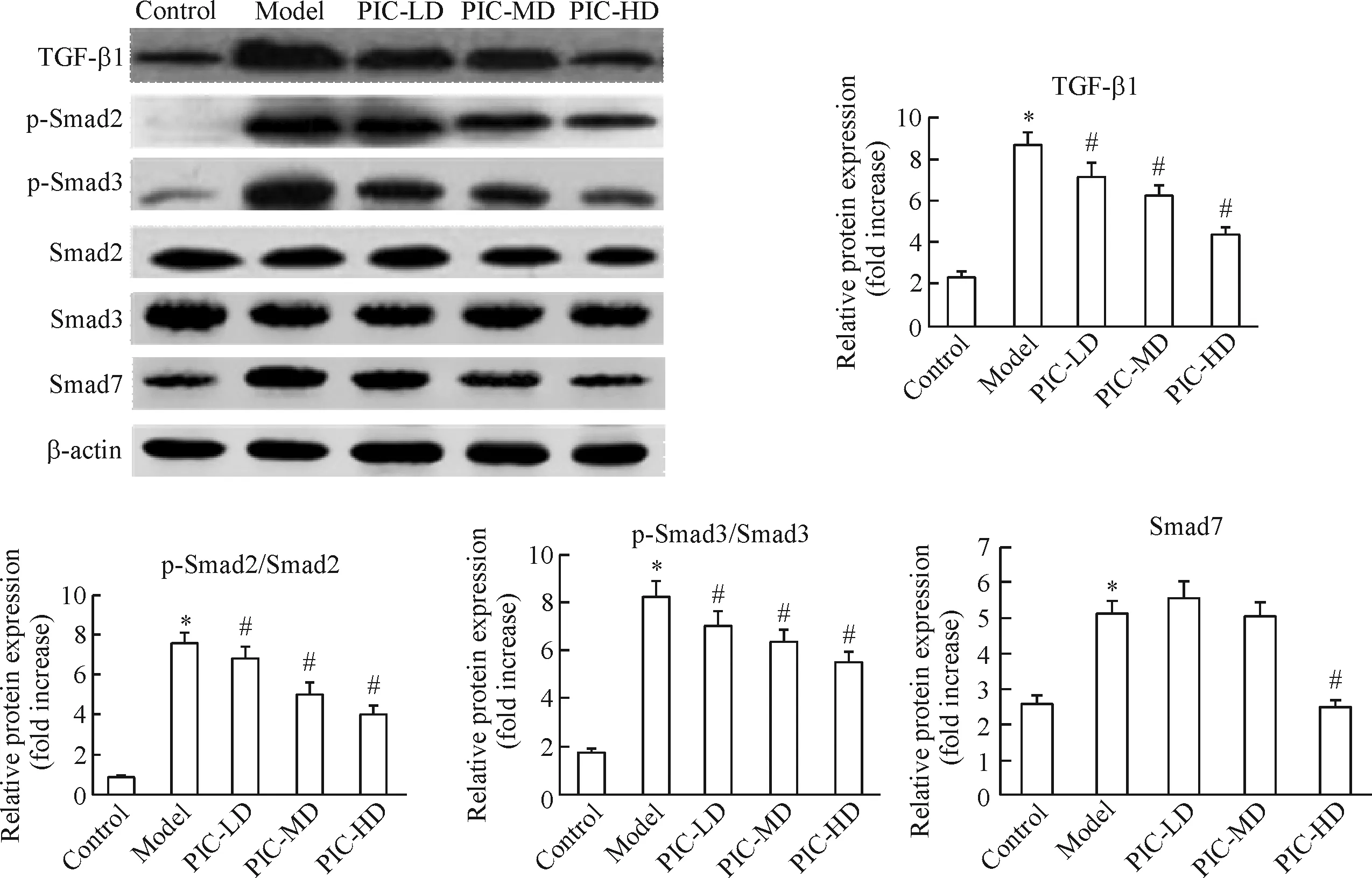
Figure 2.The effect of piceatannol on the protein levels of TGF-β1, p-Smad2, p-Smad3 and Smad7 in the kidney tissues. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsmodel group.
图2 白皮杉醇对大鼠肾组织中TGF-β1、p-Smad2、p-Smad3与Smad7蛋白水平的影响
[1] Li JH, Zhu HJ, Huang XR, et al. Smad7 inhibits fibrotic effect of TGF-β on renal tubular epithelial cells by blocking Smad2 activation[J]. J Am Soc Nephrol, 2002, 13(6):1464-1472.
[2] Yu SH, Dubey NK, Li WS, et al.Cordycepsmilitaristreatment preserves renal function in type 2 diabetic nephropathy mice[J]. PLoS One, 2016, 11(11):e0166342.
[3] 王春燕, 齐雪松, 佟 鹏, 等. 白皮杉醇和乙酰化白藜芦醇对小鼠辐射损伤的防护作用[J]. 中国生物制品学杂志, 2015, 28(4):368-370.
[4] Rossi M, Caruso F, Antonioletti R, et al. Scavenging of hydroxyl radical by resveratrol and related natural stilbenes after hydrogen peroxide attack on DNA[J]. Chem Biol Interact, 2013, 206(2):175-185.
[5] Kukreja A, Tandon S, Mishra A, et al. Piceatannol: a potential futuristic natural stilbene as fetal haemoglobin inducer[J]. J Clin Diagn Res, 2013, 7(12):3028-3031.
[6] Sebai H, Ben-Attia M, Sani M, et al. Protective effect of resveratrol on acute endotoxemia-induced nephrotoxicity in rat through nitric oxide independent mechanism[J]. Free Radic Res, 2008, 42(11-12):913-920.
[7] Barnett A. Prevention of loss of renal function over time in patients with diabetic nephropathy[J]. Am J Med, 2006, 119(5 Suppl 1):S40-S47.
[8] 欧阳涓, 姜 傥. 肾脏的损伤性诊断[J]. 中华检验医学杂志, 2005, 28(8):877-879.
[9] Xu M, Cai J, Wei H, et al. Scoparone protects against pancreatic fibrosis via TGF-β/Smad signaling in rats[J]. Cell Physiol Biochem, 2016, 40(1-2):277-286.
[10]Zhao J, Wang L, Cao AL, et al. HuangQi decoction ameliorates renal fibrosis via TGF-β/Smad signaling pathwayinvivoandinvitro[J]. Cell Physiol Biochem, 2016, 38(5):1761-1774.
[11]Zhang Y, Alexander PB, Wang XF. TGF-β family signaling in the control of cell proliferation and survival[J]. Cold Spring Harb Perspect Biol, 2017, 9(4): a022145.
[12]Akhurst RJ, Padgett RW. Matters of context guide future research in TGFβ superfamily signaling[J]. Sci Signal, 2015, 8(399):re10.
[13]Li JH, Huang XR, Zhu HJ, et al. Advanced glycation end products activate Smad signaling via TGF-beta-dependent and independent mechanisms: implications for diabetic renal and vascular disease[J]. FASEB J, 2004, 18(1):176-178.
(责任编辑: 陈妙玲, 宋延君)
Effects of piceatannol on rat kidney with diabetic nephropathy in early stage
HE Yong1, LIU De-hui2, WU Rong-yan3, TAN Fei2, WANG Li-fang2, LIU Hong-ming2, REN Cheng-fa2, XU Ren-cong2
(1DepartmentofPharmacy,2DepartmentofNephrology,GanzhouPeople’sHospital,3DepartmentofLaboratoryMedicine,ThirdPeople’sHospitalofGanzhou,Ganzhou341000,China.E-mail:liuxianmed@163.com)
AIM: To observe the effect of piceatannol on the kidney of diabetic nephropathy rats in early stage, and to explore the possible mechanisms.METHODS: The rats were randomly divided into 5 groups: control group, model group, low dose of piceatannol treatment group, medium dose of piceatannol treatment group and high dose of piceatannol treatment group. The rat model of diabetic nephropathy was induced accordingly, and the rats
20 mg/kg, 40 mg/kg or 60 mg/kg of piceatannol by gavage once a day for 4 weeks. Blood glucose was detected by glucometer. The urea nitrogen and creatinine levels in the serum were measured by urease-glutamate dehydrogenase enzymatic and inosine acid oxidase methods, respectively, and 24 h urinary microalbumin was analyzed by immune transmission turbidimetry test. Moreover, the pathological changes of the kidney tissues were observed under microscope with HE staining. The protein expression of TGF-β1 and Smad 7 and the phosphorylation levels of Smad2 and Smad3 were determined by Western blot. RESULTS: Compared with model group, piceatannol treatment significantly decreased the levels of blood glucose, blood urea nitrogen and urinary microalbumin, but had no effects on serum creatinine. Furthermore, HE staining showed that the increased mesangial cells, matrix hyperplasia and degenerated epithelial cells in model group were markedly inhibited after piceatannol treatment. Additionally, piceatannol treatment also reduced the protein expression of TGF-β1 and Smad 7, and the phosphorylation levels of Smad2 and Smad3. CONCLUSION: Piceatannol attenuates pathological progression in the kidney of diabetic nephropathy rats in early stage, which may be through inhibiting TGF-β/Smad signaling pathway.
Diabetic nephropathy; Piceatannol; TGF-β/Smad signaling pathway
1000- 4718(2017)08- 1528- 04
2017- 02- 20
2017- 04- 27
R587.1; R363.2+1
A
10.3969/j.issn.1000- 4718.2017.08.030
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0797-8111154; E-mail: liuxianmed@163.com
