TNF-α诱导MLO-Y4细胞发生RIP3介导的程序性坏死*
2017-09-03崔红旺孟志斌祝开忠赵志荣朱永俊
崔红旺, 孟志斌, 黄 涛, 祝开忠, 赵志荣, 朱永俊
(海南医学院第一附属医院 1脊柱骨病外科, 2肾病风湿科, 海南 海口 570102)
TNF-α诱导MLO-Y4细胞发生RIP3介导的程序性坏死*
崔红旺1, 孟志斌1, 黄 涛1, 祝开忠1, 赵志荣1, 朱永俊2△
(海南医学院第一附属医院1脊柱骨病外科,2肾病风湿科, 海南 海口 570102)
目的: 探讨肿瘤坏死因子α(TNF-α)能否诱导小鼠长骨骨样细胞株MLO-Y4发生程序性坏死及其发生机制。方法: 将MLO-Y4细胞分为正常对照(control)组、TNF-α处理组、TNF-α+necrostatin-1 (Nec-1)处理组、TNF-α+Z-VAD处理组和TNF-α+受体相互作用蛋白3(RIP3)-siRNA组。用流式细胞术检测各组细胞凋亡或坏死率,透射电镜鉴定细胞形态学变化,用Western blot法测定RIP1、RIP3和cleaved caspase-3的蛋白水平,应用激光共聚焦显微镜观察RIP1和RIP3蛋白的共表达,应用荧光标记法检测各组细胞活性氧(ROS)水平。结果: TNF-α诱导MLO-Y4细胞24 h,凋亡和坏死率明显高于control组(P<0.01)。与TNF-α组相比,Nec-1、Z-VAD和RIP3-siRNA均能降低细胞的凋亡或坏死率(P<0.01)。在TNF-α组可见大量坏死样细胞,在Z-VAD组仍可见到坏死样细胞,而在Nec-1和RIP3-siRNA组未见到坏死样细胞。Western blot实验结果显示Nec-1可有效抑制RIP1蛋白表达,而Z-VAD对RIP1和RIP3蛋白表达无影响,RIP3-siRNA可有效降低RIP3蛋白表达(P<0.01)。与TNF-α组比较,Nec-1可有效降低RIP1-RIP3蛋白共表达阳性细胞百分率(P<0.01),而Z-VAD对其无影响。与control组相比,TNF-α组的ROS水平明显增高(P<0.01);与TNF-α组相比,Nec-1、Z-VAD及RIP3-siRNA均能有效抑制ROS水平(P<0.01)。结论: TNF-α能诱导MLO-Y4细胞发生RIP3介导的程序性坏死;ROS可能是MLO-Y4细胞程序性坏死的执行者。
肿瘤坏死因子α; 程序性坏死; 受体相互作用蛋白3; MLO-Y4细胞
在成人骨组织中,骨细胞占 90%~95%。骨细胞通过其树突将信号传递给骨表面的成骨细胞和破骨细胞以调节骨形成和骨吸收平衡[1]。骨细胞的死亡在绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)发病过程中起重要的作用[2]。我们前期研究发现,在卵巢切除(ovariectomized,OVX)大鼠骨质疏松发病过程中,程序性坏死(necroptosis)是引起骨细胞死亡的另一种重要方式[3];应用程序性坏死特异性抑制剂necrostatin-1 (Nec-1)干预OVX大鼠骨质疏松模型,可有效减少骨细胞程序性坏死,进而减少了骨量的丢失[4]。但在PMOP的发病过程,是何种因素促发骨细胞发生程序性坏死的,目前尚不清楚。
肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)对PMOP骨代谢的调节起着重要作用[5]。大鼠OVX术后TNF-α在肝组织匀浆明显增加[6];健康的绝经前妇女接受OVX术后TNF-α增加,术后8 周达到最高水平,这些变化与骨吸收指标密切相关[7]。已证实TNF-α与其受体作用可激活细胞程序性死亡信号转导途径进而导致细胞发生程序性坏死[8]。TNF-α能否促发骨细胞发生程序性坏死,尚不清楚。本研究旨在验证TNF-α能否促发小鼠长骨骨样细胞株MLO-Y4发生程序性坏死,并初步探讨其发生机制,为PMOP的发病机理提供实验依据。
材 料 和 方 法
1 主要试剂
MLO-Y4细胞株(北京鼎国昌盛生物技术有限责任公司);受体相互作用蛋白(receptor-interacting protein,RIP)3-siRNA(上海吉玛基因公司,正义链为CCAAGUAUGACCAAGCACAdTdT,反义链为UGU-GCUUGGUCAUACUUGGdTdT);TNF-α(Sino Biological Inc.);Lipofectamine 2000(Invitrogen);小鼠抗RIP1单克隆抗体和兔抗RIP3多克隆抗体(Abcam);兔抗cleaved caspase-3单克隆抗体(Cell Signaling Technology);兔抗β-actin单克隆抗体(Santa Cruz);Nec-1(Sigma-Aldrich);DMEM/F12培养基(Gibco);临用时加入胎牛血清(fetal bovine serum,FBS;Gibco)配制为含10% FBS 的培养基。
2 实验方法
2.1 实验分组及处理 实验分为5组,处理方法如下[9]:正常对照(control)组单纯采用DMEM/F12完全培养基作用MLO-Y4细胞24 h;TNF-α组用含50 μg/L TNF-α的DMEM/F12完全培养基作用MLO-Y4细胞24 h[10];TNF-α+Nec-1组先用含50 μmol/L Nec-1的DMEM/F12完全培养基作用MLO-Y4细胞30 min,再用含50 μg/L TNF-α的DMEM/F12完全培养基作用MLO-Y4细胞24 h;TNF-α+Z-VAD组先用含20 μmol/L Z-VAD的DMEM/F12完全培养基作用MLO-Y4细胞30 min,再用含50 μg/L TNF-α的DMEM/F12完全培养基作用MLO-Y4细胞24 h;TNF-α+RIP3-siRNA组的处理方法见2.2。
2.2 RIP3-siRNA转染MLO-Y4细胞 根据转染方式不同分成对照组(仅用Lipofectamine 2000转染试剂)、阴性对照siRNA(negative control siRNA,NC-siRNA)转染组(Lipofectamine 2000转染试剂+NC-siRNA序列)和RIP3-siRNA转染组(Lipofectamine 2000转染试剂+RIP3-siRNA序列)。取生长状态良好的MLO-Y4细胞,按1×108/L接种于6孔板内,每孔加500 μL DMEM/F12完全培养基,放入5% CO2、37 ℃的细胞培养箱内过夜,次日细胞密度约为培养瓶底面积的80%左右时进行转染。用25 μL Opti-MEM稀释1.0 μL 脂质体Lipofectamine 2000配制为转染试剂,轻轻震荡混匀,室温静置5 min待用。将RIP3-siRNA或NC-siRNA序列混于转染试剂配制终浓度为100 nmol/L转染混合物,室温静置20 min。弃掉各孔内的旧DMEM/F12完全培养基,根据不同组别每孔加入100 μL转染混合物,放入5% CO2、37 ℃的细胞培养箱内,6 h后6孔板更换为含有50 μg/L TNF-α的DMEM/F12完全培养基继续培养,24 h后收集细胞提取总蛋白。应用Western blot实验验证RIP3-siRNA对RIP3蛋白的影响。
2.3 流式细胞术检测TNF-α诱导MLO-Y4细胞凋亡和坏死 收集各组细胞,用0.01 mol/L PBS洗涤2次,0.25%胰蛋白酶消化后,转入1.5 mL的离心管,1 500 r/min离心5 min,用1 mL预冷的PBS重悬细胞,Annexin V-FITC/PI 双染法测定细胞凋亡和坏死率,此实验重复3次。采用右下象限(Annexin V+/PI-,代表早期凋亡细胞)和右上象限(Annexin V+/PI+,代表晚期凋亡或坏死细胞)的数据进行统计学分析。
2.4 电镜观察细胞的形态变化 各组处理的细胞,用0.25%胰蛋白酶消化后,800 r/min离心5 min,2.5%戊二醛固定液保存所得细胞团块。细胞团块经2%锇酸(pH 7.4)常温下固定4 h后,梯度乙醇脱水,转入丙酮。然后包埋于环氧树脂包埋剂中。应用超微切片机将标本切成50 nm超薄切片,放置在Formvar膜包被的铜网格上晾干。最后用3%醋酸铀和柠檬酸铅双染色,于透射电镜下观察骨组织超微结构。
2.5 激光共聚焦显微成像检测RIP1和RIP3蛋白的共表达 向24孔板内的爬片中央滴入细胞悬液约1×106/L个细胞,放入5% CO2、37 ℃的培养箱内,6 h后细胞固定在爬片上,再向各孔内加入10% FBS的DMEM/F12培养基100 μL,放入5% CO2、37 ℃的培养箱内过夜。次日各组细胞处理同方法2.1。收集细胞爬片,PBS缓冲液冲洗3次,加入4%多聚甲醛固定细胞10 min,弃上清,PBS缓冲液冲洗3次;应用0.3%Triton X-100室温下破膜处理10 min;PBS缓冲液冲洗3次;滴加山羊血清封闭液50 μL,室温孵育10 min,甩去封闭液;滴加RIP1和RIP3的 I 抗混合液(RIP1小鼠单克隆抗体和RIP3兔多克隆抗体均稀释为1∶100,二者混合),在4 ℃冰箱中孵育过夜;次日,37 ℃培养箱孵育1 h;PBS缓冲液冲洗3次;(以下操作步骤在暗室进行)滴加1∶200稀释的Dylight 594山羊抗小鼠IgG和Dylight 488山羊抗兔IgG混合液,常温下孵育1 h;PBS缓冲液冲洗3次;DAPI复染细胞核5 min;PBS缓冲液冲洗3次;用50%甘油封片,指甲油固定。在LEICA TCS SP2激光共聚焦显微镜下,采集图片,每个样本随机选6个视野计算阳性细胞百分数,进行统计分析。
2.6 Western blot检测RIP1、RIP3和cleaved caspase-3蛋白的水平 倒掉各组T25培养瓶内培养基,用预冷的PBS洗涤2次,倒掉洗涤液,尽量去尽残液。用刮匙从T25培养瓶收集各组处理的细胞,加入蛋白裂解液,提取细胞总蛋白,测定蛋白浓度,并配平;凝胶电泳分离蛋白质,转膜,5% BSA-TBST室温封闭;加 I 抗:RIP1(1∶1 000)、 RIP3(1∶1 000)、cleaved caspase-3(1∶1 000)和β-actin(1∶2 000),4 ℃过夜;加入 II 抗37 ℃孵育1 h;TBST洗膜,ECL发光显色。以β-actin作为内参照,采用VILBER Fusion FX7分析软件进行定量分析。
2.7 荧光标记定量分析活性氧簇(reactive oxygen species,ROS)的生成 用DCFH-DA悬浮各组处理好的细胞,调整细胞浓度为5×109/L,每组设置3孔,每孔加200 μL样本,放置于5% CO2、37 ℃培养箱中孵育25 min,每5 min轻轻震荡1次,用无血清的新鲜培养基反复漂洗细胞3次,除去未进入细胞内的DCHF-DA。调整荧光酶标仪激发波长为488 nm,在发射波长525 nm下检测各组细胞的荧光强度,此实验重复3次。
3 统计学处理
采用SPSS 18.0 统计软件进行统计分析。所有数据用均数±标准误(mean±SEM)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用Bonferroni法。以P<0.05表示差异有统计学显著性。
结 果
1 RIP3-siRNA可有效干扰MLO-Y4细胞的RIP3蛋白表达
提取细胞总蛋白,应用Western blot检测各组细胞RIP3蛋白的表达,结果发现与对照组比较,RIP3-siRNA转染组的RIP3蛋白表达明显降低(P<0.01),而RIP3蛋白表达在NC-siRNA组与对照组无显著差异,说明该RIP3-siRNA序列对有效干扰了RIP3的表达,见图1。

Figure 1.The effect of RIP3-siRNA on RIP3 protein expression detected by Western blot analysis. Mean±SEM.n=3.##P<0.01vscontrol group.
图1 Western blot检测RIP3-siRNA对MLO-Y4细胞RIP3表达的影响
2 TNF-α能有效诱导MLO-Y4细胞发生凋亡和坏死
与对照组相比,TNF-α组的早期凋亡率明显增高(P<0.01),Z-VAD能有效降低MLO-Y4细胞的早期凋亡率(P<0.01),而Nec-1和RIP3-siRNA对MLO-Y4细胞的早期凋亡率无明显影响。TNF-α组的晚期凋亡或坏死率较对照组明显增高(P<0.01),Nec-1、Z-VAD和RIP3-siRNA均能有效降低MLO-Y4细胞的晚期凋亡或坏死率,差异有统计学意义(P<0.01),见图2。
3 TNF-α对MLO-Y4细胞形态学的影响
透射电镜观察结果示,在TNF-α组可见MLO-Y4细胞呈明显的坏死形态学特征:线粒体肿胀增多,细胞膜破裂,胞浆内容物外溢;在TNF-α+Z-VAD组同样可以见到坏死的细胞。而TNF-α+Nec-1和TNF-α+RIP3-siRNA组未发现明显坏死的细胞,仅见少数细胞线粒体呈轻度肿胀,见图3。
Figure 2.Comparison of apoptosis/necrosis rate in each group. Mean±SEM.n=3.##P<0.01vscontrol group;**P<0.01vsTNF-α group.
图2 各组MLO-Y4细胞凋亡或坏死率的比较

Figure 3.The morphological changes of MLO-Y4 cells were visualized by TEM. The scale bar=2 μm.
图3 透射电镜观察各组MLO-Y4细胞形态学变化
4 TNF-α对MLO-Y4细胞程序性坏死特异性蛋白表达的影响
RIP1和RIP3是程序性坏死发生过程中的关键信号分子,且二者相互作用参与形成促程序性坏死小体[11]。本实验应用激光共聚焦显微镜检测了RIP1和RIP3蛋白在MLO-Y4细胞的共表达情况。镜下可见RIP1和RIP3蛋白主要表达于细胞胞浆,RIP1(红色)和RIP3(绿色)阳性细胞表达重叠呈黄色,见图4。共表达阳性率结果显示,与对照组相比,TNF-α组细胞RIP1和RIP3的共表达阳性率明显增高(P<0.01),Nec-1和RIP3-siRNA能有效降低MLO-Y4细胞RIP1和RIP3共表达阳性率(P<0.01),见图5。
应用Western blot检测程序性坏死关键蛋白RIP1、RIP3及凋亡相关蛋白cleaved caspase-3的表达水平。与对照相比,TNF-α组的RIP1、RIP3及cleaved caspase-3蛋白水平明显增高(P<0.01)。Nec-1能有效抑制RIP1蛋白的表达(P<0.01),而Z-VAD对RIP1蛋白表达无影响。RIP3-siRNA能有效降低RIP3蛋白的表达(P<0.01)。与TNF-α组相比,TNF-α+Z-VAD组的cleaved caspase-3蛋白水平明显下降(P<0.01),但是Nec-1对cleaved caspase-3蛋白水平无影响,见图6。

Figure 4.The representative immunofluorescence images of MLO-Y4 cells for RIP1 (red), RIP3 (green), and DAPI labeling. RIP1 and RIP3 double positive cells (yellow) were shown. The scale bar=50 μm.
图4 激光共聚焦观察RIP1和RIP3 蛋白在MLO-Y4细胞共表达情况
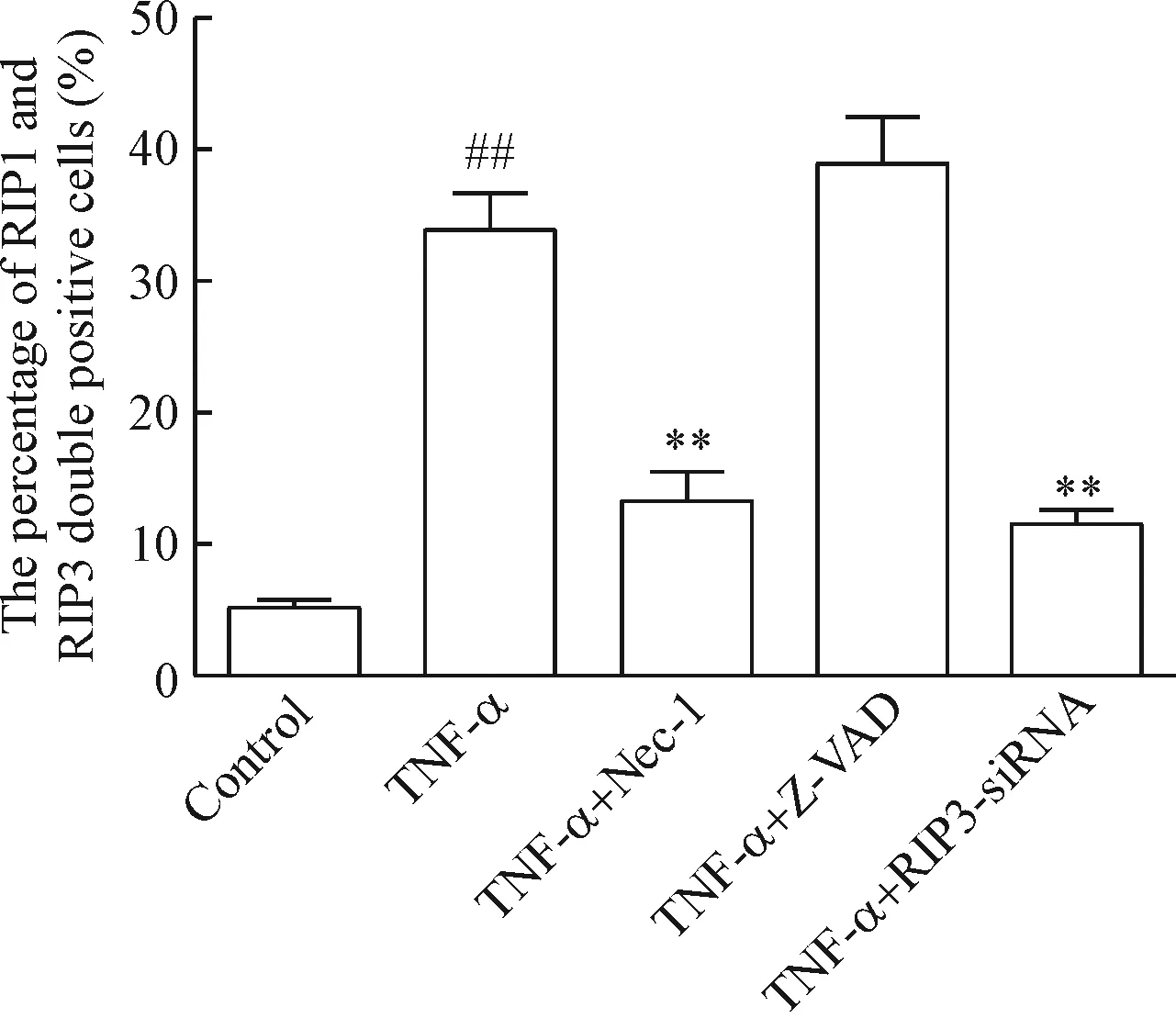
Figure 5.The quantitative analysis of RIP1-RIP3-positive cells. Mean±SEM.n=3.##P<0.01vscontrol group;**P<0.01vsTNF-α group.
图5 定量分析RIP1-RIP3共表达阳性的MLO-Y4细胞百分比
5 荧光标记法检测各组细胞ROS水平的变化
TNF-α组的ROS水平较对照组明显增高(P<0.01)。而Nec-1、Z-VAD及RIP3-siRNA均能有效抑制TNF-α导致的MLO-Y4细胞ROS水平增高(P<0.01),见图7。
讨 论
在骨骼修复重建中,骨细胞能够将外界刺激应力信号转化为生化信号,通过骨细胞-小管结构体系传递信号,调节成骨细胞和破骨细胞的功能。骨细胞的大量死亡使骨量丢失,损害了骨组织的微结构,增加了骨脆性;同时骨细胞死亡破坏了骨细胞-小管结构体系,造成对骨陷窝-小管系统内液体流动的改变,阻碍了骨组织的重建,结果形成了不可修复的骨缺损[12]。那么在病理状态下,如果能阻断骨细胞的过度死亡,就可能有效维护骨重建中骨吸收和骨形成的平衡。因此,探讨骨质疏松发病过程中骨细胞死亡的分子生物学调控机制,可能为骨质疏松防治提供新靶点。
随着人们对细胞死亡方式不断的深入研究,发现有一种细胞死亡方式具有典型细胞坏死的形态学特征,而且可以被调控,这与以往的细胞坏死具有本质的不同,因此人们将这种细胞死亡方式命名为“程序性坏死”[13]。发生程序性坏死的细胞可以被Nec-1特异性抑制,而不受凋亡抑制剂(如Z-VAD)的影响[14]。在许多生理和病理过程中,程序性坏死起着关键的调节作用[15]。我们前期研究发现OVX大鼠骨质疏松模型骨组织中具有典型坏死形态特征的程序性坏死骨细胞,RIP1和RIP3共表达且水平明显增高,应用1.65 mg/kg Nec-1连续腹膜下注射4周可有效减少骨细胞程序性坏死,进而减少了骨量的丢失[4]。这些结果提示在OVX大鼠骨质疏松发病过程中,程序性坏死可能是引起骨细胞死亡的一种重要方式。另外,我们还发现大鼠行OVX术后,TNF-α在骨细胞表达显著增强[4],这与以往的研究报道一致[6-7]。但TNF-α是否诱导骨细胞程序性坏死参与骨质疏松症发病过程的机制仍不完全明确。

Figure 6.The protein levels of RIP1, RIP3 and cleaved caspase-3 were detected by Western blot. Mean±SEM.n=3.##P<0.01vscontrol group;**P<0.01vsTNF-α group.
图6 Western blot分析各组MLO-Y4细胞RIP1、RIP3和cleaved caspase-3蛋白水平的变化

Figure 7.DCFH-DA analysis for determining the ROS levels in each group. Mean±SEM.n=3.##P<0.01vscontrol group;**P<0.01vsTNF-α group.
图7 各组MLO-Y4细胞ROS水平的比较
本实验应用流式细胞术检测到50 μg/L TNF-α诱导MLO-Y4细胞的凋亡和坏死率明显高于对照组。为了区分这些死亡的细胞是程序性坏死还是凋亡,我们分别应用程序性坏死的特异性抑制剂Nec-1、凋亡抑制剂Z-VAD以及RIP3-siRNA干预TNF-α诱导的MLO-Y4细胞作了进一步研究。结果发现50 μg/L的TNF-α诱导MLO-Y4细胞24 h,透射电镜观察发现大量的细胞肿胀、线粒体肿胀增多、细胞膜破裂、胞浆及细胞器外溢。应用Nec-1预处理MLO-Y4细胞后,在电镜下没有发现典型的坏死细胞。Wes-tern blot检测发现,TNF-α干预MLO-Y4细胞24 h后RIP3、RIP1及cleaved caspase-3的蛋白水平显著增高,Nec-1预处理后RIP1明显降低,Z-VAD预处理后cleaved caspase-3的蛋白水平显著降低,RIP3-siRNA能有效减少RIP3表达,结合电镜结果,我们推测TNF-α诱导MLO-Y4细胞发生了程序性坏死。
研究证实RIP1和RIP3能相互磷酸化,共同参与程序性坏死小体 “necrosome”的形成,从而启动程序性坏死[13]。在本实验中Nec-1和RIP3-siRNA能分别抑制RIP1 和RIP3的表达,可能影响RIP1和RIP3的相互磷酸化,抑制程序性坏死小体的形成,从而阻断程序性坏死。我们应用激光共聚焦纤维成像观察了RIP1-RIP3的共表达情况,发现在TNF-α干预MLO-Y4细胞24 h后 RIP1-RIP3共表达率高达33.96%±2.67%,而应用Nec-1或RIP3-siRNA处理后,RIP1-RIP3的共表达率明显下降,而Z-VAD对此无影响。RIP3-siRNA处理后RIP3蛋白表达下降,电镜下看不到坏死样的细胞,流式细胞术检测细胞坏死率明显降低。这些结果与程序性坏死的特征一致[14-15],进一步证实MLO-Y4细胞发生了RIP3介导的程序性坏死。
ROS在程序性坏死过程中担任着执行者的角色[16],它可以诱导脂质过氧化反应或改变某些通道蛋白的功能,从而导致细胞损伤。有研究报道高表达的RIP3可以活化磷酸化酶、谷氨酸脱氢酶1等,促使线粒体能量代谢增强,ROS产生增多,导致细胞发生程序性坏死[17]。可见RIP1-RIP3复合物作为程序性坏死信号通路的上游信号分子调控ROS的产量[18-19]。与这些报道相一致,我们也发现TNF-α干预MLO-Y4细胞24 h后ROS产生增多。在Nec-1抑制上游信号分子RIP1后或RIP3-siRNA干扰RIP3后,MLO-Y4细胞过量的ROS含量也随之下降。我们推测ROS可能是MLO-Y4细胞程序性坏死的执行者。另外,在本研究中也发现:使用凋亡抑制剂Z-VAD后,如同使用坏死抑制剂Nec-1或RIP3-siRNA干扰RIP3后一样,MLO-Y4细胞过量的ROS含量也随之下降,提示ROS参与了细胞的凋亡过程,这与以往研究报道一致[20-21]。但是,对于TNF-α干预MLO-Y4细胞24 h后细胞发生凋亡和程序性坏死的比例,我们将作进一步研究。
综上所述,TNF-α可诱导MLO-Y4 骨细胞发生了RIP3依赖的程序性坏死,ROS可能是MLO-Y4细胞程序性坏死的执行者。但骨细胞程序性坏死促发骨质疏松的具体机制有待进一步深入研究。
[1] Kalajzic I, Matthews BG, Torreggiani E, et al.Invitroandinvivoapproaches to study osteocyte biology[J]. Bone, 2013, 54(2):296-306.
[2] Dallas SL, Prideaux M, Bonewald LF. The osteocyte: an endocrine cell and more[J]. Endocr Rev, 2013, 34(5):658-690.
[3] Cui H, Zhu Y, Jiang D. The RIP1-RIP3 complex me-diates osteocyte necroptosis after ovariectomy in rats[J]. PLoS One, 2016, 11(3):e0150805.
[4] Cui H, Zhu Y, Yang Q, et al. Necrostatin-1 treatment inhibits osteocyte necroptosis and trabecular deterioration in ovariectomized rats[J]. Sci Rep, 2016, 6:33803.
[5] Weitzmann MN, Pacifici R. The role of T lymphocytes in bone metabolism[J]. Immunol Rev, 2005, 208:154-168.
[6] Kireev RA, Tresguerres AC, Garcia C, et al. Hormonal regulation of pro-inflammatory and lipid peroxidation processes in liver of old ovariectomized female rats[J]. Biogerontology, 2010, 11(2):229-243.
[7] Das UN. Nitric oxide as the mediator of the antiosteoporo-tic actions of estrogen, statins, and essential fatty acids[J]. Exp Biol Med, 2002, 227(2):88-93.
[8] Vandenabeele P, Grootjans S, Callewaert N, et al. Necrostatin-1 blocks both RIPK1 and IDO consequences for the study of cell death in experimental disease models[J]. Cell Death Differ, 2013, 20(2): 185-187.
[9] Lamothe B, Lai Y, Xie M, et al. TAK1 is essential for osteoclast differentiation and is an important modulator of cell death by apoptosis and necroptosis[J]. Mol Cell Biol, 2013, 33(3):582-595.
[10]Wehmeier KR, Kurban W, Chandrasekharan C, et al. Inhibition of ABCA1 protein expression and cholesterol efflux by TNF-α in MLO-Y4 osteocytes[J]. Calcif Tissue Int, 2016, 98(6):586-595.
[11]He S, Wang L, Miao L, et al. Receptor interacting protein kinase-3 determines cellular necrotic response to TNF-α[J]. Cell, 2009, 137(6):1100-1111.
[12]Verborgt O, Gibson GJ, Schaffler MB. Loss of osteocyte integrity in association with microdamage and bone remo-deling after fatigueinvivo[J]. J Bone Miner Res, 2000, 15(1):60-67.
[13] Linkermann A, Green DR. Necroptosis[J]. N Engl Med, 2014, 370(5): 455-465.
[14]Dunai Z, Bauer PI, Mihalik R. Necroptosis: biochemical, physiological and pathological aspects[J]. Pathol Oncol Res, 2011, 17(4):791-800.
[15]Vandenabeele P, Galluzzi L, Vanden Berghe T, et al. Molecular mechanisms of necroptosis: an ordered cellular explosion[J]. Nat Rev Mol Cell Biol, 2010, 11(10):700-714.
[16]朱永俊, 夏云峰, 钟良宝, 等. 自噬对肾大部切除大鼠肾小管上皮细胞程序性坏死的影响[J]. 中国病理生理杂志, 2016, 32(7):1266-1272.
[17]Moquin D, Chan FK. The molecular regulation of programmed necrotic cell injury[J]. Trends Biochem Sci, 2010, 35(8):434-441.
[18]Challa S, Chan FK. Going up in flames: necrotic cell injury and inflammatory diseases[J]. Cell Mol Life Sci, 2010, 67(19):3241-3253.
[19]Christofferon DE, Yuan J. Necroptosis as an alternative form of programmed cell death[J]. Curr Opin Cell Biol, 2010, 22(2):263-268.
[20]曹军军, 杨茂伟, 郭宝磊, 等. 枸橼酸铁铵通过提高ROS水平激活MAPK通路并诱导成骨细胞凋亡[J]. 中国病理生理杂志, 2013, 29(3):476-480.
[21]Neumann J, Yang Y, Köhler R, et al.Mangrove dolabrane-type of diterpenes tagalsins suppresses tumor growth via ROS-mediated apoptosis and ATM/ATR-Chk1/Chk2-regulated cell cycle arrest[J]. Int J Cancer, 2015, 137(11):2739-2748.
(责任编辑: 陈妙玲, 罗 森)
TNF-α induces PIP3-mediated necroptosis in MLO-Y4 cells
CUI Hong-wang1, MENG Zhi-bin1, HUANG Tao1, ZHU Kai-zhong1, ZHAO Zhi-rong1, ZHU Yong-jun2
(1DepartmentofSpineandOsteopathicSurgery,2DepartmentofNephrologyandRheumatology,TheFirstAffiliatedHospitalofHainanMedicalCollege,Haikou570102,China.E-mail:cqchw2013@sina.com)
AIM: To explore whether tumor necrosis factor-α (TNF-α) induces necroptosis in murine long bone osteocyte-like cell line MLO-Y4 and the possible mechanism. METHODS: The MLO-Y4 cells were divided into control group, TNF-α group, TNF-α+necrostatin-1 (Nec-1) group, TNF-α+Z-VAD group and TNF-α+receptor-interacting protein 3 (RIP3)-siRNA group. The death rate of MLO-Y4 cells was assessed by flow cytometry with Annexin V-FITC/PI staining. The morphological features of the cells were observed under transmission electron microscope (TEM). The protein levels of RIP1, RIP3 and cleaved caspase-3 were determined by Western blot. Finally, the numbers of total cells and RIP1-RIP3-positive cells were observed under laser scanning confocal microscope. The production of reactive oxygen species (ROS) in the cells was measured by DCFH-DA staining. RESULTS: Compared with control group, the apoptotic or necroptotic rate of the cells induced by TNF-α was increased significantly (P<0.01). The increased apoptotic or necroptotic rate was dramatically reduced by treating with Nec-1, Z-VAD or RIP3-siRNA transfection (P<0.01). In TNF-α group and TNF-α+Z-VAD group, a lot of MLO-Y4 cells with typical necroptotic morphological features were observed under TEM. However, obvious necroptotic cells were not found in Nec-1 or RIP3-siRNA treatment group. The protein level of RIP1 in the cells treated with Nec-1 was sharply lower than that in TNF-α group (P<0.01). However, Z-VAD did not reduce the elevated levels of RIP1 and RIP3. RIP3-siRNA effectively down-regulated the protein level of RIP3 compared with TNF-α group (P<0.01). Nec-1 effectively down-regulated the protein levels of RIP1 colocalized with RIP3 compared with TNF-α group (P<0.01). However, Z-VAD did not reduce the levels of RIP1 colocalized with RIP3. Nec-1, Z-VAD and RIP3 siRNA significantly decreased the ROS levels (P<0.01). CONCLUSION: TNF-α induces the necroptosis of MLO-Y4 cells. RIP3 play vital roles in the cell necroptotic signal pathway. ROS may be the executor of necroptosis of MLO-Y4 cells.
Tumor necrosis factor-α; Necroptosis; Receptor-interacting protein 3; MLO-Y4 cells
1000- 4718(2017)08- 1499- 07
2017- 04- 14
2017- 07- 12
海南省自然科学基金资助项目(No. 817326)
R681
A
10.3969/j.issn.1000- 4718.2017.08.025
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0898-66773740; E-mail: cqchw2013@sina.com
